一种酚和胺直接偶联合成芳胺化合物的方法
1.本发明涉及有机合成领域,具体涉及铑催化酚和胺直接偶联合成芳胺化合物的方法。
背景技术:
2.芳胺化合物在医药,农药,材料等领域已得到广泛应用(ruiz
‑
castillo,p.;buchwald,s.l.,applications of palladium
‑
catalyzed c
–
n cross
‑
coupling reactions.chem.rev.2006,116,12564
–
12649)。目前,合成芳胺化合物的方法主要为buchwald
‑
hartwig偶联和ullmann偶联等。在这些反应中,常使用卤代芳烃作为亲电试剂。但卤代芳烃价格较为昂贵,且会产生含卤废弃物污染,所以寻找新的亲电体来替代卤代芳烃具有重要意义。
3.酚是一类重要的基础化工原料,其来源广泛,可通过木质素降解生产,是一类理想的亲电偶联试剂。但由于酚c
‑
o键能(111kcal/mol)远大于o
‑
h键能(88kcal/mol),在过渡金属催化的反应中,经常发生o
‑
h键氧化加成而不是c
‑
o键断裂。所以,为了实现酚的胺化,常使用当量的三氟甲磺酸酐等作为活化试剂,预先制备成高活性的三氟甲磺酸芳基酯等参与反应。该法虽然高效,但需要使用活化试剂,步骤及原子经济性差(qiu,z.;li,c.j.,transformations of less
‑
activated phenols and phenol derivatives via c
–
o cleavage.chem.rev.2020,120,10454
–
10515)。毫无疑问,酚的直接胺化,不使用活化试剂,生成的副产物仅为水,是极具步骤、原子经济性,绿色环保的路线。
4.工业上,利用bucherer反应,使用当量的亚硫酸钠在加热条件下,可以实现萘酚的直接胺化,但对于非稠环的酚类不适用(bucherer,h.t.die einwirkung schwefligsaurer salze auf aromatische amido
‑
und hydroxylverbindungen.j.prakt.chem.1904,69,49
–
91)。2015年,李朝军等(chen,z.,et al.formal direct cross
‑
coupling of phenols with amines.angew.chem.int.ed.2015,54,14487
–
14491)使用非均相催化剂pd/c,通过加氢
‑
脱氢过程实现了非稠环酚类的直接胺化,但该反应需要使用当量的甲酸钠作为外加氢源,且半当量的三氟乙酸的使用使得该反应官能团兼容性较差,对于复杂分子的后期修饰也未能证明。因此,开发出一种无需活化试剂和外加氢源,底物兼容性好,可用于复杂分子后期修饰的酚直接胺化的方法具有重要价值。
技术实现要素:
5.本发明的目的在于提供了一种酚和胺直接偶联合成芳胺化合物的方法,该方法无需使用活化试剂和外加氢源,步骤及原子经济性好,原料来源丰富、底物普适性广,可用于复杂药物分子的后期修饰。
6.为了实现上述发明目的,本发明的技术方案如下:
7.一种酚和胺直接偶联合成芳胺化合物的方法,在有机溶剂中,以酚和胺为底物,铑为催化剂,铑和胺的摩尔比为1:(5~100),在80~150℃下进行偶联反应,再经过纯化分离
得到芳胺化合物;
8.所述酚的结构如下式(i)所示:
9.ar
‑
oh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(i)
10.所述胺的结构如下式(ii)所示:
[0011][0012]
式(i)中,ar为苯基、取代苯基、萘芳基;式(ii)中,r1和r2为烷基、取代烷基或氢,且r1和r2不能同时为氢。
[0013]
本发明方法的反应原理为:铑与酚进行π配位,在胺的作用下形成η5配位的rh
‑
phenoxo酮式结构,其中酮羰基与胺进行脱水缩合产生芳胺,然后芳胺解离释放出rh催化剂参与下一个催化循环。
[0014]
考虑到原料的简便易得,优选地,式(i)中,所述取代苯基为烷基、烷氧基、氨基、酯基、苯基、4
‑
氟苯基、4
‑
氯苯基、三氟甲苯基、酰胺基或哌啶基取代的苯基;式(ii)中,所述的取代烷基为烷基、烷氧基、羟基、硅氧基、氨基、芳基、三氟甲基、氰基、酰胺、酯基、缩酮、吡啶基、嘧啶基取代的烷基。
[0015]
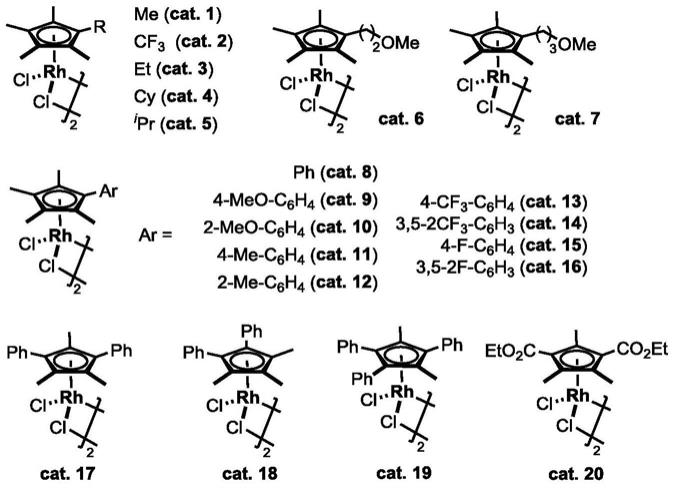
所述的金属铑催化剂为五甲基环戊二烯基二氯化铑二聚体及其衍生物,如下所示:
[0016][0017]
出于收率的考虑,作为优选,所述的铑催化剂为cat.1、8、14、17和20。
[0018]
所述的有机溶剂为二氧六环、甲苯、四氢呋喃、正庚烷、正辛烷/、2
‑
甲基四氢呋喃、叔戊醇或甲基叔丁基醚;以胺的摩尔量计,所述的溶剂用量为0.1~2l/mol;出于收率及溶剂成本的考虑,更优选地,所述的有机溶剂为甲苯、正辛烷或正庚烷,以胺的摩尔量计,所述的溶剂用量为0.1~1l/mol。
[0019]
由于反应涉及胺与形成的rh
‑
phenoxo的缩合反应,体系浓度较大有利于二者的缩合反应,当溶剂用量为大于2l/mol时,胺与rh
‑
phenoxo之间不易缩合,从而收率较低。
[0020]
所述的偶联反应的反应时间优选为12~36h。出于收率的考虑,反应温度进一步地
优选为120~140℃,反应时间优选为24~36h。
[0021]
出于收率和成本的考虑,铑和胺的摩尔比优选为1:(20~50)。
[0022]
优选地,所述胺与酚的摩尔比为1:(0.8~2)。铑催化剂对碱的耐受性不强,当胺过量较多时,会使体系碱性增强,从而破坏铑与酚配位,影响后续缩合反应,收率较差。出于收率和成本的考虑,优选为1:(1~2)。
[0023]
作为优选,所述偶联反应中还加入碱,所述碱为无水磷酸钾、碳酸钾、碳酸铯、乙酸钠、碳酸钠;所述碱与胺的摩尔比为(0.1~1):1。这是由于偶联反应中加入碱可以促进铑与苯酚生成η5配位的rh
‑
phenoxo酮式结构,提高产物收率。
[0024]
进一步优选,所述的碱为碳酸铯或碳酸钠,所述碱与胺的摩尔比为(0.1~0.2):1,可进一步提高产物的收率。
[0025]
作为优选,所述的偶联反应中还加入添加剂,所述添加剂为分子筛或分子筛。以胺的摩尔量计,所述的添加剂用量为50~250mg/mol。这是由于偶联反应中加入添加剂可以除去反应生成的水,从而提高产物收率。
[0026]
上述方法的反应方程式如下:
[0027][0028]
所述的纯化分离优选为:先加少量二氯甲烷稀释反应液,湿法上样,用硅胶柱色谱进行分离。
[0029]
与现有技术相比,本发明具有以下优点:
[0030]
(1)本发明方法无需使用活化试剂将酚预活化,且不使用外加氢源,反应步骤及原子经济性好,副产物仅为水,绿色环保。
[0031]
(2)本发明方法所用原料酚和胺化合物简单易得,价格相对低廉,且该反应收率高,对于各类带有不同官能团的酚和胺均有很好的普适性,并且可用于复杂药物分子的后期修饰。
[0032]
(3)本发明方法可用于合成一系列芳胺化合物,合成的化合物在农药、医药、材料等领域均有广泛的应用价值。
具体实施方式
[0033]
下面根据优选实施例详细描述本发明,本发明的目的和效果将变得更加明白,应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0034]
实施例1
[0035][0036]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.1(0.008mmol,4.9mg),cs2co3(0.04mmol,13.0mg)和分子筛(20.0mg),最后加入toluene(0.04ml)和哌啶(0.4mmol,34.0mg)。反应在120℃下搅拌24小时后,冷却至室温,加入1.0ml
的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物59mg,产率84%。1h nmr(500mhz,cdcl3)δ7.10(d,j=8.3hz,2h),6.90(d,j=8.6hz,2h),3.13(t,j=5.4hz,4h),2.31(s,3h),1.77
–
1.73(m,4h),1.62
–
1.57(m,2h).
13
c nmr(126mhz,cdcl3)δ150.3,129.5,128.7,116.9,51.3,25.9,24.3,20.4.
[0037]
实施例2
[0038][0039]
在氮气氛围中,依次向反应瓶中加入对异丙氧基苯酚(0.4mmol,60.8mg),cat.8(0.02mmol,14.8mg),na2co3(0.08mmol,8.5mg)和分子筛(100.0mg),最后加入正庚烷(0.4ml)和哌啶(0.4mmol,34.0mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物41mg,产率47%。1h nmr(500mhz,cdcl3)δ6.89(d,j=9.0hz,2h),6.82(d,j=9.1hz,2h),4.46
–
4.39(m,1h),3.03(t,j=5.4hz,4h),1.74
–
1.70(m,4h),1.56
–
1.52(m,2h),1.30(d,j=6.1hz,6h).
13
c nmr(126mhz,cdcl3)δ151.7,146.9,118.6,116.9,70.6,52.2,26.1,24.2,22.2。
[0040]
实施例3
[0041][0042]
在氮气氛围中,依次向反应瓶中加入对二甲胺基苯酚(0.32mmol,43.9mg),cat.14(0.004mmol,4.0mg),k3po4(0.04mmol,8.5mg)和分子筛(50.0mg),最后加入正辛烷(0.8ml)和哌啶(0.4mmol,34.0mg)。反应在130℃下搅拌12小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物39mg,产率60%。1h nmr(500mhz,cdcl3)δ6.92(d,j=9.0hz,2h),6.75(d,j=9.0hz,2h),3.00(t,j=5.4hz,4h),2.86(s,6h),1.74
–
1.70(m,4h),1.56
–
1.51(m,2h).
13
c nmr(126mhz,cdcl3)δ145.5,144.6,118.9,114.5,52.5,41.6,26.2,24.2。
[0043]
实施例4
[0044][0045]
在氮气氛围中,依次向反应瓶中加入尼泊金乙酯(0.6mmol,99.6mg),cat.17(0.08mmol,68.8mg),k2co3(0.04mmol,5.5mg)和分子筛(50.0mg),最后加入四氢呋喃(0.1ml)和哌啶(0.4mmol,34.0mg)。反应在80℃下搅拌24小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物60mg,产率64%。1h nmr(500mhz,cdcl3)δ7.90(d,j=9.0hz,2h),6.84(d,j=9.0hz,2h),4.32(q,j=7.1hz,2h),3.31(q,j=4.8hz,4h),1.68
–
1.61(m,6h),1.36(t,j=7.1hz,3h).
13
c nmr(126mhz,cdcl3)δ166.7,154.4,131.1,
119.0,113.5,60.1,48.8,25.3,24.3,14.4。
[0046]
实施例5
[0047][0048]
在氮气氛围中,依次向反应瓶中加入4
‑
苯基苯酚(0.6mmol,102.0mg),cat.20(0.04mmol,33.9mg),naoac(0.04mmol,3.3mg)和分子筛(50.0mg),最后加入1,4
‑
二氧六环(0.1ml)和哌啶(0.4mmol,34.0mg)。反应在150℃下搅拌24小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物85mg,产率90%。1h nmr(500mhz,cdcl3)δ7.63(d,j=7.0hz,2h),7.56(d,j=8.8hz,2h),7.46(t,j=7.8hz,2h),7.33(t,j=7.4hz,1h),7.05(d,j=8.8hz,2h),3.26(t,j=5.4hz,4h),1.80
–
1.76(m,4h),1.67
–
1.63(m,2h).
13
c nmr(126mhz,cdcl3)δ151.4,141.0,131.5,128.6,127.6,126.4,126.2,116.4,50.3,25.7,24.3。
[0049]
实施例6
[0050][0051]
在氮气氛围中,依次向反应瓶中加入4
‑
氟
‑
4'
‑
羟基联苯(0.6mmol,112.9mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入甲基叔丁基醚(0.1ml)和哌啶(0.4mmol,34.0mg)。反应在140℃下搅拌24小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物68mg,产率67%。1h nmr(500mhz,cdcl3)δ7.53
–
7.50(m,2h),7.46(d,j=8.8hz,2h),7.10(t,j=8.7hz,2h),7.01(d,j=8.8hz,2h),3.23(t,j=5.4hz,4h),1.77
–
1.73(m,4h),1.65
–
1.60(m,2h).
13
c nmr(126mhz,cdcl3)δ161.9(d,j=245.4hz),151.4,137.1(d,j=3.1hz),130.6,127.8(d,j=7.9hz),127.5,116.4,115.4(d,j=21.3hz),50.3,25.7,24.3.
19
f nmr(471mhz,cdcl3)δ
‑
117.2。
[0052]
实施例7
[0053][0054]
在氮气氛围中,依次向反应瓶中加入4
‑
氯
‑
4'
‑
羟基联苯(0.6mmol,122.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.4mmol,42.4mg)和分子筛(50.0mg),最后加入2
‑
甲基四氢呋喃(0.1ml)和哌啶(0.4mmol,34.0mg)。反应在140℃下搅拌24小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物70mg,产率65%。1h nmr(500mhz,cdcl3)δ7.49
–
7.44(m,4h),7.39
–
7.33(m,2h),7.00(d,j=8.4hz,2h),3.23
–
3.21
(m,4h),1.77
–
1.70(m,4h),1.63
–
1.58(m,2h).
13
c nmr(126mhz,cdcl3)δ151.5,139.4,132.2,130.2,128.7,127.6,127.5,116.4,50.3,25.7,24.3。
[0055]
实施例8
[0056][0057]
在氮气氛围中,依次向反应瓶中加入4
‑
三氟甲基
‑
4'
‑
羟基联苯(0.6mmol,142.8mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入叔戊醇(0.1ml)和哌啶(0.4mmol,34.0mg)。反应在140℃下搅拌24小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物101mg,产率83%。1h nmr(500mhz,cdcl3)δ7.66(s,4h),7.52(d,j=8.5hz,2h),7.02(d,j=8.4hz,2h),3.26(t,j=5.4hz,4h),1.81
–
1.69(m,4h),1.67
–
1.56(m,2h).
13
c nmr(126mhz,cdcl3)δ151.9,144.5(q,j=1.2hz),129.5,128.1(q,j=32.4hz),127.8,126.4,125.6(q,j=3.8hz),124.5(q,j=272.1hz)116.2,50.0,25.6,24.3.
19
f nmr(471mhz,cdcl3)δ
‑
62.2。
[0058]
实施例9
[0059][0060]
在氮气氛围中,依次向反应瓶中加入n
‑
叔丁基
‑3‑
羟基苯甲酰胺(0.6mmol,115.9mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和哌啶(0.4mmol,34.0mg)。反应在140℃下搅拌24小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物63mg,产率61%。1h nmr(500mhz,cdcl3)δ7.36(s,1h),7.23(t,j=7.9hz,1h),7.02
–
6.99(m,2h),5.94(s,1h),3.19(t,j=5.4hz,4h),1.71
–
1.66(m,4h),1.60
–
1.55(m,2h),1.45(s,9h).
13
c nmr(126mhz,cdcl3)δ167.5,152.3,136.8,128.9,118.8,116.3,115.0,51.4,50.3,28.8,25.6,24.2。
[0061]
实施例10
[0062][0063]
在氮气氛围中,依次向反应瓶中加入2
‑
(4
‑
羟基苯基)吡啶(0.6mmol,102.6mg),cat.14(0.01mmol,10.1mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和哌啶(0.4mmol,34.0mg)。反应在140℃下搅拌24小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物42mg,产率44%。1h nmr(500mhz,cdcl3)δ8.63(d,j=4.7hz,1h),7.91(d,j=8.9hz,2h),7.68
–
7.64(m,2h),7.12
–
7.10(m,1h),7.00(d,j=
8.9hz,2h),3.26(t,j=5.4hz,4h),1.74
–
1.69(m,4h),1.63
–
1.58(m,2h).
13
c nmr(126mhz,cdcl3)δ157.3,152.5,149.4,136.4,129.4,127.6,120.8,119.3,115.7,49.9,25.6,24.3。
[0064]
实施例11
[0065][0066]
在氮气氛围中,依次向反应瓶中加入苯酚(0.6mmol,56.4mg),cat.14(0.01mmol,10.1mg)和na2co3(0.04mmol,4.2mg),最后加入正庚烷(0.1ml)和哌啶(0.4mmol,34.0mg)。反应在140℃下搅拌24小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物51mg,产率79%。1h nmr(500mhz,cdcl3)δ7.25
–
7.22(m,2h),6.93(d,j=7.9hz,2h),6.81(t,j=7.3hz,1h),3.14(t,j=5.4hz,4h),1.72
–
1.68(m,4h),1.59
–
1.54(m,2h).
13
c nmr(126mhz,cdcl3)δ152.2,129.0,119.2,116.5,50.7,25.8,24.3。
[0067]
实施例12
[0068][0069]
在氮气氛围中,依次向反应瓶中加入7
‑
甲氧基
‑2‑
萘酚(0.6mmol,104.4mg),cat.14(0.01mmol,10.1mg),最后加入正庚烷(0.1ml)和哌啶(0.4mmol,34.0mg)。反应在140℃下搅拌24小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物40mg,产率41%。1h nmr(500mhz,cdcl3)δ7.63(d,j=9.0hz,1h),7.60(d,j=8.8hz,1h),7.13(dd,j=8.9,2.3hz,1h),7.06(d,j=2.0hz,1h),7.02(d,j=2.1hz,1h),6.95(dd,j=8.8,2.4hz,1h),3.91(s,3h),3.26(t,j=5.4hz,4h),1.79
–
1.75(m,4h),1.65
–
1.61(m,2h).
13
cnmr(126mhz,cdcl3)δ158.0,150.6,135.9,128.9,128.2,123.6,117.6,115.5,109.5,105.1,55.2,50.9,25.9,24.4。
[0070]
实施例13
[0071][0072]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和n
‑
(2
‑
甲氧基乙基)甲基胺(0.4mmol,35.7mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物50mg,产率70%。1h nmr(500mhz,cdcl3)δ7.08(d,j=8.4hz,2h),6.70(d,j=8.6hz,2h),3.58(t,j=5.9hz,2h),3.51(t,j=6.0hz,2h),3.39(s,3h),2.98(s,3h),2.29(s,3h).
13
c nmr(126mhz,cdcl3)δ147.3,129.6,125.6,112.6,70.1,58.9,52.7,39.0,20.1。
[0073]
实施例14
[0074][0075]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和4
‑
羟甲基哌啶(0.4mmol,46.0mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物62mg,产率76%。1h nmr(500mhz,cdcl3)δ7.07(d,j=8.3hz,2h),6.87(d,j=8.4hz,2h),3.65
–
3.63(m,2h),3.54(d,j=6.4hz,2h),2.67(t,j=12.0hz,2h),2.27(s,3h),1.86
–
1.83(m,2h),1.67
–
1.60(m,1h),1.51(br,1h),1.45
–
1.37(m,2h).
13
c nmr(126mhz,cdcl3)δ149.8,129.6,129.0,117.0,67.8,50.3,38.5,28.7,20.4。
[0076]
实施例15
[0077][0078]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和2
‑
(叔丁基二甲基硅氧基)乙胺(0.4mmol,70.1mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物71mg,产率67%。1h nmr(500mhz,cdcl3)δ7.01(d,j=8.3hz,2h),6.59(d,j=8.3hz,2h),3.94(br,1h),3.83(t,j=5.4hz,2h),3.22(t,j=5.4hz,2h),2.27(s,3h),0.94(s,9h),0.09(s,6h).
13
c nmr(126mhz,cdcl3)δ146.1,129.7,126.7,113.4,61.6,46.4,25.9,20.4,18.3,
‑
5.4。
[0079]
实施例16
[0080][0081]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和3
‑
氨基苄胺(0.4mmol,48.8mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物55mg,产率65%。1h nmr(500mhz,cdcl3)δ7.14(t,j=7.7hz,1h),7.00(d,j=8.2hz,2h),6.77(d,j=7.6hz,1h),6.71(s,1h),6.63
–
6.54(m,3h),4.23(s,2h),3.72(br,3h),2.26(s,3h).
13
c nmr(126mhz,cdcl3)δ146.7,146.0,141.0,129.7,129.5,126.6,117.6,114.0,113.9,112.9,48.6,20.3。
[0082]
实施例17
[0083][0084]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和2
‑
金刚烷胺(0.4mmol,60.5mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物83mg,产率86%。1h nmr(500mhz,cdcl3)δ7.04(d,j=8.1hz,2h),6.60(d,j=8.2hz,2h),3.83(br,1h),3.62
–
3.55(m,1h),2.30(s,3h),2.10
–
2.08(m,2h),2.00
–
1.82(m,10h),1.65(d,j=13.0hz,2h).
13
c nmr(126mhz,cdcl3)δ145.1,129.7,125.8,113.2,57.0,37.7,37.4,31.5,31.5,27.5,27.3,20.3。
[0085]
实施例18
[0086][0087]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和二甲基丙二胺(0.4mmol,40.8mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物41mg,产率53%。1h nmr(500mhz,cdcl3)δ6.94(d,j=8.1hz,2h),6.62(d,j=8.1hz,2h),5.60(br,3h),3.01(s,2h),2.84(s,2h),2.20(s,3h),1.06(s,6h).
13
c nmr(126mhz,cdcl3)δ146.5,129.6,126.9,113.7,53.0,48.7,34.8,23.9,20.3。
[0088]
实施例19
[0089][0090]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和3,5
‑
双(三氟甲基)苯甲胺(0.4mmol,97.2mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物109mg,产率82%。1h nmr(500mhz,cdcl3)δ7.86(s,2h),7.81(s,1h),7.02(d,j=8.3hz,2h),6.55(d,j=8.4hz,2h),4.46(s,2h),4.06(br,1h),2.26(s,3h).
13
c nmr(126mhz,cdcl3)δ145.0,142.8,131.8(q,j=33.3hz),129.9,127.8,127.3(q,j=3.4hz),123.3(q,j=273.1hz),121.1(hept,j=3.8hz),113.1,48.0,20.3.
19
f nmr(471mhz,cdcl3)δ
‑
62.8。
[0091]
实施例20
[0092][0093]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和4
‑
(三氟甲基)哌啶(0.4mmol,61.2mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物69mg,产率71%。1h nmr(500mhz,cdcl3)δ7.10(d,j=8.5hz,2h),6.88(d,j=8.5hz,2h),3.71
–
3.69(m,2h),2.66(td,j=12.4,2.2hz,2h),2.29(s,3h),2.19
–
2.10(m,1h),1.99
–
1.96(m,2h),1.82
–
1.74(m,2h).
13
cnmr(126mhz,cdcl3)δ149.2,129.7,129.7,127.4(q,j=278.7hz),117.2,49.5,40.3(q,j=27.4hz),24.6(q,j=2.5hz),20.4.
19
f nmr(471mhz,cdcl3)δ
‑
73.8。
[0094]
实施例21
[0095][0096]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和4
‑
氰基哌啶(0.4mmol,44.0mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物45mg,产率56%。1h nmr(500mhz,cdcl3)δ7.09(d,j=8.4hz,2h),6.86(d,j=8.5hz,2h),3.40
–
3.35m,2h),3.05
–
3.00(m,2h),2.79
–
2.74(m,1h),2.29(s,3h),2.10
–
2.05(m,2h),2.03
–
1.97(m,2h).
13
c nmr(126mhz,cdcl3)δ149.0,129.9,129.7,121.5,117.3,48.7,28.6,26.1,20.4。
[0097]
实施例22
[0098][0099]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和3
‑
哌啶甲酰胺(0.4mmol,51.2mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物45mg,产率52%。1h nmr(500mhz,cdcl3)δ7.09(d,j=8.2hz,2h),6.90(d,j=8.5hz,2h),6.85(s,1h),5.94(s,1h),3.30
–
3.22(m,2h),3.15
–
3.04(m,2h),2.64
–
2.60(m,1h),2.28(s,3h),1.92
–
1.70(m,4h).
13
c nmr(126mhz,cdcl3)δ177.3,149.4,130.5,129.7,118.0,53.1,51.5,42.0,27.0,23.4,20.4。
[0100]
实施例23
[0101][0102]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和n
‑
乙酰基乙二胺(0.4mmol,40.8mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物56mg,产率73%。1h nmr(500mhz,cdcl3)δ6.99(d,j=8.2hz,2h),6.54(d,j=8.3hz,2h),5.98(s,1h),3.47(q,j=5.8hz,2h),3.25(t,j=5.8hz,2h),2.23(s,3h),1.97(s,3h).
13
c nmr(126mhz,cdcl3)δ170.8,145.6,129.8,127.0,112.9,44.2,39.2,23.2,20.3。
[0103]
实施例24
[0104][0105]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和4
‑
哌啶甲酸乙酯(0.4mmol,62.8mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物63mg,产率64%。1h nmr(500mhz,cdcl3)δ7.07(d,j=8.4hz,2h),6.86(d,j=8.4hz,2h),4.14(q,j=7.1hz,2h),3.60
–
3.56(m,2h),2.76
–
2.71(m,2h),2.44
–
2.38(m,1h),2.27(s,3h),2.04
–
2.01(m,2h),1.93
–
1.85(m,2h),1.27(t,j=7.1hz,3h).
13
c nmr(126mhz,cdcl3)δ174.9,149.5,129.6,129.2,117.0,60.4,49.9,41.0,28.2,20.4,14.2。
[0106]
实施例25
[0107][0108]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和4
‑
哌啶酮缩乙二醇(0.4mmol,57.2mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物56mg,产率60%。1h nmr(500mhz,cdcl3)δ7.07(d,j=8.2hz,2h),6.88(d,j=8.6hz,2h),4.00(s,4h),3.27(t,j=5.7hz,4h),2.28(s,3h),1.86(t,j=5.8hz,4h).
13
c nmr(126mhz,cdcl3)δ148.9,129.6,128.9,117.0,107.1,64.2,48.3,34.6,20.4。
[0109]
实施例26
[0110][0111]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和1
‑
[5
‑
(三氟甲基)
‑2‑
吡啶基]哌嗪(0.4mmol,92.4mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物81mg,产率63%。1h nmr(500mhz,cdcl3)δ8.44(s,1h),7.66(dd,j=9.0,2.3hz,1h),7.12(d,j=8.3hz,2h),6.90(d,j=8.5hz,2h),6.69(d,j=9.0hz,1h),3.81(t,j=5.1hz,4h),3.25(t,j=5.0hz,4h),2.30(s,3h).
13
c nmr(126mhz,cdcl3)δ160.3,149.0,145.8(q,j=4.2hz),134.5(q,j=3.1hz),129.9,129.8,124.6(q,j=271.2hz),116.8,115.2(q,j=33.0hz),105.6,49.7,44.7,20.4.
19
f nmr(471mhz,cdcl3)δ
‑
61.1。
[0112]
实施例27
[0113][0114]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和1
‑
(2
‑
嘧啶基)哌嗪(0.4mmol,65.6mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物39mg,产率38%。1h nmr(500mhz,cdcl3)δ8.33(d,j=4.7hz,2h),7.10(d,j=8.1hz,2h),6.90(d,j=8.4hz,2h),6.51(t,j=4.7hz,1h),3.98(t,j=5.2hz,4h),3.20(t,j=5.2hz,4h),2.28(s,3h).
13
c nmr(126mhz,cdcl3)δ161.7,157.7,149.2,129.8,129.7,116.9,110.0,49.9,43.7,20.4。
[0115]
实施例28
[0116][0117]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和2,6
‑
二氮杂螺[3.3]庚烷
‑2‑
甲酸叔丁酯(0.4mmol,79.3mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物52mg,产率45%。1h nmr(500mhz,cdcl3)δ7.03(d,j=8.1hz,2h),6.39(d,j=8.4hz,2h),4.08(s,4h),3.92(s,4h),2.25(s,3h),1.44(s,9h).
13
c nmr(126mhz,cdcl3)δ156.1,149.2,129.5,127.5,112.0,79.7,62.5,59.4,33.5,28.4,20.4。
[0118]
实施例29
[0119][0120]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和(s,s)
‑
2,8
‑
二氮杂二环[4,3,0]壬烷(0.4mmol,50.4mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物51mg,产率59%。1h nmr(500mhz,cdcl3)δ7.04(d,j=8.1hz,2h),6.46(d,j=8.2hz,2h),3.46
–
3.36(m,3h),3.26(t,j=8.5hz,1h),3.20(d,j=9.3hz,1h),3.02
–
2.99(m,1h),2.69
–
2.64(m,1h),2.35
–
2.31(m,1h),2.26(s,3h),1.85
–
1.73(m,2h),1.70
–
1.59(m,2h),1.51
–
1.48(m,1h).
13
c nmr(126mhz,cdcl3)δ146.0,129.5,124.2,111.2,56.4,54.3,49.3,44.6,36.5,23.8,22.3,20.2。
[0121]
实施例30
[0122][0123]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和环庚亚胺(0.4mmol,39.6mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物48mg,产率63%。1h nmr(500mhz,cdcl3)δ7.02(d,j=8.5hz,2h),6.62(d,j=8.6hz,2h),3.44(t,j=6.0hz,4h),2.24(s,3h),1.81
–
1.75(m,4h),1.54
–
1.50(m,4h).
13
c nmr(126mhz,cdcl3)δ146.8,129.8,124.1,111.2,49.2,27.8,27.2,20.1。
[0124]
实施例31
[0125][0126]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和(1s,4s)
‑2‑
boc
‑
2,5
‑
二氮双环[2.2.1]庚烷(0.4mmol,79.3mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物61mg,产率53%。1h nmr(500mhz,cdcl3,rotamers)δ7.05&7.03(d,j=8.5hz,2h),6.49&6.47(d,j=7.9hz,2h),4.61&4.46(s,1h),4.35(s,1h),3.58
–
3.33(m,3h),3.17&3.08(d,j=8.6hz,1h),2.26&2.25(s,3h),1.98
–
1.96(m,1h),1.92
–
1.86(m,1h),1.44&1.42(s,9h).
13
c nmr(126mhz,cdcl3)δ154.1,144.6,129.8,125.7,112.5,79.5,57.3,57.0,56.5,50.8,37.4,28.5,20.3。
[0127]
实施例32
[0128][0129]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和吗啉(0.4mmol,34.8mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物45mg,产率64%。1h nmr(500mhz,cdcl3)δ7.10(d,j=8.4hz,2h),6.84(d,j=8.6hz,2h),3.87(t,j=4.8hz,4h),3.11(t,j=4.8hz,4h),2.28(s,3h).
13
c nmr(126mhz,cdcl3)δ149.2,129.7,129.6,116.0,67.0,49.9,20.4。
[0130]
实施例33
[0131][0132]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和四氢异喹啉(0.4mmol,53.2mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物70mg,产率75%。1h nmr(500mhz,cdcl3)δ7.16
–
7.10(m,4h),7.07(d,j=8.3hz,2h),6.89(d,j=8.6hz,2h),4.32(s,2h),3.47(t,j=5.9hz,2h),2.94(t,j=5.8hz,2h),2.26(s,3h).
13
c nmr(126mhz,cdcl3)δ148.6,134.7,134.5,129.7,128.5,128.3,126.5,126.2,125.9,115.8,51.4,47.2,29.0,20.4。
[0133]
实施例34
[0134][0135]
在氮气氛围中,依次向反应瓶中加入乙二醇保护雌酚酮(0.6mmol,188.5mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和哌啶(0.4mmol,34.0mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物73mg,产率48%。1h nmr(500mhz,cdcl3)δ7.18(d,j=8.6hz,1h),6.76(d,j=8.5hz,1h),6.68(s,1h),3.98
–
3.90(m,4h),3.10(t,j=5.4hz,4h),2.88
–
2.78(m,2h),2.35
–
2.29(m,1h),2.26
–
2.19(m,1h),2.03(t,j=11.5hz,1h),1.91
–
1.31(m,16h),0.89(s,3h).
13
c nmr(126mhz,cdcl3)δ150.2,137.1,131.5,125.8,119.5,117.0,114.5,65.2,64.5,51.0,49.4,46.2,43.6,39.1,34.2,30.7,29.9,27.1,26.0,25.9,24.3,22.3,14.3。
[0136]
实施例35
[0137][0138]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和脱氢枞胺(0.4mmol,114.1mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物128mg,产率85%。1h nmr(500mhz,cdcl3)δ7.20(d,j=8.2hz,1h),7.01(d,j=8.1hz,1h),6.98(d,j=8.2hz,2h),6.91(s,1h),6.54(d,j=8.4hz,2h),3.48(br,1h),3.03(d,j=12.4hz,1h),2.94
–
2.81(m,4h),2.31(dt,j=12.9,3.1hz,1h),2.24(s,3h),1.86
–
1.70(m,4h),1.66
–
1.63(m,1h),1.48
–
1.39(m,3h),1.25(s,6h),1.24(s,3h),1.02(s,3h).
13
c nmr(126mhz,cdcl3)δ147.4,146.8,145.6,134.7,129.7,126.8,126.0,124.2,123.9,112.7,55.3,45.3,38.4,37.5,37.4,36.3,33.4,30.1,25.3,24.0,20.3,19.3,18.8,18.7。
[0139]
实施例36
[0140][0141]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和帕罗西汀(0.4mmol,131.7mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物89mg,产率53%。1h nmr(500mhz,cdcl3)δ7.23
–
7.20(m,2h),7.13(d,j=8.2hz,2h),7.02(t,j=8.7hz,2h),6.97(d,j=8.5hz,2h),6.66(d,j=8.5hz,1h),6.40(d,j=2.4hz,1h),6.19(dd,j=8.5,2.5hz,1h),5.90(s,2h),4.07
–
3.94(m,1h),3.78
–
3.75(m,1h),3.67(dd,j=9.4,2.8hz,1h),3.57
–
3.53(m,1h),2.85
–
2.75(m,2h),2.62(td,j=11.6,4.2hz,1h),2.39
–
2.35(m,1h),2.32(s,3h),2.09
–
1.88(m,2h).
13
c nmr(126mhz,cdcl3)δ162.5(d,j=245.0hz),154.3,149.5,148.1,141.6,139.5(d,j=3.2hz),129.6,129.3,128.8(d,j=7.8hz),117.1,115.4(d,j=21.1hz),107.8,105.6,101.0,98.0,69.4,54.3,51.2,44.0,41.8,34.2,20.4.
19
f nmr(471mhz,cdcl3)δ
‑
116.4。
[0142]
实施例37
[0143]
[0144]
在氮气氛围中,依次向反应瓶中加入对甲基苯酚(0.8mmol,86.4mg),cat.14(0.01mmol,10.1mg),na2co3(0.04mmol,4.2mg)和分子筛(50.0mg),最后加入正庚烷(0.1ml)和阿莫沙平(0.4mmol,125.2mg)。反应在140℃下搅拌36小时后,冷却至室温,加入1.0ml的二氯甲烷稀释,湿法上样,过硅胶柱,得到产物51mg,产率32%。1h nmr(500mhz,cdcl3)δ7.41(dd,j=8.6,2.5hz,1h),7.37(d,j=2.5hz,1h),7.23
–
7.16(m,2h),7.12
–
7.09(m,4h),7.01(t,j=7.6hz,1h),6.90(d,j=8.5hz,2h),3.68(s,4h),3.26(s,4h),2.30(s,3h).
13
c nmr(126mhz,cdcl3)δ159.3,158.9,151.8,149.0,140.1,132.6,130.3,129.8,129.7,129.1,127.1,125.8,125.0,124.6,122.7,120.1,116.8,49.8,46.0,20.4。
[0145]
各实施例的制备工艺参数如下表1所示。
[0146]
表1实施例1~37的制备工艺参数表
[0147][0148]
[0149]
[0150][0151]
[0152][0153]
从表1可进一步验证,本发明用到的胺与酚大多商业可得,操作处理方便,无需特别纯化处理。本发明仅需将所有反应物混合加热即可一步较高产率得到芳胺化合物。本发明底物官能团兼容性好,能够应用于复杂生物活性分子以及药物分子,如雌酚酮、脱氢枞胺、帕罗西汀、阿莫沙平(例34~37)的后期修饰。
[0154]
本领域普通技术人员可以理解,以上所述仅为发明的优选实例而已,并不用于限制发明,尽管参照前述实例对发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实例记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在发明的精神和原则之内,所做的修改、等同替换等均应包含在发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1