研究药物肠道菌群代谢的体外模型的构建和分析方法与流程
1.本发明涉及药学领域,尤其涉及一种研究药物肠道菌群代谢的体外模型的构建和分析方法。
背景技术:
2.相同剂量的药物在不同的受试者体内,往往展现出不同的效果,这就是“个体药物反应”。产生这一现象的原因有多种,比如药物代谢酶、转运体、肠道菌群等等。药物代谢酶和转运体的研究方法已经成熟,也有相关指导原则。近年来,对肠道菌群对药物代谢的影响,引起了越来越多的重视及研究。然而,由于肠道菌群本身的复杂性,包括肠道不同部位之间菌群的差异,不同收集时间,不同品系,食物等影响因素,导致目前肠道菌群体外研究模型各不相同,所得结果也因此差异较大。
3.在人类的肠道中,存在着大量微生物。这些肠道微生物除了传统意义上的肠道细菌群,还包括古细菌、病毒和原生动物,其中98%以上是细菌,统称为肠道菌群。正常肠道菌群有500~1500种不同细菌种类,其中绝大多数为厌氧菌。从基因层面上看,人体自身的基因组大约携带了2.5万个基因,而人体肠道微生物编码的基因总数约是人自身基因总数的150倍,被视作人类“第二基因组”。多数药物通过胃肠道进入人体,被人体吸收,从而发挥作用,因此有必要研究药物被肠道菌群代谢的情况。如果能够通过一套有效的方法在体外对肠道菌群代谢药物的情形进行研究将非常有助于解决个体药物反应导致的不良问题,从而真正做好同病不同药。
技术实现要素:
4.为了建立统一规范并简单易行的肠道菌群体外研究药物模型并对其进行有效分析,本发明公开了一种研究药物的肠道菌群代谢的体外模型的构建和分析方法,包括以下步骤:
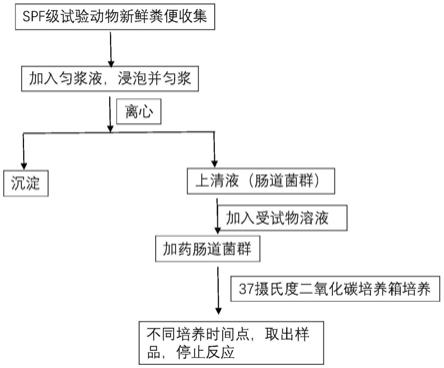
5.s1、粪便收集;
6.s2、加入匀浆液,浸泡、匀浆;
7.s3、离心,取上清液,得到肠道菌群溶液;
8.s4、将受试物溶液、溶解所述受试物的溶剂、奥美拉唑溶液分别加入一定量的所述步骤s3得到的肠道菌群溶液中制备获得受试物组、空白对照组和阳性对照组;
9.s5、将所述受试物组、所述空白对照组和所述阳性对照组放入厌氧培养密封盒,再放入二氧化碳培养箱进行培养,培养温度为37℃;
10.s6、到需要的培养时间点后,取出,并加入有机试剂停止厌氧培养;
11.s7、所得样品进行lc-ms/ms分析。
12.在一些实施方案中,所述步骤s1为收集2小时以内的新鲜粪便。
13.在一些具体实施方式中,所述步骤s1中:所述粪便来自spf级试验动物;所述spf级试验动物的数量为2-4只。
14.在另一些具体实施方式中,所述步骤s1中:所述粪便来自自然人。
15.在一些实施方案中,所述步骤s2中的匀浆液为磷酸钾盐缓冲液。
16.进一步地,所述步骤s2中:所述磷酸钾盐缓冲液的浓度为0.1m
±
0.05m,ph为7.4
±
0.2;采用8-10倍所述粪便体积的所述磷酸盐缓冲液浸泡,采用匀浆机匀浆。优选地,所述步骤s2中:所述磷酸钾盐缓冲液的浓度为0.1m,ph为7.4;采用9倍所述粪便体积的所述磷酸盐缓冲液浸泡,采用匀浆机匀浆。
17.在一些实施方案中,所述步骤s3中:离心条件为1800-2200g离心速度下离心8-15分钟。
18.进一步地,所述步骤s3中:离心条件为2000g离心速度下离心10分钟。
19.在一些实施方案中,所述步骤s4中:所述受试物溶液和所述溶解受试物的溶剂以0.8%-1.5%的比例加入所述一定量的步骤s3得到的肠道菌群溶液;所述奥美拉唑溶液加入所述一定量的步骤s3得到的肠道菌群溶液后的终浓度为8-15μm。
20.在一些实施方案中,所述步骤s5中:所述厌氧培养密封盒中含有配套的氧气消耗和二氧化碳生成材料。进一步地,所述配套的氧气消耗和二氧化碳生成材料为商业化试剂mgc anaero pack。
21.在一些实施方案中,所述步骤s6中:所述有机试剂选自甲醇、乙腈中的一种或多种。
22.在一些实施方案中,所述步骤s6中:使用2-5倍样品体积的所述有机试剂停止厌氧培养。
23.进一步地,所述步骤s6中:使用3倍样品体积的所述有机试剂停止厌氧培养。
24.本发明通过对动物肠道菌群代谢的体外模型进行建立和优化,建立了一种统一规范并简单易行的动物肠道菌群体外研究模型,从而提供了一种研究药物的肠道菌群代谢的体外模型的构建和分析方法,在保证体外研究结果可靠的基础上,有效提高肠道菌群代谢研究结果的可操作性,从而有助于解决个体药物反应导致的不良问题,真正做好个体化用药。
25.以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
26.图1是本发明一个具体实施方式的流程图。
27.图2是10μm受试物a经小鼠肠道菌群孵育后代谢物谱。其中,a是受试物a加入肠道菌群溶液后立即检测的高效液相色谱联用放射性检测(hplc-ram)图谱,即0小时时的hplc-ram图谱;b是受试物a加入肠道菌群溶液后24小时时的hplc-ram图谱;c是受试物a加入肠道菌群溶液后48小时时的hplc-ram图谱。
28.图3是10μm奥美拉唑经小鼠肠道菌群孵育后代谢物谱。其中,a是奥美拉唑加入肠道菌群溶液后立即检测的高效液相与质谱联用(hplc-ms)图谱,即0小时时的hplc-ms图谱;b是奥美拉唑加入肠道菌群溶液后24小时时的hplc-ms图谱;c是奥美拉唑加入肠道菌群溶液后48小时时的hplc-ms图谱。
具体实施方式
29.为了使发明实现的技术手段、创造特征、达成目的和功效易于明白了解,下结合具体图示,进一步阐述本发明。但本发明不仅限于以下实施的案例。
30.须知,本说明书所附图式所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。
31.实施例1
32.如图1所示,本实施例的具体技术流程如下:
33.1.收集spf级动物(比如小鼠)的新鲜粪便,收集时间为两小时,动物只数为大于3只。
34.2.将收集的新鲜粪便,加入9倍体积的0.1m磷酸钾盐缓(ph 7.4)冲液浸泡,并用匀浆机匀浆。
35.3.将粪便匀浆液,在2000g的离心速度下离心10分钟。
36.4.收集上清液,即得动物肠道菌群溶液。
37.5.将需要研究的受试物配制成溶液,并按1%比例添加到肠道菌群溶液中,可根据需要分装成不同份。
38.6.准备微生物培养所用厌氧培养密封盒,加入配套的氧气消耗和二氧化碳生成材料。
39.7.将分装的添加或不添加受试物的肠道菌群溶液放入厌氧培养密封盒,放入二氧化碳培养箱进行培养,温度设置为37摄氏度。添加受试物的样品作为受试物组;不添加受试物的样品为空白对照组,用于代谢产物鉴定背景扣除。同时设置阳性对照组,用于验证肠道菌群孵育体系的可靠性。阳性对照组为:在肠道菌群溶液中,最终浓度为10μm的奥美拉唑,并与受试物组和空白对照组在相同条件孵育相同的时间。
40.8.到不同的培养时间点,取出样品(包含受试物组、空白对照组和阳性对照组)并加入有机试剂试剂停止厌氧培养。
41.9.所得样品进行lc-ms/ms分析。
42.实施例2
43.本实施例采用人的粪便,且不同人的粪便单独处理,需要混合在一起形成肠道菌群溶液。其他与实施例1同。
44.实施例3
45.小鼠肠道菌群溶液按实施例1所述方法新鲜制备;最终浓度为10μm的受试物a,在厌氧培养密封盒37摄氏度经肠道菌群孵育0、24和48小时;设置最终浓度为10μm的奥美拉唑,相同条件下孵育0、24和48小时,作为阳性对照。在0、24和48小时,加入3倍体积的有机试剂提取,上清液用于lc-ram/ms分析。受试物a经过小鼠肠道菌群孵育24和48小时以后,主要有代谢产物m1和代谢产物m2(如图2)。阳性对照奥美拉唑,经经过小鼠肠道菌群孵育24和48小时以后,主要产生脱氧代谢产物(如图3),奥美拉唑孵育后,全部代谢成脱氧代谢产物,证明此孵育体系(研究药物的肠道菌群代谢的体外模型)功能正常,本研究药物的肠道菌群代
谢的体外模型的构建和分析方法正确可靠。
46.以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1