从胎盘组织中扩增自然杀伤细胞的方法与流程
1.本发明涉及一种从胎盘绒毛小叶组织及胎盘血来源细胞的培养扩增自然杀伤细胞的方法,属于生物工程技术领域。
背景技术:
2.自然杀伤细胞(nk细胞)于30年前在外周血中被发现,cd3-cd56+淋巴细胞被定义为人nk细胞。nk细胞通常含有大量穿孔素(perforin)和颗粒酶b(granzyme b),当激活的nk细胞遇到靶细胞时,nk细胞释放穿孔素和颗粒酶b攻击靶细胞。nk细胞还可以分泌ifn-γ、tnf-α、gm-csf和il-3等细胞因子,这些细胞因子可以直接作用于靶细胞,也可以通过激活其他种类的免疫细胞攻击靶细胞。
3.有文献(koepsell sa,miller js,mckenna dh jr.natural killer cells:a review of manufacturing and clinical utility.transfusion.2013,53(2):404-10)报道,浸润到肿瘤组织中的nk细胞数量尽管非常少,但是nk细胞浸润到肿瘤组织的患者能明显的观察到其生存期的显著延长,及其肿瘤扩散比率的显著降低。与健康人的nk细胞相比,肿瘤患者nk细胞浸润到肿瘤组织中的杀伤能力显著降低。
4.另外,肿瘤患者的nk细胞表面抑制受体如cd158a、cd158b和nkg2a表达显著上升,而激活受体如nkg2d、nkg2c、npp30和cd69则显著下降。现有研究数据表明,癌症患者的nk细胞严重受损,这使得它们无法消灭肿瘤细胞。但这为肿瘤的免疫治疗提供了一个契机,即通过体外细胞活化和扩增的方法恢复或者重建nk细胞抗肿瘤的能力,提高nk细胞对肿瘤免疫治疗的效果。已经报道的许多临床前研究表明,nk细胞作为一种有效地免疫治疗方法可以用于治疗各种肿瘤。
5.一些nk细胞临床研究的细胞制备方法已经有可能被转化成为临床级或者是cgmp级的标准制备过程(lapteva n,durett ag,et al.large-scale ex vivo expansion and characterization of natural killer cells for clinical applications.cytotherapy.2012,14(9):1131-43)。在这些报道的nk细胞制备方法中,大多使用外周血、脐血、骨髓中的单个核细胞作为培养nk细胞的样本。另外,还有文献(campbell ks,hasegawa j.natural killer cell biology:an update and future directions.j allergy clin immunol.2013,132(3):536-44)报道,体外扩增nk细胞,有多种因素都会影响到nk细胞的数量,从而降低nk细胞扩增的可能性。
6.胎盘作为连接胎儿和母体的重要器官,其结构较为复杂,至少可分为胎盘脐带连接、羊膜包被层、绒毛膜板、绒毛组织、底蜕膜等包含不同种类细胞的组织。现有研究表明,同一份胎盘至少可以获得包括造血(祖)干细胞、绒毛血管内皮干细胞以及绒毛膜、羊膜以及绒毛组织来源的间充质干细胞等不同种类的细胞。胎盘在胎儿发育早期也是重要的造血器官,研究表明,绒毛及其绒毛小叶结构中血管成分来源的内皮干细胞和造血祖细胞,在造血过程起着重要作用。在胎盘发育早期存在造血内皮组织,主要存在绒毛小叶结构之中,胎盘小叶结构中的血管内皮在一定条件下可以从血管内皮脱落、或造血内皮细胞失去表达钙
黏素5发育成为血液中的悬浮细胞,成为具备造血分化功能的干细胞。
7.胎儿分娩后胎盘中不仅留存着丰富的造血前体或造血(祖)干细胞,而且可分离得到大量的原始免疫细胞,再经体外扩增诱导为nk等过继性免疫治疗细胞用于临床辅助回输治疗。当前脐带血造血干细胞移植中造血(祖)干细胞(cd34+)细胞数量已成为临床移植植入的关键因素之一,然而单份脐带血cd34+细胞数量有限,造成植入周期较长,临床治疗费用较高,增加移植临床的风险。解决当前脐带血造血干细胞数量,可以在移植后给予辅助淋巴细胞输注提高植入效率,也可以采用移植时辅助给予间充质干细胞输注以降低gvhd不良反应。但这些措施一般只采用异体来源的淋巴细胞或间充质干细胞辅助移植,会因引入异源细胞或抗原增加负反应强度和几率,进而增加临床移植失败的风险。
8.nk细胞主要分布于外周血液、肝脏、脾脏、围产期组织等,目前采集nk细胞的主要方式主要有两种:一种为通过静脉抽取外周血来制备获得nk细胞;另外一种则通过围产期组织来获取nk细胞及制备。由于部分人群痛觉神经较为敏感,且nk细胞在外周血的含量极低,因此抽取的外周血需要达到足够的数量才能满足临床治疗的需要。相对于此种方式,采用围产期组织来获取nk细胞无疑是更具有无可比拟的优势,尤其是新生儿围产组织胎盘中富含大量的nk细胞。而且围产组织来源的nk细胞会更原始,纯净度更高、干扰素表达能力更强,拥有更强的骨髓归巢功能,但同时免疫原性也更低,这不但规避了需要采集大量外周血液繁琐的步骤,同时也保证采集过程中人不会感受到痛苦。尤其是相较于成年人来讲,未成年人的免疫系统还不够完善,并不适用于静脉抽血的方式进行nk细胞的采集及后续的治疗,因此对于这部分特定的人群来说,围产期胎盘组织无疑是最理想的nk细胞来源。
9.目前nk细胞培养扩增的方法主要有两种,第一种是主要以滋养层细胞与nk细胞共培养来刺激nk细胞的增殖能力的,该方法虽然价格便宜、效果较稳定,并且能够获得数量可观的nk细胞,但其仍然存在诸多缺点,尤其是在临床应用中,其主要原因在于培养过程中选用的滋养层细胞为多为肿瘤细胞。尽管从理论上讲,经过相应处理的肿瘤细胞已经不再具备增殖的可能性。但其潜在风险难以证明可以完全排除。另外就是伦理方面的问题,将正常细胞与肿瘤细胞共培养,然后将培养后的nk细胞回输体内,确实存在难以克服的伦理障碍。另一种方法是细胞因子诱导扩增nk细胞,向nk细胞方向诱导,并配合相应的细胞培养基,使nk细胞大量增殖。纯因子细胞培养技术以其安全性高而著称,其原因在于所使用的细胞因子,都是体内环境原本就存在的。培养过程相当于模拟体内环境,促进nk细胞的激活及大量增殖。但目前采用传统细胞因子的方法如,白细胞介素-2(il-2)等,不但价格昂贵,体外扩增nk细胞的效果也不甚理想。因此亟需寻求一种新型的细胞因子,可高效的扩增nk细胞。
10.flt3配体(flt3-ligand,fl)是一种能够调节早期造血的关键性细胞因子,与iii型酪氨酸激酶受体flt3(fms-like tryosinekinase 3)结合,在多种疾病的病理生理过程中起重要的作用。fl可促进前b淋巴细胞、树突状细胞(dc)、自然杀伤(nk)细胞、细胞毒t淋巴细胞(ctl)的增殖、分化和成熟,从而具有重要的抗肿瘤作用。
11.从19世纪开始,就发现一些细菌毒素有抗癌作用。现在已经知道,它们的抗癌作用主要是通过身体的免疫系统,因此都归因于免疫治疗或者生物治疗的范围内。溶血性链球菌的制剂,比较有名的有ok432。1972年樱井等报道,ok432对实验肿瘤的有杀伤效果。80年代的不少报道,指出了ok432激活免疫系统的作用。ok432亦常与其他治疗综合应用。ok432是由溶血性莲球菌株经青霉素处理、冷冻干燥制成的菌苗。主要通过免疫增强发挥其治疗
作用,ok432的治疗作用由免疫细胞介导和细胞因子介导,激活的中性粒细胞能够杀死ifn-γ或者tnf-α处理的癌细胞。ok432诱导的中性粒细胞对自体瘤细胞的杀伤作用通过cd11b/cd18和icam-1之间的反应实现的。ok432诱导的单核细胞能够杀死自体瘤细胞,ok432刺激淋巴细胞后,显示出lak细胞活性,这种激活的淋巴细胞对抗nk细胞的瘤细胞都显示出活性。
12.目前从血液(例如胎盘血、脐带血、外周血)中分离提取单个核细胞的方法常为人工使用密度为1.077g/ml的聚蔗糖溶液,该方法具有很多的局限性,比如提取耗时过长(单次实验多在2~3小时之间)、提取的单个核细胞数量较少、纯度过低等情况,这极大的影响了后续实验的进行,这一方面亦存在改进的必要。
13.然而,本领域仍然存在培养自然杀伤细胞的方法的需求,例如仍然存在培养胎盘来源的自然杀伤细胞的方法的需求。
技术实现要素:
14.本发明的目的在于提供一种培养自然杀伤细胞的方法,尤其是提供一种培养胎盘来源的自然杀伤细胞的方法,本发明人从胎盘小叶组织中提取单个核细胞(mononuclear cell,mnc),并在体外添加il-15、flt3-l细胞因子及ok432制剂诱导扩增nk细胞的方法,呈现优异的技术效果,本发明基于此类发现而得以完成。
15.为此,本发明第一方面提供了培养自然杀伤细胞的方法,其包括如下步骤:
16.(1)将细胞密度为0.5~1.5
×
106/ml(例如1
×
106/ml)胎盘mnc细胞悬液(例如20ml)接种至一个培养瓶(例如t75培养瓶)中,然后向培养瓶中添加il-15 50ng/ml、flt3-l 10ng/ml、ok432 10ng/ml,混匀后将培养瓶置于37℃、5%co2培养箱中培养;
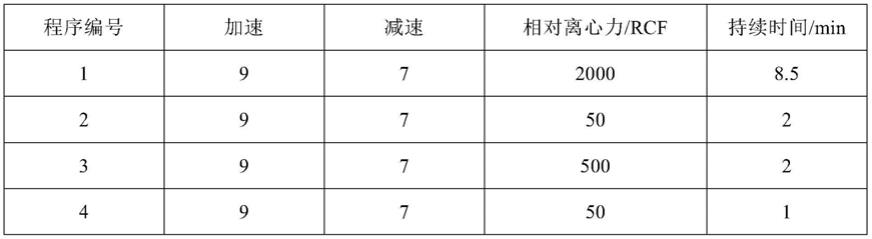
17.(2)每48h向培养瓶中补加il-15 50ng/ml、flt3-l 10ng/ml、ok43210ng/ml,每48~72h向培养瓶中补加nk细胞完全培养基,并调整细胞密度为0.5~1.5
×
106/ml,当培养的细胞悬液总体积达到200ml时,将细胞悬液转移至g-rex培养瓶中继续培养至14天;
18.(3)培养结束后,将细胞悬液吸出至离心瓶中,1500rpm、8min、25℃离心;结束后弃上清液,用pbs重悬细胞沉淀,得到自然杀伤细胞。
19.根据本发明第一方面的方法,步骤(1)和步骤(2)中随所述il-15一起还添加硝酸亚铁7μg/ml和苏氨酸60μg/ml。
20.根据本发明第一方面的方法,所述nk细胞完全培养基是以x vivo 15培养基作为基础培养基,在其中增补添加2.5%血清替代物(serum replacement,)、1mm酪氨酸、2mm的l-谷氨酰胺。
21.根据本发明第一方面的方法,所述pbs是ph6.8的磷酸盐缓冲液,其制法是:取0.2mol/l磷酸二氢钾溶液250ml,加0.2mol/l氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,即得。
22.根据本发明第一方面的方法,所述胎盘mnc细胞悬液是照包括如下步骤的方法制备得到的:
23.(i)将胎盘血和胎盘小叶组织细胞悬液混匀,用无菌注射器抽取混合液注入到含抗凝剂3.2%枸橼酸钠溶液的采血袋内,抗凝剂与生物样本的体积比为1:12,混匀后放置于摇摆器上慢速摇摆15min;
24.(ii)将自动化分离设备的一次性使用分离杯的塑料针头插入到采血袋上的无菌接口内,将采血袋挂起,使其中的血液自然流入分离杯内的中央舱室;用无菌接合仪焊接管路将血液采集袋与一次性分离杯分离;
25.(iii)将一次性分离杯配平后放置于市售的可编程的离心机中进行离心操作,离心程序参数如下:
26.程序编号加速减速相对离心力/rcf持续时间/min19720008.529750239750024975015972500.5697501
27.执行上述离心操作后从一次性分离杯的回收舱室获得细胞浓缩层,用nk细胞完全培养基将该细胞浓缩层稀释并调整细胞密度,得到胎盘mnc细胞悬液。
28.根据本发明第一方面的方法,所述胎盘血是照包括如下步骤的方法制备得到的:
29.(a)胎盘清洗:使用手术镊将胎盘组织取出,放入不锈钢托盘中,用含青霉素-链霉素-两性霉素的组织清洗液对胎盘表面进行冲洗,去除表面上的凝血污渍;
30.(b)用剪刀、镊子钝性剥离并丢弃胎盘表面的羊膜层,剪去其上的脐带组织;然后用剪刀将剩余的胎盘小叶组织剪成3~7cm3的小块,取一300目不锈钢过滤网放置在不锈钢杯上,将小块胎盘小叶组织放在300目不锈钢过滤网上,用勺子挤压全部的胎盘小叶组织,以挤出其内的胎盘血流入至不锈钢杯内,收集胎盘血。
31.根据本发明第一方面的方法,所述组织清洗液是通过如下方式配制所得溶液:用0.9%氯化钠注射液配制成含青霉素100u/ml、链霉素0.1mg/ml和0.25μg/ml两性霉素b的溶液,过滤除菌,即得。
32.根据本发明第一方面的方法,所述胎盘小叶组织细胞悬液是照包括如下步骤的方法制备得到的:
33.(c)在250ml离心杯中添加25~30ml的hbss缓冲液,将挤压完胎盘血的胎盘小叶组织小块放入离心杯中,用剪子将小叶组织进一步剪碎成0.5~1mm3,然后转移至300目筛网上,用hbss缓冲液进行过滤,并使用hbss缓冲液再清洗两次,清洗至滤液清澈;将清洗后的组织加入已预热至37℃的组织消化液100ml中,充分混匀,用封口膜封口后,于摇床中振荡消化30min(37℃,100rpm)。
34.(d)消化结束后,将装组织消化液的离心杯放入安全柜,倒入组织清洗液,使用300目滤网过滤。再用400ml组织清洗液多次洗涤组织,收集滤清液;将滤清液倾倒入若干250ml离心杯中,放入离心机,进行1500rpm、8min、25℃离心;离心结束后,弃上清液,再次用组织清洗液重悬细胞沉淀,充分混匀后再次以1500rpm、8min、25℃离心;
35.(e)离心结束后,弃上清,用含10%胎牛血清的dmem/f12培养基重悬细胞悬液,至50ml离心管中,以1800rpm、10min、25℃离心,离心结束后弃上清液,收集细胞沉淀,用pbs重悬,得到胎盘小叶组织细胞悬液。
36.根据本发明第一方面的方法,所述组织消化液是照如下方式制备得到的:
37.①
向i型胶原酶粉末中添加pbs,充分混匀溶解,配置成浓度为10mg/ml的i型胶原酶溶液;
38.②
向ii型胶原酶粉末中添加hbss缓冲液,充分混匀溶解,配置成浓度为10mg/ml的ii型胶原酶溶液;
39.③
向dna酶中添加hbss缓冲液,充分混匀溶解,配置成浓度为10mg/ml的dna酶溶液;
40.④
向嗜热菌蛋白酶粉末中添加缓冲液,充分混匀溶解,配置成浓度为10mg/ml的蛋白酶溶液;
41.⑤
将以上所得i型胶原酶溶液、ii型胶原酶溶液、dna酶溶液、蛋白酶溶液按5:5:7:5的比例进行混合,配置成为组织消化液。
42.根据本发明第一方面的方法,所述pbs是ph6.8的磷酸盐缓冲液,其制法是:取0.2mol/l磷酸二氢钾溶液250ml,加0.2mol/l氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,即得。
43.根据本发明第一方面的方法,所述hbss缓冲液是通过如下方式配制所得溶液:将8.0g的nacl、0.4g的kcl、0.1g的mgso4
·
7h2o、0.1g的mgcl2
·
6h2o、0.06g的na2hpo4
·
2h2o、0.06g的kh2po4、1.0g的葡萄糖、0.14g的cacl2、0.35g的nahco3加蒸馏水至1000ml溶解并调ph至7.4,过滤除菌,摇匀,即得。
44.根据本发明第一方面的方法,其包括实施例1~4所述的过程。
45.根据本发明第一方面的方法,其包括如下步骤:
46.a:胎盘血的获取
47.1、胎盘清洗:使用手术镊将胎盘组织(50g)取出,放入不锈钢托盘中,用少量含青霉素-链霉素-两性霉素的组织清洗液对胎盘表面进行冲洗,去除表面上的凝血污渍;[例如,所用的组织清洗液是通过如下方式配制所得溶液:用0.9%氯化钠注射液配制成含青霉素100u/ml、链霉素0.1mg/ml和0.25μg/ml两性霉素b的溶液,过滤除菌,即得];
[0048]
2、用剪刀、镊子钝性剥离并丢弃胎盘表面的羊膜层,剪去其上的脐带组织。然后用剪刀将剩余的胎盘小叶组织剪成3~7cm3的小块,取一300目不锈钢过滤网放置在不锈钢杯上,将小块胎盘小叶组织放在300目不锈钢过滤网上,用勺子挤压全部的胎盘小叶组织,以挤出其内的胎盘血流入至不锈钢杯内,收集胎盘血。
[0049]
b:胎盘小叶组织的消化
[0050]
1、消化液的配置:
[0051]
①
向i型胶原酶粉末中添加pbs,充分混匀溶解,配置成浓度为10mg/ml的i型胶原酶溶液;[例如,所用的pbs是ph6.8的磷酸盐缓冲液,其制法是:取0.2mol/l磷酸二氢钾溶液250ml,加0.2mol/l氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,即得];
[0052]
②
向ii型胶原酶粉末中添加hbss缓冲液,充分混匀溶解,配置成浓度为10mg/ml的ii型胶原酶溶液;[例如,所用的hbss缓冲液是通过如下方式配制所得溶液:将8.0g的nacl、0.4g的kcl、0.1g的mgso4
·
7h2o、0.1g的mgcl2
·
6h2o、0.06g的na2hpo4
·
2h2o、0.06g的kh2po4、1.0g的葡萄糖、0.14g的cacl2、0.35g的nahco3加蒸馏水至1000ml溶解并调ph至7.4,过滤除菌,摇匀,即得];
[0053]
③
向dna酶中添加hbss缓冲液,充分混匀溶解,配置成浓度为10mg/ml的dna酶溶
液;
[0054]
④
向嗜热菌蛋白酶粉末中添加缓冲液,充分混匀溶解,配置成浓度为10mg/ml的蛋白酶溶液;
[0055]
⑤
将以上所得i型胶原酶溶液、ii型胶原酶溶液、dna酶溶液、蛋白酶溶液按5:5:7:5的比例进行混合,配置成为组织消化液;
[0056]
2、在250ml离心杯中添加25~30ml的hbss缓冲液,将实施例1挤压完胎盘血的胎盘小叶组织小块放入离心杯中,用剪子将小叶组织进一步剪碎成0.5~1mm3,然后转移至300目筛网上,用hbss缓冲液进行过滤,并使用hbss缓冲液再清洗两次,清洗至滤液清澈。将清洗后的组织加入已预热至37℃的组织消化液100ml中,充分混匀,用封口膜封口后,于摇床中振荡消化30min(37℃,100rpm)。
[0057]
3、消化结束后,将装组织消化液的离心杯放入安全柜,倒入组织清洗液,使用300目滤网过滤。再用400ml组织清洗液多次洗涤组织,收集滤清液。将滤清液倾倒入若干250ml离心杯中,放入离心机,进行1500rpm、8min、25℃离心。离心结束后,弃上清液,再次用组织清洗液重悬细胞沉淀,充分混匀后再次以1500rpm、8min、25℃离心。
[0058]
4、离心结束后,弃上清,用含10%胎牛血清的dmem/f12培养基重悬细胞悬液,至50ml离心管中,以1800rpm、10min、25℃离心,离心结束后弃上清液,收集细胞沉淀,用pbs重悬,得到胎盘小叶组织细胞悬液。
[0059]
c:利用自动化分离设备提取胎盘血及胎盘细胞悬液中的单个核细胞
[0060]
1、将a所得胎盘血和b所得胎盘小叶组织细胞悬液混匀,用无菌注射器抽取混合液注入到含抗凝剂3.2%枸橼酸钠溶液的200ml采血袋内,抗凝剂与生物样本的体积比为1:12,混匀后放置于摇摆器上慢速摇摆15min;
[0061]
2、将自动化分离设备的一次性使用分离杯的塑料针头插入到采血袋上的无菌接口内,将采血袋挂起,使其中的血液自然流入分离杯内的中央舱室;用无菌接合仪焊接管路将血液采集袋与一次性分离杯分离。
[0062]
3、将一次性分离杯配平后放置于市售的可编程的离心机中进行离心操作,离心程序参数如下:
[0063]
程序编号加速减速相对离心力/rcf持续时间/min19720008.529750239750024975015972500.5697501
[0064]
执行上述离心操作后从一次性分离杯的回收舱室获得细胞浓缩层,用nk细胞完全培养基将该细胞浓缩层稀释并调整细胞密度,得到胎盘mnc细胞悬液。
[0065]
d:胎盘来源的单个核细胞(mnc)扩增nk细胞
[0066]
1、将c所得胎盘mnc细胞悬液用nk细胞完全培养基调整细胞密度为1
×
106/ml,接种至t75培养瓶中,每瓶添加的细胞悬液约20ml,然后向培养瓶中添加il-15 50ng/ml、flt3-l 10ng/ml、ok43 10ng/ml、硝酸亚铁7μg/ml和苏氨酸60μg/ml,混匀后将培养瓶置于
37℃、5%co2培养箱中培养;
[0067]
2、每48h向培养瓶中补加il-15 50ng/ml、flt3-l 10ng/ml、ok432 10ng/ml、硝酸亚铁7μg/ml和苏氨酸60μg/ml,每48~72h向培养瓶中补加nk细胞完全培养基,并调整细胞密度为0.5~1.5
×
106/ml,当培养的细胞悬液总体积达到200ml时,将细胞悬液转移至g-rex培养瓶中继续培养至14天;
[0068]
3、培养结束后,将细胞悬液吸出至250ml离心瓶中,1500rpm、8min、25℃离心;结束后弃上清液,用pbs重悬细胞沉淀,调整细胞密度为1
×
106/ml,得到自然杀伤细胞。
[0069]
在本发明上述各种操作步骤中,虽然其描述的具体步骤在某些细节上或者语言描述上与下文具体实施方式部分的制备例中所描述的步骤有所区别,然而,本领域技术人员根据本发明全文的详细公开完全可以概括出以上所述方法步骤。
[0070]
本发明的任一方面的任一实施方案,可以与其它实施方案进行组合,只要它们不会出现矛盾。此外,在本发明任一方面的任一实施方案中,任一技术特征可以适用于其它实施方案中的该技术特征,只要它们不会出现矛盾。下面对本发明作进一步的描述。
[0071]
本发明所引述的所有文献,它们的全部内容通过引用并入本文,并且如果这些文献所表达的含义与本发明不一致时,以本发明的表述为准。此外,本发明使用的各种术语和短语具有本领域技术人员公知的一般含义,即便如此,本发明仍然希望在此对这些术语和短语作更详尽的说明和解释,提及的术语和短语如有与公知含义不一致的,以本发明所表述的含义为准。
[0072]
本发明通过采用封闭式多细胞组分自动化分离系统可以在短时间内从胎盘小叶组织悬液及胎盘血中,直接分离出单个核细胞,保证了采集分离出的细胞具有高度的原始性,并且,经由该分离系统分离后,可直接分离为三种组分:红细胞、血浆、单个核细胞悬液;血浆及红细胞悬液可进一步进行其他工艺流程的物料准备。
[0073]
本发明从胎盘小叶组织及胎盘血中提取的单个核细胞(mononuclear cell,mnc)在体外通过添加il-15、flt3-l细胞因子及ok432制剂,诱导扩增nk细胞。
[0074]
本发明使用的封闭式多细胞组分自动化分离系统包括一次性使用分离杯,该分离杯包括单独的回收舱室(红细胞回收舱、细胞浓缩回收舱)、中央舱室(血浆回收舱)和集成的夹紧机制。分离系统的控制模块组件是一个微处理器控制的设备,在离心过程中与一次性使用分离杯结合使用,以引导红细胞、浓缩的单有核细胞(细胞浓缩液)及血浆转移到一次性使用分离杯内的独立舱室中。离心后,将控制模块放置在对接站上,以便使用datatrak软件下载处理数据。
[0075]
本发明方法呈现如说明书所述优良技术效果。
附图说明
[0076]
图1:nk细胞扩增生长曲线。
[0077]
图2:nk细胞流式表型。
具体实施方式
[0078]
通过下面的实施例可以对本发明进行进一步的描述,然而,本发明的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以
对本发明进行各种变化和修饰。本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细的描述。
[0079]
实施例1:胎盘血的获取
[0080]
1、胎盘清洗:使用手术镊将胎盘组织(50g)取出,放入不锈钢托盘中,用少量含青霉素-链霉素-两性霉素的组织清洗液对胎盘表面进行冲洗,去除表面上的凝血污渍;[在本发明中,如未另外说明,所用的组织清洗液是通过如下方式配制所得溶液:用0.9%氯化钠注射液配制成含青霉素100u/ml、链霉素0.1mg/ml和0.25μg/ml两性霉素b的溶液,过滤除菌,即得];
[0081]
2、用剪刀、镊子钝性剥离并丢弃胎盘表面的羊膜层,剪去其上的脐带组织。然后用剪刀将剩余的胎盘小叶组织剪成3~7cm3的小块,取一300目不锈钢过滤网放置在不锈钢杯上,将小块胎盘小叶组织放在300目不锈钢过滤网上,用勺子挤压全部的胎盘小叶组织,以挤出其内的胎盘血流入至不锈钢杯内,收集胎盘血。
[0082]
实施例2:胎盘小叶组织的消化
[0083]
1、消化液的配置:
[0084]
①
向i型胶原酶粉末中添加pbs,充分混匀溶解,配置成浓度为10mg/ml的i型胶原酶溶液;[在本发明中,如未另外说明,所用的pbs是ph6.8的磷酸盐缓冲液,其制法是:取0.2mol/l磷酸二氢钾溶液250ml,加0.2mol/l氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,即得];
[0085]
②
向ii型胶原酶粉末中添加hbss缓冲液,充分混匀溶解,配置成浓度为10mg/ml的ii型胶原酶溶液;[在本发明中,如未另外说明,所用的hbss缓冲液是通过如下方式配制所得溶液:将8.0g的nacl、0.4g的kcl、0.1g的mgso4
·
7h2o、0.1g的mgcl2
·
6h2o、0.06g的na2hpo4
·
2h2o、0.06g的kh2po4、1.0g的葡萄糖、0.14g的cacl2、0.35g的nahco3加蒸馏水至1000ml溶解并调ph至7.4,过滤除菌,摇匀,即得];
[0086]
③
向dna酶中添加hbss缓冲液,充分混匀溶解,配置成浓度为10mg/ml的dna酶溶液;
[0087]
④
向嗜热菌蛋白酶粉末中添加缓冲液,充分混匀溶解,配置成浓度为10mg/ml的蛋白酶溶液;
[0088]
⑤
将以上所得i型胶原酶溶液、ii型胶原酶溶液、dna酶溶液、蛋白酶溶液按5:5:7:5的比例进行混合,配置成为组织消化液;
[0089]
2、在250ml离心杯中添加25~30ml的hbss缓冲液,将实施例1挤压完胎盘血的胎盘小叶组织小块放入离心杯中,用剪子将小叶组织进一步剪碎成0.5~1mm3,然后转移至300目筛网上,用hbss缓冲液进行过滤,并使用hbss缓冲液再清洗两次,清洗至滤液清澈。将清洗后的组织加入已预热至37℃的组织消化液100ml中,充分混匀,用封口膜封口后,于摇床中振荡消化30min(37℃,100rpm)。
[0090]
3、消化结束后,将装组织消化液的离心杯放入安全柜,倒入组织清洗液,使用300目滤网过滤。再用400ml组织清洗液多次洗涤组织,收集滤清液。将滤清液倾倒入若干250ml离心杯中,放入离心机,进行1500rpm、8min、25℃离心。离心结束后,弃上清液,再次用组织清洗液重悬细胞沉淀,充分混匀后再次以1500rpm、8min、25℃离心。
[0091]
4、离心结束后,弃上清,用含10%胎牛血清的dmem/f12培养基重悬细胞悬液,至50ml离心管中,以1800rpm、10min、25℃离心,离心结束后弃上清液,收集细胞沉淀,用pbs重悬,得到胎盘小叶组织细胞悬液。
[0092]
实施例3:利用自动化分离设备提取胎盘血及胎盘细胞悬液中的单个核细胞
[0093]
1、将实施例1所得胎盘血和实施例2所得胎盘小叶组织细胞悬液混匀,用无菌注射器抽取混合液注入到含抗凝剂3.2%枸橼酸钠溶液的200ml采血袋内,抗凝剂与生物样本的体积比为1:12,混匀后放置于摇摆器上慢速摇摆15min;
[0094]
2、将自动化分离设备的一次性使用分离杯的塑料针头插入到采血袋上的无菌接口内,将采血袋挂起,使其中的血液自然流入分离杯内的中央舱室;用无菌接合仪焊接管路将血液采集袋与一次性分离杯分离。
[0095]
[自动化分离设备是一种自动化单个核细胞分离系统,即封闭式多细胞组分自动化分离系统,供应商为无锡博雅感知医疗科技有限公司,生产商为美国thermogenesis公司]
[0096]
3、将一次性分离杯配平后放置于市售的可编程的离心机(例如thermo scientific
tm
、sorvall
tm
、legend
tm xt或xtr等品牌/型号的离心机)中进行离心操作,离心程序参数如下:
[0097][0098][0099]
执行上述离心操作后从一次性分离杯的回收舱室获得细胞浓缩层,用nk细胞完全培养基将该细胞浓缩层稀释并调整细胞密度,得到胎盘mnc细胞悬液。具体的离心操作如以下步骤s4~s10。
[0100]
s4、在离心的初始高速部分(2000rcf)期间,胎盘血样本中的细胞通过密度分层在一次性使用分离杯中分为三个组分层:(1)红细胞(rbc)层、(2)细胞浓缩层、(3)血浆层;
[0101]
s5、将速度降低至50rcf,并且在此第一次低速离心期间,大部分红细胞被引导至红细胞回收舱;
[0102]
s6、短暂增加速度500rcf,以进一步将处理室中的细胞分层;
[0103]
s7、再次降低至50rcf,进一步除去红细胞;
[0104]
s8、在采集血浆之前,相对离心力短暂增加至250rcf,在此期间,细胞浓缩层和血浆进一步分层。
[0105]
s9、再次降低至50rcf,细胞浓缩层通过输送管转移至回收舱室,使大部分血浆保
留在中央舱室中,离心机减速并停止旋转。[从一次性分离杯中可分别单独采集红细胞、细胞浓缩层(单有核细胞)及血浆,该分离过程仅需耗时15min]
[0106]
s10、利用无菌接管机连接一次性分离杯上回收舱室的管路和转移袋的管路,将细胞浓缩层即单个核细胞转移到转移袋内,获得细胞浓缩层(即单个核细胞)。
[0107]
在本发明中,如未另外说明,所用的nk细胞完全培养基是以x vivo 15培养基作为基础培养基,在其中增补添加2.5%血清替代物(serum replacement,)、1mm酪氨酸、2mm的l-谷氨酰胺]。
[0108]
实施例4:胎盘来源的单个核细胞(mnc)扩增nk细胞
[0109]
1、将实施例3所得胎盘mnc细胞悬液用nk细胞完全培养基调整细胞密度为1
×
106/ml,接种至t75培养瓶中,每瓶添加的细胞悬液约20ml,然后向培养瓶中添加il-15(白细胞介素-15)50ng/ml、flt3-l(flt3-配体)10ng/ml、ok432(一种由溶血性莲球菌su株经青霉素处理、冷冻干燥制成的菌苗,)10ng/ml、硝酸亚铁7μg/ml和苏氨酸60μg/ml,混匀后将培养瓶置于37℃、5%co2培养箱中培养;[在本发明中,上述添加il-15 50ng/ml是指向培养瓶中添加il-15至其浓度达到50ng/ml,其它物料的添加的类似表述亦有类似含义]
[0110]
2、每48h向培养瓶中补加il-15 50ng/ml、flt3-l 10ng/ml、ok432 10ng/ml、硝酸亚铁7μg/ml和苏氨酸60μg/ml,每48~72h向培养瓶中补加nk细胞完全培养基,并调整细胞密度为0.5~1.5
×
106/ml(必要时接种到若干t75培养瓶中),当培养的细胞悬液总体积达到200ml时,将细胞悬液转移至g-rex培养瓶(wilson wolf manufacturing公司)中继续培养至14天;
[0111]
3、培养结束后,将细胞悬液吸出至250ml离心瓶中,1500rpm、8min、25℃离心;结束后弃上清液,用pbs重悬细胞沉淀,调整细胞密度为1
×
106/ml,得到自然杀伤细胞,计算扩增后的细胞比例和数量。
[0112]
以下提供一些补充的实施例以进一步对本发明进行说明。实施例4a:参照实施例4进行胎盘来源的mnc扩增nk细胞,不同的仅是各操作中不添加硝酸亚铁也不添加苏氨酸,得到自然杀伤细胞,并计算扩增后的细胞比例和数量。实施例4b:参照实施例4进行胎盘来源的mnc扩增nk细胞,不同的仅是各操作中不添加硝酸亚铁,得到自然杀伤细胞,并计算扩增后的细胞比例和数量。实施例4c:参照实施例4进行胎盘来源的mnc扩增nk细胞,不同的仅是各操作中不添加苏氨酸,得到自然杀伤细胞,并计算扩增后的细胞比例和数量。实施例4d:参照实施例4进行胎盘来源的mnc扩增nk细胞,不同的仅是各操作中添加的硝酸亚铁改为等摩尔量的硝酸铁,得到自然杀伤细胞,并计算扩增后的细胞比例和数量。
[0113]
实施例5:胎盘来源的nk细胞表型检测
[0114]
1、将实施例4所得扩增后的细胞悬液调整密度为1
×
106/ml,取一流式试管,向试管中添加5ul的cd3-pe抗体(invitrogen公司),5ul的cd56-apc抗体(invitrogen公司),将细胞悬液200ul加入至流式管内,充分震荡混匀,在4℃下,避光孵育30min,赋予结束后,向试管内添加1ml的pbs,300g、5min、4℃离心。离心结束后,弃上清液,沉淀用500ul的pbs重悬后,混匀上机检测。
[0115]
2、打开bd facscantoii型流式细胞仪,预热后打开facsdiva分析软件,创建fsc-ssc散点图,并以淋巴细胞、单核细胞设门p1,另建四象限散点图fl1-fl2,以cd3为横坐标,cd56为纵坐标,观察扩增后的nk细胞表型,计算nk细胞的扩增倍数和效率。
[0116]
图1显示了实施例1~4方法所得nk细胞扩增生长曲线,图2显示了实施例1~4方法所得nk细胞流式表型。
[0117]
通过实施例1~4过程(即实施例4所得nk细胞)的nk细胞扩增效率的结果如下:初始胎盘单个核细胞总数=3.0
×
107、收获细胞总数=1.21
×
109、扩增倍数=40.3倍、细胞活率=99.9%、cd3-cd56+nk细胞比例=32.4%、初始nk细胞数量=1.1
×
106、收获后nk细胞数量=0.39
×
109、nk细胞扩增倍数=354倍。
[0118]
另外参照本实施例4的方法测试实施例4a~4d所得nk细胞。实施例4a方法的nk细胞扩增效率结果为:收获细胞总数=0.67
×
109、扩增倍数=22.3倍、细胞活率=94.4%、cd3-cd56+nk细胞比例=23.2%、收获后nk细胞数量=1.02
×
108、nk细胞扩增倍数=93倍;实施例4b~4d方法的nk细胞扩增效率结果为:扩增倍数=19~24倍、细胞活率=93.7%~95.2%、cd3-cd56+nk细胞比例=21.6%~24.2%、nk细胞扩增倍数=86~101倍。
[0119]
上述结果表明,本发明所述方法可以有效的扩增胎盘血和胎盘小叶组织来源的单个核细胞向nk细胞分化、扩增。总扩增倍数约40.3倍,总细胞数1.21
×
10e9;nk细胞扩增倍数354倍,明显优于其他方法培养的nk细胞。尤其是,本发明出人意料地发现,在进行nk细胞扩增时,通过向细胞培养液中同时增补添加硝酸亚铁和苏氨酸能够显著提高nk细胞的扩增效果。
[0120]
以上所述实施例仅是为充分说明本技术而所举的较佳的实施例,本技术的保护范围不限于此。本技术领域的技术人员在本技术基础上所作的等同替代或变换,均在本技术的保护范围之内。本技术的保护范围以权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1