一种快速、持续获取VASA阳性类生殖细胞的方法
一种快速、持续获取vasa阳性类生殖细胞的方法
技术领域
1.本发明涉及干细胞培养及生物医药领域。具体的,涉及一种快速、持续获取vasa阳性类生殖细胞的方法及其应用。
背景技术:
2.生殖细胞,也称为配子,是多细胞生物遗传物质代际传递的载体。自然界物种的延续和繁殖主要依赖于生殖细胞。不孕不育已成为一种常见病,全世界有15%的夫妇受到影响。多能干细胞是一种具有自我更新能力的多能细胞,理论上具有发育成包括生殖细胞在内的所有类型细胞的能力。多能干细胞体外分化为生殖细胞为治疗不孕不育症提供了一种可行的方法。 2003年以来,相关研究组陆续报道了各种体外诱导多能干细胞为生殖细胞的研究。
3.现有技术1(embryonic stem cells can form germ cells in vitro)公开了使用bmp4和bmp8a诱导小鼠胚胎干细胞分化,并获得了少量vasa阳性的生殖细胞。
4.现有技术2(reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells)公开了通过bfgf和激活素a短期刺激获得外胚层样细胞(epilc)。随后加入bmp4、bmp8a、lif、scf和egf,对这些外胚层样细胞进行大规模转化进入原始生殖细胞。
5.现有技术3(complete meiosis from embryonic stem cell-derived germ cells in vitro)首次实现了小鼠雄性生殖细胞诱导系统的完整体外重建,在该方法应用激活素a和bmps 促进生殖细胞增殖,仅仅是在现有技术2的基础上提供一种在体外进行的方法。
6.现有技术4(sox17 is a critical specifier of human primordial germ cell fate)和5(robust in vitro induction of human germ cell fate from pluripotent stem cells)公开了与小鼠类似,当使用含有bfgf、tgf-β、1% ksr的培养基和含有bmp2/4、lif、scf和egf的培养基分两阶段培养人胚胎干细胞时,大量人原始生殖细胞也可以获得。然而,以这种方式获得的原始生殖细胞也处于早期阶段。在这些细胞中,无法检测到晚期生殖细胞标记基因的表达,如 dazl和vasa。从hesc生成更成熟的原始生殖细胞仍然是一项重大挑战,尤其是采用与临床应用兼容的策略。
7.但是,上述方法均存在过程繁琐、耗时较长,以及无法持续产生的不足,难以满足临床需要。
技术实现要素:
8.essential 8培养基是一种成分明确,无动物来源的干细胞培养基,专为人类多能干细胞的生长和扩增而配制。在本发明中,我们发现在essential 8培养基培养的条件下,会不断出现一组vasa阳性细胞。这些vasa阳性细胞可以通过生殖报告系统vasa-gfp 报告基因进行富集,表达生殖细胞的显著特征。进一步发现,这些vasa阳性细胞只需要在e6+
tgf-β的条件下即可产生。因此,本发明提供了一套持续、快速获取vasa阳性类生殖细胞的方法。具体的:本发明第一方面,提供一种生长因子在诱导多能干细胞分化为类生殖细胞中的应用,所述的生长因子包括转化生长因子-β(transforming growth factor beta,tgf-β/tgfb)。
9.优选的,所述的生长因子还包括碱性成纤维细胞生长因子(basic fibroblast growth factor,fgf2/bfgf)、骨形态发生蛋白(bone morphogenetic protein 2、4、7、8a,bmp2、4、7、8a)、从胶质细胞源性神经营养因子(glialcellline-derivedneurotrophicfactor,gdnf)、表皮细胞生长因子(epidermal growth factor,egf)、白血病抑制因子(leukemia inhibitory factor,lif)和干细胞因子(stem cell factor,scf)中的一种或多种。
10.在一个具体的实施方式中,所述生长因子仅包含tgf-β。
11.优选的,所述的tgf-β浓度为1-3ng/ml。
12.优选的,所述的多能干细胞是ips细胞或es细胞。
13.优选的,所述的多能干细胞中包含vasa报告系统,进一步优选的,所述的vasa报告系统包含vasa启动子和报告基因,更优选的,所述的报告基因包括但不限于氯霉素乙酰基转移酶基因(cat)、人生长激素基因(hgh)、分泌型碱性磷酸酶基因(seap)、红色荧光蛋白基因(rfp)、绿色荧光蛋白基因(gfp)、增强绿色荧光蛋白基因(egfp)、β-半乳糖苷酶基因(β-gal)或萤火虫荧光素酶基因。更进一步优选的,所述的报告基因为egfp或gfp。
14.优选的,所述的类生殖细胞具有原始生殖细胞、分化的生殖细胞,例如精子或卵子细胞的性能。
15.优选的,所述的原始生殖细胞为早期的原始生殖细胞或成熟的原始生殖细胞,例如vasa阳性类生殖细胞,进一步优选的,所述的类生殖细胞同时表达vasa及egfp/gfp蛋白。
16.优选的,所述的vasa阳性类生殖细胞相对于不表达vasa报告系统的细胞,其成熟的原始生殖细胞标记物表达量增高,所述的标记物包括vasa,更优选的,所述标记物还包括blimp1、c-kit、dazl、dnd1、tfap2c、klf4、lin28a、sox2、nanos3和/或stella中的一种或者多种,进一步优选的,所述标记物blimp1、c-kit、dazl、lin28a、sox2、stella显著性增加。
17.更优选的,所述的vasa阳性类生殖细胞相对于不表达vasa报告系统的细胞,其以下标记物表达量降低,所述的标记物包括nanog和/或oct4,进一步优选的,所述标记物oct4显著性降低。
18.本发明第二方面,提供一种培养基,所述培养基包括基础培养基和生长因子,所述生长因子包括tgf-β。
19.优选的,所述tgf-β浓度为1-3ng/ml。
20.优选的,所述的生长因子还包括碱性成纤维细胞生长因子(fgf2,bfgf)、骨形态发生蛋白(bmp2、4、7、8a)、从胶质细胞源性神经营养因子(gdnf)、上皮细胞生长因子(egf)、白血病抑制因子(lif)和干细胞因子(scf)中的一种或多种。
21.在一个具体的实施方式中,所述生长因子仅包含tgf-β。
22.优选的,所述基础培养基可以是任意适合多能干细胞培养的基础培养基。例如:所述的基础培养基为无血清培养基,在一个具体的实施方式中,所述基础培养基为e6
(essential 6)、ko-dmem、ko-dmem/f12、dmem/f12、tl、dmem、α-mem、f-12、mem、bme、rpmi 1640、g-mem及其任意组合;在一个优选的实施方式中,所述基础培养基选自e6、ko-dmem、ko-dmem/f12、dmem/f12、tl、dmem、dmem/f12。
23.本发明第三方面,提供一种上述培养基在诱导多能干细胞分化为类生殖细胞中的应用。
24.优选的,所述的多能干细胞是ips细胞或es细胞。
25.优选的,所述的多能干细胞中包含vasa报告系统,进一步优选的,所述的vasa报告系统包含vasa启动子和报告基因,更优选的,所述的报告基因包括但不限于氯霉素乙酰基转移酶基因(cat)、人生长激素基因(hgh)、分泌型碱性磷酸酶基因(seap)、红色荧光蛋白基因(rfp)、绿色荧光蛋白基因(gfp)、增强绿色荧光蛋白基因(egfp)、β-半乳糖苷酶基因(β-gal)或萤火虫荧光素酶基因。更进一步优选的,所述的报告基因为egfp或gfp。
26.优选的,所述的类生殖细胞具有原始生殖细胞、分化的生殖细胞,例如精子或卵子细胞的性能。
27.优选的,所述的原始生殖细胞为早期的原始生殖细胞或成熟的原始生殖细胞,例如vasa阳性类生殖细胞。
28.优选的,所述的vasa阳性类生殖细胞相对于不表达vasa报告系统的细胞,其成熟的原始生殖细胞标记物表达量增高,所述的标记物包括vasa,更优选的,所述标记物还包括blimp1、c-kit、dazl、dnd1、tfap2c、klf4、lin28a、sox2、nanos3和/或stella中的一种或者多种,进一步优选的,所述标记物blimp1、c-kit、dazl、lin28a、sox2、stella显著性增加。
29.更优选的,所述的vasa阳性类生殖细胞相对于不表达vasa报告系统的细胞,其以下标记物表达量降低,所述的标记物包括nanog和/或oct4,进一步优选的,所述标记物oct4显著性降低。
30.本发明第四方面,提供一种vasa阳性类生殖细胞的制备方法,所述制备方法包括用上述任一的培养基对多能干细胞进行培养。
31.1)制备包含vasa报告系统的载体;2)将载体导入多能干细胞中;3)将多能干细胞在上述培养基中进行培养;4)利用细胞流式检测分离、富集和/或检测vasa阳性类生殖细胞。
32.优选的,所述的vasa报告系统包含vasa启动子和报告基因,进一步优选的,所述的报告基因包括但不限于氯霉素乙酰基转移酶基因(cat)、人生长激素基因(hgh)、分泌型碱性磷酸酶基因(seap)、红色荧光蛋白基因(rfp)、绿色荧光蛋白基因(gfp)、增强绿色荧光蛋白基因(egfp)、β-半乳糖苷酶基因(β-gal)或萤火虫荧光素酶基因。进一步优选的,所述的报告基因为egfp。
33.优选的,所述的载体选自逆转录病毒、慢病毒、腺病毒、腺伴随病毒、疱疹病毒和仙台病毒,进一步优选的,所述的载体为慢病毒载体。
34.本发明第五方面,提供一种vasa阳性类生殖细胞。
35.优选的,所述的vasa阳性类生殖细胞具有原始生殖细胞、分化的生殖细胞,例如精子或卵子细胞性能。
36.优选的,所述的vasa阳性类生殖细胞同时表达vasa及egfp/gfp蛋白。
37.优选的,所述的vasa阳性类生殖细胞是指相对于不表达vasa报告系统的细胞中成熟的原始生殖细胞标记物表达量增高,所述的标记物包括vasa,更优选的,所述的标记物还可以包含blimp1、c-kit、dazl、dnd1、tfap2c、klf4、lin28a、sox2、nanos3和/或stella中的一种或者多种,进一步优选的,所述标记物blimp1、c-kit、dazl、lin28a、sox2、stella显著性增加。
38.更优选的,所述的vasa阳性类生殖细胞相对于不表达vasa报告系统的细胞,其以下标记物表达量降低,所述的标记物包括nanog和/或oct4,进一步优选的,所述标记物oct4显著性降低。
39.优选的,所述vasa阳性类生殖细胞由上述制备方法获得。
40.本发明第六方面,提供一种上述vasa阳性类生殖细胞在制备组合物中的应用。
41.优选的,所述组合物为药物组合物。优选的,所述药物组合物用于预防和/或治疗不孕不育。
42.本发明第七方面,提供一种组合物,所述组合物包括上述vasa阳性类生殖细胞。
43.优选的,所述组合物为药物组合物。优选的,所述药物组合物用于预防和/或治疗不孕不育。
44.更优选的,所述合物为注射剂、微针剂、粘膜贴片、灌肠剂、栓剂、凝胶剂、口服剂、气雾剂、滴剂、软膏剂、埋置剂、胶囊剂或气雾剂等等。
45.所述药物组合物可选的包括药物辅料。进一步优选的,所述辅料包括药学上可接受的载体、稀释剂和/或缓冲剂等等。
46.在一些具体的实施方式中,所述载体选自明胶、壳聚糖、海藻酸锅、胶原、丝蛋白、纤维素、 纤维蛋白、聚乳酸、聚氨醋、聚环氧乙皖、聚乙二醇、 聚乳酸楚基乙酸、聚 e -己内醋、硅酸盐、硅橡胶、细胞外基质、脱细胞支架或其任何组合。
47.本发明第八方面,提供一种不孕不育疾病的治疗方法,所述治疗方法包括向个体给予上述任意的药物组合物。
48.优选的,所述个体是哺乳动物,例如人。
49.上述任意的多能干细胞来源于非胚胎,例如来源于脐带血、骨髓、脂肪、滑膜、骨骼、肌肉、肺、肝、胰腺等组织以及羊水等等。
50.本发明相关术语说明多能干细胞:在本发明中作为起始材料的多能干细胞没有特别限制,只要它们是具有在保持未分化状态的同时增殖的“自我再生潜力”和“多能性”的未分化细胞即可分化为胚胎的所有三个主要胚层;例子包括ips细胞和es细胞,以及源自原始生殖细胞的胚胎生殖(eg)细胞,在从睾丸组织中建立和培养gs细胞过程中分离的多能生殖系干(mgs)细胞,多能成体祖细胞(mapc) 从骨髓等中分离。es细胞可以是体细胞核重编程产生的细胞。
51.虽然优选ips 细胞或 es 细胞,但也优选mgs细胞和mapc,因为它们可以从活体个体中获得。本发明的方法适用于任何多能干细胞已被建立或正在被选择的哺乳动物。
52.可成立例子包括人、小鼠、猴子、猪、大鼠、狗等,优选人或小鼠。
53.胚胎干细胞:简称es细胞,是早期胚胎(原肠胚期之前)或原始性腺中分离出来的一类细胞,它具有体外培养无限增殖、自我更新和多向分化的特性。无论在体外还是体内环境,es细胞都能被诱导分化为机体几乎所有的细胞类型。优选的,所述胚胎干细胞分离自未
经过体内发育的受精14天以内的人类或者动物胚胎。
54.vasa:人类 vasa 基因 (ddx4) 在生殖细胞谱系中特异性表达,vasa 表达在原始生殖细胞发育的迁移阶段结束时开始,并且仅在成人的卵巢和睾丸组织中可检测到。即成熟的原始生殖细胞开始,到分化的生殖细胞可检测到。该基因在无脊椎动物和脊椎动物物种中高度保守。vasa 基因产物是一种 dead (asp-glu-ala-asp) 盒 atp 依赖性 rna 解旋酶。
55.本发明的有益效果1.本发明单纯添加tgf-β一种生长因子即可定向诱导胚胎干细胞分化为vasa阳性类生殖细胞。
56.2.本发明的方法仅仅在无血清培养基基础上加入tgf-β即可不断出现一组vasa阳性细胞。本发明提供了一套持续、快速获取vasa阳性类生殖细胞的方法。
57.3.本发明通过生殖报告系统vasa-报告基因就可对vasa阳性类生殖细胞进行富集,方法操作简单,减少人工成本和污染问题。
附图说明
58.图1所示为vasa报告系统整合到h1胚胎干细胞的荧光结果;图2所示为e8培养基中 vgv+群体的 facs 分析;图3所示为vgv-h1及h1细胞进行传代培养后各阶段细胞流式检测结果;图4所示为vgv+细胞与 vgv-细胞中表达的生殖细胞标志物的定量 rt-pcr 分析,表达水平显示标准化为 β-肌动蛋白,误差棒表示来自独立生物学重复的平均值
±ꢀ
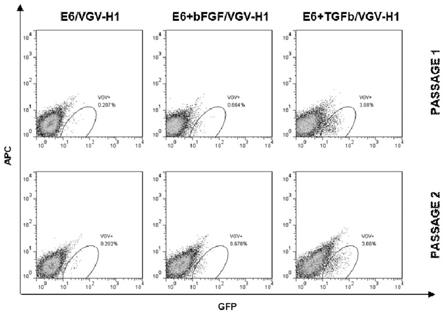
sd.p;图5所示为vgv+细胞与 vgv-细胞荧光显微镜下检测结果,merged为荧光复合结果,dapi显示细胞核染色结果,bf代表明场;图6所示为证实vasa阳性类细胞由e6培养基+tgfb即可诱导产生。
具体实施方式
59.下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
60.实施例1 制备vasa阳性类生殖细胞方法:1、将野生型的胚胎干细胞h1培养在vtn包被的培养板中,培养基为e8:将野生型的胚胎干细胞h1培养在2 ml的essential 8 (e8)培养基中,置于vtn包被的培养板中,并在达到70-80%融合后传代。为了使细胞传代,用pbs洗涤细胞并在37
°
c下在pbs中的0.5mm edta中温育5分钟。去除 edta,通过加入2 ml温热的 e8 培养基并轻轻上下移液将细胞从孔底洗掉。将细胞以约1:6的比例分配到新的包被板中,每天加入 2 ml e8培养基(参考genome-wide crispr/cas9-knockout in human induced pluripotent stem cell (ipsc)-derived macrophages)中generation of ipsc-derived macrophages部分所使用的方法。
61.其中,e8培养基成分包含:dmem/f12、l-抗坏血酸-2-磷酸镁(64 mg/l)、亚硒酸钠(14
µ
g/l)、fgf2(100
µ
g/l)、胰岛素(19.4 mg/l)、nahco
3 (543 mg/l) 和转铁蛋白(10.7 mg/l)、tgfβ1(2
ꢀµ
g/l)或nodal (100
ꢀµ
g/l)。
62.2、利用携带vasa报告系统的慢病毒侵染h1,建立含有vasa报告系统的细胞系vgv-h1:根据vasa基因相关信息,构建含有vasa启动子及报告基因egfp的重组载体,最终导入细胞含有vasa报告系统的细胞系vgv-h1;具体使用方法参考(human dazl, daz and boule genes modulate primordial germ-cell and haploid gamete formation.)中methods summary部分所使用的方法。
63.3、将vgv-h1及h1培养在e8中,培养方法同步骤1。
64.4、进行流式细胞检测:构建vasa阳性类生殖细胞的荧光检测结果如图1所示,在vasa-gfp的培养皿中可见多个荧光细胞群。流式细胞检测结果如图2所示。vgv+代表报告系统表达,vgv-代表报告系统不表达。结果显示,在含有vasa报告系统的细胞系h1细胞中能够检测到vgv+,可达到2.6%,不含有vasa报告系统的细胞系h1细胞中检测不到vgv+。
65.步骤4中所获得vgv-h1及h1细胞作为p1代,然后对细胞进行传代培养,所应用的培养基及各阶段细胞流式检测结果如图3所示,p1-p5阶段h1细胞均不能检测到vgv+,仅p1和p5阶段vgv-h1细胞可以检测到vgv+,p4阶段替换培养基为e8后,vgv+检测数值就有提升,p2、p3使用包含血清的培养基培养结果显示vgv+几乎消失,说明含血清的培养基不利于培养获得vasa阳性细胞,而无血清培养基,例如e8培养基可以有效促进vgv-h1细胞分化,e8可以特异性诱导产生vasa阳性细胞。
66.实施例2 验证vasa阳性细胞的生殖细胞属性方法:1、利用流式细胞仪通过报告基因egfp的表达将vasa阳性细胞分离富集;2、进行qpcr检测关键的生殖细胞标记基因。
67.首先从细胞中提取总rna,用dnasei消化并进行 cdna 合成。
68.采用实时qpcr用于量化生殖细胞相关标记基因(vasa、blimp1、c-kit、dazl、dnd1、egfp、tfap2c、klf4、lin28a、sox2、nanos3、nanog、oct4、stella)在vgv+及vgv-细胞中的 mrna 表达水平。pcr 反应由荧光检测系统使用 qpcr 试剂盒根据制造商的说明进行。将所选基因的含量标准化为 β-肌动蛋白的含量,其中检测各标记基因所使用的引物序列如表1所示。
69.表1: 各标记基因的引物序列信息
结果如图4所示,vasa、blimp1、c-kit、dazl、dnd1、egfp、tfap2c、klf4、lin28a、sox2、nanos3、stella的表达在vgv+细胞中均高于在vgv-细胞中的表达,其中,blimp1、c-kit、dazl、egfp、vasa、lin28a、sox2、stella的表达量具有显著性差异;同时oct4、nanog表达量在vgv+细胞中低于在vgv-细胞中,并且oct4表达量具有显著性差异。oct4基因水平已经出现的显著的下调,说明该群细胞正在退出多能细胞的状态。而blimp1、dazl、c-kit、lin28a和stella在内的多个生殖发育相关的基因上调,则预示着这群细胞的命运正朝着生殖分化的方向转变。与vgv-细胞相比,nanog的表达虽然略有下降,但并没有出现明显下调,说明该群vasa阳性类生殖细胞仍然保留有部分多能性。
70.3、为了进一步证实vasa阳性细胞的生殖细胞属性,本研究还进行了vasa免疫荧光染色,从蛋白层面进行验证。
71.方法:分别收集e8培养条件下,vgv阴性(vgv-)和vgv阳性(+)的细胞进行免疫染色,其中,vasa是生殖标记蛋白;egfp为细胞自带的荧光;dapi用于指示细胞核;bf代表明场。
72.免疫荧光结果如图5所示,dapi图中细胞有明显蓝色荧光,vasa图中细胞呈明显红色荧光,egfp图中细胞呈明显绿色荧光,merged图中细胞三色荧光均明显可见(目前由于附图修改为黑白图不明显,但在原图中可以看到,在此予以文字说明)。可见,在vgv+细胞中,vasa蛋白的表达水平要显著高于vgv-细胞,且在蛋白的分布上,主要集中在细胞质,符合生
殖细胞的特性。同时,vgv-细胞的染色结果也显示较强的vasa细胞染色,意味着从蛋白水平检测结果看,利用tgf-β可以获得更高比例的vasa阳性类生殖细胞。我们也推测在e8培养条件下,vasa基因普遍处于较为活跃的状态。以上结果表明,vgv+细胞很代表了一群开始脱离多能性并转向生殖分化命运的细胞。
73.实施例3由e6(essential6)培养基+tgf-β制备vasa阳性细胞方法:参照实施例1的培养步骤,将含有报告系统的vgv-h1细胞分别培养在e6培养基、e6+bfgf培养基、e6+tgfb培养基中,然后用流式细胞仪进行检测,其中,e6培养基与e8培养基成分近似,仅缺少bfgf和tgfb。
74.2、每种培养基的细胞都检测到第二代。
75.结果:如图6所示,无论是第一代还是第二代均仅在包含tgfb的培养基中检测到vgv+,而单纯e6培养基或者e6+bfgf培养基都检测不到vgv+,说明tgfb可以有效促进vasa的表达,进一步说明tgfb可以有效促进胚胎干细胞定向分化为成熟的(晚期)原始生殖细胞。
76.将e6培养基替换为其他无血清培养基,例如ko-dmem或tl添加tgfb也可以产生和e6培养基+tgfb类似的vgv+生殖细胞。
77.以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
78.另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
79.此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1