一种含药物分子的苯并噻吩衍生物的电催化制备方法
1.本发明属于有机合成技术领域,具体涉及一种电催化制备苯并噻吩衍生物偶联药物分子的制备方法。
背景技术:
2.苯并噻吩类化合物在自然界中广泛存在,其衍生物具有广泛的生物药理学活性:如抗炎、镇痛药,抗真菌,抗抑郁剂,雌激素受体调节,酶抑制剂,抗癌,抗结核,抗疟疾,抗血糖和杀虫剂等多方面应用。((a)eur.j.med.chem.2009,44,1718-1725.(b)j.med.chem.2007, 50,2682-2692.(c)j.heterocycl.chem.1981,39,409-410)
3.karlsruhe institute of technology大学的marius kuhn,florian c. falk,and jan paradies报道了一种合成苯并噻吩衍生物的方法:在钯催化下邻溴代苯乙炔类物质与硫脲偶联环化合成苯并噻吩衍生物(org. lett.2011,13,4100-4103)。反应式见式ⅰ:
[0004][0005]
上述方法具有使用金属催化剂以及反应时间较长、额外使用磷催化剂等明显的缺陷。
技术实现要素:
[0006]
为了克服上述合成苯并噻吩衍生物现有技术的缺陷,本发明提供了一种电催化制备苯并噻吩衍生物偶联药物分子的制备方法。
[0007]
电催化合成反应具有很多显著的优势:可以避免使用有毒或难以处理的催化剂,电子是绿色的反应试剂,反应产物纯度高容易分离,对环境几乎无污染;在电催化反应中,可通过改变电极电压或电流来调控反应速率以避免副反应的发生,从而提高目标产品的选择性以及收率。
[0008]
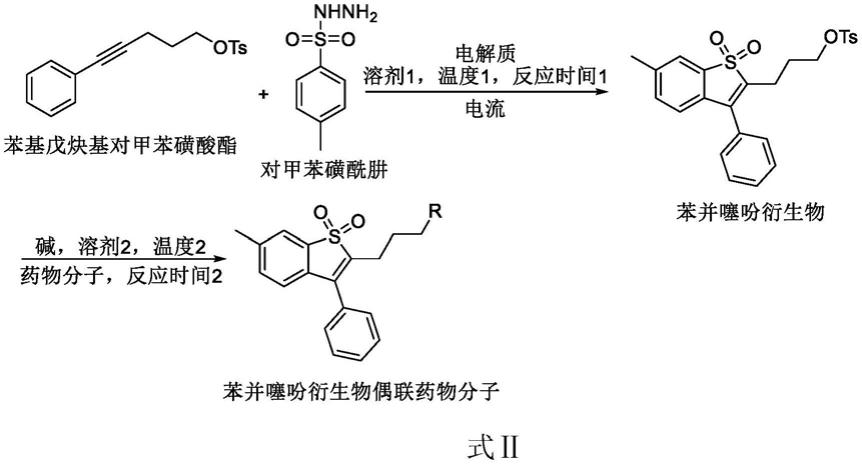
一种电催化制备苯并噻吩衍生物偶联药物分子的制备方法,所述苯并噻吩衍生物偶联药物分子具有式ⅱ所示的结构:
[0009][0010]
r取代基团选自布洛芬(ibuprofen)、吲哚美辛(indometacin)、吉非罗齐(gemfibrozil)、洛索洛芬(loxoprofen)、功夫菊酸(trifluoroaceticacidju)、萘普生(naproxen)、伊索克酸(isoxepac)。其特征在于,向反应器中,加入摩尔比为1:3的苯基戊炔基对甲苯磺酸酯与对甲苯磺酰肼,加入四乙基六氟磷酸铵作为电解质,加入体积比为47:3的六氟异丙醇与硝基甲烷作为溶剂,通过电催化策略促进反应进行。待反应完毕后,使用旋转蒸发仪浓缩得到粗产物,再经过硅胶柱层析分离得到苯并噻吩类衍生物。在反应器中加入摩尔比为1:1:1苯并噻吩类衍生物、药物分子和碳酸钾,加入n,n-二甲基乙酰胺作为溶剂,反应温度为80℃,反应时间为8h。待反应完毕后,使用旋转蒸发仪浓缩得到粗产物,再经过硅胶柱层析分离得到目标产物其化学过程见反应式ⅲ:
[0011][0012]
所述的苯基戊炔基对甲苯磺酸酯与对甲苯磺酰肼的摩尔比值为1:3,所述电解质为四乙基六氟磷酸铵,所述溶剂1为六氟异丙醇与硝基甲烷的体积比值为47:3,通过电催化策略促进反应进行,所用电流为5ma,所用电极材料为石墨毡,反应温度1为室温,反应时间1为8h,所述苯并噻吩衍生物与药物分子的摩尔比值为1:1,所述碱为碳酸钾,所述溶剂2为n,n-二甲基乙酰胺,所述温度2为80℃,所述反应时间2为8h。
[0013]
本发明的有益效果为:本发明提供的苯并噻吩和药物分子偶联的合成方法科学合理,提供了一种合成苯并噻吩偶联药物分子的新途径,通过本方法得到了具有多种药物分子和苯并噻吩偶联产物,其特点为:合成途径绿色环保,无需金属催化剂;中间体在弱电流
下即可反应得到;无需额外的磷催化剂;合成方法简单;目标化合物收率较高,产品易于纯化。
附图说明
[0014]
图1为实施例1制备的化合物5a的nmr图谱;
[0015]
图2为实施例3制备的化合物5c的nmr图谱;
[0016]
图3为实施例5制备的化合物5e的nmr图谱。
具体实施方式
[0017]
下面结合附图和具体的实施例对本发明进一步详细的说明:
[0018]
下述实施例中所述试验方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均可从商业途径获得。
[0019]
实施例1
[0020]
含布洛芬(ibuprofen)的苯并噻吩衍生物5a的制备:
[0021][0022]
向10ml无隔膜电解槽加入5-苯基戊-4-炔基4-甲基苯磺酸盐1 (0.2mmol,68.2mg)、对甲苯磺酰肼2(0.6mmol,111.7mg)、四乙基六氟磷酸铵(0.2mmol,55.0mg),阴、阳电极均采用石墨毡电极(1cmx 1cm x 0.5cm)。后向体系充换氮气,加入六氟异丙醇(4.7ml)和硝基甲烷(0.3ml)。于室温、5ma恒定电流下进行电解,反应8h。反应完毕后,使用旋转蒸发仪除去溶剂得到粗产物,粗产物经柱层析分离(200-300目硅胶,石油醚/乙酸乙酯=20/1),使用旋转蒸发仪除去溶剂,得到目标产物苯并噻吩衍生物3,其收率为55%。向10ml厚壁耐压管中加入苯并噻吩衍生物3(0.1mmol,46.8mg)、布洛芬4a(0.1 mmol,20.6mg)、碳酸钾(0.1mmol,13.8mg)、n,n-二甲基乙酰胺(1 ml)。于80℃下反应8h。反应完毕后,使用旋转蒸发仪除去溶剂得到粗产物,粗产物经柱层析分离(200-300目硅胶,石油醚/乙酸乙酯=2/1),使用旋转蒸发仪除去溶剂,得到目标产物5a,其收率为80%。
[0023]
谱图解析数据5a:
[0024]1h nmr(cdcl3,500mhz):δ7.57(s,1h),7.53
–
7.45(m,3h), 7.33
–
7.24(m,3h),7.09(d,j=7.8hz,2h),7.03(d,j=7.9hz,2h), 6.98(d,j=7.8hz,1h),4.03(ddt,j=39.6,11.5,6.1hz,2h),3.54(q,j =7.1hz,1h),2.56(t,j=8.3hz,2h),2.46
–
2.39(m,5h),2.03
(dh,j=13.5,7.0hz,2h),1.87
–
1.76(m,j=6.8hz,1h),1.39(d,j=7.2hz,3h),0.87(s,3h),0.86(s,3h);
13
cnmr(cdcl3,125mhz):δ174.52,140.46,139.23,137.64,137.22,136.41,133.90,130.74,130.68,129.44,129.29,129.12,128.41,127.13,123.45,121.91,99.99,63.60,45.03,30.16,27.00,22.41,21.35,20.27,18.40.
[0025]
实施例2
[0026]
含吲哚美辛(indometacin)的苯并噻吩衍生物5b的制备:
[0027]
用4b代替实例1中的4a,其他条件同实例1,实验结果见表1。
[0028][0029]
谱图解析数据5b:
[0030]1hnmr(500mhz,cdcl3):δ7.72(d,j=7.9hz,1h),7.64(d,j=8.2hz,2h),7.58(s,1h),7.54
–
7.47(m,3h),7.45(d,j=8.3hz,2h),7.36
–
7.27(m,4h),7.00(d,j=7.8hz,1h),6.91(d,j=2.5hz,1h),6.88(d,j=9.0hz,1h),6.65(dd,j=9.1,2.6hz,1h),4.08(t,j=6.2hz,2h),3.81(s,3h),3.55(s,2h),2.64(t,j=7.7hz,2h),2.60(d,j=5.3hz,1h),2.43(s,3h),2.30(s,3h),2.07(dd,j=6.8,2.2hz,2h);
13
cnmr(125mhz,cdcl3)δ170.70,168.27,156.07,140.58,139.39,139.17,136.96,136.32,135.88,133.97,131.19,130.63,129.69,129.51,129.18,129.10,128.38,127.26,123.48,121.92,114.97,112.49,111.73,101.20,63.94,55.72,30.14,26.87,21.35,20.22,13.35.
[0031]
实施例3
[0032]
含吉非罗齐(gemfibrozil)的苯并噻吩衍生物5c的制备:
[0033]
用4c代替实例1中的4a,其他条件同实例1,实验结果见表1。
[0034][0035]
谱图解析数据5c:
[0036]1h nmr(500mhz cdcl3):δ7.58(s,1h),7.48(dtd,j=12.7,6.9, 1.6hz,3h),7.34
–
7.28(m,2h),7.28
–
7.22(m,1h),6.98(dt,j=8.0, 1.8hz,2h),6.64(d,j=7.5hz,1h),6.59(s,1h),4.05(td,j=6.1,1.5 hz,2h),3.86(dt,j=6.7,3.4hz,2h),2.64(dd,j=9.1,6.8hz,2h), 2.42(s,3h),2.29(s,3h),2.15(s,3h),2.07(dt,j=10.5,3.8hz,2h), 1.73
–
1.58(m,4h),1.11(s,6h);
13
c nmr(125mhz,cdcl3):δ177.57, 156.95,140.51,139.26,137.24,136.44,136.41,133.93,130.73,130.66, 130.30,129.46,129.19,128.40,123.55,123.47,121.92,120.69,111.97, 67.89,63.36,42.05,37.01,27.26,25.13,25.08,21.44,21.36,20.47, 15.81.
[0037]
实施例4
[0038]
含洛索洛芬(loxoprofen)的苯并噻吩衍生物5d的制备:
[0039]
用4d代替实例1中的4a,其他条件同实例1,实验结果见表1。
[0040][0041]
谱图解析数据5d:
[0042]1h nmr(500mhz,cdcl3):δ7.59(s,1h),7.55
–
7.48(m,3h), 7.34
–
7.28(m,3h),7.14
–
7.04(m,4h),7.00(d,j=7.8hz,1h),4.04 (ddt,j=34.5,11.5,6.2hz,2h),3.56(q,j=7.1hz,1h),3.11(dd,j= 13.9,4.2hz,1h),2.63(dd,j=5.5,1.2hz,1h),2.57(t,j=7.9hz,2h), 2.44(s,3h),2.36
–
2.28(m,2h),2.06
–
2.00(m,4h),1.97
–
1.89(m, 1h),1.77
–
1.65(m,1h),1.60
–
1.47(m,1h),1.40(dd,j=7.3,1.3hz, 3h);
13
c nmr(125mhz,cdcl3):δ174.40,140.52,139.26,138.81, 138.23,137.12,136.34,133.93,130.69,130.64,
129.70,129.46,129.13, 129.08,128.39,127.49,127.27,123.47,121.90,63.66,50.98,44.99, 38.18,35.18,29.22,26.99,21.35,20.52,20.25,18.34.
[0043]
实施例5
[0044]
含功夫菊酸(trifluoroacetic acid ju)的苯并噻吩衍生物5e的制备:
[0045]
用4e代替实例1中的4a,其他条件同实例1,实验结果见表1。
[0046][0047]
谱图解析数据5e:
[0048]1h nmr(cdcl3,500mhz):δ7.59(s,1h),7.51(q,j=7.5,7.1 hz,3h),7.35
–
7.31(m,2h),7.29(s,1h),7.01(d,j=7.8hz,1h),6.90 (d,j=9.4hz,1h),4.04(qt,j=11.4,6.0hz,2h),2.68(t,j=7.7hz, 2h),2.44(s,3h),2.14
–
2.01(m,3h),1.81(d,j=8.3hz,1h),1.26(s, 3h),1.23(s,3h);
13
c nmr(cdcl3,125mhz):δ170.07,140.54, 139.41,137.02,136.35,133.94,130.69,130.64,130.19(q,j=4.5hz), 129.42,129.10,128.40,123.47,121.91,63.44,32.74,30.82,28.63,28.32, 26.86,21.33,20.23,14.84.
[0049]
实施例6
[0050]
含萘普生(naproxen)的苯并噻吩衍生物5f的制备:
[0051]
用4f代替实例1中的4a,其他条件同实例1,实验结果见表1。
[0052][0053]
谱图解析数据5f:
[0054]1h nmr(cdcl3,500mhz):δ7.66(t,j=8.5hz,2h),7.58(t,j= 2.2hz,2h),7.52
–
7.44(m,3h),7.29(ddd,j=16.8,6.9,2.8hz,4h), 7.18
–
7.08(m,2h),6.98(d,j=7.9hz,1h),4.05(ddt,j=45.4,11.6, 6.2hz,2h),3.90(s,3h),3.71(q,j=7.2hz,1h),2.58(ddd,j=8.7,6.9, 2.1hz,2h),2.43(s,3h),2.08
–
2.00(m,2h),1.49(d,j=7.1hz,3h);
13
c nmr
(cdcl3,125mhz):δ174.45,157.59,140.47,139.26,137.10, 136.33,135.55,133.89,133.64,130.70,130.60,129.39,129.26,129.07, 128.87,128.35,127.10,126.22,125.86,123.43,121.88,118.92,105.57, 63.69,55.29,45.31,26.95,21.33,20.24,18.44.
[0055]
实施例7
[0056]
含伊索克酸(isoxepac)的苯并噻吩衍生物5g的制备:
[0057]
用4g代替实例1中的4a,其他条件同实例1,实验结果见表1。
[0058][0059]
谱图解析数据5g:
[0060]1h nmr(cdcl3,500mhz):δ8.04(d,j=2.4hz,1h),7.90
–ꢀ
7.85(m,1h),7.59
–
7.58(m,1h),7.57
–
7.50(m,4h),7.48
–
7.44(m, 1h),7.38
–
7.32(m,4h),7.28(d,j=7.8hz,1h),7.00(t,j=8.1hz, 2h),5.17(s,2h),4.08(t,j=6.0hz,2h),3.48(s,2h),2.66(dd,j=8.6, 6.7hz,2h),2.43(s,3h),2.07(p,j=6.8hz,2h);
13
c nmr(cdcl3, 125mhz):δ190.69,171.14,170.60,160.40,140.48,140.36,139.41, 136.89,136.30,135.56,133.92,132.75,132.34,130.61,130.54,129.48, 129.38,129.18,129.13,128.36,127.81,127.62,125.02,123.45,121.81, 121.02,73.55,63.66,39.86,26.76,21.29,20.07.
[0061]
表1
[0062]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1