含有萘环和两个硼原子的稠环化合物及有机电致发光器件
1.本发明涉及材料技术领域,具体是含有萘环和两个硼原子的稠环化合物及有机电致发光器件。
背景技术:
2.有机发光器件(oleds)通常是由阴极、阳极及阴极和阳极之间插入的有机物层构成,即器件是由透明ito阳极、空穴注入层(til)、空穴传输层(htl)、发光层(el)、空穴阻挡层 (hbl)、电子传输层(etl)、电子注入层(eil)和阴极组成,按需要可省略1~2有机层,其作用机理为两个电极之间形成电压,从阴极注入电子的同时从阳极注入空穴,电子和空穴在发光层结合形成激发态,激发态辐射回到基态,进而实现器件发光。由于色彩丰富、快速响应以及可制备柔性器件等特点,有机电致发光材料被认为是最具发展前景的下一代平板显示和固体照明材料。
3.传统的荧光材料由于受到自旋量子统计规律的限制,在电致发光过程中仅能利用占全部激子数目 25%的单线态激子,其余75%的三线态激子通过非辐射跃迁的方式失活,器件内量子效率(iqe)的理论极限值为25%。为了提高激子利用率,需要实现对三线态激子。例如,磷光金属配合物利用重金属原子的旋轨耦合作用可以将三线态激子转化为光子,实现100%的内量子效率,但这一途径面临磷光金属配合物价格昂贵的问题。另一利用三线态激子的途径是发展具有热活化延迟荧光(thermallyactivated delayed fluorescence,tadf)性质的发光材料,利用热活化的反向系间窜越(risc)过程将三线态激发态转移至单线态激发态发出荧光,从而实现对单线态和三线态激子的充分利用。具有 tadf性质的分子一般须满足两方面条件:较小的单线态-三线态能级差(δe
st
)和较高的荧光量子效率(plqy)。一方面,较小的δe
st
(<0.3ev)有利于发生热活化的反向系间窜越过程,从而有利于提高三线态激子的利用效率;另一方面,材料须具有较高的plqy,从而促进单线态激子以光的形式衰减,提高器件效率。
4.目前发展tadf分子的主要途径是引入给体(d)和受体(a)基团,使得最高占据轨道 (homo)和最低空轨道(lumo)在空间上有效分离,从而实现小的δe
st
。但是这种d-a结构由于其激发态的振动弛豫而表现出较大的stokes位移,且发光光谱较宽,半峰宽(fwhm)一般在70~100 nm,在实际应用中往往需要采用滤波片或者构造光学微腔来提高色纯度,但这样会导致器件的外量子效率降低或器件结构变得复杂。
5.因此如何通过合适的化学结构设计,开发出既具有tadf效应、又具有窄光谱特性的荧光材料,解决上述材料面临的半峰宽较宽的缺陷,已成为领域内诸多具有前瞻性的研究人员亟待解决的问题之一。
技术实现要素:
6.有鉴于此,本发明所要解决的技术问题在于提供一种含有萘环和两个硼原子的稠环化合物及有机电致发光器件,该稠环化合物既具有tadf效应、又具有窄半峰宽光谱特性。
7.本发明提供了一种含有萘环和两个硼原子的稠环化合物,具有式(i)结构:
[0008][0009]
其中,x1选自s、se、te或n(ra),x2、y1和y2选自o、s、se、te或n(ra),且x1、x2、y1和y2不同时为s或n(ra);所述ra选自取代或未取代的c1~c30的直链烃基、取代或未取代的c1~c30的支链烃基、取代或未取代的c1~c30的卤代烷烃基、取代或未取代的c3~c30的环烷基、取代或未取代的c6~c60的芳香基团、取代或未取代的c5~c60的杂芳香基团;
[0010]
各自独立地选自取代或未取代的c5~c60的芳香环基团、取代或未取代的c3~c60的芳香杂环基团;
[0011]
r1’
~r4’
、r1~r2各自独立地选自h、d、f、cl、br、i、-cn、cn、cn、取代或未取代的c1~c30的直链烃基、取代或未取代的c1~c30的支链烃基、取代或未取代的c1~c30的卤代烷烃基、取代或未取代的c3~c30的环烷基、取代或未取代的c6~c60的芳香基团、取代或未取代的c5~c60的杂芳香基团;
[0012]
所述r1、r2和r3各自独立地选自取代或未取代的c1~c30的直链烃基、取代或未取代的 c1~c30的支链烃基、取代或未取代的c1~c30的卤代烷烃基、取代或未取代的c3~c30的环烷基、取代或未取代的c6~c60的芳香基团、取代或未取代的c5~c60的杂芳香基团;
[0013]
所述杂芳香基团中的杂原子选自si、ge、n、p、o、s与se中的一种或多种;
[0014]
n1、n2独立地选自0,1或2;
[0015]
m1~m4独立地选自0~10的整数;
[0016]
或者y1为n(ra),ra与ar1、r1’
、ar2或r2’
通过单键、-o-、-s-、、与中的任意一种连接形成环;或者y2为n(ra),ra与 ar3、r3’
、ar4或r4’
通过单键、-o-、-s-、、与中的任意一种连接形成环;或者x1为n(ra),ra与ar1或r1’
通过单键、-o-、
ꢀ‑
s-、与中的任意一种连接形成环;或者x2为n(ra),ra与ar4或r4’
通过单键、-o-、-s-、、与中的任意一种连接形成环。
[0017]
本发明提供了一种含有萘环和两个硼原子的稠环化合物,如式(i)或者(a)~式(e)所示,这类化合物一方面可利用萘环的刚性骨架结构降低激发态结构弛豫程度,从而实现较窄的半峰宽;另一方面还利用硼原子与杂原子之间的共振效应实现homo和lumo的分离,从而实现较小的δe
st
和 tadf效应,从而实现高的发光效率。同时,通过改变稠环化合物中含有的芳环或杂芳环的种类,还能够实现对延迟荧光寿命和半峰宽的进一步调节。实验结果表明,采用本发明的发光化合物作为电致发光器件的发光层,既能够在无需滤光片和微腔结构的情况下实现窄的电致发光半峰宽(18-30 nm),又能实现高的器件外量子效率(24.0-34.0%)。
具体实施方式
[0018]
本发明提供了一种含有萘环和两个硼原子的稠环化合物,具有式(i)结构:
[0019][0020]
其中,x1选自s、se、te或n(ra),x2、y1和y2选自o、s、se、te或n(ra),且x1、x2、y1和y2不同时为s或n(ra);所述ra选自取代或未取代的c1~c30的直链烃基、取代或未取代的c1~c30的支链烃基、取代或未取代的c1~c30的卤代烷烃基、取代或未取代的c3~c30的环烷基、取代或未取代的c6~c60的芳香基团、取代或未取代的c5~c60的杂芳香基团;
[0021]
各自独立地选自取代或未取代的c5~c60的芳香环
基团、取代或未取代的c3~c60的芳香杂环基团;
[0022]
r1’
~r4’
、r1~r2各自独立地选自h、d、f、cl、br、i、-cn、cn、cn、取代或未取代的c1~c30的直链烃基、取代或未取代的c1~c30的支链烃基、取代或未取代的c1~c30的卤代烷烃基、取代或未取代的c3~c30的环烷基、取代或未取代的c6~c60的芳香基团、取代或未取代的c5~c60的杂芳香基团;
[0023]
所述r1、r2和r3各自独立地选自取代或未取代的c1~c30的直链烃基、取代或未取代的 c1~c30的支链烃基、取代或未取代的c1~c30的卤代烷烃基、取代或未取代的c3~c30的环烷基、取代或未取代的c6~c60的芳香基团、取代或未取代的c5~c60的杂芳香基团;
[0024]
所述杂芳香基团中的杂原子选自si、ge、n、p、o、s与se中的一种或多种;
[0025]
n1、n2独立地选自0,1或2;
[0026]
m1~m4独立地选自0~10的整数,优选为0~8的整数,更优选为0~4的整数,最优选为0~2的整数;
[0027]
或者y1为n(ra),ra与ar1、r1’
、ar2或r2’
通过单键、-o-、-s-、、与中的任意一种连接形成环;或者y2为n(ra),ra与ar3、r3’
、ar4或r4’
通过单键、-o-、-s-、、与中的任意一种连接形成环;或者x1为n(ra),ra与ar1或r1’
通过单键、-o-、
ꢀ‑
s-、与中的任意一种连接形成环;或者x2为n(ra),ra与ar4或r4’
通过单键、-o-、-s-、、与中的任意一种连接形成环。
[0028]
在一个实施例中,所述稠环化合物具有式(a)~式(e)结构:
[0029][0030]
其中,r3~r4各自独立地选自h、d、f、cl、br、i、-cn、cn、cn、取代或未取代的c1~c30的直链烃基、取代或未取代的c1~c30的支链烃基、取代或未取代的c1~c30的卤代烷烃基、取代或未取代的c3~c30的环烷基、取代或未取代的c6~c60的芳香基团、取代或未取代的c5~c60的杂芳香基团;
[0031]
所述r1、r2和r3各自独立地选自取代或未取代的c1~c30的直链烃基、取代或未取代的 c1~c30的支链烃基、取代或未取代的c1~c30的卤代烷烃基、取代或未取代的c3~c30的环烷基、取代或未取代的c6~c60的芳香基团、取代或未取代的c5~c60的杂芳香基团;
[0032]
所述杂芳香基团中的杂原子选自si、ge、n、p、o、s与se中的一种或多种。
[0033]
在一个实施例中,所述上的碳原子优选通过其各自相连接的 b、x1或y1或x2或y2与中间萘环上的碳原子构成六元环。
[0034]
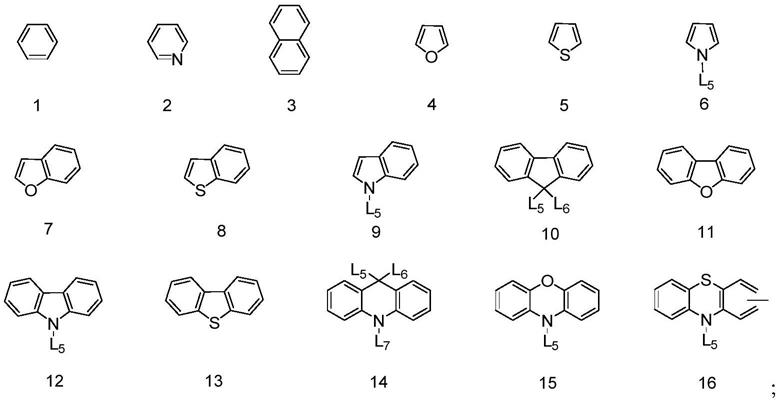
在一个实施例中,所述与各自独立地选自式1~16所示基团中的一种:
[0035][0036]
l5~l7各自独立选自h、d、取代或未取代的c1~c30的直链烃基、取代或未取代的c1~c30的支链烃基、取代或未取代的c1~c30的卤代烷烃基、取代或未取代的c3~c30的环烷基、取代或未取代的c6~c60的芳香基团、取代或未取代的c5~c60的杂芳香基团;更优选为h、d、取代或未取代的c1~c20的直链烃基、取代或未取代的c1~c20的支链烃基、取代或未取代的c1~c20的卤代烷烃基、取代或未取代的c3~c20的环烷基、取代或未取代的c6~c40的芳香基团、取代或未取代的c5~c40的杂芳香基团;再优选为h、d、取代或未取代的c1~c10的直链烃基、取代或未取代的c1~c10的支链烃基、取代或未取代的c1~c10的卤代烷烃基、取代或未取代的c3~c10的环烷基、取代或未取代的 c6~c30的芳香基团、取代或未取代的c5~c30的杂芳香基团;最优选为h、d、取代或未取代的 c1~c5的直链烃基、取代或未取代的c1~c5的支链烃基、取代或未取代的c1~c5的卤代烷烃基、取代或未取代的c3~c8的环烷基、取代或未取代的c6~c20的芳香基团、取代或未取代的c5~c20的杂芳香基团;所述杂芳香基团中的杂原子选自si、ge、n、p、o、s与se中的一种或多种。
[0037]
r1’
~r4’
、r1~r4各自独立地选自h、d、f、cl、br、i、-cn、-no2、、、取代或未取代的c1~c30的直链烃基、取代或未取代的c1~c30的支链烃基、取代或未取代的c1~c30的卤代烷烃基、取代或未取代的c3~c30的环烷基、取代或未取
代的c6~c60的芳香基团、取代或未取代的c5~c60的杂芳香基团;
[0038]
所述r1、r2和r3各自独立地选自取代或未取代的c1~c30的直链烃基、取代或未取代的 c1~c30的支链烃基、取代或未取代的c1~c30的卤代烷烃基、取代或未取代的c3~c30的环烷基、取代或未取代的c6~c60的芳香基团、取代或未取代的c5~c60的杂芳香基团;优选为取代或未取代的 c1~c20的直链烃基、取代或未取代的c1~c20的支链烃基、取代或未取代的c1~c20的卤代烷烃基、取代或未取代的c3~c20的环烷基、取代或未取代的c6~c40的芳香基团、取代或未取代的c5~c40的杂芳香基团;更优选为取代或未取代的c1~c10的直链烃基、取代或未取代的c1~c10的支链烃基、取代或未取代的c1~c10的卤代烷烃基、取代或未取代的c3~c15的环烷基、取代或未取代的c6~c30 的芳香基团、取代或未取代的c5~c30的杂芳香基团;再优选为取代或未取代的c1~c5的直链烃基、取代或未取代的c1~c5的支链烃基、取代或未取代的c1~c5的卤代烷烃基、取代或未取代的c3~c8 的环烷基、取代或未取代的c6~c15的芳香基团、取代或未取代的c5~c15的杂芳香基团;所述杂芳香基团中的杂原子选自si、ge、n、p、o、s与se中的一种或多种。
[0039]
在一个实施例中,所述稠环化合物具有式(a-a)或式(d-d)结构:
[0040][0041]
式(a-a)中,x1选自s或te,x2选自s或te,y2选自n(ra)或s;所述ra选自取代或未取代的c6~c60的芳香基团;或者ra与ar2或r
2'
通过单键、-o-或连接形成环;或者ra与ar3或r
3'
通过单键、-o-或连接形成环;
[0042]
式(d-d)中,x1选自s或se,x2选自s或o;所述ra选自取代或未取代的c6~c60的芳香基团;或者ra与ar2或r1’
通过单键、-o-或连接形成环;或者ra与ar3或r3’
通过单键、-o-或连接形成环。
[0043]
在一个实施例中,式(a-a)中,所述与各自独立地选自式1、式 3、式7、式10或式12所示基团;
[0044]
式(d-d)中,所述与各自独立地选自式1、式3、式7、式10或式12所示基团。
[0045]
具体而言,所述稠环化合物具有式a-1~式e10-1结构:
[0046]
[0047]
[0048]
[0049]
[0050]
[0051]
[0052]
[0053]
[0054]
[0055]
[0056][0057]
本发明提供的稠环化合物含有萘环和两个硼原子,这类化合物一方面可利用萘环的刚性骨架结构降低激发态结构弛豫程度,从而实现较窄的半峰宽;另一方面还利用硼原子与杂原子之间的共振效应实现homo和lumo的分离,从而实现较小的δe
st
和tadf效应,从而实现高的发光效率。同时,通过改变稠环化合物中含有的芳环或杂芳环的种类,还能够实现对延迟荧光寿命和半峰宽的进一步调节。实验结果表明,采用本发明的发光化合物作为电致发光器件的发光层,既能够在无需滤光片和微腔结构的情况下实现窄的电致发光半峰宽(18-30nm),又能实现高的器件外量子效率(24.0
‑ꢀ
34.0%)。
[0058]
本发明对所述稠环化合物的制备方法没有特殊限制,其一个典型制备过程如下:
[0059]
将式(a)~式(e)所示的化合物与烷基锂反应后,再与三卤化硼及有机胺反应,分别得到式 (a)~式(e)所示的稠环化合物;所述烷基锂优选为丁基锂、仲丁基锂、叔丁基锂、甲基锂与乙基锂中的一种或多种;所述三卤化硼优选为三氟化硼、三氯化硼、三溴化硼与三碘化硼中的一种或多种;所述有机胺优选为n,n-二异丙基乙胺、三乙胺与三正丁基胺中的一种或多种。
[0060][0061]
其中,lu1~lu4为氢或卤素;其他取代基均同上所述,在此不再赘述。
[0062]
本发明提供的稠环化合物可以作为发光材料应用。
[0063]
本发明还提供了一种有机电致发光器件,包括阳极、阴极以及位于所述阳极和所述阴极之间的有机薄膜层;所述有机薄膜层包括上述式(i)所示的稠环化合物。
[0064]
本发明对所述有机电致发光器件的结构没有特别限制,以本领域技术人员熟知的常规有机电致发光器件即可,本领域技术人员可以根据应用情况、质量要求和产品要求进行选择和调整,本发明所述有机电致发光器件的结构优选包括:衬底;设置于所述衬底上的阳极;设置于所述阳极上的有机薄膜层;设置于所述有机薄膜层上的阴极。
[0065]
所述衬底的厚度优选为0.3~0.7mm,更优选为0.4~0.6mm;本发明对所述衬底的选择并没有特殊的限制,以本领域技术人员熟知的常规有机电致发光器件的衬底即可,本领域技术人员可以根据应用情况、质量要求和产品要求进行选择和调整,在本发明中所述衬底优选为玻璃或塑料。
[0066]
按照本发明,所述阳极优选为易于空穴注入的材料,更优选为导电金属或导电金属氧化物,再优选为铟锡氧化物。
[0067]
所述有机薄膜层可以为一层也可为多层,且至少一层为发光层;在本发明中,所述
有机薄膜层优选包括发光层;所述发光层包括上述式(i)所示的稠环化合物;本发明提供的式(i)所示的稠环化合物作为发光材料直接构成有机电致发光层。
[0068]
所述阴极优选为金属,包括但不限于钙、镁、钡、铝和银,优选为铝。
[0069]
为了提高器件的性能和效率,所述阳极和发光层之间的有机薄膜层优选还包括空穴注入层、空穴传输层和电子阻挡层中的一层或多层。所述发光层与阴极之间的有机薄膜层优选还包括空穴阻挡层、电子注入层和电子传输层中的一种或多种。本发明对所述空穴注入层、空穴传输层、电子阻挡层、有机电致发光层、空穴阻挡层、电子注入层和电子传输层的材料和厚度没有特别限制,可以按照本领域技术人员熟知的材料和厚度进行选择和调整。本发明对所述电极、空穴注入层、空穴传输层、电子阻挡层、有机电致发光层、空穴阻挡层、电子注入层和电子传输层的制备工艺没有特别限制,优选采用真空蒸镀、溶液旋涂、溶液刮涂、喷墨印刷、胶版印刷和立体印刷的工艺进行制备。
[0070]
在一个实施例中,所述有机薄膜层包括:依次叠层设置的空穴传输层、激子阻挡层、发光层和电子传输层。
[0071]
在一个实施例中,所述空穴传输层由tapc形成;所述激子阻挡层由tcta形成;所述发光层由质量比为1~2:8~9的稠环化合物和simcp2形成;所述电子传输层由tmpypb形成。
[0072]
在一个实施例中,所述有机薄膜层包括:依次叠层设置的空穴传输层、发光层、空穴阻挡层和电子传输层。
[0073]
在一个实施例中,所述空穴传输层由pedot:pss形成,发光层由质量比为1~2:8~9的稠环化合物和simcp2形成;空穴阻挡层由tspo1形成;电子传输层由tmpypb形成。
[0074]
本发明对所述有机电致发光器件的制备方法没有特殊限制,可以按照以下方法进行:在所述衬底上形成阳极;在所述阳极上形成一层或多层有机薄膜层,其中包含一层发光层;在所述有机薄膜层上形成阴极;所述发光层包括一种或多种式(i)所示的化合物。
[0075]
本发明对上述制备方法中有机电致发光器件的结构和材料,以及相应的优选原则,与前述有机电致发光器件中所对应的材料和结构,以及相应的优选原则可以进行对应,在此不再一一赘述。
[0076]
本发明首先在衬底上形成阳极,本发明对所述阳极的形成方式没有特殊限制,按照本领域技术人员熟知的方法即可。本发明对所述发光层及发光层以下和以上的有机薄膜层的形成方式没有特殊限制,可以通过真空蒸镀、溶液旋涂、溶液刮涂、喷墨印刷、胶版印刷或立体印刷在所述阳极形成。所述有机层形成后,在其表面上制备阴极,本发明对阴极形成方式没有特殊限制,优选为本领域技术人员熟知的方法,包括但不限于真空沉积。
[0077]
为了进一步说明本发明,以下结合实施例对本发明提供的含有萘环和两个硼原子的稠环化合物及有机电致发光器件进行详细描述。
[0078]
以下实施例中所用的试剂均为市售。
[0079]
实施例1
[0080]
反应式如下式:
[0081][0082]
在氩气氛围下,在500ml三口烧瓶中加入1-溴-2,6-二氟苯(化合物1-1)(30.0g,157.1 mmol),3,6-二叔丁基咔唑(21.9g,78.5mmol)和碳酸铯(55.4g,157.1mmol),取200ml n,n
‑ꢀ
二甲基甲酰胺(dmf)加入瓶中,升温至130℃,搅拌反应3小时,冷却至室温后,将反应液加入 400ml饱和食盐水中沉降,过滤,真空干燥,所得固体经过硅胶柱分离得到产物1-2(36.1g,产率: 45%)。元素分析结构(c
26h27
brfn):理论值c,69.03;h,6.02;br,17.66;f,4.20;n,3.10测试值c, 69.02;h,6.03;n,3.10。maldi-tof质谱:理论值451.1;实验值451.1(m
+
)。
[0083]
在氩气氛围下,在500ml三口烧瓶中加入1-2(10.0g,22.1mmol),1,5-萘二硫酚(1.9g,10.0 mmol)和无水碳酸钾(5.5g,40.0mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至 115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物1-3(8.46g,产率:80%)。元素分析结构(c
62h60
br2n2s2):理论值c,70.45;h,5.72;br,15.12;n, 2.65;s,6.07测试值c,70.45;h,5.71;n,2.63;s,6.09。maldi-tof质谱:理论值1054.3;实验值 1054.3(m
+
)。
[0084]
在氩气氛围下,在500ml双口烧瓶中加入1-3(5.0g,4.7mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(4.1ml,2.5m,10.3mmol),滴加完毕后,升温至60℃反应2小时。于-40℃滴加三溴化硼(1.1ml,11.3mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(3.1ml,18.8mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用150 ml甲醇洗涤(0.9g,产率:20%)。元素分析结构(c
62h56
b2n2s2):理论值c,81.40;h,6.17;b,2.36; n,3.06;s,7.01测试值c,81.40;h,6.17;n,3.06;s,7.01。maldi-tof质谱:理论值914.4;实验值 914.4(m
+
)。
[0085]
对本发明实施例1制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0086]
实施例2
[0087]
反应式如下式:
[0088][0089]
在氩气氛围下,在500ml三口烧瓶中加1-溴-2-氯-3-氟苯(化合物2-1)(10.0g,47.8mmol), 9,9-二甲基吖啶(9.99g,47.8mmol),三(二亚苄基丙酮)二钯(1.1g,1.20mmol),三叔丁基磷四氟硼酸盐(1.4g,4.8mmol)和叔丁醇钠(7.0g,0.07mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物2-2 (12.1g,产率:75%)。元素分析结构(c
21h17
clfn):理论值c,74.66;h,5.07;cl,10.49;f,5.62;n, 4.15测试值c,74.65;h,5.08;n,4.14。基质辅助激光解吸电离飞行时间质谱(maldi-tof)质谱:理论值337.1;实验值337.1(m
+
)。
[0090]
在氩气氛围下,在500ml三口烧瓶中加入2-2(10.0g,29.7mmol),1,5-萘二硫酚(2.4g,13.4 mmol)和无水碳酸钾(8.2g,59.4mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至 115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 2-3(8.18g,产率:80%)。元素分析结构(c
52h40
cl2n2s2):理论值c,75.44;h,4.87;cl,8.56;n,3.38; s,7.74测试值c,75.44;h,4.87;n,3.38;s,7.74。maldi-tof质谱:理论值826.2;实验值826.2。
[0091]
在氩气氛围下,在500ml双口烧瓶中加入2-3(10.0g,12.1mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(26.6ml,2.5m,10.6mmol),滴加完毕后,升温至60℃反应2小时。于
‑ꢀ
40℃滴加三溴化硼(2.8ml,29.0mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(8.0ml,48.4mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(1.8g,产率:20%)。元素分析结构(c
52h36
b2n2s2):理论值c,80.63;h,4.68;b, 2.79;n,3.62;s,8.28测试值c,80.63;h,4.68;n,3.62;s,8.28。maldi-tof质谱:理论值774.3;实验值774.3(m
+
)。
[0092]
对本发明实施例2制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0093]
实施例3
[0094]
反应式如下式:
[0095][0096]
在氩气氛围下,在500ml三口烧瓶中加入1-溴-2-氯-3-氟苯(10.0g,47.8mmol),9,9-二苯基吖啶(15.9g,47.8mmol),三(二亚苄基丙酮)二钯(1.1g,1.20mmol),三叔丁基磷四氟硼酸盐(1.4 g,4.8mmol)和叔丁醇钠(7.0g,0.07mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物3-2(20.3g,产率: 92%)。元素分析结构(c
31h21
clfn):理论值c,80.60;h,4.58;cl,7.67;f,4.11;n,3.03测试值c, 80.59;h,4.58;n,3.03。基质辅助激光解吸电离飞行时间质谱(maldi-tof)质谱:理论值461.1;实验值461.1(m
+
)。
[0097]
在氩气氛围下,在500ml三口烧瓶中加入3-2(10.0g,21.6mmol),1,5-萘二硫酚(2.1g,10.8 mmol)和无水碳酸钾(6.0g,43.3mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至 115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 3-3(8.4g,产率:72%)。元素分析结构(c
72h48
cl2n2s2):理论值c,80.36;h,4.50;cl,6.59;n,2.60; s,5.96测试值c,80.36;h,4.51;n,2.62;s,5.94。maldi-tof质谱:理论值1074.3;实验值1074.3。
[0098]
在氩气氛围下,在500ml双口烧瓶中加入3-3(10.0g,9.3mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(9.3ml,2.5m,23.2mmol),滴加完毕后,升温至60℃反应2小时。于-40℃滴加三溴化硼(2.2ml,23.2mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(6.1ml,37.2mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用150 ml甲醇洗涤(2.1g,产率:22%)。元素分析结构(c
72h44
b2n2s2):理论值c,84.54;h,4.34;b,2.11; n,2.74;s,6.27测试值c,84.54;h,4.34;n,2.74;s,6.27。maldi-tof质谱:理论值1022.3;实验值 1022.4(m
+
)。
[0099]
对本发明实施例3制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0100]
实施例4
[0101]
反应式如下式:
[0102][0103]
在氩气氛围下,在500ml三口烧瓶中加入1-溴-2,6-二氟苯(10.0g,51.8mmol),二苯并呋喃并咔唑(10.8g,31.1mmol)和碳酸铯(40.5g,124.4mmol),取200ml n,n-二甲基甲酰胺(dmf) 加入瓶中,升温至130℃,搅拌反应3小时,冷却至室温后,将反应液加入400ml饱和食盐水中沉降,过滤,真空干燥,所得固体经过硅胶柱分离得到产物4-2(8.6g,产率:53%)。元素分析结构 (c
30h15
brfno2):理论值c,69.25;h,2.91;br,15.36;f,3.65;n,2.69;o,6.15测试值c,69.25;h,2.92; n,2.69。maldi-tof质谱:理论值519.0;实验值519.0(m
+
)。
[0104]
在氩气氛围下,在500ml三口烧瓶中加入4-2(10.0g,28.8mmol),5-巯基萘酚(2.5g,14.4 mmol)和无水碳酸钾(8.0g,57.6mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至 115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 4-3(13.1g,产率:72%)。元素分析结构(c
76h48
br2n2o5s):理论值c,72.38;h,3.84;br,12.67;n, 2.22;o,6.34;s,2.54测试值c,72.40;h,3.84;n,2.22;s,2.53。maldi-tof质谱:理论值1258.2;实验值1258.2(m
+
)。
[0105]
在氩气氛围下,在500ml双口烧瓶中加入4-3(10.0g,7.9mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(7.9ml,2.5m,19.8mmol),滴加完毕后,升温至60℃反应2小时。于-40℃滴加三溴化硼(1.9ml,19.8mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(5.2ml,31.7mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用150 ml甲醇洗涤(1.6g,产率:16%)。元素分析结构(c
76h44
b2n2o5s):理论值c,81.59;h,3.96;b,1.93; n,2.50;o,7.15;s,2.87测试值c,81.59;h,3.96;n,2.50;s,2.88。maldi-tof质谱:理论值1118.3;实验值1118.3(m
+
)。
[0106]
对本发明实施例4制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0107]
实施例5
[0108]
反应式如下式:
[0109][0110]
在氩气氛围下,在500ml三口烧瓶中加入2-氯-1,3-二溴苯(10.0g,47.8mmol),二苯胺(8.1g, 47.8mmol),三(二亚苄基丙酮)二钯(1.1g,1.20mmol),三叔丁基磷四氟硼酸盐(1.4g,4.8 mmol)和叔丁醇钠(7.0g,0.07mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物5-2(12.9g,产率: 91%)。元素分析结构(c
18h13
clfn):理论值c,72.61;h,4.40;cl,11.91;f,6.38;n,4.70测试值c, 72.61;h,4.40;n,4.70。maldi-tof质谱:理论值297.1;实验值297.1(m
+
)。
[0111]
在氩气氛围下,在500ml三口烧瓶中加入5-2(10.0g,37.0mmol),二苯胺(6.3g,37.0 mmol),三(二亚苄基丙酮)二钯(1.1g,1.20mmol),三叔丁基磷四氟硼酸盐(1.4g,4.8mmol)和叔丁醇钠(7.0g,0.07mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物5-3(12.5g,产率:94%)。元素分析结构(c
18h13
brcln):理论值c,60.28;h,3.65;br,22.28;cl,9.88;n,3.91测试值c,60.28;h,3.65;n, 3.91。maldi-tof质谱:理论值357.0;实验值357.0(m
+
)。
[0112]
在氩气氛围下,在500ml三口烧瓶中加入5-3(10.0g,27.9mmol),苯胺(2.6g,27.9mmol),三(二亚苄基丙酮)二钯(0.5g,0.60mmol),三叔丁基磷四氟硼酸盐(0.7g,2.4mmol)和叔丁醇钠 (3.5g,35.0mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用 200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物5-4(9.7g,产率:94%)。元素分析结构 (c
24h19
cln2):理论值c,77.72;h,5.16;cl,9.56;n,7.55;测试值c,77.72;h,5.16;n,7.55。maldi
‑ꢀ
tof质谱:理论值370.1;实验值370.1(m
+
)。
[0113]
在氩气氛围下,在500ml三口烧瓶中加入5-4(10.0g,27.0mmol),5-溴-1-萘硒酚(7.7g,27.0 mmol),三(二亚苄基丙酮)二钯(0.5g,0.60mmol),三叔丁基磷四氟硼酸盐(0.7g,2.4mmol)和叔丁醇钠(3.5g,35.0mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合
并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物5-5(14.0g,产率:90%)。元素分析结构(c
34h25
cln2se):理论值c,70.90;h,4.37;cl,6.15;n,4.86;se,13.71;测试值c,70.90;h,4.37;n, 4.84。maldi-tof质谱:理论值576.1;实验值576.1(m
+
)。
[0114]
在氩气氛围下,在500ml三口烧瓶中加入5-5(10.0g,17.4mmol),5-2(5.2g,17.4mmol)和无水碳酸钾(4.8g,34.8mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物5-6(11.9g,产率:80%)。元素分析结构(c
52h37cl2
n3se):理论值c,73.16;h,4.37;cl,8.30;n,4.92;se,9.25;测试值c, 73.18;h,4.37;n,4.90。maldi-tof质谱:理论值853.2;实验值853.2(m
+
)。
[0115]
在氩气氛围下,在500ml双口烧瓶中加入5-6(10.0g,11.7mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(11.7ml,2.5m,29.3mmol),滴加完毕后,升温至60℃反应2小时。于
‑ꢀ
40℃滴加三溴化硼(2.8ml,29.3mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(7.7ml,46.8mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(0.9g,产率:10%)。元素分析结构(c
52h33
b2n3se):理论值c,78.03;h,4.16;b, 2.70;n,5.25;se,9.87测试值c,78.03;h,4.16;n,5.25。maldi-tof质谱:理论值801.2;实验值 801.2(m
+
)。
[0116]
对本发明实施例5制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0117]
实施例6
[0118]
反应式如下式:
[0119][0120]
在氩气氛围下,在500ml三口烧瓶中加入1-溴-2,6-二氟苯(10.0g,51.8mmol),苯并噻吩并咔唑(8.5g,31.1mmol)和碳酸铯(40.5g,124.4mmol),取200ml n,n-二甲基甲酰胺(dmf)加入瓶中,升温至130℃,搅拌反应3小时,冷却至室温后,将反应液加入400ml饱和食盐水中沉降,过滤,真空干燥,所得固体经过硅胶柱分离得到产物6-2(6.2g,产率:45%)。元素分析结构 (c
24h13
brfns):理论值c,69.25;h,2.91;br,15.36;f,3.65;n,2.69;o,6.15测试值c,69.25;h,2.92;n, 2.69。maldi-tof质谱:理论值445.0;实验值445.0(m
+
)。
[0121]
在氩气氛围下,在500ml三口烧瓶中加入6-2(10.0g,22.4mmol),5-羟基,1-萘硒酚(2.5g, 11.2mmol)和无水碳酸钾(6.2g,44.8mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 6-3(10.2g,产率:72%)。元素分析结构(c
70h40
br2n2os2se):理论值c,68.47;h,3.28;br,13.01;n, 2.28;o,1.30;s,5.22;se,6.43测试值c,68.47;h,3.28;n,2.30;s,5.21。maldi-tof质谱:理论值 1226.0;实验值1226.0(m
+
)。
[0122]
在氩气氛围下,在500ml双口烧瓶中加入6-3(10.0g,7.9mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(7.9ml,2.5m,19.8mmol),滴加完毕后,升温至60℃反应2小时。于-40℃滴加三溴化硼(1.9ml,19.8mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(5.2ml,31.7mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用150 ml甲醇洗涤(1.8g,产率:22%)。元素分析结构(c
70h36
b2n2os2se):理论值c,77.43;h,3.34;b, 1.99;n,2.58;o,1.47;s,5.91;se,7.27测试值c,77.43;h,3.34;n,2.58;s,5.91。maldi-tof质谱:理论值1086.2;实验值1086.2(m
+
)。
[0123]
对本发明实施例6制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0124]
实施例7
[0125]
反应式如下式:
[0126][0127]
在氩气氛围下,在500ml三口烧瓶中加入1-溴-2-氯-3-氟苯(10.0g,47.8mmol),10h-螺[吖啶
‑ꢀ
9,9'-芴](15.8g,47.8mmol),三(二亚苄基丙酮)二钯(1.1g,1.2mmol),三叔丁基磷四氟硼酸盐 (1.4g,4.8mmol)和叔丁醇钠(7.0g,72.8mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物7-2(20.2g,产率:92%)。元素分析结构(c
31h19
clfn):理论值c,80.95;h,4.16;cl,7.71;f,4.13;n,3.05测试值c, 80.95;h,4.16;n,3.04。基质辅助激光解吸电离飞行时间质谱(maldi-tof)质谱:理论值459.1;实验值459.1(m
+
)。
[0128]
在氩气氛围下,在500ml三口烧瓶中加入7-2(10.0g,21.7mmol),1,5-萘二碲酚(4.2g,10.9 mmol)和无水碳酸钾(6.0g,43.5mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶
中,升温至 115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 6-3(8.2g,产率:60%)。元素分析结构(c
72h44
cl2n2te2):理论值c,68.46;h,3.51;cl,5.61;n,2.22; te,20.20测试值c,68.46;h,3.51;n,2.22。maldi-tof质谱:理论值1266.1;实验值1266.1。
[0129]
在氩气氛围下,在500ml双口烧瓶中加入7-3(10.0g,7.9mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(7.9ml,2.5m,19.8mmol),滴加完毕后,升温至60℃反应2小时。于-40℃滴加三溴化硼(1.9ml,19.8mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(5.2ml,31.7mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用150 ml甲醇洗涤(1.0g,产率:12%)。元素分析结构(c
72h40
b2n2te2):理论值c,71.47;h,3.33;b,1.79; n,2.32;te,21.09测试值c,71.47;h,3.34;n,2.32。maldi-tof质谱:理论值1214.2;实验值1214.2 (m
+
)。
[0130]
对本发明实施例7制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0131]
实施例8
[0132]
反应式如下式:
[0133][0134]
在氩气氛围下,在500ml三口烧瓶中加入1-溴-2-氯-3-氟苯(10.0g,47.8mmol),吩噁嗪(8.8g, 47.8mmol),三(二亚苄基丙酮)二钯(1.1g,1.2mmol),三叔丁基磷四氟硼酸盐(1.4g,4.8 mmol)和叔丁醇钠(7.0g,72.8mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物8-2(14.0g,产率: 94%)。元素分析结构(c
18h11
clfno):理论值c,69.35;h,3.56;cl,11.37;f,6.09;n,4.49;o,5.13测试值c,69.35;h,3.56;n,4.49。基质辅助激光解吸电离飞行时间质谱(maldi-tof)质谱:理论值 311.1;实验值311.1(m
+
)。
[0135]
在氩气氛围下,在500ml三口烧瓶中加入8-2(10.0g,32.1mmol),1,5-萘二硫酚(3.1g,16.1 mmol)和无水碳酸钾(8.9g,64.3mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至 115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅
胶柱分离得到产物 8-3(10.0g,产率:80%)。元素分析结构(c
46h28
cl2n2o2s2):理论值c,71.22;h,3.64;cl,9.14;n, 3.61;o,4.12;s,8.27测试值c,71.22;h,3.64;n,3.61;s,8.27。maldi-tof质谱:理论值774.1;实验值774.1(m
+
)。
[0136]
在氩气氛围下,在500ml双口烧瓶中加入8-3(10.0g,12.9mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(12.9ml,2.5m,32.2mmol),滴加完毕后,升温至60℃反应2小时。于
‑ꢀ
40℃滴加三溴化硼(3.1ml,32.2mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(8.5ml,51.6mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(2.4g,产率:26%)。元素分析结构(c
46h24
b2n2o2s2):理论值c,76.48;h,3.35;b, 2.99;n,3.88;o,4.43;s,8.88测试值c,76.49;h,3.36;n,3.88s,8.90。maldi-tof质谱:理论值 722.1;实验值722.1(m
+
)。
[0137]
对本发明实施例8制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0138]
实施例9
[0139]
反应式如下式:
[0140][0141]
在氩气氛围下,在500ml三口烧瓶中加入1-溴-2-氯-3-氟苯(10.0g,47.8mmol),n-苯基-2-萘胺(10.5g,47.8mmol),三(二亚苄基丙酮)二钯(1.1g,1.2mmol),三叔丁基磷四氟硼酸盐(1.4 g,4.8mmol)和叔丁醇钠(7.0g,72.8mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物9-2(15.6g,产率: 94%)。元素分析结构(c
22h15
clfn):理论值c,75.97;h,4.35;cl,10.19;f,5.46;n,4.03测试值c, 75.97;h,4.36;n,4.03。基质辅助激光解吸电离飞行时间质谱(maldi-tof)质谱:理论值347.1;实验值347.1(m
+
)。
[0142]
在氩气氛围下,在500ml三口烧瓶中加入9-2(10.0g,28.8mmol),1,5-萘二硫酚(2.8g,14.4 mmol)和无水碳酸钾(7.9g,57.5mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至 115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 9-3(9.1g,产率:75%)。元素分析结构(c
54h36
cl2n2s2):理论值c,76.49;
h,4.28;cl,8.36;n,3.30; s,7.56测试值c,76.49;h,4.29;n,3.33;s,7.56。maldi-tof质谱:理论值846.2;实验值846.2 (m
+
)。
[0143]
在氩气氛围下,在500ml双口烧瓶中加入9-3(10.0g,11.8mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(11.8ml,2.5m,29.5mmol),滴加完毕后,升温至60℃反应2小时。于
‑ꢀ
40℃滴加三溴化硼(2.8ml,29.5mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(7.8ml,48.1mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(2.2g,产率:23%)。元素分析结构(c
54h32
b2n2s2):理论值c,81.62;h,4.06;b, 2.72;n,3.53;s,8.07测试值c,81.62;h,4.06;n,3.51;s,8.05。maldi-tof质谱:理论值794.2;实验值794.2(m
+
)。
[0144]
对本发明实施例9制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0145]
实施例10
[0146]
反应式如下式:
[0147][0148]
在氩气氛围下,在500ml三口烧瓶中加入1-溴-2-氯-3-氟苯(10.0g,47.8mmol),n-苯基-2-苯并噻吩胺(10.8g,47.8mmol),三(二亚苄基丙酮)二钯(1.1g,1.2mmol),三叔丁基磷四氟硼酸盐(1.4g,4.8mmol)和叔丁醇钠(7.0g,72.8mol),加入250ml甲苯。升温至105℃,搅拌反应3 小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物10-2(15.4 g,产率:91%)。元素分析结构(c
20h13
clfns):理论值c,67.89;h,3.70;cl,10.02;f,5.37;n,3.96;s, 9.06测试值c,67.89;h,3.71;n,3.94;s,9.07。基质辅助激光解吸电离飞行时间质谱(maldi-tof)质谱:理论值353.0;实验值353.0(m
+
)。
[0149]
在氩气氛围下,在500ml三口烧瓶中加入10-2(10.0g,28.3mmol),1,5-萘二硫酚(2.87g,14.2 mmol)和无水碳酸钾(7.8g,56.7mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至 115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 10-3(9.1g,产率:75%)。元素分析结构(c
54h36
cl2n2s2):理论值c,69.83;h,3.75;cl,8.24;n,3.26; s,14.91测试值c,69.83;h,3.76;n,3.26;s,14.90。maldi-tof质谱:理论值858.1;实验值858.1 (m
+
)。
[0150]
在氩气氛围下,在500ml双口烧瓶中加入10-3(10.0g,11.7mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(11.7ml,2.5m,29.1mmol),滴加完毕后,升温至60℃反应2小时。于
‑ꢀ
40℃滴加三溴化硼(2.8ml,29.1mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(7.7ml,46.6mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(1.8g,产率:19%)。元素分析结构(c
50h28
b2n2s4):理论值c,74.45;h,3.50;b, 2.68;n,3.47;s,15.90测试值c,74.45;h,3.51;n,3.46;s,15.90。maldi-tof质谱:理论值806.1;实验值806.0(m
+
)。
[0151]
对本发明实施例10制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0152]
实施例11
[0153]
反应式如下式:
[0154][0155]
在氩气氛围下,在500ml三口烧瓶中加入1-溴-2-氯-3-氟苯(10.0g,47.8mmol),(n-苯基)-n
‑ꢀ
(9-苯基-9h-咔唑-3)-胺(16.0g,47.8mmol),三(二亚苄基丙酮)二钯(1.1g,1.2mmol),三叔丁基磷四氟硼酸盐(1.4g,4.8mmol)和叔丁醇钠(7.0g,72.8mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200 ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物11-2(20.1g,产率:91%)。元素分析结构(c
30h20
clfn2):理论值c,77.83;h,4.35;cl,7.66;f, 4.10;n,6.05测试值c,77.83;h,4.35;n,6.04。基质辅助激光解吸电离飞行时间质谱(maldi-tof) 质谱:理论值462.1;实验值462.1(m
+
)。
[0156]
在氩气氛围下,在500ml三口烧瓶中加入11-2(10.0g,21.6mmol),1,5-萘二硫酚(2.1g,10.8 mmol)和无水碳酸钾(6.0g,43.2mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至 115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 11-3(7.3g,产率:63%)。元素分析结构(c
70h46
cl2n4s2):理论值c,77.98;h,4.30;cl,6.58;n,5.20; s,5.95测试值c,77.96;h,4.32;n,5.21;s,5.95。maldi-tof质谱:理论值1076.3;实验值1076.3 (m
+
)。
[0157]
在氩气氛围下,在500ml双口烧瓶中加入11-3(10.0g,9.3mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(9.3ml,2.5m,23.2mmol),滴加完毕后,升温至60℃反应
2小时。于-40℃滴加三溴化硼(2.2ml,23.2mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(6.1ml,37.2mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用150 ml甲醇洗涤(1.3g,产率:14%)。元素分析结构(c
70
h42b2n4s2):理论值c,82.04;h,4.13;b,2.11; n,5.47;s,6.26测试值c,82.04;h,4.13;n,5.46;s,6.26。maldi-tof质谱:理论值1024.3;实验值 1024.3(m
+
)。
[0158]
对本发明实施例11制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0159]
实施例12
[0160]
反应式如下式:
[0161][0162]
在氩气氛围下,在500ml三口烧瓶中加入1-溴-2-氯-3-氟苯(10.0g,47.8mmol),n-对叔丁基苯基-2-苯并呋喃胺(12.7g,47.8mmol),三(二亚苄基丙酮)二钯(1.1g,1.2mmol),三叔丁基磷四氟硼酸盐(1.4g,4.8mmol)和叔丁醇钠(7.0g,72.8mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物12-2 (17.9g,产率:95%)。元素分析结构(c
24h21
clfno):理论值c,73.18;h,5.37;cl,9.00;f,4.82;n, 3.56;o,4.06测试值c,73.18;h,5.37;n,3.58。基质辅助激光解吸电离飞行时间质谱(maldi-tof) 质谱:理论值393.1;实验值393.1(m
+
)。
[0163]
在氩气氛围下,在500ml三口烧瓶中加入12-2(10.0g,25.4mmol),5-羟基-1-萘硒酚(2.6g, 12.7mmol)和无水碳酸钾(7.0g,50.8mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 12-3(8.0g,产率:63%)。元素分析结构(c
58h48cl2
n2o3se):理论值c,71.75;h,4.98;cl,7.30;n, 2.89;o,4.94;se,8.13测试值c,71.75;h,4.98;n,2.89。maldi-tof质谱:理论值970.2;实验值 970.2(m
+
)。
[0164]
在氩气氛围下,在500ml双口烧瓶中加入12-3(10.0g,10.3mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(10.3ml,2.5m,25.8mmol),滴加完毕后,升温至60℃反应2小时。于
‑ꢀ
40℃滴加三溴化硼(2.5ml,25.8mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(6.8ml,41.2mmol),滴加完毕后,升温至170℃反应24小时。
降至室温,过滤,用 150ml甲醇洗涤(1.3g,产率:14%)。元素分析结构(c
58h44
b2n2o3se):理论值c,75.92;h,4.83;b, 2.36;n,3.05;o,5.23;se,8.61测试值c,75.92;h,4.83;n,3.05。maldi-tof质谱:理论值918.3;实验值918.3(m
+
)。
[0165]
对本发明实施例12制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0166]
实施例13
[0167]
反应式如下式:
[0168][0169]
在氩气氛围下,在500ml三口烧瓶中加入11-2(10.0g,21.6mmol),1,5-萘二硒酚(3.1g,10.8 mmol)和无水碳酸钾(6.0g,43.2mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至 115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 13-3(7.0g,产率:55%)。元素分析结构(c
70h46
cl2n4se2):理论值c,71.74;h,3.96;cl,6.05;n, 4.78;se,13.48测试值c,71.74;h,3.96;n,4.78。maldi-tof质谱:理论值1172.1;实验值1172.1 (m
+
)。
[0170]
在氩气氛围下,在500ml双口烧瓶中加入13-3(10.0g,8.5mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(8.5ml,2.5m,21.3mmol),滴加完毕后,升温至60℃反应2小时。于-40℃滴加三溴化硼(2.1ml,21.3mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(5.6ml,34.1mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用150 ml甲醇洗涤(1.1g,产率:11%)。元素分析结构(c
70h42
b2n4se2):理论值c,75.16;h,3.78;b,1.93; n,5.01;se,14.12测试值c,75.16;h,3.78;n,5.01。maldi-tof质谱:理论值1120.2;实验值1120.2 (m
+
)。
[0171]
对本发明实施例13制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0172]
实施例14
[0173]
反应式如下式:
[0174][0175]
在氩气氛围下,在500ml三口烧瓶中加入1-溴-2,6-二氟苯(10.0g,51.8mmol),苯硫酚(3.4g, 31.1mmol)和无水碳酸钾(8.6g,62.2mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 14-2(6.2g,产率:70%)。元素分析结构(c
12
h8brfs):理论值c,50.90;h,2.85;br,28.22;f,6.71;s, 11.32测试值c,50.90;h,2.88;s,11.32。maldi-tof质谱:理论值282.0;实验值282.0(m
+
)。
[0176]
在氩气氛围下,在500ml三口烧瓶中加入14-2(10.0g,35.3mmol),1,5-萘二硫酚(9.5g,19.2 mmol)和无水碳酸钾(27.3g,197.7mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至 115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 14-3(10.5g,产率:65%)。元素分析结构(c
22h15
brs3):理论值c,58.02;h,3.32;br,17.54;s,21.12 测试值c,58.02;h,3.32;s,21.12。maldi-tof质谱:理论值454.0;实验值454.0(m
+
)。
[0177]
在氩气氛围下,在500ml三口烧瓶中加入14-3(10.0g,22.0mmol),5-2(9.5g,22.0mmol)和无水碳酸钾(6.1g,43.9mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物14-4(15.4g,产率:90%)。元素分析结构(c
40h27br2
ns3):理论值c,61.78;h,3.50;br,20.55;n,1.80;s,12.37测试值c,61.78;h,3.50;n,1.83;s,12.37。maldi-tof质谱:理论值775.0;实验值775.0(m
+
)。
[0178]
在氩气氛围下,在500ml双口烧瓶中加入14-4(10.0g,12.9mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(12.9ml,2.5m,32.1mmol),滴加完毕后,升温至60℃反应2小时。于
‑ꢀ
40℃滴加三溴化硼(3.1ml,32.1mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(8.5ml,51.4mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(2.5g,产率:30%)。元素分析结构(c
40h23
b2ns3):理论值c,75.61;h,3.65;b, 3.40;n,2.20;s,15.14测试值c,75.61;h,3.65;n,2.20;s,15.14。
maldi-tof质谱:理论值635.1;实验值635.1(m
+
)。
[0179]
对本发明实施例14制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0180]
实施例15
[0181]
反应式如下式:
[0182][0183]
在氩气氛围下,在500ml三口烧瓶中加入5-4(10.0g,27.0mmol),5-溴-1-萘硫酚(4.2g,27.0 mmol),三(二亚苄基丙酮)二钯(0.5g,0.60mmol),三叔丁基磷四氟硼酸盐(0.7g,2.4mmol)和叔丁醇钠(3.5g,35.0mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物15-2(12.9g,产率:90%)。元素分析结构(c
34h25
cln2s):理论值c,77.18;h,4.76;cl,6.70;n,5.29;s,6.06;测试值c,77.18;h,4.76;n,5.29; s,6.06。maldi-tof质谱:理论值528.1;实验值528.1(m
+
)。
[0184]
在氩气氛围下,在500ml三口烧瓶中加入15-2(10.0g,18.9mmol),14-2(5.3g,18.9mmol) 和无水碳酸钾(5.2g,37.8mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物15-3(12.0g,产率:85%)。元素分析结构(c
46h32
cl2n2s2):理论值c,73.88;h,4.31;cl,9.48;n,3.75;s,8.57;测试值 c,73.88;h,4.31;n,3.75;s,8.57。maldi-tof质谱:理论值746.1;实验值746.1(m
+
)。
[0185]
在氩气氛围下,在500ml双口烧瓶中加入15.3(10.0g,13.4mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(13.4ml,2.5m,33.5mmol),滴加完毕后,升温至60℃反应2小时。于
‑ꢀ
40℃滴加三溴化硼(3.2ml,33.5mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(8.9ml,53.6mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(1.5g,产率:16%)。元素分析结构(c
46h28
b2n2s2):理论值c,79.56;h,4.06;b, 3.11;n,4.03;s,9.23测试值c,79.56;h,4.06;n,4.03;s,9.23。maldi-tof质谱:理论值694.2;实验值694.2(m
+
)。
[0186]
对本发明实施例15制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0187]
实施例16
[0188]
反应式如下式:
[0189][0190]
在氩气氛围下,在500ml三口烧瓶中加入1-溴-2,6-二氟苯(10.0g,51.8mmol),苯硒酚(4.9g, 31.1mmol)和无水碳酸钾(8.6g,62.2mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 16-2(4.1g,产率:40%)。元素分析结构(c
12
h8brfse):理论值c,43.67;h,2.44;br,24.21;f,5.76; se,23.93测试值c,43.65;h,2.44。maldi-tof质谱:理论值329.9;实验值329.9(m
+
)。
[0191]
在氩气氛围下,在500ml三口烧瓶中加入16-2(10.0g,30.3mmol),1,5-萘二硒酚(4.3g,15.1 mmol)和无水碳酸钾(8.4g,60.6mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至 115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 16-3(9.6g,产率:70%)。元素分析结构(c
34h22
br2se4):理论值c,45.06;h,2.45;br,17.63;se, 34.86测试值c,45.06;h,2.45。maldi-tof质谱:理论值907.7;实验值907.7(m
+
)。
[0192]
在氩气氛围下,在500ml双口烧瓶中加入16-3(10.0g,11.0mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(11.0ml,2.5m,27.6mmol),滴加完毕后,升温至60℃反应2小时。于
‑ꢀ
40℃滴加三溴化硼(2.7ml,27.6mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(7.3ml,44.1mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(2.8g,产率:33%)。元素分析结构(c
34h18
b2se4):理论值c,53.45;h,2.37;b, 2.83;se,41.34测试值c,53.47;h,2.37。maldi-tof质谱:理论值767.8;实验值767.8(m
+
)。
[0193]
对本发明实施例16制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0194]
实施例17
[0195]
反应式如下式:
[0196][0197]
在氩气氛围下,在500ml三口烧瓶中加入5-2(10.0g,33.6mmol),4,7-二异丙基-1,5-萘二硫酚 (4.6g,16.8mmol)和无水碳酸钾(9.3g,67.2mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次 (100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物17-3(10.6g,产率:76%)。元素分析结构(c
52h44
cl2n2s2):理论值c,75.07;h,5.33;cl,8.52; n,3.37;s,7.71测试值c,75.03;h,5.34;n,3.39;s,7.71。maldi-tof质谱:理论值830.2;实验值 830.2(m
+
)。
[0198]
在氩气氛围下,在500ml双口烧瓶中加入17-3(10.0g,12.0mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(12.0ml,2.5m,30.1mmol),滴加完毕后,升温至60℃反应2小时。于
‑ꢀ
40℃滴加三溴化硼(2.9ml,30.1mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(8.0ml,48.2mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(1.7g,产率:14%)。元素分析结构(c
52h40
b2n2s2):理论值c,80.21;h,5.18;b, 2.78;n,3.60;s,8.23测试值c,80.21;h,5.18;n,3.62;s,8.21。maldi-tof质谱:理论值778.3;实验值778.3(m
+
)。
[0199]
对本发明实施例17制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0200]
实施例18
[0201]
反应式如下式:
[0202][0203]
在氩气氛围下,在500ml三口烧瓶中加入1-2(10.0g,22.1mmol),1,5
‑‑
二甲基-2,6-萘二硫酚 (2.4g,11.1mmol)和无水碳酸钾(6.1g,44.2mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次 (100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物18-3(9.6g,产率:80%)。元素分析结构(c
64h64
br2n2s2):理论值c,70.84;h,5.94;br,14.73; n,2.58;s,5.91测试值c,70.84;h,5.94;n,2.56;s,5.93。maldi-tof质谱:理论值1082.3;实验值 1082.3(m
+
)。
[0204]
在氩气氛围下,在500ml双口烧瓶中加入18-3(10.0g,9.2mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(9.2ml,2.5m,23.0mmol),滴加完毕后,升温至60℃反应2小时。于-40℃滴加三溴化硼(2.2ml,23.0mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(6.1ml,36.9mmol),滴加完毕后,升温至170℃反应24小时。降至
室温,过滤,用150 ml甲醇洗涤(2.5g,产率:26%)。元素分析结构(c
64h60
b2n2s2):理论值c,81.52;h,6.41;b,2.29; n,2.97;s,6.80测试值c,81.52;h,6.41;n,2.97;s,6.80。maldi-tof质谱:理论值942.4;实验值 942.4(m
+
)。
[0205]
对本发明实施例18制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0206]
实施例19
[0207]
反应式如下式:
[0208][0209]
在氩气氛围下,在500ml三口烧瓶中加入2-2(10.0g,29.6mmol),1,5
‑‑
二甲基-2,6-萘二硫酚 (3.3g,14.8mmol)和无水碳酸钾(8.2g,59.2mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次 (100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物19-3(10.8g,产率:85%)。元素分析结构(c
54h44
cl2n2s2):理论值c,75.77;h,5.18;cl,8.28; n,3.27;s,7.49测试值c,75.73;h,5.18;n,3.29;s,7.49。maldi-tof质谱:理论值854.2;实验值 854.2(m
+
)。
[0210]
在氩气氛围下,在500ml双口烧瓶中加入19-3(10.0g,11.7mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(11.7ml,2.5m,29.2mmol),滴加完毕后,升温至60℃反应2小时。于
‑ꢀ
40℃滴加三溴化硼(2.8ml,29.2mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(7.7ml,46.7mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(2.1g,产率:22%)。元素分析结构(c
54h40
b2n2s2):理论值c,80.80;h,5.02;b, 2.69;n,3.49;s,7.99测试值c,80.80;h,5.02;n,3.49;s,7.99。maldi-tof质谱:理论值802.3;实验值802.3(m
+
)。
[0211]
对本发明实施例19制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0212]
实施例20
[0213]
反应式如下式:
[0214][0215]
在氩气氛围下,在500ml三口烧瓶中加入16-2(10.0g,30.3mmol),1,5-二苯基-2,6-萘二硒酚 (6.6g,15.1mmol)和无水碳酸钾(8.4g,60.6mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次 (100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去
溶剂后,经硅胶柱分离得到产物20-3(11.2g,产率:70%)。元素分析结构(c
46h30
br2se4):理论值c,52.20;h,2.86;br,15.10; se,29.84测试值c,52.19;h,2.84。maldi-tof质谱:理论值1059.7;实验值1059.7(m
+
)。
[0216]
在氩气氛围下,在500ml双口烧瓶中加入20-3(10.0g,9.4mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(9.4ml,2.5m,23.6mmol),滴加完毕后,升温至60℃反应2小时。于-40℃滴加三溴化硼(2.3ml,23.6mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(6.3ml,37.8mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用150 ml甲醇洗涤(3.3g,产率:38%)。元素分析结构(c
46h26
b2se4):理论值c,60.30;h,2.86;b,2.36; se,34.48测试值c,60.30;h,2.86。maldi-tof质谱:理论值919.9;实验值919.9(m
+
)。
[0217]
对本发明实施例20制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0218]
实施例21
[0219]
反应式如下式:
[0220][0221]
在氩气氛围下,在500ml三口烧瓶中加入1-溴-2-氯-3-氟苯(10.0g,47.8mmol),n-对叔丁基苯基-2-苯并噻吩胺(13.4g,47.8mmol),三(二亚苄基丙酮)二钯(1.1g,1.2mmol),三叔丁基磷四氟硼酸盐(1.4g,4.8mmol)和叔丁醇钠(7.0g,72.8mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物21-2 (17.6g,产率:90%)。元素分析结构(c
24h21
clfns):理论值c,70.32;h,5.16;cl,8.65;f,4.63;n, 3.42;s,7.82测试值c,70.32;h,5.16;n,3.42;s,7.82。基质辅助激光解吸电离飞行时间质谱(maldi
‑ꢀ
tof)质谱:理论值409.1;实验值409.1(m
+
)。
[0222]
在氩气氛围下,在500ml三口烧瓶中加入21-2(10.0g,24.4mmol),1,5-二甲基-2,6-萘二硒酚 (10.8g,34.2mmol)和无水碳酸钾(18.9g,136.9mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物21-3(8.6g,产率:50%)。元素分析结构(c
36h32
clnsse2):理论值c,61.41;h,4.58;cl,5.03; n,1.99;s,4.55;se,22.43测试值c,61.41;h,4.58;n,1.99;s,4.55。基质辅助激光解吸电离飞行时间质谱(maldi-tof)质谱:理论值705.0;实验
值705.0(m
+
)。
[0223]
在氩气氛围下,在500ml三口烧瓶中加入21-2(10.0g,24.4mmol),1,5-二甲基-2,6-萘二硒酚(10.8g,34.2mmol)和无水碳酸钾(9.5g,68.4mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次 (100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物21-3(8.6g,产率:50%)。元素分析结构(c
36h32
clnsse2):理论值c,61.41;h,4.58;cl,5.03; n,1.99;s,4.55;se,22.43测试值c,61.41;h,4.58;n,1.99;s,4.55。基质辅助激光解吸电离飞行时间质谱(maldi-tof)质谱:理论值705.0;实验值705.0(m
+
)。
[0224]
在氩气氛围下,在500ml三口烧瓶中加入21-3(10.0g,14.2mmol),1,5-二甲基-2,6-萘二硒酚 (6.4g,14.2mmol)和无水碳酸钾(3.9g,28.4mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次 (100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物21-4(13.7g,产率:85%)。元素分析结构(c
62h58
brcln2sse2):理论值c,65.52;h,5.14;br, 7.03;cl,3.12;n,2.46;s,2.82;se,13.90测试值c,65.52;h,5.14;n,2.44;s,2.82。基质辅助激光解吸电离飞行时间质谱(maldi-tof)质谱:理论值1136.2;实验值1136.2(m
+
)。
[0225]
在氩气氛围下,在500ml双口烧瓶中加入21-4(10.0g,8.8mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(8.8ml,2.5m,22.0mmol),滴加完毕后,升温至60℃反应2小时。于-40℃滴加三溴化硼(2.1ml,22.0mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(5.8ml,35.2mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用150 ml甲醇洗涤(0.9g,产率:10%)。元素分析结构(c
62h54
b2n2sse2):理论值c,71.69;h,5.24;b, 2.08;n,2.70;s,3.09;se,15.21测试值c,71.69;h,5.24;n,2.70;s,3.09。maldi-tof质谱:理论值 1040.3;实验值1040.3(m
+
)。
[0226]
对本发明实施例21制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0227]
实施例22
[0228]
反应式如下式:
[0229][0230]
在氩气氛围下,在500ml三口烧瓶中加入1-2(10.0g,22.1mmol),3,7
‑‑
二甲基-2,6-萘二硫酚 (2.4g,11.1mmol)和无水碳酸钾(6.1g,44.2mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和
食盐水洗涤三次 (100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物22-3(9.6g,产率:80%)。元素分析结构(c
64h64
br2n2s2):理论值c,70.84;h,5.94;br,14.73;n,2.58;s,5.91测试值c,70.84;h,5.94;n,2.56;s,5.93。maldi-tof质谱:理论值1082.3;实验值 1082.3(m
+
)。
[0231]
在氩气氛围下,在500ml双口烧瓶中加入22-3(10.0g,9.2mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(9.2ml,2.5m,23.0mmol),滴加完毕后,升温至60℃反应2小时。于-40℃滴加三溴化硼(2.2ml,23.0mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(6.1ml,36.9mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用150 ml甲醇洗涤(2.5g,产率:26%)。元素分析结构(c
64h60
b2n2s2):理论值c,81.52;h,6.41;b,2.29; n,2.97;s,6.80测试值c,81.52;h,6.41;n,2.98;s,6.80。maldi-tof质谱:理论值942.4;实验值 942.4(m
+
)。
[0232]
对本发明实施例22制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0233]
实施例23
[0234]
反应式如下式:
[0235][0236]
在氩气氛围下,在500ml三口烧瓶中加入1-溴-2-氯-3-氟苯(10.0g,51.8mmol),3,6-二叔丁基咔唑(14.5g,51.8mmol)和碳酸铯(67.5g,207.3mmol),取200ml n,n-二甲基甲酰胺(dmf) 加入瓶中,升温至130℃,搅拌反应3小时,冷却至室温后,将反应液加入400ml饱和食盐水中沉降,过滤,真空干燥,所得固体经过硅胶柱分离得到产物23-2(20.2g,产率:83%)。元素分析结构 (c
26h27
brcln):理论值c,66.60;h,5.80;br,17.04;cl,7.56;n,2.99测试值c,66.60;h,5.81;n,2.99。 maldi-tof质谱:理论值467.1;实验值467.1(m
+
)。
[0237]
在氩气氛围下,在500ml三口烧瓶中加入23-3(10.0g,21.3mmol),苯胺(2.0g,21.3 mmol),三(二亚苄基丙酮)二钯(1.1g,1.20mmol),三叔丁基磷四氟硼酸盐(1.4g,4.8mmol)和叔丁醇钠(7.0g,0.07mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物18-3(9.6g,产率:94%)。元素分析结构(c
32h33
cln2):理论值c,79.89;h,6.91;cl,7.37;n,5.82测试值c,
79.89;h,6.91;n,5.82。基质辅助激光解吸电离飞行时间质谱(maldi-tof)质谱:理论值480.2;实验值480.2(m
+
)。
[0238]
在氩气氛围下,在500ml三口烧瓶中加入23-3(10.0g,20.8mmol),3,7-二甲基-5-溴-2萘硫酚 (5.6g,20.8mmol),三(二亚苄基丙酮)二钯(1.1g,1.20mmol),三叔丁基磷四氟硼酸盐(1.4g, 4.8mmol)和叔丁醇钠(7.0g,0.07mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物23-4(12.7g,产率: 92%)。元素分析结构(c
44h43
cln2s):理论值c,79.19;h,6.49;cl,5.31;n,4.20;s,4.80测试值c, 79.19;h,6.49;n,4.20;s,4.80。maldi-tof质谱:理论值666.3;实验值666.2(m
+
)。
[0239]
在氩气氛围下,在500ml三口烧瓶中加入23-4(10.0g,15.0mmol),1-2(5.1g,15.0mmol)和无水碳酸钾(4.1g,30.0mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物23-5(12.6g,产率:80%)。元素分析结构(c
69h67
brcln3):理论值c,78.65;h,6.41;br,7.58;cl,3.36;n,3.99测试值 c,78.65;h,6.41;n,3.99。maldi-tof质谱:理论值1051.4;实验值1051.4(m
+
)。
[0240]
在氩气氛围下,在500ml双口烧瓶中加入23-5(10.0g,9.5mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(9.5ml,2.5m,23.8mmol),滴加完毕后,升温至60℃反应2小时。于-40℃滴加三溴化硼(2.3ml,23.8mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(6.3ml,38.0mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用150 ml甲醇洗涤(1.5g,产率:16%)。元素分析结构(c
71h67
b2n3):理论值c,86.67;h,6.86;b,2.20;n, 4.27测试值c,86.68;h,6.86;n,4.24。maldi-tof质谱:理论值983.6;实验值983.6(m
+
)。
[0241]
对本发明实施例23制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0242]
实施例24
[0243][0244]
在氩气氛围下,在500ml三口烧瓶中加入1-2(10.0g,22.1mmol),3,7
‑‑
二甲基-2-羟基-6-萘硒酚(2.8g,21.1mmol)和无水碳酸钾(6.1g,44.2mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次 (100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除
去溶剂后,经硅胶柱分离得到产物24-3(8.0g,产率:65%)。元素分析结构(c
64h64
br2n2ose):理论值c,68.88;h,5.78;br,14.32; n,2.51;o,1.43;se,7.08测试值c,68.88;h,5.78;n,2.51。maldi-tof质谱:理论值1114.3;实验值 1114.3(m
+
)。
[0245]
在氩气氛围下,在500ml双口烧瓶中加入24-3(10.0g,9.0mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(9.0ml,2.5m,22.4mmol),滴加完毕后,升温至60℃反应2小时。于-40℃滴加三溴化硼(2.2ml,22.4mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(5.9ml,35.8mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用150 ml甲醇洗涤(1.1g,产率:11%)。元素分析结构(c
64h60
b2n2ose):理论值c,78.94;h,6.21;b, 2.22;n,2.88;o,1.64;se,8.11测试值c,78.94;h,6.21;n,2.88。maldi-tof质谱:理论值974.4;实验值974.4(m
+
)。
[0246]
对本发明实施例24制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0247]
实施例25
[0248]
反应式如下式:
[0249][0250]
在氩气氛围下,在500ml三口烧瓶中加入2-氯-1,3-二溴苯(10.0g,37.0mmol),n-对叔丁基苯基-2-苯并呋喃胺(9.8g,37.0mmol),三(二亚苄基丙酮)二钯(1.1g,1.2mmol),三叔丁基磷四氟硼酸盐(1.4g,4.8mmol)和叔丁醇钠(7.0g,72.8mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物25-2 (15.5g,产率:92%)。元素分析结构(c
24h21
brclno):理论值c,63.38;h,4.65;br,17.57;cl,7.79; n,3.08;o,3.52测试值c,63.38;h,4.65;n,3.08。基质辅助激光解吸电离飞行时间质谱(maldi
‑ꢀ
tof)质谱:理论值453.0;实验值453.0(m
+
)。
[0251]
在氩气氛围下,在500ml三口烧瓶中加入25-2(10.0g,22.0mmol),苯胺(2.0g,22.0 mmol),三(二亚苄基丙酮)二钯(1.1g,1.2mmol),三叔丁基磷四氟硼酸盐(1.4g,4.8mmol)和叔丁醇钠(7.0g,72.8mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物25-3(9.4g,产率:
tof质谱:理论值1054.3;实验值 1054.3(m
+
)。
[0260]
在氩气氛围下,在500ml双口烧瓶中加入26-3(5.0g,4.7mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(4.1ml,2.5m,10.3mmol),滴加完毕后,升温至60℃反应2小时。于-40℃滴加三溴化硼(1.1ml,11.3mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(3.1ml,18.8mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用150 ml甲醇洗涤(0.9g,产率:20%)。元素分析结构(c
62h56
b2n2s2):理论值c,81.40;h,6.17;b,2.36; n,3.06;s,7.01测试值c,81.40;h,6.17;n,3.06;s,7.01。maldi-tof质谱:理论值914.4;实验值 914.4(m
+
)。
[0261]
对本发明实施例26制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0262]
实施例27
[0263]
反应式如下式:
[0264][0265]
在氩气氛围下,在500ml三口烧瓶中加入5-4(10.0g,27.0mmol),8-溴-1-萘硒酚(7.7g,27.0 mmol),三(二亚苄基丙酮)二钯(0.5g,0.60mmol),三叔丁基磷四氟硼酸盐(0.7g,2.4mmol)和叔丁醇钠(3.5g,35.0mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物27-3(14.0g,产率:90%)。元素分析结构(c
34h25
cln2se):理论值c,70.90;h,4.37;cl,6.15;n,4.86;se,13.71;测试值c,70.90;h,4.37;n, 4.84。maldi-tof质谱:理论值576.1;实验值576.1(m
+
)。
[0266]
在氩气氛围下,在500ml三口烧瓶中加入27-3(10.0g,17.4mmol),5-2(5.2g,17.4mmol)和无水碳酸钾(4.8g,34.8mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物27-4(11.9g,产率:80%)。元素分析结构(c
52h37
cl2n3se):理论值c,73.16;h,4.37;cl,8.30;n,4.92;se,9.25;测试值c,73.18;h,4.37;n,4.90。maldi-tof质谱:理论值853.2;实验值853.2(m
+
)。
[0267]
在氩气氛围下,在500ml双口烧瓶中加入27-4(10.0g,11.7mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(11.7ml,2.5m,29.3mmol),滴加完毕后,升温至60℃反
应2小时。于
‑ꢀ
40℃滴加三溴化硼(2.8ml,29.3mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(7.7ml,46.8mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(0.9g,产率:10%)。元素分析结构(c
52h33
b2n3se):理论值c,78.03;h,4.16;b, 2.70;n,5.25;se,9.87测试值c,78.03;h,4.16;n,5.25。maldi-tof质谱:理论值801.2;实验值 801.2(m
+
)。
[0268]
对本发明实施例27制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0269]
实施例28
[0270]
反应式如下式:
[0271][0272]
在氩气氛围下,在500ml三口烧瓶中加入12-2(10.0g,25.4mmol),5-羟基-1-萘硒酚(2.6g, 25.4mmol)和无水碳酸钾(7.0g,50.8mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 28-3(8.0g,产率:63%)。元素分析结构(c
34h28
clno2se):理论值c,68.40;h,4.73;cl,5.94;n, 2.35;o,5.36;se,13.23;o,4.94;se,8.13测试值c,68.40;h,4.73;n,2.35。maldi-tof质谱:理论值 597.1;实验值597.1(m
+
)。
[0273]
在氩气氛围下,在500ml三口烧瓶中加入28-3(10.0g,16.8mmol),5-羟基-1-萘硒酚(5.6g, 16.8mmol)和无水碳酸钾(4.6g,33.5mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100 ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物 28-4(10.7g,产率:70%)。元素分析结构(c
55h44
cl2n2o2se):理论c,72.21;h,4.85;cl,7.75;n, 3.06;o,3.50;se,8.63测试值c,72.21;h,4.85;n,3.06。maldi-tof质谱:理论值914.2;实验值 914.2(m
+
)。
[0274]
在氩气氛围下,在500ml双口烧瓶中加入28-4(10.0g,10.9mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(10.9ml,2.5m,28.4mmol),滴加完毕后,升温至60℃反应2小时。于
‑ꢀ
40℃滴加三溴化硼(2.6ml,27.4mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(7.2ml,43.8mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(1.3g,产率:14%)。元素分析结构(c
55h40
b2n2o2se):理论值c,76.68;h,4.68;b, 2.51;n,3.25;o,3.71;se,9.17测试值c,76.68;h,4.68;n,3.25。
maldi-tof质谱:理论值862.2;实验值862.2(m
+
)。
[0275]
对本发明实施例28制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0276]
实施例29
[0277]
反应式如下式:
[0278][0279]
在氩气氛围下,在500ml三口烧瓶中加入5-2(10.0g,33.6mmol),1,8-二甲基-2,7-萘二硫酚 (3.7g,16.8mmol)和无水碳酸钾(9.3g,67.2mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次 (100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物29-3(9.2g,产率:72%)。元素分析结构(c
48h36
cl2n2s2):理论值c,74.31;h,4.68;n,3.61;s, 8.26测试值c,74.31;h,4.68;n,3.61;s,8.26。maldi-tof质谱:理论值774.2;实验值774.2 (m
+
)。
[0280]
在氩气氛围下,在500ml双口烧瓶中加入29-3(10.0g,13.2mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(13.2ml,2.5m,33.1mmol),滴加完毕后,升温至60℃反应2小时。于
‑ꢀ
40℃滴加三溴化硼(2.2ml,33.1mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(8.8ml,52.9mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(1.8g,产率:19%)。元素分析结构(c
48h32
b2n2s2):理论值c,79.79;h,4.46;b, 2.99;n,3.88;s,8.87测试值c,79.79;h,4.46;n,3.88;s,8.87。maldi-tof质谱:理论值722.2;实验值722.2(m
+
)。
[0281]
对本发明实施例29制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0282]
实施例30
[0283]
反应式如下式:
[0284][0285]
在氩气氛围下,在500ml三口烧瓶中加入1-2(10.0g,22.1mmol),3,7
‑‑
二甲基-2,6-萘二硫酚 (2.4g,11.1mmol)和无水碳酸钾(6.1g,44.2mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次 (100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物30-3(9.6g,产率:80%)。元素分析结构(c
64h64
br2n2s2):理论值c,70.84;h,5.94;br,14.73; n,2.58;s,5.91测试值c,70.84;h,5.94;n,2.56;s,5.93。maldi-tof质谱:理论值1082.3;实验值 1082.3(m
+
)。
[0286]
在氩气氛围下,在500ml双口烧瓶中加入30-3(10.0g,9.2mmol),叔丁基苯
(200ml)。于 0℃滴加正丁基锂溶液(9.2ml,2.5m,23.0mmol),滴加完毕后,升温至60℃反应2小时。于-40℃滴加三溴化硼(2.2ml,23.0mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n-二异丙基乙胺(6.1ml,36.9mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用150 ml甲醇洗涤(2.5g,产率:26%)。元素分析结构(c
64h60
b2n2s2):理论值c,81.52;h,6.41;n,2.97; s,6.80测试值c,81.52;h,6.41;b,2.30;n,2.98;s,6.80。maldi-tof质谱:理论值942.4;实验值 942.4(m
+
)。
[0287]
对本发明实施例30制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0288]
实施例31
[0289]
反应式如下式:
[0290][0291]
在氩气氛围下,在500ml三口烧瓶中加入5-4(10.0g,27.0mmol),1,8-二甲基-7-溴-2-萘硒酚 (8.5g,27.0mmol),三(二亚苄基丙酮)二钯(0.5g,0.60mmol),三叔丁基磷四氟硼酸盐(0.7g, 2.4mmol)和叔丁醇钠(3.5g,35.0mol),加入250ml甲苯。升温至105℃,搅拌反应3小时。冷却至室温后,将反应液用200ml乙醚萃取,饱和食盐水洗涤三次(200ml
×
3),有机相合并后,加入无水硫酸钠干燥,减压蒸馏除去溶剂后,所得固体经过硅胶柱分离得到产物31-4(14.8g,产率: 91%)。元素分析结构(c
36h29
cln2se):理论值c,71.58;h,4.84;cl,5.87;n,4.64;se,13.07;测试值c, 71.58;h,4.84;n,4.64。maldi-tof质谱:理论值604.1;实验值604.1(m
+
)。
[0292]
在氩气氛围下,在500ml三口烧瓶中加入31-4(10.0g,16.6mmol),5-2(4.9g,16.6mmol)和无水碳酸钾(4.6g,33.1mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物31-4(12.1g,产率:83%)。元素分析结构(c
54h41
cl2n3se):理论值c,73.55;h,4.69;cl,8.04;n,4.77;se,8.96;测试值c,73.55;h,4.69;n,4.77。maldi-tof质谱:理论值881.2;实验值881.2(m
+
)。
[0293]
在氩气氛围下,在500ml双口烧瓶中加入31-5(10.0g,11.3mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(11.3ml,2.5m,28.4mmol),滴加完毕后,升温至60℃反
应2小时。于
‑ꢀ
40℃滴加三溴化硼(2.7ml,28.4mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(7.5ml,45.4mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(0.9g,产率:10%)。元素分析结构(c
54h37
b2n3se):理论值c,78.29;h,4.50;b, 2.61;n,5.07;se,9.53测试值c,78.29;h,4.50;n,5.07。maldi-tof质谱:理论值829.2;实验值 829.2(m
+
)。
[0294]
对本发明实施例31制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0295]
实施例32
[0296]
反应式如下式:
[0297][0298]
在氩气氛围下,在500ml三口烧瓶中加入31-4(10.0g,16.6mmol),12-2(6.5g,16.6mmol) 和无水碳酸钾(4.6g,33.1mmol),取180ml n-甲基吡咯烷酮(nmp)加入瓶中,升温至115℃,搅拌反应5小时,冷却至室温后,200ml二氯甲烷萃取,用饱和食盐水洗涤三次(100ml
×
3),分离出有机相,加入无水硫酸钠干燥,有机相减压蒸馏除去溶剂后,经硅胶柱分离得到产物32-5(11.4g,产率:75%)。元素分析结构(c
56h41
cl2n3ose):理论值c,72.96;h,4.48;cl,7.69;n,4.56;o,1.74;se, 8.57;测试值c,72.96;h,4.48;n,4.56。maldi-tof质谱:理论值921.2;实验值921.2(m
+
)。
[0299]
在氩气氛围下,在500ml双口烧瓶中加入32-5(10.0g,10.8mmol),叔丁基苯(200ml)。于 0℃滴加正丁基锂溶液(10.8ml,2.5m,27.1mmol),滴加完毕后,升温至60℃反应2小时。于
‑ꢀ
40℃滴加三溴化硼(2.6ml,27.1mmol),滴加完毕后,升至室温反应0.5小时。于0℃滴加n,n
‑ꢀ
二异丙基乙胺(7.2ml,43.4mmol),滴加完毕后,升温至170℃反应24小时。降至室温,过滤,用 150ml甲醇洗涤(1.0g,产率:11%)。元素分析结构(c
56h37
b2n3ose):理论值c,77.44;h,4.29;b, 2.49;n,4.84;o,1.84;se,9.09测试值c,77.44;h,4.29;n,4.84。maldi-tof质谱:理论值869.2;实验值869.2(m
+
)。
[0300]
对本发明实施例32制备的稠环化合物的光物理性质进行检测,结果参见表1,表1为本发明实施例制备的稠环化合物的光物理性质。
[0301]
表1本发明实施例制备的稠环化合物的光物理性质
[0302]
实施例化合物δe
st
(ev)延迟荧光寿命(μs)半峰宽(nm)1a2-10.1716.1182a3-10.169.9193a4-10.2020.4224a19-100.2223.9215a14-30.1921.4206a20-30.2218.3237a5-30.1626.619
8a6-10.1928.4249a7-10.2314.82110a10-20.1812.72011a11-40.157.92012a20-10.2214.2.2313a11-50.2118.02014a13-10.1925.12115a13-40.1624.32016a16-20.1726.51917a17-30.2319.92318b2-10.2411.62419b3-10.2110.42220b20-10.1920.82121b21-10.207.52022c2-10.1828.61923c18-10.2123.72424c19-10.2429.02425c20-10.1912.62326d2-10.1714.42427d14-20.1616.71928d19-10.1517.92129e1-10.2520.02130e2-20.228.32231e8-20.1813.52332e10-10.1611.424
[0303]
表1中,δe
st
为单线态能级与三线态能级之差,通过将化合物以10-4
mol/l的浓度溶解于甲苯溶液中制成被测样本,测得的荧光光谱与磷光光谱的起始(onset)值之差,测试仪器为horiba fluoromax spectrofluorometer(日本);延迟荧光寿命为将化合物以1wt%的浓度掺杂在聚苯乙烯中制成被测样本,利用时间分辨荧光光谱仪测试得到,测试仪器为edinburgh fluorescence spectrometer(fls
‑ꢀ
980,英国);半峰宽为室温下的荧光光谱的谱峰高度一半处的峰宽度,即通过峰高的中点作平行于峰底的直线,此直线与峰两侧相交两点之间的距离,其中荧光光谱是通过将化合物以10-5
mol/l的浓度溶解于甲苯溶液中制成被测样本,利用荧光光谱仪(horiba fluoromax spectrofluorometer(日本))测试得到。
[0304]
从表1可见,本发明提供的实施例中的稠环化合物具有较小的δe
st
(《0.2ev),表现出热活化延迟荧光效应,其延迟荧光寿命在7~30μs;同时,本发明提供的发光化合物还表现出较窄的半峰宽(《 30nm),克服了传统tadf发光材料的半峰宽较宽(70~100nm)的缺陷。
[0305]
器件实施例
[0306]
有机发光层采用真空蒸镀工艺制备器件的过程如下:在负载于玻璃基底的氧化铟锡上,4
×
10-4
pa 的真空度下依次沉积tapc、tcta、eml(本发明实施例稠环化合物与simcp2
按照质量比1: 9)、tmpypb和lif/al阴极,得到有机电致发光器件,其中tapc、tmpypb分别作为空穴传输层和电子传输层,tcta为激子阻挡层,其结构式如下所示:
[0307][0308]
具体器件结构(器件结构a)为:
[0309]
ito/tapc(50nm)/tcta(5nm)/eml(30nm)/tmpypb(30nm)/lif(0.8nm)/al(100nm)。
[0310]
有机发光层采用溶液加工工艺制备器件的过程如下:在负载于玻璃基底的氧化铟锡上旋涂聚(3,4
‑ꢀ
亚乙二氧基噻吩)-聚(苯乙烯磺酸)(pedot:pss),120℃退火30分钟,随后以1500rpm的转速旋涂所发明发光化合物与simcp2按照质量比1:9混合后的甲苯溶液1分钟,并于80℃退火30分钟,然后在4
×
10-4
pa的真空度下依次沉积tspo1、tmpypb和lif/al阴极,得到有机电致发光器件,其中 tspo1、tmpypb分别作为空穴阻挡层、电子传输层和主体材料,其结构式如下所示:
[0311][0312]
具体器件结构(器件结构b)为:
[0313]
ito/pedot:pss(40nm)/eml(30nm)/tspo1(8nm)/tmpypb(42nm)/lif(1nm)/al(100nm)。
[0314]
实施例33~64
[0315]
分别以实施例1中的a2-1、实施例2中的a3-1、实施例3中的a4-1、实施例4中的a19-10、实施例5中的a14-3、实施例6中的a20-3、实施例7中的a5-3、实施例8中的a6-1、实施例9中的 a7-1、实施例10中的a10-2、实施例11中的a11-4、实施例12中的a20-1、实施例13中的a11-5、实施例14中的a13-1、实施例15中的a13-4、实施例16中的a16-2、实施例17中的a17-3、实施例 18中的b2-1、实施例19中的b3-1、实施例20中的b20-1、实施例21中的b21-1、实施例22中的 c2-1、实施例23中的c18-1、实施例24中的c19-1、实施例25中的c20-1、实施例26中的d2-1、实施例27中的d14-2、实施例28中的d19-1、实施例29中的e1-1、实施例30中的e2-2、实施例31中的e8-2和实施例32中的e10-1为实施对象,将a2-1与simcp2按照质量比1:9混合作为有机发光层。有机发光层采用真空蒸镀工艺,利用“器件结构a”所述结构制备有机电致发光器件,对所得的器件进行测试。
[0316]
参见表2,表2提供了本发明实施例提供的电致发光器件的性能参数。
[0317]
表2本发明实施例提供的电致发光器件的性能参数
[0318][0319][0320]
表2中,启亮电压为亮度为1cd m-2时器件的驱动电压;最大外量子效率根据器件的电流-电压曲线与电致发光光谱依照文献(jpn.j.appl.phys.2001,40,l783)记载的计算方法得到;半峰宽为室温下电致发光光谱的谱峰高度一半处的峰宽度,即通过峰高的中点作平行于峰底的直线,此直线与峰两侧相交两点之间的距离。
[0321]
从表2可见,本发明提供的化合物制备的器件具有很窄的电致发光光谱,其半峰宽小于30nm,克服了传统d-a结构的tadf化合物电致发光光谱较宽(70~100nm)的问题,同时具有很高的器件效率,器外量子效率为24.0-34.0%。
[0322]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1