大鲵软骨硫酸软骨素及其提取方法
大鲵软骨硫酸软骨素及其提取方法
1.本案是申请日为2016年10月19日、申请号为201610909420.0、发明名称为“大鲵软骨硫酸软骨素及其提取方法”的发明专利申请的分案申请。
技术领域
2.本发明涉及从大鲵软骨中提取的大鲵软骨硫酸软骨素以及其提取方法。
背景技术:
3.糖胺聚糖(gags)属于杂多糖,是一种不分支的长链聚合物,由己糖胺和己糖醛酸的重复复合单位构成。按单糖残基、残基间连接键的类型以及硫酸基团的数量和位置,糖胺聚糖可分为6个主要类别:透明质酸(ha)、硫酸软骨素(cs)、硫酸皮肤素(ds)、硫酸角质素(ks)和硫酸乙酰肝素(hs)和肝素(hp)。
4.硫酸软骨素(chondroitinsulfate,以下有时简称为“cs”)广泛存在于各种动物组织中,尤其在软骨和结缔组织中含量丰富。目前硫酸软骨素主要来源于动物的软骨组织,如牛、猪、羊的气管和鼻软骨,鸡胸和软体动物类,以及鲨鱼等海洋生物。
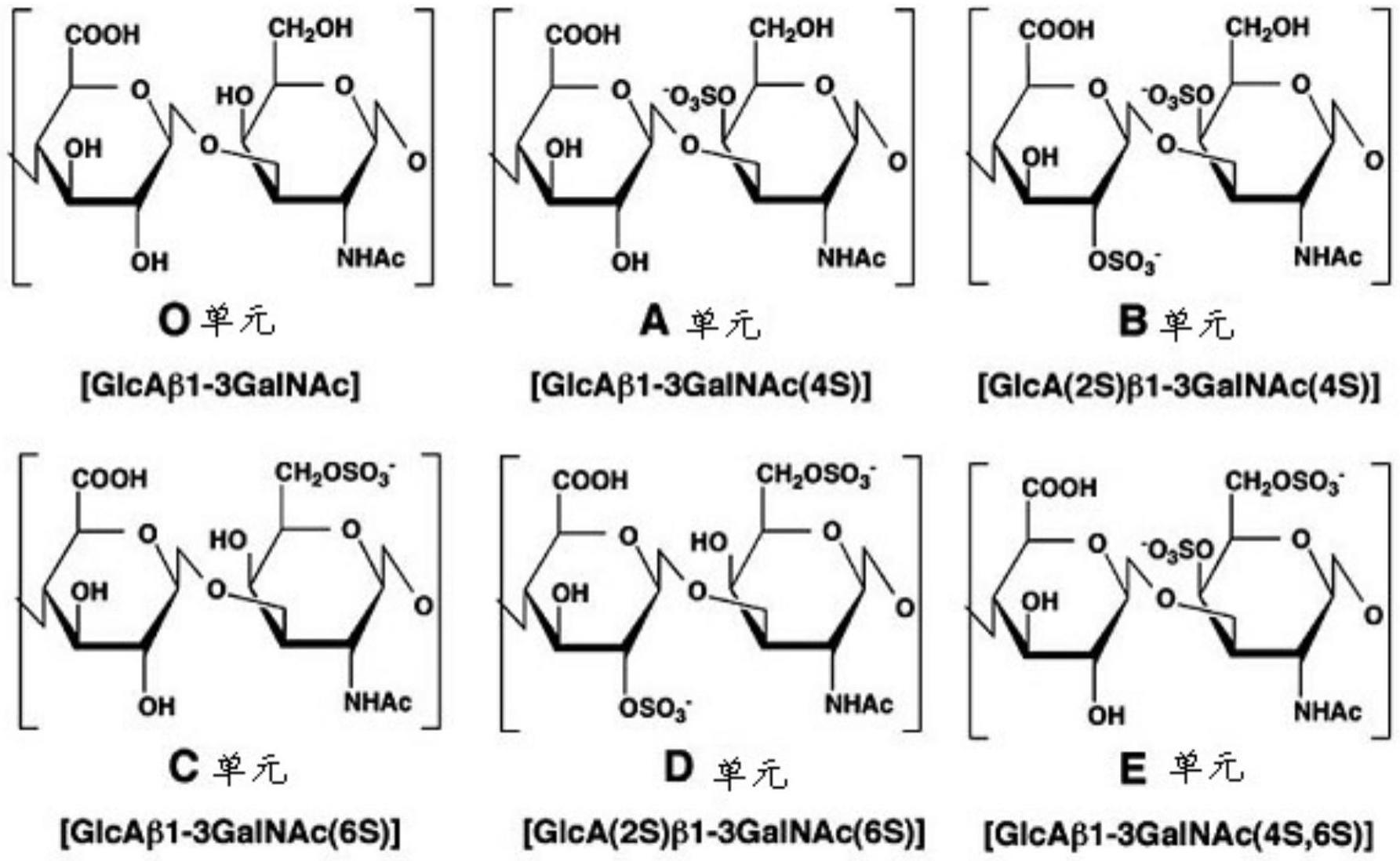
5.不同来源的硫酸软骨素在含量、分子大小、组成及其应用上存在很大差异,且提取工艺也有所不同。作为cs的组成单位,cs二糖单元主要包括软骨素二糖(chondroitin,以下简称为“cs-o”或o单元)、硫酸软骨素a(chondroitinsulfatea,以下简称为“cs-a”或a单元)、硫酸软骨素c(chondroitinsulfatec,以下简称为“cs-c”或c单元)、硫酸皮肤素(chondroitinsulfateb,dermatansulfate,以下简称为“ds”或者“cs-b”或b单元)以及硫酸软骨素d(chondroitinsulfated,以下简称为“cs-d”或d单元),此外还可能硫酸软骨素e(chondroitinsulfatee,以下简称为“cs-e”或e单元)等。上述二糖结构单元结构式(参见:shuheiyamada,kazuyukisugahara,potentialtherapeuticapplicationofchondroitinsulfate/dermatansulfatecurrentdrugdiscoverytechnologies,2008,5,289-301)如下式所示:
[0006][0007]
上述六种多糖的二糖结构单元
[0008]
如上所述,硫酸软骨素(cs)是一种结构和分子量不均一的混合物,其活性是复杂多样的。作为一类重要的生物大分子,cs具有广泛的生物活性,作为安全有效的保健食品和药品在世界各国得到了广泛应用。大量研究表明,cs具有降血脂、抗动脉粥样硬化和抗病毒性肝炎等活性,临床中已用于防治关节炎、肾炎、神经痛和偏头痛,以及用于治理心血管和眼科疾病等。
技术实现要素:
[0009]
近年来,针对不同的来源,研究人员提取了多种不同的硫酸软骨素,例如从鲟鱼头骨或脊骨中提取的硫酸软骨素(参见cn103467621b),从菲律宾刺参中提取的硫酸软骨素多糖,该多糖的主链为硫酸软骨素e结构,同时带有硫酸岩藻糖构成的支链(参见cn102367285b),从日本刺参 (s.japonicus)体壁中分离纯化出的海参糖胺聚糖,对其进行结构分析发现该物质主要由硫酸软骨素e结构构成(参见cn102367285b),从牦牛骨中提取的硫酸软骨素,从兔耳软骨中提取的较纯的硫酸软骨素a(参见 cn103788231a)等等。
[0010]
随着研究人员对于多种不同来源的硫酸软骨素进行研究,发现来自陆生动物如牛、猪、鸡的硫酸软骨素与来自水生动物如鲨鱼、乌贼等的硫酸软骨素有非常大的区别,下表1总结了一些来自不同生物的硫酸软骨素的组成分布,可以看出天然来源的硫酸软骨素都是由多种硫酸软骨素结构单元构成,但每种结构单元的组成比例有显著的差别,因此有研究人员认为硫酸软骨素a与硫酸软骨素c的比值(a/c)可以作为判断硫酸软骨素来源的重要依据(张天民,凌沛学.硫酸软骨素的过去、现在和将来[j].食品与药品, 2010,12(1):1-3.)。
[0011]
表1 不同来源的cs的各结构单元的组成
[0012][0013]
除了上述各种结构单元的组成比有明显的不同之外,天然来源的硫酸软骨素在数均分子量、重均分子量以及多分散性上也有明显的不同,在 cn103635491a中也总结不同来源的硫酸软骨素的分子量分布和结构单元的组成比例。下表2的数据来自于cn103635491a。
[0014]
表2 不同来源的硫酸软骨素的各结构单元的组成比以及分子量数据
[0015][0016]
根据上述内容,可以采用cs不同组成单元的含量,mn和mw等数据来限定不同天然来源的硫酸软骨素混合物。
[0017]
中国大鲵(拉丁学名:andrias davidianus),是世界上现存最大的两栖动物。它的叫声像婴儿的哭声,因此人们又叫它“娃娃鱼”。大鲵是两栖动物中体形最大的一种,全长可达1米及以上,体重最重的可超百斤。大鲵体表光滑无鳞,但有各种斑纹,布满粘液。身体腹面颜色浅淡。
[0018]
大鲵是含有优质蛋白质、丰富的氨基酸和微量元素,营养价值极高,被誉为“水中人参”,在中国香港、中国台湾及东南亚市场上被视为珍稀补品。大鲵肌肉蛋白是一种优质蛋白,必需氨基酸含量高,组成比例好,完全符合人体需要量模式。大鲵肌肉蛋白富含18种氨基酸,其中6种呈味氨基酸占氨基酸总量的42.77%,8种人体必需氨基酸占氨基酸总量的40.72%,必需氨基酸与非必需氨基酸比值为68.68%。大鲵肌肉中脂肪含量虽然不高,但不饱和脂肪酸含量高,特别是二十二碳六烯酸(dha)含量丰富,具有与深海鱼类相似的不饱和脂肪酸组成和较高dha含量的特点。
[0019]
但目前对于大鲵的软骨中的成分的研究还非常的少,本发明人通过深入研究从大鲵的软骨中提取了一种天然硫酸软骨素组合物,与现有的来自陆生动物和水生动物的天然来源的硫酸软骨素均具有显著的区别,现有硫酸软骨素技术中尚缺少以大鲵软骨为原料进行提取的工艺和产品。开发大鲵来源的硫酸软骨素产品一方面可以使大鲵资源得到充分利用,同时大鲵来源的硫酸软骨素独特的组成和性质也为其新的生物活性和药用功能的开发
提供了基础,本发明是基于以上见解完成的。
[0020]
由此,本发明涉及以下方面:
[0021]
1.一种硫酸软骨素,其硫酸软骨素二糖组成中的硫酸软骨素a与硫酸软骨素c的含量比,即硫酸软骨素a的含量/硫酸软骨素c的含量(有时也简称为a/c比)为0.4~0.6,优选为0.45~0.55,进一步优选为0.46~0.53,硫酸软骨素o在硫酸软骨素中的含量为15质量%以上。
[0022]
2.根据项1所述的硫酸软骨素,其硫酸软骨素o在硫酸软骨素中的含量为20质量%以下。
[0023]
3.根据项1或2所述的硫酸软骨素,其中,所述二糖组成包括硫酸软骨素o(软骨素二糖)、硫酸软骨素a(4-硫酸化软骨素二糖)、硫酸软骨素c(6
‑ꢀ
硫酸化软骨素二糖)。
[0024]
4.根据项1或2所述的硫酸软骨素,其中,所述二糖组成由硫酸软骨素o(软骨素二糖)、硫酸软骨素a(4-硫酸化软骨素二糖)、硫酸软骨素c(6
‑ꢀ
硫酸化软骨素二糖)组成。
[0025]
5.根据项1~4中任一项所述的硫酸软骨素,其数均分子量(mn)为 45kda~65kda,优选为50kda~60kda,进一步优选为54kda~58kda,重均分子量(mw)为60kda~80kda,优选为65kda~75kda,进一步优选为 68kda~74kda。
[0026]
6.根据项1~5中任一项所述的硫酸软骨素,其是从大鲵软骨中提取的硫酸软骨素。
[0027]
7.根据项1~6中任一项所述的硫酸软骨素,其硫酸软骨素c在硫酸软骨素中的含量为50质量%以上,优选为55质量%以上。
[0028]
8.根据项1~7中任一项所述的硫酸软骨素,其z均分子量为 80kda~100kda,优选为85kda~95kda。
[0029]
9.根据项1~8中任一项所述的硫酸软骨素,其用于预防或治疗骨关节炎、调节血脂、预防或治疗血栓、预防或治疗心血管疾病、保护角膜胶原纤维、增强人体体质、或改善肌肤干燥等。
[0030]
10.一种组合物,其包含根据项1~9中任一项所述的硫酸软骨素和药学或营养学上可接受的载体。
[0031]
11.一种从大鲵软骨组织中提取硫酸软骨素的方法,包括:
[0032]
(1)预处理步骤,取去除皮肤和尾部脂肪的大鲵,切块后放沸水中煮,剔除肉质后收集软骨,冷冻干燥后粉碎获得大鲵软骨样品;
[0033]
(2)碱解步骤,针对步骤(1)获得的大鲵软骨样品,添加纯水、氢氧化钠和氯化钠溶液,搅拌均匀,进行碱解过夜;
[0034]
(3)酶解步骤,利用盐酸调节经上述步骤(2)的溶液的ph至7.5~8.5,然后加入胰酶进行酶解,酶解过程中控制ph值在7.0~8.5、温度在40~45℃;
[0035]
(4)灭活和离心步骤,通过加热对步骤(3)中的胰酶进行灭活,冷却后将灭活后的混合溶液离心,获得上清;
[0036]
(5)分级沉淀步骤,针对步骤(4)获得的上清液加入乙醇,搅拌均匀后充分静置,待沉淀完全后转移上清液,获得沉淀;
[0037]
(6)针对步骤(5)中的获得的沉淀,加入适量超纯水溶解后进行透析;
[0038]
(7)冻干步骤,针对步骤(6)中的获得的透析液,对其进行冷冻干燥,从而得到硫酸
软骨素产品。
[0039]
12.一种大鲵软骨来源的硫酸软骨素,其根据项11所涉及的方法获得。
[0040]
13.项1~8中任一项所述的硫酸软骨素用于制备预防或治疗骨关节炎、调节血脂、预防或治疗血栓、预防或治疗心血管疾病、保护角膜胶原纤维、增强人体体质、或改善肌肤干燥的药物中的用途。
附图说明
[0041]
图1来自牛软骨的硫酸软骨素的二糖组成分析结果;
[0042]
图2来自鲨鱼软骨的硫酸软骨素的二糖组成分析结果;
[0043]
图3来自实施例1制备的大鲵软骨硫酸软骨素的二糖组成分析结果;
[0044]
图4来自实施例2制备的大鲵软骨硫酸软骨素的二糖组成分析结果。
具体实施方式
[0045]
本发明涉及一种从大鲵软骨组织中提取的硫酸软骨素,其二糖组成包括硫酸软骨素o、硫酸软骨素a、硫酸软骨素c和硫酸软骨素d,优选其二糖由硫酸软骨素o、硫酸软骨素a、硫酸软骨素c这三种二糖组成。硫酸软骨素中的硫酸软骨素a/硫酸软骨素c的含量比为0.4~0.6,优选为 0.45~0.55,进一步优选为0.46~0.53,硫酸软骨素o在硫酸软骨素中的含量为15质量%以上,硫酸软骨素o的含量为20质量%以下。此外,硫酸软骨素c在硫酸软骨素中的含量为50质量%以上,优选为55质量%以上。
[0046]
由于本发明的硫酸软骨素是来源于两栖动物大鲵软骨中的硫酸软骨素,从其组成分析,该硫酸软骨素的结构单元的组成与上述陆生动物和水生动物均有很大的区别。
[0047]
虽然来源于不同文献中的数值存在一定的偏差(参见上表1和表2),但往往来自牛、猪和鸡的气管中的硫酸软骨素中硫酸软骨素a的含量远远高于硫酸软骨素c的含量。而鲨鱼等海洋来源的硫酸软骨素中,硫酸软骨素 a的含量则少于硫酸软骨素c的含量。
[0048]
而本发明涉及的大鲵软骨来源的硫酸软骨素,其硫酸软骨素中的硫酸软骨素a/硫酸软骨素c的含量比在0.4~0.6,优选0.45~0.55,即硫酸软骨素 c是硫酸软骨素a的2倍左右。在一个具体的实施方式中,a/c为0.53,在另一个具体的实施方式中,a/c为0.46。因此a/c的比值可以是0.40、 0.41、0.42、0.43、0.44、0.45、0.46、0.47、0.48、0.49、0.50、0.51、0.52、 0.53、0.54、0.55、0.56、0.57、0.58、0.59或0.60。
[0049]
此外,更为特殊的是,本发明涉及的大鲵软骨来源的硫酸软骨素其硫酸软骨素o的含量较高,明显高于目前已经发现的来源于陆生动物和水生动物的硫酸软骨素,如上表1和表2所总结的,目前现有已知的硫酸软骨素中的硫酸软骨素o的含量均较低,基本在10质量%以下,除了有个别报道显示存在13质量%。而大鲵软骨来源的硫酸软骨素中的含量在15质量%以上,在20质量%以下。在一个具体的实施方式中,o的含量为16%,在另一个具体的实施方式中,o的含量为17%。因此o的含量可以为15质量%、 16质量%、17质量%、18质量%、19质量%或20质量%。
[0050]
本发明的硫酸软骨素,其数均分子量(mn)在45kda~65kda,优选 50kda~60kda,重均分子量(mw)在60kda~80kda,优选65kda~75kda,多分散性为1.1~1.5,优选为1.2~1.4。在一个具体实施方式中,本发明的硫酸软骨素,其数均分子量(mn)为54.146k,重均分
子量(mw)为68.838k,z均分子量(mz)为89.928k,多分散性为1.27。在另一具体实施方式中,本发明的硫酸软骨素,其数均分子量(mn)为57.768k,重均分子量(mw)为73.839k, z均分子量(mz)为95.940k,多分散性为1.28。
[0051]
根据上表2的总结可以看出,虽然来自不同来源的硫酸软骨素的分子量有显著的差异,但是可以看出,来自水生动物(鲨鱼,鳐鱼和乌贼等)的数均分子量和重均分子量均高于来自与陆生动物的牛、猪和鸡的数均分子量和重均分子量,另外,有文献报道了来自鲟鱼头骨和脊骨的硫酸软骨素的数均mn分别为28kda和32kda左右,而来自鲟鱼头骨和脊骨的硫酸软骨素的重均mw分别为38.5kda和49.2kda左右(宋居易,桂萌,马长伟,等.鲟鱼硫酸软骨素制备工艺优化[j].中国农业大学学报,2014,19(5):116-123),可见鲟鱼的硫酸软骨素的数均和重均分子量也高于陆生动物的数均和重均分子量。而来自两栖动物大鲵软骨的硫酸软骨素的重均分子量与水生动物接近,较高。此外,本发明的大鲵软骨来源的硫酸软骨素的数均分子量与表2 中的总结的不同来源的硫酸软骨素的数均分子量(mn)也有明显的,其高于动物,例如牛、猪、以及鸡来源的cs,并且也高于来自于鲨鱼和鳐鱼,以及上述鲟鱼的mn,但是却低于乌贼来源的cs。
[0052]
本发明的大鲵软骨来源的硫酸软骨素可用于预防或治疗骨关节炎,调节血脂,防治血栓,防治心血管疾病,保护角膜胶原纤维,增强人体体质,改善肌肤干燥等。
[0053]
本发明的大鲵软骨来源的硫酸软骨素可用于制备预防或治疗骨关节炎,调节血脂,防治血栓,防治心血管疾病,保护角膜胶原纤维,增强人体体质,改善肌肤干燥等药物。
[0054]
本发明还涉及一种组合物,其包含本发明的硫酸软骨素和药学或营养学上可接受的载体。其中药学或营养学上可接收的载体是本领域技术人员已知的那些,例如赋形剂(例如,淀粉,乳糖,蔗糖,碳酸钙,磷酸钙等等),粘合剂(例如,淀粉,阿拉伯胶,羧甲纤维素,羟丙基纤维素,结晶纤维素,海藻酸,凝胶,聚乙烯吡咯烷酮等等),润滑剂(例如,硬脂酸镁,硬脂酸钙,滑石粉等等),崩解剂(例如,羧甲纤维素钙,滑石粉等等),稀释剂(例如,注射用水,盐水等等),添加剂(例如,稳定剂,防腐剂,着色剂,调味剂,溶解助剂,乳化剂,缓冲剂,等渗剂等等),等等。
[0055]
本领域技术人员根据本领域的常识可以理解,本发明的组合物可以配制成多种形式,如片剂、胶囊、粉末等固体,以及溶液剂或糖浆等液体。
[0056]
在本发明涉及一种获取大鲵软骨来源的硫酸软骨素的方法,该方法涉及大鲵软骨预处理步骤,碱解步骤、酶解步骤、灭活和离心步骤、分级沉淀步骤,以及冻干步骤。
[0057]
(1)预处理步骤,取去除皮肤和尾部脂肪的大鲵,切块后放沸水中煮,剔除肉质后收集软骨,冷冻干燥后粉碎获得大鲵软骨样品;
[0058]
(2)碱解步骤,针对步骤(1)获得的大鲵软骨样品,添加纯水、氢氧化钠和氯化钠溶液,搅拌均匀,进行碱解过夜;
[0059]
(3)酶解步骤,利用盐酸调节经上述步骤(2)的溶液的ph至7.5~8.5,然后加入胰酶进行酶解,酶解过程中控制ph值在7.0~8.5、温度在40~45℃;
[0060]
(4)灭活和离心步骤,通过加热对步骤(3)中的胰酶进行灭活,冷却后将灭活后的混合溶液离心,获得上清;
[0061]
(5)分级沉淀步骤,针对步骤(4)获得的上清液加入乙醇,搅拌均匀后充分静置,待沉淀完全后转移上清液,获得沉淀;
[0062]
(6)针对步骤(5)中的获得的沉淀,加入适量超纯水溶解后进行透析;
[0063]
(7)冻干步骤,针对步骤(6)中的获得的透析液,对其进行冷冻干燥,从而得到硫酸软骨素产品。
[0064]
本领域技术人员可以根据实际需要选择上述步骤(1)~(7)的具体的操作条件,以下作为例子给出如下具体的操作步骤,本领域技术人员完全可以根据实际需要对以下具体的操作步骤进行修改,并用其他常规的试剂或步骤代替只要可以获得相同或相似的效果即可:
[0065]
在第(1)步预处理中,取去除皮肤和尾部脂肪的大鲵,切块后放沸水中煮1h左右,剔除肉质后收集软骨,冷冻干燥后粉碎,获得大鲵软骨样品。
[0066]
在第(2)步碱解过程中,称取第(1)步的大鲵软骨样品120g,置于1000ml 烧杯中,加入400ml纯化水,然后加入8g氢氧化钠和4g的氯化钠(所用试剂均为分析纯),搅拌均匀,碱解过夜。
[0067]
在第(3)步酶解过程中,首先用6mol/l的盐酸溶液调节上述经碱解的溶液的ph值至8.0,置于40℃恒温水浴中,开动磁力搅拌器,加入软骨重量的2%(w/w)的胰酶(本领域技术人员可以根据需要选择适当的胰酶,以及其含量,例如,在本发明中可以使用购买自四川德博尔制药有限公司的胰酶粉末(usp规格)),每隔1小时调节一次溶液温度及ph值,通过常规方法,例如利用氢氧化钠溶液或盐酸溶液控制ph值在7.5~8.5、温度在40℃,酶解反应进行4个小时。
[0068]
在第(4)步灭活、离心过程中,针对第(3)步得到的酶解反应后的溶液用 6mol/l的盐酸溶液调节ph值至中性,水浴加热升温至80~85℃并保温10 分钟,加热过程中不断搅拌,以使得胰酶灭活。将灭活后的溶液倒入离心杯中,用少量纯化水冲洗烧杯后并入离心杯,将离心杯用配平后放入离心机中,3000rpm离心10分钟。离心结束立即将澄清液倒入干净的烧杯中。上述离心过程根据需要调节离心速度和时间,并且可以重复进行。
[0069]
在第(5)步分级沉淀过程中,将第(4)步得到的澄清液转移至1000ml的烧杯中,加入乙醇(分析纯)至乙醇质量浓度60
±
2%,充分搅拌,20℃静置至沉淀完全,将上层澄清溶液转移获取沉淀。上述分级沉淀过程可重复多次进行。
[0070]
在第(6)步透析过程中,在第(5)步获得的沉淀中加入适量纯化水溶解,使用截留量为3kda的透析袋在4℃条件下进行透析24h,透析过程中不断更换纯化水。
[0071]
在第(7)步冻干过程中,将第(6)步获得的透析液分装后冷冻干燥48小时,得到硫酸软骨素产品。
[0072]
实施例
[0073]
下面结合具体实施例对本文作进一步说明,但本文并不限于以下实施例。
[0074]
方法一:二糖组成分析方法(参考中国药典2015年版,第1040-1041页)
[0075]
测试条件:
[0076]
色谱柱:用强阴离子交换硅胶为填充剂(如hypersil-sax柱, 250mm
×
4.6mm,5μm);
[0077]
检测器:紫外检测器
[0078]
检测波长:232nm
[0079]
流速:1.0ml/分钟
[0080]
线性梯度洗脱:
[0081]
时间(分钟)流动相a(%)流动相b(%)0100041000455050
[0082]
测试溶液的制备
[0083]
1)流动相溶液的制备
[0084]
流动相a:水(用稀盐酸调节ph值至3.5)。
[0085]
流动相b:2mol/l氯化钠溶液(用稀盐酸调节ph值至3.5)。
[0086]
2)缓冲液及酶溶液的制备
[0087]
三羟甲基氨基甲烷缓冲液:称取三羟甲基氨基甲烷6.06g与三水乙酸钠 8.17g,加水900ml溶解,用稀盐酸调节ph值至8.0,用水稀释至1000ml。
[0088]
硫酸软骨素abc酶液:取硫酸软骨素abc酶适量,按标示单位用三羟甲基氨基甲烷缓冲液稀释成每100μl含0.1单位的溶液。)
[0089]
3)供试品及对照品溶液的制备
[0090]
称取以下实施例中获得的样品0.1g,精密称定,置于10ml容量瓶中,加水溶解并稀释至刻度,摇匀,浓度记为c
t
(g/ml)。用0.45μm的滤膜滤过,精密量取100μl,置具塞试管中,加入三羟甲基氨基甲烷缓冲液800μl,充分混匀,再加入硫酸软骨素abc酶液100μl,摇匀,置于37℃水浴中反应 1小时,取出,在100℃加热5分钟,用冷水冷却。以每分钟10 000转离心 20分钟,取上清液,用0.45μm的滤膜滤过,作为供试品溶液。另取硫酸软骨素钠对照品适量,精密称定,以同样的方法制备对照品溶液。
[0091]
4.11.3系统适用性实验
[0092]
取对照品溶液,进样20μl于高效液相色谱仪中,按测试条件中的方法进行线性梯度洗脱,记录色谱图,并测量硫酸软骨素钠o、c和a二糖的保留时间和峰面积。色谱出峰顺序应为硫酸软骨素o、c和a二糖,计算峰面积rsd应不大于2.0%,相邻各色谱峰之间分离度r应不小于1.5,对硫酸软骨素钠a峰来说,理论塔板数应不小于2000。
[0093]
4.11.4测定
[0094]
取上述标准溶液和系列浓度的对照品溶液,分别进样20μl于高效液相色谱仪中,记录色谱图,按外标法以硫酸软骨素o、硫酸软骨素a、硫酸软骨素c和硫酸软骨素d的二糖峰面积计算。
[0095]
方法二:硫酸软骨素分子量检测(可以参考《国家药品监督管理局国家药品标准》ws-10001-(hd-0892)-2002、《中华人民共和国药典》2000版二部(附录vh多糖的分子量与分子量分布测定法)、《中华人民共和国药典》 2010版二部)
[0096]
1标准溶液的配制:
[0097]
分别称取右旋糖酐标准品(分子量4600、10000、21400、41100、 84400)100mg,置烧杯中,加流动相10ml使溶解,0.45um滤膜滤过,放置过夜,做为标准品溶液(10mg/ml)。
[0098]
2样品溶液的配制:
[0099]
称取以下实施例获得的样品100mg,置烧杯中,加流动相10ml使溶解, 0.45um滤膜滤过,放置过夜,作为样品溶液。
[0100]
3检测:
[0101]
色谱条件如下:色谱柱tskg3000sw
[0102]
流动相:0.2mol/l硫酸钠溶液(ph 5.0);
[0103]
色谱柱温度:35℃;
[0104]
流速:0.5ml/min;
[0105]
将标准及样品溶液依次取25ml注入高效液相色谱中,记录色谱图。
[0106]
4结果计算:
[0107]
4.1取标准品的保留时间及对应分子量,用gpc专用软件做标准曲线。
[0108]
4.2选择样品图谱及相应标准曲线,gpc专用软件自动计算分子量及分布系数,打印谱图及结果。
[0109]
实施例1 制备大鲵软骨硫酸软骨素1(简称为大鲵cs(1))
[0110]
根据本发明如上所述的方法预处理步骤获取大鲵软骨样品62.8g,粉碎后按照顺序进行上述步骤(2)~(7)提取硫酸软骨素,得到硫酸软骨素1.33g,按照上述二糖组成分析方法来分析得到的硫酸软骨素的二糖组成,结果如图3所示,根据图3的分析计算的含量的结果如下表3所示。按照上述分子量检测方法来分析各硫酸软骨素的分子量结果,如下表4所示。
[0111]
通过方法一测定硫酸软骨素含量,使用牛来源的硫酸软骨素标准品建立标准曲线,计算大鲵硫酸软骨素中硫酸软骨素含量为97.7%,大鲵软骨中硫酸软骨素的收率为2.1%。
[0112]
实施例2 制备大鲵软骨硫酸软骨素2(简称为大鲵cs(2))
[0113]
根据本发明如上所述的方法预处理步骤获取大鲵软骨样品43.12g,粉碎后按照顺序进行上述步骤(2)~(7)提取硫酸软骨素,得到硫酸软骨素粗品1.11g,按照上述二糖组成分析方法来分析得到的硫酸软骨素的二糖组成,结果如图4所示,根据图4的分析计算的含量的结果如下表3所示。按照上述分子量检测方法来分析各硫酸软骨素的分子量结果,如下表4所示。
[0114]
通过方法一测定硫酸软骨素含量,使用牛来源的硫酸软骨素标准品建立标准曲线,计算大鲵硫酸软骨素粗品中硫酸软骨素含量为88.6%,大鲵软骨中硫酸软骨素的收率为2.3%。
[0115]
实施例3 各硫酸软骨素的二糖组成分析以及分子量分布分析
[0116]
除了实施例1和2获得的大鲵cs(1)和大鲵cs(2)之外,还针对牛硫酸软骨素(购买自sigma,来源于牛软骨,以下有时简称为牛cs)和鲨鱼硫酸软骨素(购买自烟台东诚药业,来源于鲨鱼软骨,以下有时简称为鲨鱼cs)的二糖组成和分子量进行了分析(分析方法如上所述),其中图1和图2分别显示了二糖组成分析的结果,计算结果也同样总结在表3和表4中。
[0117]
其中,测定硫酸软骨素的组成的结果如图1~4所示,其中,图1显示了上述牛硫酸软骨素(牛cs)的二糖组成,图2显示了上述鲨鱼硫酸软骨素 (鲨鱼cs)的二糖组成,图3和图4分别显示了大鲵cs(1)和大鲵cs(2)的二糖组成。根据图1~图4,硫酸软骨素完全酶解后得到的二糖被完全分离,不同出峰时间分别对应硫酸软骨素o(约12.5分钟)、硫酸软骨素a(约20 分钟)、硫酸软骨素c(约21.4分钟)和硫酸软骨素d(约29.4分钟),通过对对应二糖峰进
行积分可以得到不同硫酸软骨素二糖的含量,结果总结在下表3中。
[0118]
表3 实施例中各软骨硫酸软骨素的各组成分布
[0119]
样品ocada/c牛cs0.050.360.59-1.64鲨鱼cs0.020.50.310.170.62大鲵cs(1)0.160.550.29-0.53大鲵cs(2)0.170.560.26-0.46
[0120]
表4 实施例中各硫酸软骨素的分子量分布
[0121]
分子量mnmwmz多分散性牛cs3531442909593371.22鲨鱼cs64785944611264631.46大鲵cs(1)5414668838899281.27大鲵cs(2)5776873839959401.28
[0122]
根据上述结果可以看出,大鲵的硫酸软骨素o、a、c组分的含量,以及a/c比和牛以及鲨鱼的硫酸软骨素存在较大区别。数均分子量、重均分子量、z均分子量以及多分散性方面也存在显著地不同。可见本发明获得了一种新型的大鲵软骨来源的硫酸软骨素。
[0123]
以上全面描述了本发明的优选实施例,但是可对它们进行各种替代和修改。因此,不应参照以上描述来决定本发明的范围,而是应参照所附权利要求书及其全部等同物来决定本发明的范围。任何特征,(不论是否为优选)均可与任何其他特征(不论是否为优选)相结合。本发明的权利要求书不应被理解为具有方法+功能的限制,除非在某一权利要求中通过术语
“…
的方法”明确地列举出此类限制。将本文中出现的参考文献并入作为参考。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1