体外评价肿瘤细胞侵袭的模型及其应用
1.本发明涉及医药领域,具体涉及用于体外评价肿瘤细胞侵袭的模型及其应用。
背景技术:
2.导致肿瘤患者死亡的主要原因就是肿瘤转移,肿瘤浸润是肿瘤转移发展过程中的首要环节。瘤是机体在各种致癌因素作用下,局部组织的某一个细胞在基因水平上失去对其生长的正常调控,导致其克隆性异常增生而形成的一个整体。肿瘤是由一个转化细胞不断增生繁衍形成的。一个典型的恶性肿瘤的自然生长过程可以分为:一个细胞的恶性转化
→
转化细胞的克隆性增生
→
局部浸润
→
远处转移(图1)。肿瘤细胞是单克隆性的,即一个肿瘤中的所有瘤细胞均是一个突变的细胞的后代。
3.然而现有技术中用于研究和评价肿瘤细胞侵袭的体外方法中通常是使单个细胞均匀地接种并生长于transwell培养板中,只能观察肿瘤细胞作为独立个体所具备的侵袭迁移能力。
4.因此,迫切需要提供一种能够真实有效模拟体内肿瘤浸润、侵袭并转移的体外模型,以用于研究肿瘤细胞侵袭过程中的分子机制并筛选治疗肿瘤浸润转移的抗肿瘤药物。
技术实现要素:
5.本发明旨在至少在一定程度上解决相关技术中的技术问题之一。
6.为此,本发明第一方面的实施方案提供了一种用于体外评价肿瘤细胞侵袭的模型。
7.本发明第二方面的实施方案提供了一种用于体外评价肿瘤细胞侵袭的方法。
8.本发明第三方面的实施方案提供了一种药物筛选方法。
9.在第一方面,本发明的实施方案提供了用于体外评价肿瘤细胞侵袭的模型,所述模型用于非诊断或非治疗目的。所述模型包括:细胞培养室和单克隆细胞群体,其中所述细胞培养室包括生长空间和侵袭空间,其中所述生长空间与所述侵袭空间通过生物膜相连通,其中所述单克隆细胞群体生长于所述生长空间并且能够穿过所述生物膜进入所述侵袭空间,并且其中所述单克隆细胞群体中处于中心位置的细胞相比于外周位置的细胞更多地穿过所述生物膜进入所述侵袭空间。
10.根据本发明的实施方案,用于体外评价肿瘤细胞侵袭的模型可以在体外更好的模拟体内肿瘤组织向外侵袭扩张的病理过程,以便更准确地研究肿瘤细胞侵袭过程中的分子机制;并且以体外方式有效筛选能够抑制肿瘤细胞侵袭的抗肿瘤药物。
11.此外,根据本发明实施方案的用于体外评价肿瘤细胞侵袭的模型还可以具有以下附加技术特征。
12.在一些实施方案中,所述单克隆细胞群体由3
×
103至3
×
104个细胞、优选4
×
103至2
×
104个细胞、更优选5
×
103至1
×
104个细胞构成。
13.在一些实施方案中,所述单克隆细胞群体呈单层或多层生长。
14.在一些实施方案中,所述单克隆细胞群体中处于中心位置的细胞相比于外周位置的细胞具有更小的体积。
15.在一些实施方案中,所述生物膜为含有细胞外基质的人工基底膜或明胶。
16.在第二方面,本发明的实施方案提供了用于体外评价肿瘤细胞侵袭的方法,所述方法用于非诊断或非治疗目的,所述方法包括:使单个细胞在细胞培养室的生长空间生长为单克隆细胞群体;和确定所述单克隆细胞群体从所述生长空间穿过生物膜进入侵袭空间的细胞的数目和位置。
17.根据本发明的实施方案,用于体外评价肿瘤细胞侵袭的方法利用上述第一方面实施方案提供的模型可以在体外更好地模拟体内肿瘤组织向外侵袭扩张的病理过程,从而以体外方式评价肿瘤细胞的侵袭程度,并研究肿瘤细胞侵袭过程中的分子机制;进而在实验室对候选药物是否能够阻止或减缓肿瘤细胞的侵袭程度进行准确评价和筛选。
18.此外,根据本发明实施方案的用于体外评价肿瘤细胞侵袭的方法还可以具有以下附加技术特征。
19.在一些实施方案中,使单个细胞在细胞培养室的生长空间生长至少7天、至少8天、至少10天、至少12天、或至少14天以形成单克隆细胞群体。
20.在一些实施方案中,所述细胞培养室包括所述生长空间和所述侵袭空间,所述生长空间与所述侵袭空间通过生物膜相连通,所述生物膜为含有细胞外基质的人工基底膜或明胶,所述方法还包括:检测所述生物膜的厚度;和/或检测所述生物膜中细胞外基质的含量。
21.在第三方面,本发明的实施方案提供了药物筛选方法。该方法包括:将候选药物施用于前述第一方面实施方案所述的用于体外评价肿瘤细胞侵袭的模型,其中将所述候选药物在生长空间与单克隆细胞群体接触;和比较所述接触前后从所述生长空间穿过生物膜进入侵袭空间的细胞的数目的变化,其中侵袭空间中减少的细胞数目指示所接触候选药为抑制肿瘤细胞侵袭的药物。
22.根据本发明的实施方案,所述药物筛选方法基于上述第一方面实施方案提供的模型可以在体外更好地模拟体内肿瘤组织向外侵袭扩张的过程,从而在实验室以体外方式对候选药物是否能够阻止或减缓肿瘤细胞的侵袭程度进行评价和筛选。
23.本技术的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本技术的实践了解到。
附图说明
24.本技术上述的和/或附加的方面和优点从下面结合附图对实施例的描述中将变得明显和容易理解,其中:
25.图1示出了体内肿瘤细胞的侵袭过程的示意图。原发位置的上皮细胞发生癌变,不断克隆性异常增生,长成一个肿瘤。肿瘤组织内部拥挤的环境迫使中心区域细胞发生形变,通过分泌金属蛋白酶降解细胞外基质,促进肿瘤细胞的侵袭和转移。
26.图2显示了根据本发明实施方案的体外评价肿瘤细胞侵袭的模型的显微示意图。a图:追踪同一个克隆,持续每天使用相差显微镜拍照记录克隆生长;b图:统计生长到8天时克隆各个区域的单个细胞面积,细胞越接近克隆中心,细胞越拥挤,细胞面积越小;c图:生
长5天的mdck细胞克隆;d图:生长7天的b16f10细胞克隆。。
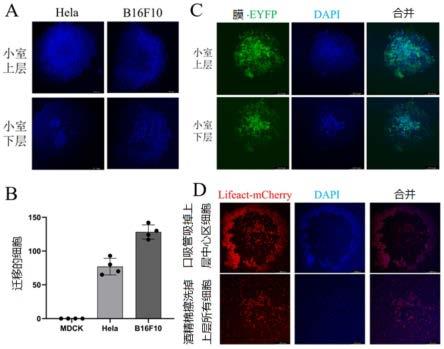
27.图3显示了根据本发明实施方案的体外评价肿瘤细胞侵袭的模型中不同位置细胞侵袭能力的激光共聚焦显微镜示意图。a图:hela和b16f10细胞克隆的transewell侵袭实验;b图:统计mdck、hela和b16f10细胞克隆侵袭到小室下层的细胞数目;c图:表达细胞膜eyfp荧光的hela克隆侵袭实验;d图:表达细胞骨架mcherry荧光的hela克隆侵袭实验。
28.图4显示了根据本发明实施方案的体外评价肿瘤细胞侵袭的模型降解细胞外基质能力的荧光显微镜示意图。a图:hela接种在fitc标记的明胶上生成克隆;b图:hela接种在cy5标记的明胶上生成克隆。荧光显微镜拍照观察细胞克隆和记录克隆周围细胞外基质荧光强度;c图:细胞克隆的拥挤程度与明胶-cy5胶高度的线性分析。
具体实施方式
29.下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
30.本发明是基于发明人对以下事实和问题的发现和认识做出的:
31.近年来的研究发现,上皮细胞发生癌变并异常的大量增殖,肿瘤细胞生存的微环境变得拥挤,肿瘤细胞从局部开始发生浸润。通过3d胶原基质培养的实验发现,在小孔隙中培养的细胞更容易形成血管拟态结构,而形成血管是帮助肿瘤细胞获得营养大量增殖的必要条件,也是肿瘤细胞向人体其他器官组织进行转移的基础。组织内部拥挤的环境迫使肿瘤细胞发生形态改变进而促进了肿瘤细胞的浸润转移,说明了肿瘤细胞拥挤的核心区更容易发生浸润过程。
32.基于以上发现,发明人模拟肿瘤细胞自发性受到内部相互挤压的微环境创建了基于多层细胞单克隆的评价肿瘤细胞侵袭的模型。该模型可以更好的模拟体内肿瘤组织向外侵袭扩张的过程,因此可以有效用于研究肿瘤细胞侵袭过程中的分子机制;并筛选治疗肿瘤浸润转移的抗肿瘤药物。
33.体外评价肿瘤细胞侵袭的模型
34.本发明第一方面的实施方案提供了用于体外评价肿瘤细胞侵袭的模型,所述模型用于非诊断或非治疗目的。所述模型包括:细胞培养室和单克隆细胞群体,其中所述细胞培养室包括生长空间和侵袭空间,其中所述生长空间与所述侵袭空间通过生物膜相连通,其中所述单克隆细胞群体生长于所述生长空间并且能够穿过所述生物膜进入所述侵袭空间,并且其中所述单克隆细胞群体中处于中心位置的细胞相比于外周位置的细胞更多地穿过所述生物膜进入所述侵袭空间。
35.根据本发明的实施方案,用于体外评价肿瘤细胞侵袭的模型可以在体外更好的模拟体内肿瘤组织向外侵袭扩张的病理过程,以便更准确地研究肿瘤细胞侵袭过程中的分子机制;并且以体外方式有效筛选能够抑制肿瘤细胞侵袭的抗肿瘤药物。
36.在一些实施方案中,所述单克隆细胞群体由3
×
103至3
×
104个细胞、优选4
×
103至2
×
104个细胞、更优选5
×
103至1
×
104个细胞构成。在一些实施方案中,所述单克隆细胞群体呈单层或多层生长。在一些实施方案中,所述单克隆细胞群体中处于中心位置的细胞相比于外周位置的细胞具有更小的体积。
37.在一些具体实施例中,利用胰酶使生长中的细胞彼此分离成为单细胞,进而通过
无限稀释以足够低的细胞密度接种于细胞培养室的生长空间,以确保由单个细胞扩增成长为单克隆细胞群体,而最初接种的单细胞经过生长不会彼此接触而汇合生长。显微成像结果显示,单个细胞经过一周可以生长出由约100个左右细胞构成的单个克隆;经过10天的生长,克隆中心的细胞开始分层;继续生长单克隆细胞群体呈现多层生长的状态(参见图2a)。通过成像分析细胞面积,结果显示克隆中心的细胞相对于边缘的细胞面积更小,表明越靠近克隆中心的细胞体积越小,细胞受到挤压的程度越大(参见图2b)。
38.在一些具体实施例中,激光共聚焦实验(图3a和3b)和免疫荧光染色(图3c和3d)实验均证明,在细胞培养室中生长的单克隆细胞群体中,受挤压而体积更小的处于中心的肿瘤细胞更多地穿过生长空间与侵袭空间的生物膜而进入侵袭空间。
39.在一些实施方案中,所述生物膜为含有细胞外基质的人工基底膜或明胶。
40.在一些具体实施例中,通过肿瘤细胞在侵袭迁移的过程中伴随着细胞外基质的降解。经实验证明,肿瘤细胞从生长空间进入侵袭空间而经过的生物膜位置厚度变薄(图4b),表明生物膜中的细胞外基质被显著降解(图4a),并且细胞克隆也显著更多的进入侵袭空间(图4c)。
41.因此,根据本发明实施方案的用于体外评价肿瘤细胞侵袭的模型,类似于生理情况下的上皮细胞发生癌变,经过大量的分裂增殖,在癌变的原发灶位置堆积,然后开始破坏基底膜,穿过细胞外基质,发生浸润转移。由此发明人成功地建立了一种模仿体内肿瘤细胞转移的模型,可以用于体外评价肿瘤细胞的侵袭程度,并且用于准确可靠地筛选可以抑制肿瘤细胞侵袭的药物。本发明创建的肿瘤细胞自发生长的多层细胞克隆模型,可以更好的模拟上皮细胞癌变增生的实体瘤浸润。
42.体外评价肿瘤细胞侵袭的方法
43.本发明第二方面的实施方案提供了用于体外评价肿瘤细胞侵袭的方法,所述方法用于非诊断或非治疗目的,所述方法包括:使单个细胞在细胞培养室的生长空间生长为单克隆细胞群体;和确定所述单克隆细胞群体从所述生长空间穿过生物膜进入侵袭空间的细胞的数目和位置。
44.在一些实施方案中,使单个细胞在细胞培养室的生长空间生长至少7天、至少8天、至少10天、至少12天、或至少14天以形成单克隆细胞群体。
45.在一些具体实施例中,利用胰酶使生长中的细胞彼此分离成为单细胞,进而通过无限稀释以足够低的细胞密度接种于细胞培养室的生长空间,以确保由单个细胞扩增成长为单克隆细胞群体,而最初接种的单细胞经过生长不会彼此接触而汇合生长。显微成像结果显示,单个细胞经过一周可以生长出由约100个左右细胞构成的单个克隆;经过10天的生长,克隆中心的细胞开始分层;继续生长单克隆细胞群体呈现多层生长的状态(参见图2a)。通过成像分析细胞面积,结果显示克隆中心的细胞相对于边缘的细胞面积更小,表明越靠近克隆中心的细胞体积越小,细胞受到挤压的程度越大(参见图2b)。
46.在一些实施方案中,所述细胞培养室包括所述生长空间和所述侵袭空间,所述生长空间与所述侵袭空间通过生物膜相连通,所述生物膜为含有细胞外基质的人工基底膜或明胶,所述方法还包括:检测所述生物膜的厚度;和/或检测所述生物膜中细胞外基质的含量。
47.在一些具体实施例中,激光共聚焦实验(图3a和3b)和免疫荧光染色(图3c和3d)实
验均证明,在细胞培养室中生长的单克隆细胞群体中,受挤压而体积更小的处于中心的肿瘤细胞更多地穿过生长空间与侵袭空间的生物膜而进入侵袭空间。
48.在一些具体实施例中,通过肿瘤细胞在侵袭迁移的过程中伴随着细胞外基质的降解。经实验证明,肿瘤细胞从生长空间进入侵袭空间而经过的生物膜位置厚度变薄(图4b),表明生物膜中的细胞外基质被显著降解(图4a),并且细胞克隆也显著更多的进入侵袭空间(图4c)。
49.根据本发明的实施方案,用于体外评价肿瘤细胞侵袭的方法利用上述第一方面实施方案提供的模型可以在体外更好地模拟体内肿瘤组织向外侵袭扩张的病理过程,从而以体外方式评价肿瘤细胞的侵袭程度,并研究肿瘤细胞侵袭过程中的分子机制;进而在实验室对候选药物是否能够阻止或减缓肿瘤细胞的侵袭程度进行准确评价和筛选。
50.筛选药物的方法
51.目前抗肿瘤药物在细胞水平检测肿瘤细胞的侵袭能力,更多还是采用传统的tranwell侵袭方法,无法很好的模拟体内肿瘤组织向外侵袭扩张的过程。这就造成了筛选得到的有效药物无法在动物水平甚至临床上取得相应的疗效。本发明创建的肿瘤细胞自发生长的多层细胞克隆模型,可以更好的模拟上皮细胞癌变增生的实体瘤浸润。以此模型筛选得到的抗肿瘤浸润转移药物才能更好的进入后续的动物以及临床研究,因此具有更好的临床价值和医学意义。
52.本发明第三方面的实施方案提供了药物筛选方法。该方法包括:将候选药物施用于前述第一方面实施方案所述的用于体外评价肿瘤细胞侵袭的模型,其中将所述候选药物在生长空间与单克隆细胞群体接触;和比较所述接触前后从所述生长空间穿过生物膜进入侵袭空间的细胞的数目的变化,其中侵袭空间中减少的细胞数目指示所接触候选药为抑制肿瘤细胞侵袭的药物。
53.根据本发明的实施方案,所述药物筛选方法基于上述第一方面实施方案提供的模型可以在体外更好地模拟体内肿瘤组织向外侵袭扩张的过程,从而在实验室以体外方式对候选药物是否能够阻止或减缓肿瘤细胞的侵袭程度进行评价和筛选。
54.本文所用术语“单克隆细胞群体”是指由单个细胞不断扩增生长出的细胞群体。
55.需要说明的是,在药理研究和药物筛选过程中,对于本领域技术人员而言,接种细胞通常是将经消化吹打均匀的单细胞悬液均匀的接种在细胞培养室,并且在接种时确保一定的细胞密度,以使得生长中的各个细胞之间的合适距离,由此细胞经贴壁、分裂、伸展后可以彼此融汇接合,形成一定的细胞汇合程度(例如给药前至少70%的汇合度)。这样做的原因是:在后续评价药物功效和分子机制研究中,细胞可以更加均匀全面地与药物分子接触,避免由于初始细胞接种密度过低而呈彼此独立的克隆样生长多层生长或由于初始细胞接种密度过高而导致融合程度太高,从而真实反映出所研究药物对细胞的影响。然而,本发明实施方案提供的用于肿瘤细胞侵袭的模型,采取无限稀释以极低细胞密度而使单个细胞生长出单克隆细胞群体。发明人惊奇的发现,呈多层克隆样生长的细胞群体不仅能够模拟体内上皮细胞癌变增生的实体瘤浸润,而且更能真实准确地反映出药物对肿瘤细胞侵袭的抑制作用。
56.以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
57.实施例
58.【实施例一】肿瘤细胞自发生长克隆模型的建立
59.实验方法:细胞单克隆培养
60.细胞培养方式采用常规培养:dmem高糖培养基+10%fbs+青霉素-链霉素混合液。首先在细胞爬片或者confocal皿上铺有明胶,将hela、b16f10或mdck细胞制做成细胞悬液,以单细胞的形式将细胞独立培养,通过定期换液保证细胞单克隆生长,单层克隆生长需要10天左右,克隆开始出现多层需要12-14天左右。
61.实验结果
62.首先使用hela细胞以极低的细胞密度培养,保证细胞间独立生长,待细胞生长到1周左右,观察开始形成一个由100个细胞左右构成的克隆。10天左右,克隆中心的细胞开始出现分层现象,继续生长hela克隆就会呈现一个多层现象(图2a)。同时,还计算了同一个克隆内部各个区域细胞的拥挤水平。结果显示:克隆中心的细胞相对于边缘,细胞面积更小(图2b)。统计不同克隆也可以得到相似的实验结果,即越靠近克隆中心的细胞面积越小,细胞越拥挤。进一步地,还观察了mdck和b16f10克隆生长状况,结果显示:与hela细胞类似,mdck和b16f10也能够由一个细胞生长成克隆(图2c和2d)。但是区别在于,mdck由于具有很强的流动性,成熟的克隆既无法形成拥挤状态也无法分裂增殖成多层细胞。b10f10在细胞克隆很小,便可以出现两层细胞。通过上述实验,以hela细胞为主建立一个肿瘤细胞自发生长的拥挤克隆模型。
63.【实施例二】拥挤克隆模型中细胞侵袭能力的检测
64.实验方法:transwell
65.选用24孔板8μm滤膜孔径,含有预制matrigel胶的transwell板(corning,3422)进行实验。小室接种肿瘤细胞,下室加入常规培养基。检测前48小时,将小室内常规培养基换成无血清的培养基,下室继续使用含20%fbs的培养基。肿瘤细胞克隆在matrigel胶上生长较缓慢,肿瘤细胞克隆开始出现侵袭需要14天左右。后续使用dapi标记细胞核,利用激光共聚焦显微镜观察小室上下两层细胞数目和位置。
66.实验结果
67.在建立的肿瘤细胞拥挤克隆模型中,观察到类似于生理情况下的上皮细胞发生癌变,经过大量的分裂增殖,在癌变的原发灶位置堆积,然后开始破坏基底膜,穿过细胞外基质,发生浸润转移。因此,在接下来的实验中,利用此模型观察细胞侵袭情况。首先将上述实验提到的三种细胞以同样的方式接种在transwell小室中,待细胞克隆长到接近开始拥挤的时候,去除培养基中的血清,培养48小时后,细胞核染色检测侵袭能力。结果显示,hela和b16f10细胞克隆中心的细胞发生了侵袭,但是细胞克隆边缘区域并没有发生侵袭现象,同时mdck细胞克隆无论是中心还是边缘区都没有发生侵袭(图3a和3b)。
68.【实施例三】构建肿瘤细胞骨架和细胞膜带荧光的稳转细胞模型
69.实验方法:质粒转染
70.为了更好的观察肿瘤细胞在侵袭过程中发生的物理性变化,本实施例将使用lifeact-mcherry(骨架)和peyfp-membrane(膜)的质粒以脂质体转染方式转到hela细胞内,分别加入相应的g418和puromycin抗生素筛选插入基因组的稳定表达细胞。待稳定细胞系筛选后,用荧光定量pcr和免疫荧光染色的方法验证过表达细胞系是否成功。成功建立的
稳转细胞模型用于后续实验。
71.实验结果
72.此方法证实了细胞克隆侵袭能力的可靠性,细胞膜表达eyfp荧光和细胞骨架表达mcherry荧光的hela进行transwell侵袭实验,结果更加清晰的显示:与边缘区域相比,克隆中心细胞确实能够侵袭到小室下层(图3c和3d),同时在8μm滤膜孔径内也发现正在侵袭的肿瘤细胞的骨架或者细胞膜的荧光。
73.【实施例四】拥挤克隆模型中细胞降解细胞外基质的检测
74.实验方法:荧光标记的明胶
75.选用含有异硫氰酸荧光素(fitc)或cy5标记的明胶,使用上述同样的方式,将细胞以极低的细胞密度培养,保证细胞间独立生长和细胞克隆的形成,观察细胞克隆生长过程中对细胞外基质的降解能力,待细胞长到12天达到拥挤,进行免疫荧光染色,并通过激光共聚焦显微镜观察。
76.实验结果
77.肿瘤细胞在侵袭迁移的过程中伴随着细胞外基质的降解。结果显示,细胞克隆中心区域的明胶荧光强度更弱,表明此区域的细胞外基质被降解的更多,细胞降解能力更强(图4a)。为了更好的观察细胞外基质降解情况,使用光交联的带有cy5荧光的明胶进行相关实验。实验结果发现,相较于克隆边缘区域,中心区域的明胶凹下去,变得更薄(图4b)。同时细胞克隆也显著的向着下方向偏移(图4c)。
78.在本发明中,术语“一个实施例”、“一些具体实施例”、“示例”、“具体示例”、或“一些示例”等意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
79.尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1