一种FcRn抗原结合蛋白及其制备方法和应用与流程
一种fcrn抗原结合蛋白及其制备方法和应用
技术领域
1.本发明属于生物医药领域,具体涉及一种fcrn抗原结合蛋白及其制备方法和应用。
背景技术:
2.免疫系统(immune system)是生物体抵抗外来病原、维持自身健康的重要防御性体系,主要由免疫器官、免疫细胞和免疫活性物质组成。免疫球蛋白(immunoglobulin,ig)作为一种重要的免疫活性物质,其结构是由两条相同的轻链和两条相同的重链通过链间二硫键连接而成的,分为决定抗原结合特异性的可变区(variable region)和发挥免疫效应的恒定区(constant region)。免疫球蛋白根据恒定区结构不同可以分为五类,即igg、iga、igm、ige和igd。
3.免疫球蛋白g(igg)是初乳中含量最丰富的免疫球蛋白成分,母源igg向乳中分泌和被新生动物摄取均需要通过胞转作用穿越上皮细胞屏障,这个过程需要一种具有转运功能的受体即新生儿fc受体(neonatal fc receptor,fcrn)的参与。其首先发现于新生的大鼠胃肠细胞,被认为与吸收母体乳液中的抗体有关。然后在人的胎盘细胞中发现,被认为与母体igg通过胎盘屏障进入胎儿循环有关。后来在成人的多种组织中发现,这些组织包括肺,肝,肾,肠相关的表皮细胞和内皮细胞。
4.fcrn是由大小两个亚基组成的异源二聚体,大亚基分子量为45-53kd,称为α链,小亚基是β2微球蛋白(β2m),分子量为14kd,称为β链,两条链以非共价键的形式结合在一起。β2微球蛋白对于fcrn功能有重要的作用,α链必须和β2微球蛋白装配后才能发挥转运作用。α链与mhcⅰ类分子一样,具有α1、α2和α3共3个胞外功能区、1个跨膜区和1个胞浆尾区。跨膜区、细胞外功能区与mhcⅰ类分子相应区域同源性很高,但胞浆尾区同源性较低。由44个氨基酸残基组成的胞浆尾区,可能含有介导胞内途径的信号。在成年个体,fcrn的主要作用是通过与igg的结合,帮助其通过细胞转运并保护igg在细胞内转运过程中不被溶酶体降解,从而延长igg分子在生物体内的半衰期。
5.在多种自身免疫性疾病中,自身抗体的产生是其发病和病情进展的主要原因之一。这些自身免疫性疾病包括:免疫中性粒细胞减少症,自身免疫性脑炎,自身免疫性贫血,重症肌无力,多发性硬化,类风湿性关节炎,狼疮,特发性血小板减少性紫癜(itp),狼疮性肾炎和膜性肾病等。
6.因此,在正常生理条件下,fcrn具有延长igg分子半衰期的作用,在许多自身免疫性疾病中,fcrn同时延长了致病性的自身免疫性抗体(igg)的半衰期,起到了加重疾病的作用。如果减弱fcrn的这种作用,可以起到加速致病性自身抗体代谢,从而减轻这些自身免疫性疾病的症状和延缓进展,达到治疗效果。通过fcrn特异性的单抗,结合并阻断fcrn与igg的结合,是实现上述目的的有效方法之一。
7.专利cn201580029793.2提供了一种分离的抗fcrn抗体或其片段,可与igg非竞争性地结合fcrn,以减少血清致病性自身抗体水平,并且因此可以用于治疗自身免疫疾病。专
利cn201680008485.6也提供了一种对人类新生儿fc受体(fcrn)具有高结合亲和力的抗体,可用于例如促进受试者中自身抗体的清除,抑制受试者中的抗原呈递,阻断受试者中免疫应答例如阻断基于免疫复合体的免疫应答激活,以及治疗受试者中的免疫性疾病(例如自身免疫疾病)。
8.但现有技术中针对fcrn的抗体较少,因此,亟需提供一种新的高亲和力的fcrn特异性单抗,用于阻断fcrn与igg分子的结合,从而用于多种自身免疫性疾病的治疗。
技术实现要素:
9.针对上述不足,本发明提供了一种新的fcrn抗原结合蛋白及其制备方法和应用。本发明采用杂交瘤技术,得到了一系列新的具有生物学功能的fcrn抗原结合蛋白,所述的fcrn抗原结合蛋白对人fcrn-ecd具有较好的亲和力及结合活性,能够阻断fcrn与igg分子的结合,同时在体内可以加速igg的代谢。本发明所述的fcrn抗原结合蛋白可用于治疗多种自身免疫性疾病,为自身免疫性疾病的治疗提供了一种新的思路。
10.为了实现上述发明目的,本发明的技术方案如下:
11.一方面,本发明提供了一种fcrn抗原结合蛋白。
12.具体地,所述的fcrn抗原结合蛋白包含以下互补决定区:
13.(1)包含seq id no:16所示的氨基酸序列或其变体序列的重链互补决定区1hcdr1;
14.(2)包含seq id no:17所示的氨基酸序列或其变体序列的重链互补决定区2hcdr2;
15.(3)包含seq id no:18所示的氨基酸序列或其变体序列的重链互补决定区3hcdr3;
16.(4)包含seq id no:19所示的氨基酸序列或其变体序列的轻链互补决定区1lcdr1;
17.(5)包含seq id no:20所示的氨基酸序列或其变体序列的轻链互补决定区2lcdr2;
18.(6)包含seq id no:21所示的氨基酸序列或其变体序列的轻链互补决定区3lcdr3;
19.优选地,所述变体序列为与其来源的cdr相比具有一个或几个氨基酸的置换、缺失或添加的cdr序列;所述的置换为保守置换。
20.进一步具体地,所述的fcrn抗原结合蛋白包含:
21.(1)、包含seq id no:3所示的氨基酸序列的重链可变区vh;和/或包含seq id no:5所示的氨基酸序列的轻链可变区vl;
22.或者(2)、与(1)中的vh相比具有至少70%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的vh;和/或,与(1)中的vl相比具有至少70%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的vl;
23.或者(3)、与(1)中的vh相比具有一个或几个氨基酸的置换、缺失或添加或其任意
组合的vh;和/或,与(1)中的vl相比具有一个或几个氨基酸的置换、缺失或添加或其任意组合的vl;所述的置换是保守置换。
24.进一步具体地,所述的fcrn抗原结合蛋白还包含人的igg4恒定区和人的kappa链恒定区,所述的人的igg4恒定区的氨基酸序列如seq id no:6所示,所述的人的kappa链恒定区的氨基酸序列如seq id no:7所示。
25.进一步具体地,所述的fcrn抗原结合蛋白的vh与人的igg4恒定区连接形成重链,所述的fcrn抗原结合蛋白的vl与人的kappa链恒定区连接形成轻链。
26.进一步具体地,所述的fcrn抗原结合蛋白包含:
27.(1)包含seq id no:9所示的氨基酸序列的重链hc;和/或包含seq id no:10所示的氨基酸序列的轻链lc;
28.或者(2)重链和轻链,其中,与(1)中的重链和轻链相比,所述重链具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性;和/或,所述轻链具有至少70%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性。
29.进一步具体地,上述fcrn抗原结合蛋白包括嵌合抗体、人源化抗体或全人源抗体。
30.进一步具体地,上述fcrn抗原结合蛋白包括全长抗体、fab、fab’、f(ab’)2、fv、scfv、di-scfv、双特异性抗体、多特异性抗体、重链抗体和/或单域抗体,或由上述抗体制得的单克隆抗体和/或多克隆抗体。
31.另一方面,本发明提供了上述fcrn抗原结合蛋白的突变体,所述的突变体包含突变的人igg4恒定区,所述的突变的人igg4恒定区氨基酸序列如seq id no:8所示。
32.具体地,所述的突变体包含:如seq id no:11所示的hc,和/或如seq id no:10所示的lc。
33.又一方面,本发明提供了一种人源化fcrn抗原结合蛋白,所述的人源化fcrn抗原结合蛋白包含:
34.(1)、包含seq id no:22所示的氨基酸序列的重链可变区vh;和/或包含seq id no:25所示的氨基酸序列的轻链可变区vl;
35.或者(2)、与(1)中的vh相比具有至少70%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的vh;和/或,与(1)中的vl相比具有至少70%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的vl;
36.或者(3)、与(1)中的vh相比具有一个或几个氨基酸的置换、缺失或添加或其任意组合的vh;和/或,与(1)中的vl相比具有一个或几个氨基酸的置换、缺失或添加或其任意组合的vl;所述的置换是保守置换。
37.具体地,所述的人源化fcrn抗原结合蛋白包含:
38.(1)包含seq id no:23所示的氨基酸序列的重链hc;和/或包含seq id no:26所示的氨基酸序列的轻链lc;
39.或者(2)重链和轻链,其中,与(1)中的重链和轻链相比,所述重链具有至少80%、
至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性;和/或,所述轻链具有至少70%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性。
40.又一方面,本发明提供了一种人源化fcrn抗原结合蛋白突变体,所述的人源化fcrn抗原结合蛋白突变体包含:
41.(1)包含seq id no:24所示的氨基酸序列的重链hc;和/或包含seq id no:26所示的氨基酸序列的轻链lc;
42.或者(2)重链和轻链,其中,与(1)中的重链和轻链相比,所述重链具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性;和/或,所述轻链具有至少70%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性。
43.又一方面,本发明提供了一系列编码所述fcrn抗原结合蛋白或突变体,或,人源化fcrn抗原结合蛋白或突变体的核酸分子。
44.具体地,所述的核酸分子包含一种或多种经密码子优化的核酸分子。
45.又一方面,本发明提供了一系列载体,所述的载体包含本技术所述的一个或多个核酸分子。
46.具体地,所述的载体包括但不限于质粒、病毒、噬菌体。
47.又一方面,本发明提供了一系列包含上述核酸分子或上述载体的宿主细胞。
48.具体地,所述的宿主细胞包括但不限于微生物、植物或动物细胞,可通过本领域技术人员已知的方法将本发明所述的载体引入所述宿主细胞中,例如电穿孔、lipofectine转染、lipofectamin转染等方法。
49.又一方面,本发明提供了一种嵌合抗原受体,所述的嵌合抗原受体包含上述fcrn抗原结合蛋白或突变体,或,人源化fcrn抗原结合蛋白或突变体。
50.又一方面,本发明提供了一种免疫细胞,所述的免疫细胞包含上述嵌合抗原受体。
51.又一方面,本发明提供了一种抗原结合蛋白衍生物,所述的抗原结合蛋白衍生物包含上述fcrn抗原结合蛋白或突变体,或,人源化fcrn抗原结合蛋白或突变体和可检测的标记分子。
52.具体地,所述的可检测的标记分子为酶(例如辣根过氧化物酶)、放射性核素、荧光染料、发光物质(如化学发光物质)或生物素。
53.又一方面,本发明提供了一种多特异性抗体,所述的多特异性抗体包含上述fcrn抗原结合蛋白或突变体,或,人源化fcrn抗原结合蛋白或突变体和另外的抗体或其片段或抗体类似物。
54.具体地,所述多特异性抗体是双特异性抗体或三特异性抗体或四特异性抗体。
55.又一方面,本发明提供了一种抗体药物偶联物,所述的抗体药物偶联物包括抗体部分和偶联部分,所述抗体部分包含上述fcrn抗原结合蛋白或突变体,或,人源化fcrn抗原结合蛋白或突变体,所述偶联部分包括但不限于可检测标记物、药物、毒素、细胞因子、放射性核素、酶、或其组合,所述抗体部分和偶联部分通过化学键或接头进行偶联。
56.又一方面,本发明提供了一种药物组合物,所述的药物组合物包含上述fcrn抗原结合蛋白或突变体、人源化fcrn抗原结合蛋白或突变体、核酸分子、载体、宿主细胞、嵌合抗原受体、免疫细胞、抗原结合蛋白衍生物、多特异性抗体和/或抗体药物偶联物。
57.具体地,所述的药物组合物还包含任选的药学上可接受的载体。
58.进一步具体地,所述的药学上可接受的载体包括但不限于:稀释剂、赋形剂、填充剂、润湿剂、崩解剂、矫味剂和粘合剂。
59.具体地,所述的药物组合物还包含组合治疗剂,所述的组合治疗剂包括但不限于化学治疗剂、放射治疗剂、免疫抑制剂、细胞毒性药物。
60.又一方面,本发明提供了上述fcrn抗原结合蛋白或突变体、或,人源化fcrn抗原结合蛋白或突变体的生产方法,所述的方法包括在使得所述抗原结合蛋白表达的情况下,培养上述宿主细胞。
61.又一方面,本发明提供了所述的fcrn抗原结合蛋白或突变体、人源化fcrn抗原结合蛋白或突变体、核酸分子、载体、宿主细胞、嵌合抗原受体、免疫细胞、抗原结合蛋白衍生物、多特异性抗体、抗体药物偶联物和/或药物组合物在制备用于fcrn阻断药物、试剂盒和/或医疗装置中的应用。
62.具体地,所述的fcrn阻断药物、试剂盒和/或装置主要应用于自身抗体相关疾病中。
63.又一方面,本发明提供了所述的fcrn抗原结合蛋白或突变体、人源化fcrn抗原结合蛋白或突变体、核酸分子、载体、宿主细胞、嵌合抗原受体、免疫细胞、抗原结合蛋白衍生物、多特异性抗体、抗体药物偶联物和/或药物组合物在制备用于预防和/或治疗自身抗体相关疾病的药物、试剂盒和/或给药装置中的应用。
64.具体地,所述的自身抗体相关疾病为自身免疫性疾病。
65.进一步具体地,所述的自身免疫性疾病包括但不限于:免疫中性粒细胞减少症,自身免疫性脑炎,自身免疫性贫血,重症肌无力,多发性硬化,类风湿性关节炎,狼疮,特发性血小板减少性紫癜(itp),狼疮性肾炎和膜性肾病等疾病。
66.又一方面,本发明提供了所述的fcrn抗原结合蛋白或突变体、人源化fcrn抗原结合蛋白或突变体、或抗原结合蛋白衍生物在制备fcrn检测试剂或试剂盒中的用途。
67.又一方面,本发明提供了fcrn检测方法,利用上述fcrn抗原结合蛋白或突变体,或,人源化fcrn抗原结合蛋白或突变体定性或定量分析检测fcrn,所述的检测方法用于非疾病诊断或治疗目的。
68.又一方面,本发明提供了自身抗体相关疾病的治疗方法,所述的治疗方法为向有需要的受试者施用有效量的上述fcrn抗原结合蛋白或突变体、人源化fcrn抗原结合蛋白或突变体、免疫细胞、抗原结合蛋白衍生物、多特异性抗体,抗体药物偶联物和/或药物组合物。
69.具体地,所述的自身抗体相关疾病为自身免疫性疾病。
70.进一步具体地,所述的自身免疫性疾病包括但不限于:免疫中性粒细胞减少症,自身免疫性脑炎,自身免疫性贫血,重症肌无力,多发性硬化,类风湿性关节炎,狼疮,特发性血小板减少性紫癜(itp),狼疮性肾炎和膜性肾病等疾病。
71.又一方面,本发明提供了一种试剂盒,所述的试剂盒包括所述的fcrn抗原结合蛋
白或突变体、人源化fcrn抗原结合蛋白或突变体、核酸分子、载体、宿主细胞、嵌合抗原受体、免疫细胞、抗原结合蛋白衍生物、多特异性抗体、抗体药物偶联物和/或药物组合物,及任选地,说明书。
72.又一方面,本发明提供了一种给药装置,所述的给药装置包含:(1)用于对有需要的受试者施用所述的药物组合物的输注模块,以及(2)任选的药效监控模块。
73.与现有技术相比,本发明的积极和有益效果在于:
74.(1)本发明提供了一种新的fcrn抗原结合蛋白,所述的fcrn抗原结合蛋白通过杂交瘤技术得到,对人fcrn-ecd具有较好的亲和力及结合活性,能够阻断fcrn与igg分子的结合,同时在体内可以加速igg的代谢。本发明所述的fcrn抗原结合蛋白可用于治疗多种自身免疫性疾病,为自身免疫性疾病的治疗提供了一种新的思路。
75.(2)本发明还对这种fcrn特异性单抗进行了fc的突变,发现这种突变的fcrn单抗,可以进一步增强加速igg在体内代谢的作用。
附图说明
76.图1为在ph7.4下,spga01-102结合人fcrn-ecd亲和力检测结果图。
77.图2为在ph6.0下,spga01-102结合人fcrn-ecd亲和力检测结果图。
78.图3为spga01-102特异性结合细胞表面fcrn高表达细胞流式检测结果图。
79.图4为spga01-102阻断人igg结合人fcrn-ecd检测结果图。
80.图5为spga01-ch102结合人fcrn-ecd亲和力检测结果图。
81.图6为spga01-ch102阻断人igg结合人fcrn-ecd检测结果图。
82.图7为spga01-ch102mu结合人fcrn-ecd亲和力检测结果图。
83.图8为spga01-ch102mu阻断人igg结合人fcrn-ecd检测结果图。
84.图9为spga01-102与还原变性的fcrn和fcrn区域的结合能力的检测结果图。
85.图10为spga01-102对靶抗原多肽的结合检测结果图。
86.图11为spga01-102对靶抗原结合关键位点的检测结果图。
87.图12为spga01-102与食蟹猴、小鼠fcrn的交叉结合活性检测结果图。
88.图13为spga01-ch102和spga02-ch102mu加速人igg在人fcrn转基因小鼠中的清除检测结果图。
89.图14为spga01-ch102和spga02-ch102mu加速人igg在人fcrn转基因小鼠中的清除检测结果图。
90.图15为spga01-ch102和spga02-ch102mu在人fcrn转基因小鼠中的代谢动力学检测结果图。
91.图16为spga02-hu102结合人fcrn-ecd亲和力检测结果图。
92.图17为spga02-hu102阻断人igg结合人fcrn-ecd检测结果图。
93.图18为spga02-hu102mu结合人fcrn-ecd亲和力检测结果图。
94.图19为spga02-hu102mu阻断人igg结合人fcrn-ecd检测结果图。
95.图20为spga01-hu102和spga02-hu102mu加速人igg在人fcrn转基因小鼠中的清除检测结果图。
96.图21为spga01-hu102和spga02-hu102mu加速人igg在人fcrn转基因小鼠中的清除
检测结果图。
97.图22为spga01-hu102和spga02-hu102mu在人fcrn转基因小鼠中的代谢动力学检测结果图。
98.图23为spga01-hu102和spga02-hu102mu在人fcrn转基因小鼠中的代谢动力学检测结果图。
具体实施方式
99.下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
100.术语定义
101.为了更容易理解本发明,以下具体定义了某些技术和科学用语。除非在本文中另有明确定义,本文使用的所有的其他技术和科学术语都具有本公开所属领域的一般技术人员通常理解的含义。
102.本发明所用氨基酸三字母代码和单字母代码如j.biol.chem,243,p3558(1968,iupac-iub委员会)中所述。
103.本发明所述的“抗原结合蛋白”通常是指包含结合抗原部分的蛋白质,以及任选地允许结合抗原的部分采用促进抗原结合蛋白与抗原结合的构象的支架或骨架部分。可典型地包含抗体轻链可变区(vl)、抗体重链可变区(vh)或上述两者。vh和vl区可进一步被区分为称为互补决定区(cdr)的高变区,它们散布在称为框架区(fr或fwr)的更保守的区域中。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗原结合蛋白的实例包括但不限于抗体、抗原结合片段(fab,fab’,fv片段,f(ab’)2,scfv,di-scfv和/或dab)、免疫缀合物、多特异性抗体(例如双特异性抗体)、抗体片段、抗体衍生物、抗体类似物、嵌合抗原受体或融合蛋白等,只要它们显示出所需的抗原结合活性即可。
104.本发明所述的“抗体”指免疫球蛋白,是由两条相同的重链和两条相同的轻链通过链间二硫键链接而成的四肽链结构。免疫球蛋白重链恒定区的氨基酸组成和排列顺序不同,故其抗原性也不同。据此,可将免疫球蛋白分为五类,或称为免疫球蛋白的同种型,即igm、igd、igg、iga、ige,其相应的重链分别为μ链、δ链、γ链、α链、ε链。同一类ig根据其铰链区氨基酸组成和重链二硫键的数目和位置的差别,又可分为不同的亚类,如igg可以分为igg1、igg2、igg3、igg4。轻链通过恒定区的不同分为κ链或λ链。五类ig中每类ig都可以有κ链或λ链。
105.抗体重链和轻链靠近n端的约110个氨基酸的序列变化很大,为可变区(v区);靠近c端的其余氨基酸序列相对稳定,为恒定区(c区)。可变区包括3个高变区(hvr)和4个序列相对保守的骨架区(fr)。3个高变区决定抗体的特异性,又称为互补决定区(cdr)。每条轻链可变区(vl或lcvr)和重链可变区(vh或hcvr)由3个cdr区和4个fr区组成,从氨基端到羧基端依次排列的顺序为:fr1,cdr1,fr2,cdr2,fr3,cdr3,fr4。轻链的3个cdr区指lcdr1、lcdr2和lcdr3,重链的3个cdr区指hcdr1、hcdr2和hcdr3。
106.术语“互补决定区”(cdr)指抗体的可变结构域内主要促成抗原结合的6个高变区
之一。通常每个重链可变区中存在三个cdr(hcdr1、hcdr2、hcdr3),每个轻链可变区中存在三个cdr(lcdr1、lcdr2、lcdr3)。cdr可根据本领域已知的各种编号系统确定,例如kabat、chothia或,abm或imgt编号系统。本发明中使用“kabat编号规则”(参见kabat等(1991))确定cdr的氨基酸序列边界。
107.术语“构架区”或“fr”残基是指,抗体可变区中除了如上定义的cdr残基以外的那些氨基酸残基。
108.术语“单克隆抗体”、“单抗”、“mab”是指从基本上均质抗体的群里获得的抗体,即除可能的变体抗体外,构成所述群体的个别抗体相同和/或结合相同的表位。与通常包含针对不同决定簇的不同抗体的多克隆抗体制备物不同,单克隆抗体制备物的每个单克隆抗体是针对抗原上的单一决定簇的。因此。“单克隆”是指从基本上均质抗体群体获得的抗体的特性,且不应解释为需要通过任何特定方法来制造抗体。本发明所述的单克隆抗体可通过各种本领域技术人员已知的技术制备,所述技术包括但不限于杂交瘤方法、重组dna方法、噬菌体展示方法及转基因方法等。
109.术语“人源化单克隆抗体”是指将鼠的cdr序列移植到人的抗体可变区框架,即不同类型的人种系抗体框架序列中产生的抗体,可以克服由于嵌合抗体携带大量鼠蛋白成分,从而诱导的异源性反应。为避免免疫原性下降的同时,引起的活性下降,可对所述的人抗体可变区框架序列进行最少反向突变(或回复突变),以保持活性。为制备人源化抗体,可以使用本领域已知的方法将鼠cdr区插入人源框架序列(参见winter的美国专利no.5225539;queen等人的美国专利nos.5530101;5585089;5693762和6180370;以及lo,benny,k.c.,editor,in antibody engineering:methods and protocols,volume 248,humana press,new jersey,2004)。或者,还可以利用转基因动物,其能够在免疫后不产生内源性免疫球蛋白、并且能够产生完整人抗体库(参见例如,jakobovits等,1993,proc.natl.acad.sci.usa 90:2551;jakobovits等,1993,nature 362:255-258;bruggermann等,1993,year in immunology 7:33;和duchosal等,1992,nature 355:258;lonberg等人(1994)nature 368(6474):856-859;wo02/43478)。其他抗体人源化改造的方法还包括噬菌体展示技术(hoogenboom等,1991,j.mol.biol.227:381;marks等,j.mol.biol.1991,222:581-597;vaughan等,1996,nature biotech 14:309)。
110.术语“特异性结合”、“选择性结合”是指两分子间的非随机的结合反应,如抗体和其所针对的抗原之间的反应。特异性结合相互作用的强度或亲和力可以用相互作用的解离平衡常数(kd)表示。在本文中,术语“kd”是指特定抗体-抗原相互作用的解离平衡常数,其用于描述抗体与抗原之间的结合亲和力。解离平衡常数越小,抗体-抗原结合越紧密,抗体与抗原之间的亲和力越高。通常,抗体以大约小于10-8
m,例如大约小于10-9
m、10-10
m、10-11
m或更小的亲和力(kd)结合。
111.术语“同一性”通常是指在比对序列后,查询序列中氨基酸残基或核苷酸与第二参考多肽序列或其部分中相同的残基所占百分比,必要时引入空位(gaps)以实现最大序列同一性百分比,并且不考虑任何保守取代作为序列同一性的一部分。用于确定氨基酸/核苷酸序列同一性百分比的比对可以通过本领域已知的各种方式来实现,例如,使用可公开获得的计算机软件,例如blast,blast-2,align,needle或megalign(dnastar)。本领域技术人员可以确定用于测量比对的合适参数,包括在所比较的序列的全长上实现最大比对所需的任
何算法。同一性百分比可以在整个确定的多肽/多核苷酸序列的长度上测定,或者可以在较短的长度上,例如在从较大的确定的多肽/多核苷酸序列中获得的片段的长度上测定。应当理解,在表,附图或序列表中,本文所示的序列所支持的任何片段长度可用于作为可测量同一性百分比的长度。具有“%同一性”的序列保留与其比较或来源的序列的重要生物活性,如抗体结合特异性。具有一个或几个氨基酸的置换、缺失或添加或其任意组合的序列保留与其比较或来源的序列的重要生物活性,如抗体结合特异性。具有“%同一性”的核苷酸序列或相差不超过3、6、15、30或45个核苷酸的核苷酸序列能够实现与其比较或来源的核苷酸序列近似的功能,如所表达的蛋白都能特异地结合同一抗原或分子。
112.术语“保守置换”指不会不利地影响或改变包含氨基酸序列的蛋白/多肽的预期性质的氨基酸置换。例如,可通过本领域内已知的标准技术例如定点诱变和pcr介导的诱变引入保守置换。保守氨基酸置换包括用具有相似侧链的氨基酸残基替代氨基酸残基的置换,例如用在物理学上或功能上与相应的氨基酸残基相似(例如具有相似大小、形状、电荷、化学性质,包括形成共价键或氢键的能力等)的残基进行的置换。已在本领域内定义了具有相似侧链的氨基酸残基的家族。这些家族包括具有碱性侧链(例如,赖氨酸、精氨酸和组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸)、β分支侧链(例如,苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)的氨基酸。因此,优选用来自相同侧链家族的另一个氨基酸残基替代相应的氨基酸残基。鉴定氨基酸保守置换的方法在本领域内是熟知的(参见,例如,brummell等人,biochem.32:1180-1187(1993);kobayashi等人protein eng.12(10):879-884(1999);和burks等人proc.natl acad.set usa 94:412-417(1997),其通过引用并入本文)。
113.术语“载体(vector)”是指,可将多聚核苷酸插入其中的一种核酸运载工具。当载体能使插入的多核苷酸编码的蛋白获得表达时,载体称为表达载体。载体可以通过转化,转导或者转染导入宿主细胞,使其携带的遗传物质元件在宿主细胞中获得表达。载体是本领域技术人员公知的,包括但不限于:质粒;噬菌粒;柯斯质粒;人工染色体,例如酵母人工染色体(yac)、细菌人工染色体(bac)或p1来源的人工染色体(pac);噬菌体如λ噬菌体或m13噬菌体及动物病毒等。可用作载体的动物病毒包括但不限于,逆转录酶病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如sv40)。一种载体可以含有多种控制表达的元件,包括但不限于,启动子序列、转录起始序列、增强子序列、选择元件及报告基因。另外,载体还可含有复制起始位点。
114.术语“宿主细胞”,通常是指可以或已经含有包括本技术所述的核酸分子的质粒或载体,或者能够表达本技术所述的抗体或其抗原结合片段的个体细胞、细胞系或细胞培养物。所述细胞可以包括单个宿主细胞的子代。由于天然的、意外的或故意的突变,子代细胞与原始亲本细胞在形态上或在基因组上可能不一定完全相同,但能够表达本技术所述的抗体或其抗原结合片段即可。所述细胞可以通过使用本技术所述的载体体外转染细胞而得到。所述细胞可以是原核细胞(例如大肠杆菌),也可以是真核细胞(例如酵母细胞,例如cos细胞,中国仓鼠卵巢(cho)细胞,hela细胞,hek293细胞,cos-1细胞,ns0细胞或骨髓瘤细胞)。在某些情形中,所述细胞可以是哺乳动物细胞。例如,所述哺乳动物细胞可以是chok1
细胞。
115.术语“药学上可接受的载体”是指在药理学和/或生理学上与受试者和活性成分相容的载体,是本领域公知的(参见例如remington's pharmaceutical sciences.edited by gennaro ar,19th ed.pennsylvania:mack publishing company,1995),并且包括但不限于:ph调节剂,表面活性剂,佐剂,离子强度增强剂,稀释剂,维持渗透压的试剂,延迟吸收的试剂,防腐剂。例如,ph调节剂包括但不限于磷酸盐缓冲液。表面活性剂包括但不限于阳离子,阴离子或者非离子型表面活性剂,例如tween-80。离子强度增强剂包括但不限于氯化钠。防腐剂包括但不限于各种抗细菌试剂和抗真菌试剂,例如对羟苯甲酸酯,三氯叔丁醇,苯酚,山梨酸等。维持渗透压的试剂包括但不限于糖、nacl及其类似物。延迟吸收的试剂包括但不限于单硬脂酸盐和明胶。稀释剂包括但不限于水,水性缓冲液(如缓冲盐水),醇和多元醇(如甘油)等。防腐剂包括但不限于各种抗细菌试剂和抗真菌试剂,例如硫柳汞,2-苯氧乙醇,对羟苯甲酸酯,三氯叔丁醇,苯酚,山梨酸等。稳定剂具有本领域技术人员通常理解的含义,其能够稳定药物中的活性成分的期望活性,包括但不限于谷氨酸钠,明胶,spga,糖类(如山梨醇,甘露醇,淀粉,蔗糖,乳糖,葡聚糖,或葡萄糖),氨基酸(如谷氨酸,甘氨酸),蛋白质(如干燥乳清,白蛋白或酪蛋白)或其降解产物(如乳白蛋白水解物)等。
116.术语“药物组合物”通常是指这样的制剂,其以允许活性成分的生物学活性有效的形式存在,并且不包含对将施用所述组合物的对象具有不可接受的毒性的另外的成分。所述组合物是无菌的。
117.术语“受试者”是指哺乳动物,例如灵长类哺乳动物,例如非人灵长类哺乳动物或人。在某些实施方式中,所述受试者(例如人)患有自身免疫性疾病(包括但不限于:免疫中性粒细胞减少症,自身免疫性脑炎,自身免疫性贫血,重症肌无力,多发性硬化,类风湿性关节炎,狼疮,特发性血小板减少性紫癜(itp),狼疮性肾炎和膜性肾病等疾病),或者,具有患有上述疾病的风险。
118.术语“有效量”是指足以获得或至少部分获得期望的效果的量。例如,预防疾病(例如,自身抗体相关疾病)有效量是指,足以预防,阻止,或延迟疾病(例如,自身抗体相关疾病)的发生的量;治疗疾病有效量是指,足以治愈或至少部分阻止已患有疾病的患者的疾病和其并发症的量。测定这样的有效量完全在本领域技术人员的能力范围之内。例如,对于治疗用途有效的量将取决于待治疗的疾病的严重度、患者自己的免疫系统的总体状态、患者的一般情况例如年龄,体重和性别,药物的施用方式,以及同时施用的其他治疗等等。
119.术语“嵌合抗原受体”指的是嵌合抗原受体t细胞通过识别某种抗原的抗体的抗原结合部位与cd3-δ链或fcεriγ的胞内部分在体外偶联为一个嵌合蛋白,通过基因转导的方法转染患者的t细胞,使其表达嵌合抗原受体,使得患者的t细胞被“重编码”后,能够生成大量特异性的car-t细胞。把重新编码后的嵌合抗原受体t细胞加进患者身体里,这种嵌合抗原受体就像gps一样可以特异性地追踪和识别并引导t细胞杀伤细胞。大多数嵌合抗原受体由胞外抗原结合区(由来源于单克隆抗体的轻链和重链组成,中间由带韧性的铰链区连接形成单链抗体)、跨膜区域和胞内信号转导区组成。通过将识别相关抗原的scfv和胞内信号域“免疫受体酪氨酸活化基序”在体外进行基因重组获得car结构。
120.术语“免疫细胞”包括具有造血的起源并在免疫应答中起作用的细胞,例如淋巴细胞,例如b细胞和t细胞;天然杀伤细胞;髓样细胞,例如单核细胞、巨噬细胞、嗜曙红细胞、肥
大细胞、嗜碱细胞和粒细胞。
121.缩略词
122.cdr:免疫球蛋白可变区中的互补决定区。
123.vh:抗体重链可变区。
124.vl:抗体轻链可变区。
125.hc:抗体重链。
126.lc:抗体轻链。
127.igg:免疫球蛋白g。
128.abm:abm cdr定义方式来源于martin的相关研究(martin acr,cheetham jc,rees ar(1989)modelling antibody hypervariable loops:a combined algorithm.proc natl acad sci usa 86:9268-9272),此定义方法整合了kabat及chothia两者的部分定义。
129.kabat:由elvin a.kabat提出的免疫球蛋白比对及编号系统(参见,例如kabat et al.,sequences of proteins of immunological interest,5th ed.public health service,national institutes of health,bethesda,md.,1991)。
130.chothia:由chothia等人提出的免疫球蛋白编号系统,其是基于结构环区的位置鉴定cdr区边界的经典规则(参见,例如chothia&lesk(1987)j.mol.biol.196:901-917;chothia等人(1989)nature 342:878-883)。
131.imgt:基于由lefranc等人发起的国际免疫遗传学信息系统(the international immunogenetics information(imgt))的编号系统,可参阅lefranc et al.,dev.comparat.immunol.27:55-77,2003。
132.mab:单克隆抗体。
133.ec50:产生50%功效或结合的浓度。
134.ic50:产生50%抑制的浓度。
135.elisa:酶联免疫吸附测定。
136.pcr:聚合酶链式反应。
137.hrp:辣根过氧化物酶。
138.fcrn:新生儿fc受体。
139.hfc:人igg抗体fc段。
140.kd:解离平衡常数。
141.hcdr1:免疫球蛋白重链可变区中的互补决定区1。
142.hcdr2:免疫球蛋白重链可变区中的互补决定区2。
143.hcdr3:免疫球蛋白重链可变区中的互补决定区3。
144.lcdr1:免疫球蛋白轻链可变区中的互补决定区1。
145.lcdr2:免疫球蛋白轻链可变区中的互补决定区2。
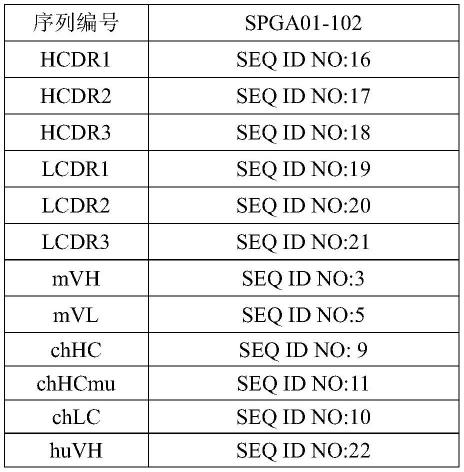
146.lcdr3:免疫球蛋白轻链可变区中的互补决定区3。
147.发明详述
148.抗原结合蛋白
149.本发明制备了一系列fcrn抗原结合蛋白,这些fcrn抗原结合蛋白通过免疫小鼠、分子生物学和抗体工程技术制备得到。
150.在某些实施方式中,本发明提供的抗原结合蛋白包括以下互补决定区:
151.(1)包含seq id no:16所示的氨基酸序列或其变体序列的重链互补决定区1hcdr1;
152.(2)包含seq id no:17所示的氨基酸序列或其变体序列的重链互补决定区2hcdr2;
153.(3)包含seq id no:18所示的氨基酸序列或其变体序列的重链互补决定区3hcdr3;
154.(4)包含seq id no:19所示的氨基酸序列或其变体序列的轻链互补决定区1lcdr1;
155.(5)包含seq id no:20所示的氨基酸序列或其变体序列的轻链互补决定区2lcdr2;
156.(6)包含seq id no:21所示的氨基酸序列或其变体序列的轻链互补决定区3lcdr3;
157.优选地,所述变体序列为与其来源的cdr相比具有一个或几个氨基酸的置换、缺失或添加的cdr序列;所述的置换为保守置换。
158.在某些实施方式中,本发明提供的抗原结合蛋白包含如下重链可变区vh和轻链可变区vl:
159.(1)、包含seq id no:3所示的氨基酸序列的重链可变区vh;和/或包含seq id no:5所示的氨基酸序列的轻链可变区vl;
160.或者(2)、与(1)中的vh相比具有至少70%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的vh;和/或,与(1)中的vl相比具有至少70%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的vl;
161.或者(3)、与(1)中的vh相比具有一个或几个氨基酸的置换、缺失或添加或其任意组合的vh;和/或,与(1)中的vl相比具有一个或几个氨基酸的置换、缺失或添加或其任意组合的vl;所述的置换是保守置换。
162.在某些实施方式中,本发明提供的抗原结合蛋白包括如下重链hc和轻链lc:
163.(1)包含seq id no:9所示的氨基酸序列的重链hc;和/或包含seq id no:10所示的氨基酸序列的轻链lc;
164.或者(2)重链和轻链,其中,与(1)中的重链和轻链相比,所述重链具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性;和/或,所述轻链具有至少70%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性。
165.在某些具体的实施方式中,本发明制备获得的fcrn抗原结合蛋白包括下表1所述的重链及轻链的组合。
166.表1.fcrn抗原结合蛋白的序列特征
[0167][0168][0169]
抗体衍生物和多特异性抗体
[0170]
如上部分所述的本发明提供的抗原结合蛋白包括抗体或抗原结合片段,其可进行衍生化(例如被连接至另一个分子,例如另一个多肽或蛋白)。通常,抗体或其抗原结合片段的衍生化(例如,标记)不会对其与fcrn的结合产生不利影响。因此,本发明的抗体或其抗原结合片段还意欲包括此类衍生化的形式。例如,可以将本发明的抗体或其抗原结合片段连接于一个或多个其它分子基团,形成双特异性抗体,检测试剂,药用试剂,和/或能够介导抗体或抗原结合片段与另一个分子结合的蛋白或多肽(例如,抗生物素蛋白或多组氨酸标签)。
[0171]
一种类型的衍生化抗体是标记的抗体。例如,可以将本发明的抗体或其抗原结合片段连接至可检测的标记。本发明所述的可检测的标记可以是可通过荧光、光谱、光化学、生物化学、免疫学、电学、光学或化学手段检测的任何物质。这类标记是本领域熟知的,其实例包括但不限于,酶(例如,辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶、脲酶、葡萄糖氧化酶,等)、放射性核素(例如,3h、125i、35s、14c或32p)、荧光染料(例如,异硫氰酸荧光素(fitc)、荧光素、异硫氰酸四甲基罗丹明(tritc)、藻红蛋白(pe)、德克萨斯红、罗丹明、量子点或花菁染料衍生物(例如cy7、alexa 750))、吖啶酯类化合物、磁珠(例如,)、测热标记物例如胶体金或有色玻璃或塑料(例如,聚苯乙烯、聚丙烯、乳胶,等)珠、以及用于结合上述标记物修饰的亲和素(例如,链霉亲和素)的生物素。教导该标记物的使用的专利包括,但不限于,美国专利3,817,837;3,850,752;3,939,350;3,996,345;4,277,437;4,275,149;及4,366,241(全部通过引用并入本文)。如上所述的可检测的标记可通过本领域已知的方法检测。例如,放射性标记可使用摄影胶片或闪烁计算器检测,荧光标记物可使用光检测器检测,以检测发射的光。酶标记物一般通过给酶提供底物及检测通过酶对底物的作用产生的反应产物来检测,及测热标记物通过简单可视化着色标记物来检测。在某些实
施方案中,此类标记能够适用于免疫学检测(例如,酶联免疫测定法、放射免疫测定法、荧光免疫测定法、化学发光免疫测定法等)。在某些实施方案中,可通过不同长度的接头(linker)将如上所述的可检测的标记连接至本发明的抗体或其抗原结合片段,以降低潜在的位阻。
[0172]
此外,本发明的抗体或其抗原结合片段还可以用化学基团进行衍生,例如聚乙二醇(peg),甲基或乙基,或者糖基。这些基团可用于改善抗体的生物学特性,例如增加血清半衰期。
[0173]
作为另一种抗体的衍生物,本发明提供一种多特异性抗体,所述多特异性抗体包含第一抗体或其片段,和另外的抗体或其片段,或抗体类似物,其中第一抗体或其片段,另外的抗体或其片段,或抗体类似物保留其原始结合特异性。所述第一抗体或其片段是本发明的任一结合tslp的(单克隆)抗体或其抗原结合片段。如本文中所使用的,“抗体类似物(antibody mimetic)”,指与抗体一样特异性结合抗原,但却没有抗体结构。它们通常是人工肽或蛋白质,摩尔质量约为3至20kda,例如锚蛋白重复蛋白(darpin)和fynomer。经设计的锚蛋白重复蛋白(darpin)可以与igg抗体、scfv-fc抗体片段或其组合相连,如cn104341529a所述。抗il-17a的fynomer与抗il-6r抗体融合产生双特异性融合多肽,如wo2015141862a1所述。
[0174]
在某些实施方案中,所述多特异性抗体由第一抗体或其抗原结合片段与其他抗体或其抗原结合片段或抗体类似物通过偶联形成,并且其中各抗体或其抗原结合片段或抗体类似物保持其原结合特异性,所述第一抗体或其抗原结合片段为本发明所述的抗体或其抗原结合片段。某些实施方案中,所述多特异性抗体为双特异性抗体或三特异性抗体或四特异性抗体。
[0175]
抗体药物偶联物
[0176]
抗体药物偶联物包括本发明提供的抗原结合蛋白部分以及偶联部分。抗原结合蛋白部分包括如上所述的“抗原结合蛋白”,以及在“抗原结合蛋白”基础上获得的抗原结合片段。抗原结合片段的实例包括但不限于fab,fab’,fv片段,f(ab’)2,scfv,di-scfv和/或dab等。偶联部分可以包含至少一个载荷药物。所述载荷药物可以包含药物活性物成分和/或前述的标记分子。载荷药物是一类具有药学活性的小分子化合物或者毒素或其他药物分子形式,可以是但不局限于小分子化合物、毒素分子、寡核苷酸、蛋白降解靶向嵌合体(protac)、亲和配体、荧光基团、核素基团等。本领域已知多种载荷药物。例如,小分子化合物通常是指具有较强细胞毒性的一类物质。示例性的小分子化合物可通过包括但不限于微管蛋白结合、dna结合、抑制rna聚合酶、蛋白质合成或抑制拓扑异构酶等机制来发挥此类细胞毒性和细胞抑制性效应。例如,小分子化合物可以是微管蛋白抑制剂;例如,所述微管蛋白抑制剂可以是美登素(例如,dm1或dm4)和奥瑞司他汀(例如,mmae或mmaf)等等。例如,所述小分子化合物可以是dna损伤剂;例如,所述dna损伤剂可以是卡奇霉素(calicheamicins)、吡咯并苯并二氮杂卓(pbd,pyrrolobenzodiazepines)等等。例如,蛋白降解靶向嵌合体(protac)是一类能够通过诱导靶蛋白的多聚泛素化而导致靶蛋白降解的化合物;例如,所述protac可以是bet蛋白降解剂。所述药物偶联物还可以包含至少一个连接子。例如,所述连接子可包含可断裂连接子或非可断裂连接子。所述连接子用于将一个或多个载荷药物连接到抗原结合蛋白。在本技术中,可断链的连接子可以是便于释放药物的“可切割”连接子。例如,可
切割连接子可以包括但不局限于酸敏感连接子,蛋白酶敏感连接子,光敏感连接子,或含二硫化物连接子。连接子可包含一种或多种连接子构件,本领域已知多种连接子构件,例如,马来酰亚胺基己酰基(mc,maleimidocaproyl),马来酰亚胺基丙酰基(mp),缬氨酸-瓜氨酸(val-cit或vc,valine-citrulline),对氨基苄氧羰基(pab,paminobenzyloxycarbonyl)。
[0177]
核酸、载体、宿主细胞及抗体的制备
[0178]
本发明的抗原结合蛋白可通过本领域已知的各种方法来制备,例如通过基因工程重组技术来获得。例如,通过化学合成或pcr扩增获得编码本发明抗体的重链和轻链基因的dna分子。将所得dna分子插入表达载体内,然后转染宿主细胞。然后,在特定条件下培养转染后的宿主细胞,并表达本发明的抗体。
[0179]
在某些具体的实施方式中,本发明提供了分离的核酸分子,包含编码本发明的抗体或其抗原结合片段、或其重链可变区和/或轻链可变区、或其一个或多个cdr的核苷酸序列。根据本领域已知的密码子简并性,在某些实施方案中,所述核苷酸序列是可以根据密码子简并性进行替换的。在某些实施方案中,所述核苷酸序列是密码子最优化的。
[0180]
在某些实施方式中,本发明提供了包含本发明的分离的核酸分子的克隆载体或表达载体。在某些实施方案中,所述的载体是例如质粒,粘粒,噬菌体,慢病毒等。在某些实施方案中,所述的载体能够在受试者(例如哺乳动物,例如人)体内表达本发明的抗体或其抗原结合片段。在某些实施方式中,本发明提供了包含本发明的分离的核酸分子或本发明的载体的宿主细胞。宿主细胞可以是真核细胞(例如哺乳动物细胞、昆虫细胞、酵母细胞)或原核细胞(例如大肠杆菌)。合适的真核细胞包括但不限于ns0细胞、vero细胞、hela细胞、cos细胞、cho细胞、hek293细胞、bhk细胞、和mdckii细胞。适宜的昆虫细胞包括但不限于sf9细胞。在某些实施方案中,本发明的宿主细胞是哺乳动物细胞,例如cho(例如cho-k1、cho-s、cho dxb11、cho dg44)。
[0181]
在某些实施方式中,本发明提供了制备本发明的抗体或其抗原结合片段的方法,其包括,在允许所述抗体或其抗原结合片段表达的条件下,培养本发明的宿主细胞,和从培养的宿主细胞培养物中回收所述抗体或其抗原结合片段。
[0182]
制药用途、治疗方法、药物组合物和给药装置
[0183]
本发明提供了所述的fcrn抗原结合蛋白、抗原结合蛋白衍生物、多特异性抗体、免疫细胞、抗体药物偶联物在制备用于fcrn阻断药物、制备用于预防和/或治疗自身抗体相关疾病的药物中的用途。
[0184]
相应地,本发明提供了所述的fcrn抗原结合蛋白、抗原结合蛋白衍生物、多特异性抗体、免疫细胞、抗体药物偶联物用于阻断fcrn、用于预防和/或治疗自身抗体相关疾病的方法。
[0185]
在某些实施方式中,本发明提供了用于治疗的药物组合物,所述的药物组合物包含所述的fcrn抗原结合蛋白、核酸分子、载体、宿主细胞、免疫细胞、抗原结合蛋白衍生物、多特异性抗体和/或抗体药物偶联物及任选地药学上可接受的载体。“药学上可接受的载体”包括但不限于:稀释剂、赋形剂、填充剂、润湿剂、崩解剂、矫味剂和粘合剂。
[0186]
在某些实施方式中,所述的药物组合物还包含组合治疗剂,所述的组合治疗剂包括但不限于化学治疗剂、放射治疗剂、免疫抑制剂、细胞毒性药物。
[0187]
在某些实施方式中,在所述药物组合物中,本发明的抗原结合蛋白与所述组合治
疗剂作为分离的组分或作为同一组合物的组分提供。因此,本发明的抗原结合蛋白与所述组合治疗剂可以联合或分开,同时或相继施用。抗fcrn的抗体或其抗原结合片段可单独或与其它治疗剂组合给药。抗fcrn的抗体或其抗原结合片段和一种或多种其它治疗剂可分开、同时或相继给药。
[0188]
药物组合物可呈任何适合形式(视将其投予患者的所需方法而定),可通过多种途径(例如经口、经皮、皮下、鼻内、静脉内、肌肉内、眼内、局部、鞘内和脑室内)向患者投予本发明的fcrn抗体。在任何指定情况下最适于投药的途径将视特定抗体、个体和疾病的性质和严重度以及个体的身体状况而定。
[0189]
在某些实施方式中,本发明还提供了施用所述抗原结合蛋白、抗原结合蛋白衍生物、多特异性抗体、免疫细胞、抗体药物偶联物及包含上述成分的药物组合物的给药装置,所述装置包括:
[0190]
(i)输注模块,所述输注模块用于对受试者施用包括具有一活性成分的药物组合物;
[0191]
(ii)用于输注的药物组合物,所述药物组合物中含有一活性成分,所述活性成分选自下组:抗原结合蛋白、抗原结合蛋白衍生物、多特异性抗体、免疫细胞、抗体药物偶联物或其组合;以及
[0192]
(iii)任选的药效监控模块。
[0193]
在另一优选例中,所述的施用包括肠道外施用和非肠道外施用。在另一优选例中,所述肠道外施用包括注射施用,所用的注射的路径包括:静脉内、肌内、动脉内、膜内、囊内、眶内、心脏内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬脑膜上和胸骨内注射和推注。在另一优选例中,所述非肠道外施用包括外用、表皮施用或粘膜施用,例如鼻内、经口、阴道、直肠、舌下、或局部外用。在另一优选例中,所述的输注模块为无针皮下注射设备、微量输液泵、经皮给药设备、推注设备,或渗透设备。
[0194]
检测方法、试剂盒
[0195]
本发明的抗体或其抗原结合片段能够结合fcrn,从而可用于检测fcrn在样品中的存在或其水平。
[0196]
在一方面,本发明提供了一种试剂盒,其包括本发明的抗原结合蛋白。在某些实施方案中,本发明的抗原结合蛋白带有可检测的标记。在一个优选的实施方案中,所述试剂盒还包括第二抗体,其特异性识别本发明的抗体或其抗原结合片段。优选地,所述第二抗体还包括可检测的标记。
[0197]
在本发明中,所述可检测的标记可以是可通过荧光、光谱、光化学、生物化学、免疫学、电学、光学或化学手段检测的任何物质。特别优选的是,此类标记能够适用于免疫学检测(例如,酶联免疫测定法、放射免疫测定法、荧光免疫测定法、化学发光免疫测定法等)。
[0198]
在本发明中,提供了对fcrn表达的检测,其包含使用一种或一种以上本发明的fcrn抗体(任选接合于可检测部分)接触生物样品(个体细胞、组织或体液),和检测样品关于fcrn表达是否呈阳性,或检测样品相较于对照样品是否具有改变(例如减少或增加)的表达。在某些实施例中,组织或体液为周边血液、周边血液白血球、活组织检查组织(例如肺或皮肤活组织检查)以及组织。所述方法可以用于诊断目的,或者非诊断目的(例如,用于fcrn途径研究、药物筛选、组化分析等)。在某些实施方案中,用于非诊断目的的样品是细胞样
his结合能力。
[0209]
其中,检测杂交瘤孔竞争人igg结合fcrn的方法如下:将重组人fcrn-ecd(即fcrn(β2m)-his)蛋白以包被液(磷酸盐包被缓冲液,ph7.4)稀释至2μg/ml,100μl/孔加入酶标板,4℃包被过夜。pbst(ph6.0)洗板1次,加入300μl/孔封闭液(1%bsa-pbst(ph6.0)),37℃孵育2h后pbst(ph6.0)洗板3次待用。将杂交瘤上清加入酶标板,100μl/孔,37℃孵育1h。pbst(ph6.0)洗板3次,加入0.125μg/ml人igg-biotin(自制),100μl/孔,37℃孵育1h。pbst(ph6.0)洗板3次,加入sa-hrp(购自diamond,货号b110053),37℃孵育30min;pbst(ph6.0)洗板3次后,在吸水纸上尽量拍干残留液滴,每孔加入100μl的tmb(购自kpl公司,货号52-00-03),室温(20
±
5℃)避光放置5min;每孔加入50μl 2m h2so4终止液终止底物反应,酶标仪450nm处读取od值,分析待测抗体阻断人igg与fcrn-his结合的能力。
[0210]
1.3鼠源抗人fcrn单克隆抗体的大量制备及鉴定
[0211]
在含血清完全培养基中扩增筛选获得的杂交瘤细胞株,离心换液至无血清培养液sfm培养基,使细胞密度为1-2
×
107/ml,在5%co2,37℃条件下培养2周,离心获取培养上清,通过protein g亲和层析进行纯化,获得鼠源抗人fcrn-ecd蛋白单克隆抗体spga01-102。
[0212]
实施例2.鼠源抗人fcrn单克隆抗体的体外活性测定
[0213]
2.1鼠源抗体在ph7.4时对靶抗原人fcrn-ecd的亲和力的测定
[0214]
间接酶联免疫吸附测定法测定鼠源抗体对人fcrn的结合能力,具体方法如下:将重组人fcrn-ecd以包被液(磷酸盐包被缓冲液,ph7.4)稀释至0.5μg/ml,100μl/孔加入酶标板,4℃包被过夜。pbst洗板1次,加入300μl/孔封闭液(1%bsa-pbst,ph7.4),37℃孵育2h后pbst洗板3次。将纯化的抗体用1%bsa-pbst(ph7.4)稀释至1μg/ml,1:3梯度稀释后加入酶标板,100μl/孔,37℃孵育1h。pbst(ph7.4)洗板3次,加入hrp标记的羊抗小鼠igg二抗(购自abcam,货号ab6789),37℃孵育30min;pbst洗板3次后,在吸水纸上尽量拍干残留液滴,每孔加入100μl的tmb(购自kpl公司,货号52-00-03),室温(20
±
5℃)避光放置5min;每孔加入50μl 2m h2so4终止液终止底物反应,酶标仪450nm处读取od值,分析待测抗体与靶抗原人fcrn-ecd结合能力。
[0215]
结果如图1,所示抗体spga01-102在ph7.4时,与fcrn有很好的结合活性,ec50为14.89ng/ml,即0.10nm。
[0216]
2.2鼠源抗体在ph6.0时对靶抗原人fcrn-ecd的亲和力的测定
[0217]
间接酶联免疫吸附测定法测定鼠源抗体对人fcrn的结合能力,具体方法如下:将重组人fcrn-ecd蛋白以包被液(磷酸盐包被缓冲液,ph7.4)稀释至0.5μg/ml,100μl/孔加入酶标板,4℃包被过夜。pbst洗板1次,加入300μl/孔封闭液(1%bsa-pbst(ph6.0)),37℃孵育2h后pbst(ph6.0)洗板3次。将纯化的抗体用1%bsa-pbst(ph6.0)稀释至1μg/ml,1:3梯度稀释后加入酶标板,100μl/孔,37℃孵育1h。pbst(ph6.0)洗板3次,加入hrp标记的羊抗小鼠igg二抗(购自abcam,货号ab6789),37℃孵育30min;pbst(ph6.0)洗板3次后,在吸水纸上尽量拍干残留液滴,每孔加入100μl的tmb(购自kpl公司,货号52-00-03),室温(20
±
5℃)避光放置5min;每孔加入50μl 2m h2so4终止液终止底物反应,酶标仪450nm处读取od值,分析待测抗体与靶抗原人fcrn-ecd结合能力。
[0218]
结果如图2,所示抗体spga01-102在ph6.0时,与fcrn有很好的结合活性,ec50为15.97ng/ml,即0.11nm。
[0219]
实施例3.流式细胞法测定鼠源单抗结合人fcrn
[0220]
通过流式细胞荧光分选技术(fluorescence activated cell sorting,facs)的方法测定spga01-102对fcrn高表达细胞cho-hfcrn的结合亲和力。具体检测方法为:
[0221]
将处于生长对数期的cho细胞以人fcrn过表达慢病毒(吉满生物,pgmlv-cmv-h_fcrn-pgk-puro)感染,在5μg/ml嘌呤霉素盐酸puromycin dihydrochloride(吉满生物,货号gm-040401-1)条件下筛选和亚克隆获得稳定过表达人fcrn的细胞系,即cho-hfcrn。以cho-hfcrn细胞作为靶细胞,将100μl按照6倍梯度从20μg/ml连续稀释6个梯度的spga01-102作为一抗,分别与悬浮于100μl rpmi-1640无血清培养基(购自gibco公司,货号61870036)中的2
×
105个cho-hfcrn细胞于室温孵育30min(单抗的最高工作浓度为10μg/ml),pbs洗涤细胞两次以去除未结合的spga01-102,再将细胞与50μl含5μg/ml alexa fluor 488标记的抗鼠荧光二抗(购自thermo,invitrogen公司,货号a11001)于4℃孵育40min,pbs洗涤细胞两次以去除未结合的二抗,最后将细胞重悬在100μl pbs中,通过流式细胞仪(购自beckman,型号cytoflex)测定spga01-102对该细胞的结合亲和力,所得数据通过graphpad prism 6软件拟合分析。
[0222]
结果如图3所示,结果表明spga01-102可以特异性结合人fcrn高表达细胞cho-hfcrn,且其ec50为307.1ng/ml,即2.01nm。
[0223]
实施例4.鼠源抗体阻断igg fc结合fcrn活性
[0224]
fcrn是igg fc的受体,igg fc在ph6.0时与fcrn结合,在ph7.4时与fcrn解离,故阻断实验应在ph6.0的条件下进行,抗体的阻断活性可以反映其中和活性。具体方法如下:将重组人fcrn-ecd蛋白以包被液(磷酸盐包被缓冲液,ph7.4)稀释至2μg/ml,100μl/孔加入酶标板,4℃包被过夜。pbst(ph6.0)洗板1次,加入300μl/孔封闭液(1%bsa-pbst(ph6.0)),37℃孵育2h后pbst(ph6.0)洗板3次待用。将纯化的抗体用1%bsa-pbst(ph6.0)稀释至10μg/ml,1:3梯度稀释后加入酶标板,100μl/孔,37℃孵育1h。pbst(ph6.0)洗板3次,加入0.125μg/ml人igg-biotin(自制),100μl/孔,37℃孵育1h。pbst(ph6.0)洗板3次,加入sa-hrp(购自diamond,货号b110053),37℃孵育30min;pbst(ph6.0)洗板3次后,在吸水纸上尽量拍干残留液滴,每孔加入100μl的tmb(购自kpl公司,货号52-00-03),室温(20
±
5℃)避光放置5min;每孔加入50μl 2m h2so4终止液终止底物反应,酶标仪450nm处读取od值,分析待测抗体阻断人igg与fcrn-his结合的能力。
[0225]
结果见图4,图中所示的抗体spga01-102有很好的阻断活性,ec50为42.2ng/ml,即0.28nm。
[0226]
实施例5.嵌合抗体的制备
[0227]
本实施例通过分子生物学的相关方法获取杂交瘤spga01-102的重链可变区和轻链可变区,并进一步构建嵌合抗体。
[0228]
通过trizol提取spga01-102杂交瘤细胞的rna并进行mrna反转录获取cdna,随后以cdna为模板,分别用鼠源抗体的重链和轻链简并引物(《antibody engineering》volume 1,edited by roland kontermann and stefan d
ü
bel,组合引物的序列来自第323页)进行pcr,对所获得的pcr产物进行测序并通过kabat数据库分析,确定所获得的序列为鼠源抗体的可变区序列。
[0229]
相关序列具体信息如上表1所示,其中,
[0230]
spga01-102的重链可变区基因序列,全长均为366bp,编码122个氨基酸残基,核苷酸序列如seq id no:2所示,氨基酸序列如seq id no:3所示;
[0231]
spga01-102的轻链可变区基因序列,全长均为321bp,编码107个氨基酸残基,核苷酸序列如seq id no:4所示,氨基酸序列如seq id no:5所示;
[0232]
对所得的杂交瘤重链可变区序列与人的igg4恒定区(氨基酸序列如seq id no:6所示)拼接,形成嵌合抗体重链,spga01-ch102重链的氨基酸序列如seq id no:9所示;轻链可变区序列与人的kappa链恒定区(氨基酸序列如seq id no:7所示)拼接,形成嵌合抗体轻链,spga01-ch102轻链的氨基酸序列如seq id no:10所示;分别构建各嵌合抗体的重链和轻链至pcdna3.4表达载体,转染expi-293f细胞,通过protein a纯化获得各嵌合抗体,通过sds-page电泳及sec-hplc确定所表达各抗体分子量在150kd左右,抗体纯度》95%,定量,分装,冻存于-80℃备用。
[0233]
实施例6.嵌合抗体对人fcrn-ecd的结合活性
[0234]
本实施例通过elisa的方法测定spga01-ch102对人fcrn-ecd的亲和力。
[0235]
实验方法参照实施例2.1。
[0236]
结果如图5所示,表明spga01-ch102对人fcrn-ecd的结合亲和力,ec50为9.73ng/ml,即0.06nm。
[0237]
实施例7.嵌合抗体阻断igg fc结合fcrn活性
[0238]
本实施例通过elisa的方法测定spga01-ch102阻断igg fc结合fcrn活性。
[0239]
实验方法参照实施例4。
[0240]
结果如图6所示,spga01-ch102有很好的阻断活性,ic50为51.37ng/ml,即0.34nm。
[0241]
实施例8.制备fc突变的嵌合抗体
[0242]
spga01-102重链可变区序列(氨基酸序列如seq id no:3所示)与突变的人igg4恒定区(氨基酸序列如seq id no:8所示)拼接,形成spga01-ch102mu的重链(氨基酸序列如seq id no:11所示),轻链同spga01-ch102(氨基酸序列如seq id no:10所示);分别将其构建至pcdna3.4表达载体,转染expi-293f细胞,通过protein a纯化获得突变嵌合抗体spga01-ch102mu,通过sds-page电泳及sec-hplc确定所表达各抗体分子量在150kd左右,抗体纯度》95%,定量,分装,冻存于-80℃备用。
[0243]
实施例9.突变的嵌合抗体的结合活性及阻断活性
[0244]
通过elisa法测定实施例8制备的spga01-ch102mu对人fcrn-ecd的结合亲和力及阻断人igg与fcrn的结合的活性,相关实验方法同实施例2.1及实施例3。
[0245]
实验结果分别如图7和图8所示,突变的嵌合抗体spga01-ch102mu对人fcrn-ecd的结合亲和力的ec50为9.76ng/ml,即0.06nm。阻断igg结合fcrn的ic50为12.23ng/ml,即0.08nm,与嵌合抗体spga01-ch102相比,嵌合抗体的突变增强了阻断活性。
[0246]
实施例10.抗原结合表位的测定
[0247]
10.1.spga01-102与还原变性的fcrn结合能力的测定
[0248]
通过蛋白免疫印迹(western blot)的方法测定spga01-102与还原变性的人fcrn(β2m)的结合能力。
[0249]
将还原变性的人fcrn(β2m)进行sds-page电泳(400ng/泳道)后,通过电转移法转印至pvdf膜,于1%bsa-tbst中封闭(室温震荡1h),加入1μg/ml(1%bsa-tbst稀释)的鼠源
抗体spga01-102,室温震荡孵育2h,tbst洗3次后,加入hrp标记羊抗小鼠igg二抗(购自abcam公司,货号ab6789,按说明书以1%bsa-tbst稀释10000倍),室温震荡孵育1h后,tbst洗3次后,pvdf膜上滴加适量pierce
tm ecl western印迹底物溶液(购自thermo公司,货号32209),室温避光于生物分子成像仪(购自thermo公司,型号cl1500)上自动成像。
[0250]
结果如图9所示,在25kd至35kd的目标位置之间出现了特异的免疫印迹,说明spga01-102可以特异性结合还原变性的人fcrn(β2m),提示了抗体spga01-102特异性结合人fcrn(β2m)蛋白的表位为线性表位。
[0251]
10.2.spga01-102对靶抗原结合区域的确定
[0252]
通过常规的western blot和elisa的方法确定spga01-102对人fcrn(β2m)的结合区域。
[0253]
为确认spga01-102对fcrn的结合表位,经查阅文献及ncbi获取人fcrn的胞外域基因(fcrn-ecd)基因(ncbi登记号为np_001129491.1的24至297位氨基酸(氨基酸序列如seq id no:1所示),其中,包含了功能结构域α-1(a24-p110,氨基酸序列如seq id no:12)、功能结构域α-2(y111-k200,氨基酸序列如seq id no:13)、功能结构域α-3(p201-s290,氨基酸序列如seq id no:14)。将fcrn功能结构域α1,α2和α3与人的fc区(氨基酸序列如seq id no:15所示)拼接,分别形成α1-fc、α2-fc和α3-fc,分别构建至pcdna3.4表达载体,转染hek-293f细胞,通过protein g纯化获得各fc融合蛋白。随之,参照上述10.1所述的方法,通过常规的western blot方法测定spga01-102对人fcrn-ecd各结构域α1、α2和α3的结合情况。
[0254]
结果如图9所示,western blot检测结果均表明spga01-102只与人fcrn-ecd的第二个功能结构域,即α2结合。
[0255]
10.3.spga01-102对靶抗原结合多肽的确认
[0256]
通过elisa的方法检测spga01-102与人fcrn结构域α2区域内多肽的结合能力,进一步确认spga01-102对人fcrn结合的区域。
[0257]
由10.1和10.2的结果已经确定spga01-102可以结合变性的fcrn和fcrnα2,判断spga01-102结合的表位为线性表位,可以采用合成多肽经elisa方法检测,进一步明确spga01-102结合表位的位置。
[0258]
首先将人fcrnα2结构域分解成相互有重叠的8个部分,每个部分合成一条n端生物素修饰的多肽,即:
[0259]
1.bio-ytlqgllgcelgpdntsvpt(111-130);
[0260]
2.bio-lgpdntsvptakfalngeef(121-140);
[0261]
3.bio-akfalngeefmnfdlkqgtw(131-150);
[0262]
4.bio-mnfdlkqgtwggdwpealai(141-160);
[0263]
5.bio-ggdwpealaisqrwqqqdka(151-170);
[0264]
6.bio-sqrwqqqdkaankeltfllf(161-180);
[0265]
7.bio-ankeltfllfscphrlrehl(171-190);
[0266]
8.bio-scphrlrehlergrgnlewk(181-200)。
[0267]
elisa法测定spga01-102与上述8个多肽的结合活性,结果如图10所示,spga01-102只与多肽5结合,即人fcrn-ecd蛋白n端的第151-170位氨基酸的多肽结合,说明spga01-102的结合表位位于人fcrn蛋白的g151至a170之间。
[0268]
再通过丙氨酸扫描(将非丙氨酸的氨基酸位点分别单点突变成丙氨酸)的方式,合成了n端生物素修饰的17条多肽(151-170,下划线部分为突变的氨基酸位点),即:
[0269]
5-1:bio-agdwpealaisqrwqqqdka;
[0270]
5-2:bio-gadwpealaisqrwqqqdka;
[0271]
5-3:bio-ggawpealaisqrwqqqdka;
[0272]
5-4:bio-ggdapealaisqrwqqqdka;
[0273]
5-5:bio-ggdwaealaisqrwqqqdka;
[0274]
5-6:bio-ggdwpaalaisqrwqqqdka;
[0275]
5-7:bio-ggdwpeaaaisqrwqqqdka;
[0276]
5-8:bio-ggdwpealaasqrwqqqdka;
[0277]
5-9:bio-ggdwpealaiaqrwqqqdka;
[0278]
5-10:bio-ggdwpealaisarwqqqdka;
[0279]
5-11:bio-ggdwpealaisqawqqqdka;
[0280]
5-12:bio-ggdwpealaisqraqqqdka;
[0281]
5-13:bio-ggdwpealaisqrwaqqdka;
[0282]
5-14:bio-ggdwpealaisqrwqaqdka;
[0283]
5-15:bio-ggdwpealaisqrwqqadka;
[0284]
5-16:bio-ggdwpealaisqrwqqqaka;
[0285]
5-17:bio-ggdwpealaisqrwqqqdaa。
[0286]
结果如图11所示,spga01-102对肽5-9和5-10的结合明显减弱,对肽5-8的结合稍有减弱,而对其他多肽的结合与原始多肽(pep5)一致,说明多肽pep5中氨基酸s和氨基酸q对spga01-102结合最关键,氨基酸i次之,即人fcrn蛋白中s161和q162是单抗spga01-102结合的最关键位点,而i159是次关键位点。
[0287]
实施例11.spga01-102与食蟹猴、小鼠fcrn的交叉结合活性测定
[0288]
本实施例通过elisa的方法测定spga01-102的跨种属免疫反应性。
[0289]
将食蟹猴和小鼠的fcrn(β2m)蛋白(均购自acro公司,货号分别为fcm-c52w9和fcm-m52w8),即cyno-fcrn-ecd和m-fcrn-ecd按照0.5μg/孔包被96孔elisa板,测定spga01-102对这两个种属fcrn(β2m)的交叉反应,其它具体实验方法参照实施例2.1。
[0290]
结果如图12所示,表明spga01-102对食蟹猴的fcrn(β2m)蛋白具有良好的亲和力,ec50为47.24ng/ml,即0.31nm,稍弱于与人fcrn的结合力(14.89ng/ml),但不能与小鼠源的fcrn(β2m)蛋白结合。
[0291]
实施例12.spga01-ch102和spga01-ch102mu加速人igg在人fcrn转基因小鼠中的清除
[0292]
本实施例分别测定了spga01-ch102、spga01-ch102mu在hufcrn转基因小鼠中对人her2单抗曲妥珠(igg)代谢清除的影响。
[0293]
实验用hufcrn转基因小鼠(购自上海南方模式生物科技股份有限公司),雌性,体重18-20g。
[0294]
实验方法如下:给药前72小时,22只hufcrn转基因小鼠腹腔注射20mg/kg的人igg(曲妥珠,roche公司),在给药前4小时,取血,离心取血清elisa法检测人igg(曲妥珠)血药
浓度,根据检测的血药浓度,将hufcrn转基因小鼠分成3组,每组4只小鼠,分别为同类igg组(即人igg4对照抗体,购自bio x cell公司)、spga01-ch102组、spga01-ch102mu组。小鼠腹腔注射20mg/kg的各受试抗体或pbs,分别在给药后24h,48h,72h,96h取血,收集血清-20℃保存。
[0295]
将收集的血清样品用elisa检测人igg(曲妥珠)含量,检测方法如下:用pbs ph7.4将her2蛋白(购自北京acro systems公司,货号he2-h5225)稀释至0.5μg/ml,100μl/孔包被在96孔酶标板上,4℃过夜。pbst洗板1次,加入300μl 1%bsa-pbst封闭酶标板,37℃2h。pbst洗板3次,用曲妥珠抗体配制标准曲线:100ng/ml,50ng/ml,25ng/ml,12.5ng/ml,6.25ng/ml,3.13ng/ml,1.56ng/ml,0.78ng/ml,0.39ng/ml;血清根据不同的取血时间点用1%bsa-pbst稀释合适的倍数,将标曲、质控、稀释样品100μl/孔加入酶标板中,37℃1h。pbst洗板3次,加入羊抗人igg fc-hrp(购自abcam,货号:ab97225),100μl/孔,37℃30min。pbst洗板3次后,在吸水纸上尽量拍干残留液滴,每孔加入100μl的tmb(购自kpl公司,货号52-00-03),室温(20
±
5℃)避光放置3-5min;每孔加入50μl 2m h2so4终止液终止底物反应,酶标仪450nm处读取od值。
[0296]
根据曲妥珠标准曲线,计算各个血清样品中曲妥珠的含量,与pbs组对照比较,评价各受试抗体对小鼠清除人抗体(曲妥珠)的影响。
[0297]
结果如图13所示,与同型抗体对照组相比,给药后,spga01-ch102和spga01-ch102mu组小鼠体内目标抗体的更浓度快速下降,spga01-ch102mu的效果更明显;如图14所示,spga01-ch102和spga01-ch102mu均快速降低了实验小鼠体内目标抗体的血药浓度,以spga01-ch102mu更明显。突变的嵌合抗体体现了更强的作用。
[0298]
实施例13.spga01-ch102和spga01-ch102mu在人fcrn转基因小鼠中的代谢动力学
[0299]
本实施例测定了spga01-ch102和spga01-102mu在hufcrn转基因小鼠中代谢清除特征。
[0300]
实验用hufcrn转基因小鼠(购自上海南方模式生物科技股份有限公司),雌性,体重18-20g。
[0301]
实验方法如下:8只hufcrn转基因小鼠分2组,4只/组,分别腹腔注射10mg/kg的spga1-ch102和spga01-ch102mu,分别在给药后2h,6h,24h,48h,72h,120h和168h取血,收集血清-20℃保存。
[0302]
将收集的血清样品用elisa检测spga01-ch102和spga01-ch102mu含量,检测方法如下:用pbs ph7.4将fcrn-ecd蛋白(购自北京acro systems公司)稀释至0.5μg/ml,100μl/孔包被在96孔酶标板上,4℃过夜。pbst洗板1次,加入300μl 1%bsa-pbst封闭酶标板,37℃2h。pbst洗板3次,分别用spga01-ch102和spga01-ch102mu标准浓度:100ng/ml,50ng/ml,25ng/ml,12.5ng/ml,6.25ng/ml,3.13ng/ml,1.56ng/ml,0.78ng/ml,0.39ng/ml;血清根据不同的取血时间点用1%bsa-pbst稀释合适的倍数,将标曲、稀释血清样品100μl/孔加入酶标板中,37℃1h。pbst洗板3次,加入羊抗人igg fc-hrp(购自abcam,货号:ab97225),100μl/孔,37℃30min。pbst洗板3次后,在吸水纸上尽量拍干残留液滴,每孔加入100μl的tmb(购自kpl公司,货号52-00-03),室温(20
±
5℃)避光放置3-5min;每孔加入50μl 2m h2so4终止液终止底物反应,酶标仪450nm处读取od值。
[0303]
分别根据spga01-ch102和spga01-ch102mu标准曲线,计算各个血清样品中
spga01-ch102或spga01-ch102mu的含量,评价spga01-ch102和spga01-ch102mu在hufcrn转基因小鼠体内的代谢动力学。
[0304]
结果如图15所示,spga01-ch102mu和spga01-ch102在hufcrn转基因小鼠中的半衰期分别为45.19小时和31.15小时。根据实施例9、实施例12和实施例13的实验结果,spga01-ch102mu可以通过更强结合fcrn,延长了在实验动物体内的半衰期,从而明显较spga01-ch102加快人igg在小鼠体内的清除。
[0305]
实施例14.spga01-102的人源化
[0306]
对候选鼠源抗体spga01-102轻链可变区和重链可变区的氨基酸序列进行分析,依据kabat规则确定鼠源抗体的3个抗原互补决定区(cdr)和4个框架区(fr)。spga01-102重链互补决定区的氨基酸序列为hcdr1:gytftnhg(seq id no:16)、hcdr2:intytgep(seq id no:17)、hcdr3:areeiygnyyytmdy(seq id no:18),轻链互补决定区的氨基酸序列为lcdr1:sasqgisky(seq id no:19)、lcdr2:ytsilhs(seq id no:20)和lcdr3:qqysklppt(seq id no:21)。
[0307]
在germline数据库中选取与上述各鼠源抗体fr区匹配最好的人源化模板。然后将鼠源抗体的cdr区移植到所选择的人源化模板上,替换人源模板的cdr区,形成人源化抗体重链可变区(spga01-hu102 vh,seq id no:22),与人igg4恒定区(包含s228p突变,seq id no:6)或突变的人igg4恒定区(seq id no:8)重组,分别形成人源化单抗重链(spga01-hu102 h,seq id no:23)和突变的人源化单抗重链(spga01-hu102mu h,seq id no:24);人源化抗体轻链可变区(spga01-hu102 vl,seq id no:25)与人的kappa链恒定区重组形成人源化轻链(spga01-hu102 l,seq id no:26)。分别构建人源化抗体的重链和轻链至pcdna3.4表达载体,spga01-hu102 h与spga01-hu102l配对,spga01-hu102mu h与spga01-hu102 l配对,与分别转染expi-293f细胞,通过proteina纯化获得人源化抗体spga01-hu102和spga01-hu102mu,并通过sds-page电泳及sec-hplc确定各抗体分子量大小正确及纯度》95%。
[0308]
实施例15.人源化抗体spga01-hu102结合和阻断fcrn-ecd
[0309]
方法同实施例2.1和实施例3。
[0310]
结果分别如图16和图17所示,人源化抗体spga01-hu102对人fcrn-ecd的结合亲和力的ec50为10.04ng/ml,即0.07nm。阻断igg结合fcrn的ic50为44.68ng/ml,即0.30nm。
[0311]
实施例16.突变的人源化抗体spga01-hu102mu结合和阻断fcrn-ecd
[0312]
方法同实施例2.1和实施例3。
[0313]
结果分别如图18和图19所示,突变的人源化抗体spga01-hu102mu对人fcrn-ecd的结合亲和力的ec50为9.5ng/ml,即0.06nm。阻断igg结合fcrn的ic50为10.95ng/ml,即0.07nm。
[0314]
实施例17.spga01hu102和spga01-hu102mu加速hufcrn转基因小鼠体内人igg的清除
[0315]
方法同实施例12。
[0316]
结果如图20和图21所示,与同型抗体对照组相比,给药后,spga01-ch102和spga01-ch102mu组小鼠体内目标抗体浓度均快速下降效果更明显。spga01-ch102mu组目标抗体的血药浓度,在给药后48小时起,相比同型抗体组,均非常显著降低(p=0.0006);
spga01-ch102组目标抗体的血药浓度,在给药后96小时起,相比同型抗体组,也显著降低(p=0.02);spga01-ch102mu与spga01-ch102相比,在48小时后,目标抗体浓度开始非常显著降低(p=0.0005),说明spga01-ch102mu的效果更明显。
[0317]
实施例18.spga01hu102和spga01-hu102mu在hufcrn转基因小鼠体内的代谢
[0318]
方法同实施例13。
[0319]
结果如图22和图23所示,spga01-ch102mu在hufcrn转基因小鼠中的血药浓度较spga01-hu102下降更慢,给以相同剂量的抗体,在给药后24小时,两组血药浓度无显著差别(p=0.9275)开始,但从给药后48小时开始,spga01-ch102mu组的血药浓度显著高于spga01-hu102组(p=0.0134)说明spga01-ch102mu可以通过更强结合fcrn,获得在体内更好的稳定性,从而实现更强的药效。
[0320]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1