一种共培养巨噬细胞和肝癌细胞的体系和方法
1.本发明涉及细胞培养技术领域,尤其涉及一种共培养巨噬细胞和肝癌细胞的体系和方法。
背景技术:
2.原发性肝癌是世界上第5位最常见的恶性肿瘤,预后差,病死率高,为第二常见的引起肿瘤相关性死亡的原因。基于中国肿瘤登记中心数据库72个登记点(2009~2011年)数据显示:我国60岁以下男性中,肝癌是最常见和死亡率最高的恶性肿瘤。在我国,导致肝癌发生的主要原因是乙型肝炎病毒(hbv)、丙型肝炎病毒(hcv)的感染,慢性酒精性肝炎等。由于慢性炎症导致了不可逆转的肝组织损伤,并最终导致了肝癌的发生。肝癌具有早期诊断率低、恶性程度高、易转移、常常合并肝硬化等特点,早期肝癌患者可以采取手术切除、肝移植、局部物理治疗等治疗方法,而对于晚期肝癌患者和术后复发的患者来说,系统治疗只能使有限的患者受益,术后5年复发率高达70%。当前以手术切除为主的临床治疗手段反应差,因而致残、致死率高。为改变当前肝癌的预后,深入研究肝癌分子发病机制,探索新的有效治疗方法,从而对使更多进展期肝癌患者和术后复发患者获益具有重要的意义。
3.肝癌是经典的炎症相关性癌症,肝癌预后较差的原因是因为其极易侵袭、转移。随着研究的不断深入,学者发现存在于肿瘤微环境中的巨噬细胞在肝癌的发生、发展中起了重要作用,巨噬细胞参与上皮间质转化、促进血管生成参与肿瘤细胞的侵袭和转移。肿瘤相关巨噬细胞是肝癌微环境中主要的炎症细胞,大量研究表明:肿瘤间质中的巨噬细胞在肿瘤的发生和演变过程中起重要作用。近年来随着人们对肿瘤研究的不断深入,发现肿瘤细胞并非肿瘤组织中的唯一成分,其形成与演变不仅与肿瘤细胞本身相关,还与微环境有关。肿瘤微环境在肿瘤的演变过程中起重要作用,是决定肿瘤细胞行为的关键因素。巨噬细胞是肿瘤免疫微环境中的主要组成。有研究指出肿瘤间质中的巨噬细胞能够通过分泌一些特殊的细胞因子,促进肿瘤细胞的增殖和转移能力,诱导肿瘤新生血管和淋巴管生成,抑制机体免疫反应,进而促进肿瘤复发和转移。
4.有研究证实,肝癌细胞对肿瘤相关巨噬细胞具有非常活跃的招募功能,并且能使m1细胞向m2细胞转换。有病理结果研究显示,肿瘤相关巨噬细胞的密度越高,患者的预后越差。巨噬细胞是一种高度可塑的细胞,可以被极化以获得一系列功能性表型。为了应对微环境中的刺激,巨噬细胞可以在表型上极化为两个主要细胞群:m1型巨噬细胞主要表现为杀伤肿瘤,促进炎性反应的活性;而m2型巨噬细胞主要表现为抗炎症,促进肿瘤的活性。而肿瘤周围的肿瘤相关巨噬细胞往往表现为m2型。肿瘤细胞都能以某种方式促进m2型巨噬细胞的极化,从而促进肿瘤的发生、发展。有研究证明,在肿瘤细胞的背景下,肿瘤微环境中的肿瘤相关巨噬细胞通常促进癌细胞增殖、免疫抑制和血管生成,以支持肿瘤的生长和转移。在促进肿瘤增殖、侵袭和转移方面,巨噬细胞(主要是m2型巨噬细胞)都发挥着巨大的作用。
5.肝癌细胞或肝癌起始细胞发出信号吸引外周血中的单核细胞围绕自身进行聚集,此时单核细胞就转变为肿瘤相关巨噬细胞。肝癌细胞通过各种机制诱导肿瘤相关巨噬细胞
向着促瘤的m2型巨噬细胞极化。被诱导了的巨噬细胞又通过分泌细胞因子或者表面分子相互作用等机制促进肿瘤细胞的增殖、侵袭和转移。这在肝肿瘤细胞与巨噬细胞之间形成了一个正反馈环,共同促进肿瘤的发生、生长和转移。在病毒性肝炎免疫耐受期时,病毒和免疫系统达到一种病理下平衡;而当免疫激活时,肝内巨噬细胞和t细胞清除被病毒感染的肝细胞发生肝炎;慢性、持续性炎症的发展,激活肝脏内在免疫反应,释放多种细胞因子包括:肿瘤坏死因子α、白介素6、白介素10等;驻留肝内的巨噬细胞(kupffer细胞)和招募而来的巨噬细胞,在炎症微环境下,出现m1/m2型转化,向m2型巨噬细胞分化,部分m2型巨噬细胞转变为肿瘤相关巨噬细胞;同时损伤肝内卵圆细胞增殖,而增殖的卵圆细胞在分化成熟的过程中,细胞周围微环境决定了它的命运;不良微环境,如th1型细胞因子减少,th2型细胞因子为主,以及富含肿瘤相关巨噬细胞的微环境,和/或内源性调控机制异常,可能使成熟前、各阶段的卵圆细胞内原癌基因活化、抑癌基因失活,激活细胞增殖信号通路,如wnt/β-catenin通路异常活化,进而启动肝癌发生。
6.总之,巨噬细胞在肝癌发生发展过程中起着至关重要的作用。因此,将巨噬细胞和肝癌细胞共培养,对于研究巨噬细胞活化的异常炎症环境与肝癌之间的关系,以及明确“炎-癌”过程中细胞微环境状况等均具有十分重要的意义。
技术实现要素:
7.本发明针对现有技术的不足,提供了一种共培养巨噬细胞和肝癌细胞的体系和方法。
8.为实现上述目的,本发明采用以下技术方案:
9.第一方面,本发明提供了一种共培养巨噬细胞和肝癌细胞的体系,包括胎牛血清、ham's f-12k基础培养基和dmem高糖培养基。
10.进一步地,上述体系包括含20%胎牛血清的ham's f-12k基础培养基和含10%胎牛血清的dmem高糖培养基。
11.进一步地,上述含20%胎牛血清的ham's f-12k基础培养基和含10%胎牛血清的dmem高糖培养基的体积比为1:8~1:1,优选为1:1。
12.进一步地,上述巨噬细胞为nr8383细胞;上述肝癌细胞为rh35细胞。
13.第二方面,本发明提供上述体系的构建方法,包括如下步骤:
14.步骤一,将上述20%胎牛血清的ham's f-12k基础培养基和含10%胎牛血清的dmem高糖培养基按照不同的体积比进行混合配制共培养体系,接种巨噬细胞或肝癌细胞;
15.步骤二,培养24小时后采用mtt法、钙黄绿素染色、细胞凋亡流式检测测定细胞的活力、死亡率或凋亡率,比较各个体积比下共培养体系中的巨噬细胞或肝癌细胞的活力、死亡率或凋亡率,选择最佳的体积比。
16.进一步地,步骤一中接种的巨噬细胞或肝癌细胞处于对数生长期。
17.进一步地,上述构建方法还包括设置对照组和空白组;相对于肝癌细胞,该对照组为含10%胎牛血清的dmem高糖培养基中接种的肝癌细胞组,空白组为不含细胞的dmem高糖培养基组;针对巨噬细胞,该对照组为20%胎牛血清的ham's f-12k基础培养基中接种的巨噬细胞组,空白组为不含细胞的ham's f-12k基础培养基组。
18.进一步地,步骤二中采用的mtt浓度为0.5%。
19.第三方面,本发明提供了一种共培养巨噬细胞和肝癌细胞的方法,包括将巨噬细胞和肝癌细胞同时接种于上述体系进行培养。
20.进一步地,上述巨噬细胞为nr8383细胞;上述肝癌细胞为rh35细胞。
21.进一步地,共培养的条件为37℃,5%co2的细胞培养箱。
22.本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
23.本发明提供的共培养巨噬细胞和肝癌细胞的体系和方法将含20%胎牛血清的ham's f-12k基础培养基和含10%胎牛血清的dmem高糖培养基按照1:1的比例进行混合,可将这两种细胞的活力达到最大值,操作简单,成本较低,为研究巨噬细胞活化的异常炎症环境与wnt/βcatenin通路之间关系以及明确“炎-癌”过程卵圆细胞癌变机制和细胞微环境状况提供了方便而高效的条件。
附图说明
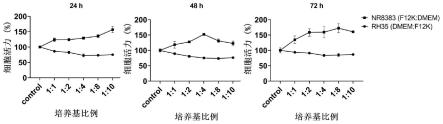
24.图1是本发明一实施例中巨噬细胞和肝癌细胞在共培养体系中培养后的活力曲线对照图;
25.图2是混合不同比例两种细胞培养基培养24h后nr8383细胞的活死细胞染色图片;
26.图3是混合不同比例两种细胞培养基培养24h后rh35细胞的活死细胞染色图片;
27.图4是混合不同比例两种细胞培养基培养24h后nr8383细胞凋亡的流式检测图;
28.图5:混合不同比例两种细胞培养基培养24h后rh35细胞凋亡的流式检测图。
具体实施方式
29.本发明为了便于研究巨噬细胞活化的异常炎症环境与wnt/βcatenin通路之间关系,以及明确“炎-癌”过程卵圆细胞癌变机制和细胞微环境状况等,提供了一种共培养巨噬细胞和肝癌细胞的体系和方法。本发明采用mtt比色法检测在各种培养条件下两种细胞的细胞活性,从而确定最佳培养条件。检测原理:mtt比色法是一种检测细胞存活和增殖的方法,所用的显色剂是一种能接受氢原子的淡黄色化合物染料mtt,即3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四氮唑噻唑蓝。原理是活细胞内线粒体中的琥珀酸脱氢酶能将外源性mtt还原为水不溶性的蓝紫色的结晶formazan(甲臜),并沉积在细胞中,而死细胞则无此功能。formazan的产量与活细胞数成正相关。formazan可用二甲基亚砜(dmso)溶解,在酶标仪上以波长490nm或570nm处进行比色。所检测的od值的大小可反应细胞代谢活性的强弱。
30.具体地,该体系包括胎牛血清、ham's f-12k基础培养基和dmem高糖培养基。
31.在本发明一优选的实施方式中,上述体系包括含20%胎牛血清的ham'sf-12k基础培养基和含10%胎牛血清的dmem高糖培养基。
32.在本发明一优选的实施方式中,上述含20%胎牛血清的ham's f-12k基础培养基和含10%胎牛血清的dmem高糖培养基的体积比为1:8~1:1,优选为1:1。
33.在本发明一优选的实施方式中,上述巨噬细胞为nr8383细胞;上述肝癌细胞为rh35细胞。
34.此外,本发明提供的一种共培养巨噬细胞和肝癌细胞的方法,包括将巨噬细胞和肝癌细胞同时接种于上述体系进行培养。
35.在本发明一优选的实施方式中,上述巨噬细胞为nr8383细胞;上述肝癌细胞为
rh35细胞。
36.在本发明一优选的实施方式中,共培养的条件为37℃,5%co2的细胞培养箱。
37.下面通过具体实施例对本发明进行详细和具体的介绍,以使更好的理解本发明,但是下述实施例并不限制本发明范围。
38.实施例中方法如无特殊说明的采用常规方法,使用的试剂如无特殊说明的使用常规市售试剂或按常规方法配制的试剂。
39.实施例1
40.本实施例,针对nr8383细胞和rh35细胞,构建这两种细胞共培养的体系;其中nr8383是大鼠肺泡巨噬细胞,属于半贴壁细胞;rh35是大鼠肝癌细胞,属于贴壁细胞。具体的构建过程以及结果如下:
41.①
将ham's f-12k基础培养基(含20%胎牛血清)和dmem高糖培养基(含10%胎牛血清)分别按体积比1:1,2:1,4:1,8:1,10:1混匀。收集处于对数生长期的rh-35细胞,计数后对细胞浓度进行调整,按照10000个/孔/200μl的量分别用上述比例的混合培养基接种于96孔板。每个比例设置6个复孔。同时也设置对照组和空白组。对照组为dmem高糖培养基接种的rh-35细胞组,空白组为不含细胞的dmem高糖培养基组。每组均设置6个复孔。
42.②
将ham's f-12k基础培养基(含20%胎牛血清)和dmem高糖培养基(含10%胎牛血清)分别按体积比1:1,1:2,1:4,1:8,1:10混匀。收集处于对数生长期的nr8383细胞,计数后对细胞浓度进行调整,按照20000个/孔/200μl的量分别用上述比例的混合培养基接种于96孔板。每个比例设置6个复孔。同时也设置对照组和空白组。对照组为ham's f-12k基础培养基接种的nr8383细胞组,空白组为不含细胞的ham's f-12k基础培养基组。每组均设置6个复孔。
43.接下来对上述条件下培养的细胞进行性能验证:
44.1.mtt法
45.步骤一,96孔板最外圈边缘孔用无菌pbs填充。然后将96孔板置于37℃,5%co2的细胞培养箱中培养24小时。24小时后每孔加入20μl的mtt(浓度为5mg/ml,即0.5%mtt),继续将96孔板置于37℃,5%co2的细胞培养箱中培养4小时。
46.步骤二,反应4小时后,用一次性注射器小心沿孔壁吸去孔内培养液,避免吸掉孔底结晶。然后每孔加入150μl二甲基亚砜,置摇床上室温低速振荡10min,使结晶物充分溶解。用全波长酶标仪于490nm波长处检测吸光度值,实验重复3次。
47.步骤三,计算细胞活力;细胞活力(%)=(实验组平均od值-空白组平均od值)/(对照组平均od值-空白组平均od值)
×
100%。
48.由图1可知,当ham's f-12k基础培养基和dmem高糖培养基两种培养基体积混合比例为1:1时,nr8383和rh-35两种细胞的活力均为最大值。
49.2.钙黄绿素染色
50.步骤一,对于贴壁细胞rh35,先用胰酶-edta消化细胞,离心收集细胞(1000rpm,3min)。对于悬浮细胞nr8383,直接离心收集细胞。
51.步骤二,去上清,用pbs(或者其他缓冲液)充分清洗细胞2~3次,以充分去除残留的酯酶活性。
52.步骤三,用1/10细胞培养基体积的calcein、am染色工作液(5μm)重悬细胞,37℃培
养细胞15~30min。
53.步骤四,用pbs(或者其他缓冲液)洗涤细胞两次去除多余的染料。用含490nm激发波长,515nm发射波长的滤光片的荧光显微镜观察细胞。
54.如图2所示,nr8383和r35培养基比例在1:1和1:2时,培养24h后,nr8383细胞死亡率最低,接近正常培养条件下的细胞状态。如图3所示,在r35和nr8383培养基比例为1:1时,培养24h后,r35细胞死亡率最低,接近正常培养条件下的细胞状态。
55.3.细胞凋亡流式检测(采用annexinv-fitc/pi凋亡检测试剂盒(货号:fxp018-050))
56.步骤一,对于贴壁细胞rh35,收集细胞培养液至离心管中,用无edta的胰酶消化细胞,再用上一步收集的细胞培养液中和,离心。对于悬浮细胞nr8383,直接离心收集细胞。
57.步骤二,去上清,用pbs重悬细胞并清洗1-2次,离心去上清。
58.步骤三,每管加入100μl稀释好的annexinv-fitc结合液,混匀。
59.步骤四,fitc单染组和实验组,每管加入5μlannexinv-fitc,混匀,避光孵育5min。
60.步骤五,pi单染组和实验组,每管加入10μlpi,混匀。
61.步骤六,300-500μlpbs重悬,上机检测。
62.如图4所示,nr8383和r35培养基比例在1:1和1:8时,培养24h后,nr8383细胞凋亡率分别为10.19%和10.12%,最接近正常培养条件下的细胞凋亡率(10.09%)。如图5所示,在r35和nr8383培养基比例为1:1时,培养24h后,r35细胞凋亡率为1.48%,最接近正常培养条件下的细胞细胞凋亡率(1.46%)。
63.综上,当r35和nr8383培养基比例为1:1时,两种细胞的活力、死亡率、凋亡率都与正常培养条件下的细胞状态最为接近,故选择两种培养基体积比为1:1时的共培养体系最佳。
64.以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1