一种用于中药肝毒性评价的基于微流控体系的精密肝切片培养模型
1.本发明涉及生物技术领域,特别是涉及一种用于中药肝毒性评价的基于微流控体系的精密肝切片培养模型。
背景技术:
2.肝脏是药物在体内代谢的最主要场所,药物在此进行聚合、氧化、还原、羟化以及去甲基化等一系列的代谢过程。从而,在全身诸多脏器发挥效应,因而肝脏也成为最容易遭受药物损害的靶器官。美国fda公布数据显示,肝毒性研究处于所有药物不良反应的首位。文献研究显示,中草药所致肝损害占临床报道的药物性肝损伤病例30%以上,其病理损伤类型主要有肝细胞变性、坏死、胆汁淤积和肝血管病变等。由于肝脏是体内进行生物转化的重要场所,因而无论是哪种病变,都会给机体带来巨大影响,若病程持续则可危害生命。
3.对于临床医师来说,直接诊断药物性肝病是很困难的,这种诊断只能在肝损害发生后。因此,充分的临床前药物毒性研究,是减少药物性肝损伤发生的最有效途径。目前用于研究中药对肝脏损伤作用机制、药物代谢及作用物质基础的技术手段大部分仍停留在动物的体内研究和体外细胞培养这两种方式。体内研究能够全面反应药物在整体环境下对机体的毒性反应,但方法敏感性差,较难实现肝脏毒性的早期预警和快速检测;体外研究具有周期短,节约动物,可控性强,能够实现高通量筛选等优点。目前应用于中药研究最多的体外技术手段当推肝细胞体外培养技术,然而体外肝细胞不能完全保持肝脏的组织特异性功能,药物代谢酶谱表达不完全,而且随着培养时间的延长,细胞的基因型和表现型容易发生偏离。且随着科学技术手段的发展,一些传统意义上“无毒”的中药逐渐发现具有潜在和实际的肝毒性,如何首乌、麦冬、苍术、甘草、柴胡等等,面对日益彰显的中药不良反应问题,常规方法不能解决问题,亟需建立一些更为高效、敏感的中药临床前安全性评价方法与技术体系来研究中药的肝毒性问题。
4.微流控芯片技术(microfluidics)也被称为芯片实验室(lab-on-a-chip,loc),其研究领域涉及物理、化学、医学、流体、电子、材料、机械等多学科。通过微通道、反应室和其他某些功能部件的有效集合,并通过与一体化检测平台的有效结合,可以实现个性化检测,具有液体流动可控、集成化、消耗低、通量高、分析快等优点,已经被广泛应用于生物医学领域。基于微流控芯片技术的人体器官芯片(human organs-on-chips)近几年来发展迅速,已经实现肺、肾、肠、肝、心脏、血管、皮肤、大脑、骨骼、乳腺、脾脏、血脑屏障、气血屏障等芯片的构建,可体外模拟多种活体细胞、组织器官微环境,反映人体组织器官的主要结构和功能特征。
5.目前,国内外还没有用于专门进行中药肝毒性检测的基于微流控体系的精密肝切片培养模型的研究报道。
技术实现要素:
6.本发明的目的是提供一种用于中药肝毒性评价的基于微流控体系的精密肝切片培养模型,以解决上述现有技术存在的问题,本发明将精密肝切片培养于微流控体系之中,建立基于微流控培养的精密肝切片模型,并检测具有肝毒性的中药提取物对肝损伤标记物和细胞形态学的影响,同时与培养于微流控体系的单一细胞和非微流控体系的精密肝切片做对比,以明确本发明建立的培养模型的敏感性和准确性。
7.为实现上述目的,本发明提供了如下方案:
8.本发明提供一种用于中药肝毒性评价的基于微流控体系的精密肝切片培养模型,所述模型的构建方法包括以下步骤:
9.(1)微流控体系的安装
10.所述微流控体系的芯片为五层四通道结构:第一层为pc材质的芯片培养小室,第二层为细胞培养室底部pet膜的上面,所述第一次和第二层构成整个芯片的上层,用于精密肝切片的培养;第三层为所述pet膜的底面,用于huvecs细胞的培养,第四层为pc材质的芯片流道板,所述流道板上层为所述芯片培养小室的基座,下层包含豆荚状流道,为培养液的流动层,所述第三层和第四层构成整个芯片的中层;第五层为pmma材质薄膜,构成了整个芯片的下层;将所述芯片流道板与所述pmma薄膜进行紧密封接,整个芯片的上层和中层之间不进行封接,直接进行各个部件组装后,通过灌流管路系统连接微量蠕动泵及控制器,从而构成一个芯片结构;
11.(2)微流控培养
12.所述pet膜的底面经黏附蛋白预处理后,接种huvecs细胞,12h后,在所述pet膜的上面接种精密肝切片,开启微量蠕动泵,培养12h后,以不同浓度的中药提取物为循环液进行灌流,同时所述芯片培养小室内加入含有所述中药提取物的培养液,继续培养24h后,取培养液上清对肝损伤标记物进行检测,并对培养后的肝切片进行形态学观察。
13.进一步地,在步骤(2)中,所述黏附蛋白的预处理时间为3h。
14.进一步地,在步骤(2)中,所述微量蠕动泵的流速为251μl/min。
15.进一步地,在步骤(2)中,所述huvecs细胞的接种密度为5
×
105个/ml。
16.进一步地,在步骤(2)中,所述精密肝切片的制备方法包括:在无菌条件下取出肝脏,置于预先以氧饱和的dmem培养液中,持续通氧,于肝右叶中间部位切取一块肝组织,之后用琼脂糖包埋,最后切片,得到所述精密肝切片。
17.进一步地,所述精密肝切片的厚度为300μm。
18.进一步地,在步骤(2)中,所述肝损伤标记物包括alt、ldh、ggt、tg、tbil和tba。
19.进一步地,在步骤(2)中,所述形态学观察包括精密肝切片和huvecs细胞的he染色。
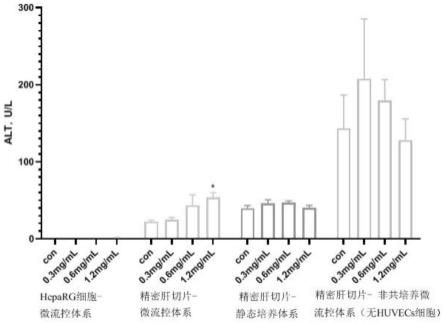
20.本发明公开了以下技术效果:
21.本发明针对中药肝毒性评价中的问题,利用微流控技术建立精密肝切片培养体系,并将之应用于中药的肝毒性评价。该系统的突出特点在于肝芯片中使用3d培养的精密肝切片,精密肝切片技术是一种介于器官与细胞水平之间、融体内外检测技术为一体的先进技术方法,相较于单一细胞或几种细胞的共培养体系,它的优点是保存了肝脏的组织结构,一个肝切片包含了肝组织内所有类型的细胞,并保存了完好的细胞基质和细胞间的结
构,其代谢能力接近整体器官。
附图说明
22.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
23.图1为肝器官微流控芯片结构图;
24.图2为不同培养体系下雷公藤提取物对培养上清中alt含量的影响;
25.图3为不同培养体系下雷公藤提取物对培养上清中ldh含量的影响;
26.图4为不同培养体系下雷公藤提取物对培养上清中ggt含量的影响;
27.图5为不同培养体系下雷公藤提取物对培养上清中tg含量的影响;
28.图6为不同培养体系下雷公藤提取物对培养上清中tbil含量的影响;
29.图7为不同培养体系下雷公藤提取物对培养上清中tba含量的影响;
30.图8为dmso对照组(微流控培养体系)组织病理检查照片,肝he
×
200,肝组织结构未见显著异常;
31.图9为0.3mg/ml剂量组(微流控培养体系)组织病理检查照片,肝he
×
200,局灶性肝细胞轻微肿胀;
32.图10为0.6mg/ml剂量组(微流控培养体系)组织病理检查照片,肝he
×
200,弥漫性肝细胞核嗜碱性减弱,核质分界不清晰,局灶性肝细胞肿胀;
33.图11为1.2mg/ml剂量组(微流控培养体系)组织病理检查照片,肝he
×
200,弥漫性肝细胞核溶解、消失,肝细胞索结构松散,肝细胞肿胀;
34.图12为dmso对照组(静态培养体系)组织病理检查照片,肝he
×
200,肝组织结构未见显著异常;
35.图13为0.3mg/ml剂量组(静态培养体系)组织病理检查照片,肝he
×
200,局灶性肝细胞核溶解、消失,肝细胞肿胀;
36.图14为0.6mg/ml剂量组(静态培养体系)组织病理检查照片,肝he
×
200,偶见肝细胞轻微肿胀;
37.图15为1.2mg/ml剂量组(静态培养体系)组织病理检查照片,肝he
×
200,局灶性肝细胞轻微肿胀;
38.图16为dmso对照组(精密肝切片微流控培养体系)huvecs细胞he
×
200,huvecs细胞未见显著异常;
39.图17为0.3mg/ml组(精密肝切片微流控培养体系)huvecs细胞he
×
200,huvecs细胞未见显著异常;
40.图18为0.6mg/ml组(精密肝切片微流控培养体系)huvecs细胞he
×
200,huvecs细胞未见显著异常;
41.图19为1.2mg/ml组(精密肝切片微流控培养体系)huvecs细胞he
×
200,huvecs细胞未见显著异常;
42.图20为dmso对照组(微流控培养体系)heparg细胞he
×
200,heparg细胞未见显著
异常;
43.图21为0.3mg/ml组(微流控培养体系)heparg细胞he
×
200,heparg细胞未见显著异常;
44.图22为0.6mg/ml组(微流控培养体系)heparg细胞he
×
200,heparg细胞未见显著异常;
45.图23为1.2mg/ml组(微流控培养体系)heparg细胞he
×
200,部分细胞形态不规则,细胞核染色质边移或碎裂;
46.图24为dmso对照组(heparg微流控培养体系)huvecs细胞he
×
200,huvecs细胞未见显著异常;
47.图25为0.3mg/ml组(heparg微流控培养体系)huvecs细胞he
×
200,huvecs细胞未见显著异常;
48.图26为0.6mg/ml组(heparg微流控培养体系)huvecs细胞he
×
200,huvecs细胞未见显著异常;
49.图27为1.2mg/ml组(heparg微流控培养体系)huvecs细胞he
×
200,huvecs细胞未见显著异常;
50.图28为dmso对照组(精密肝切片非共培养微流控培养体系):肝he
×
200,肝组织结构未见显著异常;
51.图29为0.3mg/ml组(精密肝切片非共培养微流控培养体系):肝he
×
200,肝组织结构未见显著异常;
52.图30为0.6mg/ml组(精密肝切片非共培养微流控培养体系):肝he
×
200,肝组织结构未见显著异常;
53.图31为1.2mg/ml组(精密肝切片非共培养微流控培养体系):肝he
×
200,肝组织结构未见显著异常。
具体实施方式
54.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
55.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值,以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
56.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
57.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实
施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
58.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
59.本实施例中采用的人肝原代细胞系的终末分化肝细胞(heparg细胞),人脐静脉内皮细胞(huvecs细胞),均购自商城北纳创联生物科技有限公司。
60.本实施例中采用的大鼠精密肝切片,由新鲜大鼠肝脏制备而成(制备方法见下),sd大鼠购自北京维通利华实验动物技术有限公司,许可证编号:scxk(京)2021-0011。
61.本实施例中采用的微流控体系(mimicup kit),包括:芯片流道板(型号:hze-plate-01)、芯片培养小室(型号:hze-well-01)、灌流管路系统(型号:hze-glxt-01)、微量蠕动泵+控制器(型号:hze-bmz-01),均购自上海微新技术研发中心有限公司。
62.本实施例中使用的受试物,为卫矛科植物雷公藤(triptergium wilfordii hook.f.)饮片粉末的醇提物(tw,制备方法见下)。雷公藤饮片粉末,购自安国市昌达中药饮片有限公司,批号:2105001,生产日期:20210506,产地:湖南,药品生产许可证号:翼20150041。
63.实施例1
64.1.雷公藤醇提物的制备
65.精密称取雷公藤粉末100.00g,放置到烧杯,加入1000ml 95%乙醇,盖上保鲜膜,放置过夜(约16h),超声处理45min,放冷至室温,过滤,滤渣用500ml体积分数为95%的乙醇润洗2遍,合并滤液,用旋转蒸发仪减压回收至无醇味,放置在冰箱中冷藏,用冷冻干燥机冻干成粉。得药物粉末5.01g(转移出4.73g)药物得率为5.01%。
66.2.大鼠精密肝切片的制备
67.将大鼠断头处死。在无菌条件下取出肝脏,置于预先以氧饱和的dmem培养液中,持续通氧(95%o2,5%co2)。于肝右叶中间部位切取一块约20
×
15
×
4mm3的肝组织。将肝组织块置于6孔板中,用2wt%琼脂糖包埋。用生物胶将包埋的肝组织块固定于震荡切片机的切片台上,将切片台置于含hk缓冲液的切片机标本槽中。调整刀片角度18
°
左右,将刀的前进速度调至最低,振幅调至最大,切片厚度300μm进行肝切片,并用循环泵将缓冲液温度保持在2-4℃。选取完整的肝切片,用6mm打孔器打成大小一致的圆形肝片,用于培养。
68.3.微流控体系的安装
69.芯片为五层四通道结构。第一层为pc材质的芯片培养小室,第二层为细胞培养室底部pet膜的上面,上述两层构成整个芯片的上层,用于heparg细胞/大鼠精密肝切片的培养;第三层为细胞培养室pet膜的底面,用于huvecs的培养,第四层为pc材质的芯片流道板,该流道板上层为芯片培养小室的基座,下层包含豆荚状流道,为培养液的流动层,上述三、四层构成整个芯片的中层;第五层为pmma材质薄膜,构成了整个芯片的下层。将芯片流道板与pmma薄膜进行紧密封接,上、中层之间不进行封接,直接进行各个部件的组装后,通过灌流管路系统连接微量蠕动泵及控制器,从而构成一个芯片结构。如图1所示。
70.4.对heparg、huvecs细胞增殖作用的影响
71.heparg、huvecs细胞以1
×
105/ml的密度分别接种于96孔板,100μl/孔,37℃,5%co2培养箱中培养24h后加药。雷公藤醇提物用dmso助溶,终质量浓度为25.000、12.500、6.250、3.125、1.563、0.781、0.390mg生药/ml,dmso终浓度为0.5wt%,同时设定培养液对照
组(dmem)和0.5wt%dmso对照组。药物干预24h后,吸弃上清液,每孔加入cck-8溶液100μl,37℃培养30min后,450nm处测定吸光度(a),计算药物对细胞的抑制率(%),计算ic
50
,选择对heparg细胞无明显抑制及具有明显抑制的不同质量浓度(包括5%抑制浓度至90%抑制浓度)进行下述毒性检测。
72.实验结果表明,雷公藤提取物在0.390mg生药/ml浓度对heparg细胞生长无明显抑制作用,0.781mg生药/ml及以上浓度则明显抑制heparg细胞的生长,对heparg细胞的半数抑制浓度(ic
50
)为0.993mg生药/ml;在0.781mg生药/ml及以下浓度对huvecs细胞生长无明显抑制作用,1.563mg生药/ml及以上浓度则明显抑制heparg细胞的生长,对huvecs细胞的半数抑制浓度为14.210mg生药/ml。根据以上试验结果并考虑到药物配制的方便,雷公藤醇提物选择1.2、0.6、0.3mg生药/ml剂量进行下一步试验。
73.5.基于微流控肝芯片的雷公藤醇提物的肝脏毒性研究
74.5.1微流控培养
75.pet膜底面以10μg/ml的黏附蛋白100μl预处理3h后,pbs冲洗底面,5
×
105个/ml的密度接种huvecs细胞,接种体积100μl/孔,12h后,翻转压紧于已预先压有底膜的芯片流道板,pet膜上层面5
×
105个/ml,接种体积100μl/孔的密度接种heparg细胞或者如上所述方法制备的直径6mm大小的精密肝切片,连接灌流管路系统,调整微量蠕动泵流速在251μl/min,打开控制器,37℃,5%co2的培养箱培养12h后,以1.2、0.6、0.3mg生药/ml的雷公藤醇提物为循环液进行灌流,同时芯片培养小室内加入上述浓度的雷公藤醇提物的含0.5wt%dmso的dmem培养液150μl,对照组的循环液和皿内液均为含0.5wt%dmso的dmem培养液,继续在37℃,5%co2的培养箱中培养24h后,取培养上清用全自动生化分析仪对肝损伤标记物,包括谷丙转氨酶(alt)、乳酸脱氢酶(ldh)、谷氨酰转肽酶(ggt)、甘油三酯(tg)、总胆红素(tbil)、胆汁酸(tba),进行检测。取培养后的肝切片迅速置于4%甲醛溶液中固定7d后,进行脱水、透明、包埋,常规制备3μm厚石蜡切片,he染色,光学显微镜检查。
76.5.2静态精密肝切片培养
77.按“2.大鼠精密肝切片的制备”的方法制备肝切片,将直径6mm大小的精密肝切片置于6孔板中,设0.5%wtdmso对照组,雷公藤醇提物1.2、0.6、0.3mg生药/ml组(终浓度),分别与肝切片共培养,切片厚度300μm,dmem培养液,ph值6.8,37℃,5%co2培养箱中培养24h后,按上述5.1中所述方法测定培养上清的肝损伤标记物,对肝切片进行形态学观察。
78.5.3非共培养体系的微流控精密肝切片培养
79.pet膜底面不以黏附蛋白处理,并且不接种huvecs细胞。连接微流控灌流管路系统后,将直径6mm大小的精密肝切片置于pet膜上面,按5.1所述方法进行培养、分组和检测。
80.不同培养体系下雷公藤提取物对培养上清中alt、ldh、ggt含量的影响见表1,不同培养体系下雷公藤提取物对培养上清中tg、tbil、tba含量的影响见表2,相应的柱形对比图见图2-7。
81.试验结果表明,雷公藤提取物0.3-1.2mg生药/ml剂量对共培养体系中的huvecs细胞均未见明显影响,说明共培养体系良好(见图16-19,图24-27)。雷公藤提取物0.3mg生药/ml以上剂量,在微流控的动态体系和静态体系下,均会对培养的精密肝切片造成不同程度的损伤,光镜形态学观察显示肝细胞不同程度肿胀,弥漫性肝细胞核溶解、消失,肝细胞索结构松散。但在微流控动态精密肝切片培养体系下,形态学的改变呈现出一定的剂量相关
性(见图8-15)。雷公藤提取物1.2mg生药/ml剂量对微流控体系下培养的单一heparg细胞能造成明显损伤,镜下观察可见部分heparg细胞形态不规则,细胞核染色质边移或细胞核碎裂,但对低、中剂量下的heparg细胞无明显影响(见图20-23)。0.3-1.2mg生药/ml剂量对非共培养体系中的精密肝切片均未见明显影响(见图28-31)。说明在同等剂量下,微流控体系培养的精密肝切片相对单一细胞、静态精密肝切片培养体系和非共培养(无huvecs)精密肝切片微流控体系更为敏感。
82.雷公藤引发的肝损伤在临床上表现相似,患者出现食欲不振、乏力、恶心、呕吐、尿黄、皮肤和巩膜黄染等症状,并存在肝脏肿大、有压痛、血清alt、tbil升高、胆汁瘀积明显等临床表现。可见雷公藤所致肝损伤主要表现为胆汁瘀积型肝损伤,敏感的生物标记物为alt、tbil等。本试验证实,在微流控精密肝切片培养体系,雷公藤提取物0.3mg生药/ml以上剂量与精密肝切片共孵育一定时间后,与肝细胞损伤相关的生物标志物alt、ldh(见表1,图2-3),与胆管损伤的生物标志物ggt(见表1,图4),与脂质代谢相关的生物标志物tg(见表2,图5),与肝胆排泄功能相关的生物标志物tbil、tba(见表2,图6-7),均表现出不同程度的升高,其中1.2mg生药/ml剂量组alt、ldh、ggt、tg、tbil指标的升高与对照组比较均有统计学差异(p<0.05,p<0.01),0.6mg生药/ml剂量组的ldh亦较对照组有明显升高(p<0.05),tba的升高虽然未见统计学差异,但升高幅度与对照组比较升高2倍之多,有些指标,如tg、ggt、alt,呈现一定的剂量相关性;同等剂量的雷公藤提取物在单一heparg细胞微流控培养体系中,0.6、1.2mg生药/ml剂量组可引起tg的明显升高(p<0.05,p<0.01),1.2mg生药/ml剂量组尚可引起ggt的明显升高(p<0.01),且均呈现剂量依赖性;在静态精密肝切片培养体系和非共培养(无huvecs)精密肝切片微流控体系中,上述指标与对照组比较均未见明显差异;上述结果进一步证明,精密肝切片在微流控培养体系下,对受试物引起的肝损伤更为敏感和准确;且鉴于微流控培养体系中的huvecs细胞生长良好,上述指标的升高为非huvecs细胞损伤所致。
83.表1不同培养体系下雷公藤提取物对培养上清中alt、ldh、ggt含量的影响(mean
±
sd,n=3)
[0084][0085]
注:注:与对照组比较,
*
p<0.05,
**
p<0.01。
[0086]
表2不同培养体系下雷公藤提取物对培养上清中tg、tbil、tba含量的影响(mean
±
sd,n=3)
[0087]
[0088][0089]
注:与对照组比较,
*
p<0.05,
**
p<0.01
[0090]
本发明通过对微流控动态精密肝切片培养体系下,受试物的肝毒性检测,证实基于该培养体系,在较低的剂量、较短的作用时间,雷公藤醇提物可造成alt、ldh、ggt、tg、tbil的显著性升高,肝细胞形态学不同程度改变,可用于药物肝毒性的早期检测,且该培养体系优于单一细胞heparg微流控培养体系、静态精密肝切片培养体系和非共培养精密肝切片培养体系。
[0091]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1