DUB1基因、其检测试剂和抑制剂的应用
dub1基因、其检测试剂和抑制剂的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及dub1基因、其检测试剂和抑制剂的应用。
背景技术:
2.胃癌的致癌过程是包括胃炎、肠化生和上皮瘤变在内的病变过程。由于发病隐匿和症状轻微,大部分癌症患者发现时已经时晚期患者。其5年生存率仅为35%。一些生物医学研究表明,幽门螺杆菌感染和慢性炎症参与胃癌发展,但胃癌进展的具体机制尚不清楚。因此,发现新的胃癌生物标志物和胃癌治疗靶点是迫切和必要的。
3.一些研究已经发现了hippo信号通路与胃癌之间的潜在联系。hippo信号通路在器官大小控制、组织稳态、癌变和免疫反应等多个生物过程中起着重要作用。hippo信号的激活受磷酸化级联反应,哺乳动物hippo激酶mst1/2磷酸化lats1/2激酶,而磷酸化的lats1/2促进yap/taz蛋白的磷酸化,导致细胞质定位和蛋白降解。如果hippo信号通路失活,yap/taz就会被未磷酸化,易位到细胞核中,并与多个转录因子相互作用,促进其靶基因的表达。在幽门螺杆菌诱导小鼠胃癌模型中,yap/taz过表达抑制胃癌的进展。然而,尽管研发靶向hippo信号的药物已经付出了大量的努力,其临床应用仍处于不成熟阶段。
4.taz(与pdz结合基序的转录共激活因子)是hippo信号的下游效应,是多个转录因子的转录辅助因子,包括teads。一些研究表明,taz可能是人类癌症致癌的一个关键因素。例如,分子研究表明,taz的激活可以反式激活多种信号通路,如wnt和heddehog信号通路。在人类癌症样本中,taz蛋白水平在乳腺癌和胃癌中水平升高,其表达水平与预后不良相关。因此,靶向taz蛋白可以作为泛素-蛋白酶体系统的候选成分,可以用来挽救hippo信号通路的肿瘤抑制功能和胃癌进展的进展。
5.蛋白质稳定性的调控受e3泛素连接酶和去泛素酶之间平衡的影响,这是维持正常生理稳态的关键。蛋白质泛素化调控的中断可能导致多种人类疾病,包括癌症。我们和其他研究小组发现了几个e3泛素连接酶对hippo通路效应因子发挥作用,调节hippo信号活性和癌症进展。虽然有研究报道了几种去泛素酶参与调节hippo信号,但仍不清楚哪一种去泛素酶产生重要影响。
技术实现要素:
6.为了弥补现有技术的不足,本发明特提供dub1基因、其检测试剂和抑制剂在胃癌诊断和治疗中的相关应用。
7.第一方面,本发明提供检测dub1基因表达水平的试剂在制备诊断胃癌的产品中的应用。
8.进一步的,所述dub1基因在胃癌患者体内表达升高。
9.更进一步的,所述试剂选自:
10.特异性识别所述dub1基因的探针;或
11.特异性扩增所述dub1基因的引物;或
12.特异性结合所述dub1基因编码的蛋白的特异性结合剂。
13.更进一步的,特异性扩增所述dub1基因的引物序列如seq id no.9-10所示。
14.第二个方面,本发明提供所述dub1基因在筛选治疗胃癌的潜在物质中的应用,所述物质为下调所述dub1基因表达水平的物质。
15.第三个方面,本发明提供所述dub1基因的表达抑制剂在制备治疗胃癌的药物中的应用。
16.进一步的,所述抑制剂包括能够靶向干扰所述dub1基因sirna。
17.更进一步的,所述sirna的序列如seq id no.3-6所示。
18.第三个方面,本发明提供一种用于治疗胃癌的药物组合物,所述药物组合物包括治疗有效量的所述的抑制剂。
19.进一步的,所述药物组合物还包括与所述抑制剂配伍的其他药类以及药学上可接受的载体和/或辅料。
20.本发明的有益效果:
21.本发明首次在临床样本和实验研究中发现dub1基因与胃癌的发生相关。我们证实了dub1基因在胃癌中表达升高,并与低生存率相关。通过检测受试者中所述dub1基因的表达水平,可以判断受试者是否患有胃癌以及患胃癌的风险。
22.本发明首次发现dub1消耗可抑制体内外胃癌的进展,由此可见,以dub1基因作为靶点进行胃癌的治疗具有较好的可行性及推广性。
附图说明
23.图1为tcga数据分析不同分期胃癌组织与正常癌旁组织中dub1 mrna表达水平的箱型图。
24.图2为组织芯片和免疫组化分析dub1蛋白在胃癌组织与正常癌旁组织的差异表达的结果图。
25.图3为靶向dub1基因的sirna的沉默效率验证,图3a为mgc803细胞的western blot检测结果图,图3b为ags细胞的western blot检测结果图,图3c为mgc803细胞的rt-qpcr检测结果图,图3d为ags细胞的的rt-qpcr检测结果图。
26.图4为靶向dub1基因的sirna对胃癌细胞活性影响的测定结果,图a为mgc803细胞,图b为ags细胞。
27.图5为靶向dub1基因的sirna对胃癌细胞中edu阳性细胞影响的测定结果,图a为mgc803细胞的图像分析结果,图b为图a的具体量化结果,图c为ags细胞的图像分析结果,图d为图c的具体量化结果。
28.图6为靶向dub1基因的sirna对胃癌细胞周期影响的测定结果,图a为mgc803细胞的图像分析结果,图b为图a的具体量化结果。
29.图7为靶向dub1基因的sirna对胃癌细胞侵袭能力影响的测定结果,图a为mgc803细胞的图像分析结果,图b为图a的具体量化结果,图c为ags细胞的图像分析结果,图d为图c的具体量化结果。
30.图8为靶向dub1基因的sirna对胃癌细胞迁移能力影响的测定结果,,图a为mgc803细胞的图像分析结果,图c为图a的具体量化结果,图b为ags细胞的图像分析结果,图d为图b
的具体量化结果。
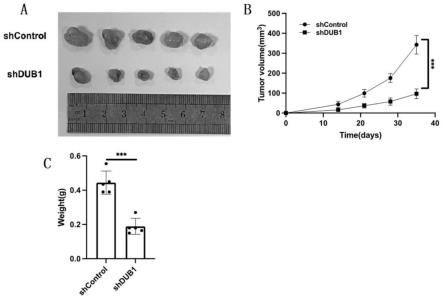
31.图9为下调dub1基因对胃癌肿瘤生长影响的测定结果,图a为瘤体体积的图像分析结果,图b为注射胃癌细胞后不同时间瘤体体积的量化结果,图c为瘤体重量的量化结果。
具体实施方式
32.下面结合附图和具体实施例对本发明进行详细说明,但不应理解为本发明的限制。如未特殊说明,下述实施例中所用的技术手段为本领域技术人员所熟知的常规手段,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
33.本发明经过广泛而深入的研究,通过dub(去泛素酶)sirna筛选文库,我们首次发现dub1(gene id:57602;其基因序列如seq id no.1所示,氨基酸序列如seq id no.2所示)是调节胃癌患者hippo通路活性的关键调节因子,而dub1在胃癌样本中升高,且胃癌患者预后不良与taz表达相关。dub1通过hippo/taz axis促进胃癌进展,dub1与taz相关,抑制k48连接的泛素化和降解,dub1在胃癌中增强hippo信号活性,可能是胃癌很有前途的诊断和治疗的标志物。本发明的附加方面和优点将在以下实施例的描述中变得明显,或通过本发明的实践了解到。
34.实施例1:tcga数据分析胃癌不同分期中dub1 mrna的表达
35.385例tcga胃癌患者的基因表达数据从gepia网站(http://gepia.cancer-pku.cn/index.html)获取,并在线分析比较正常胃组织与不同胃癌分期中dub1 mrna的表达水平;绘制箱型图。
36.结果表明:与正常胃组织相比,不同胃癌分期的dub1 mrna均有升高(图1)。
37.实施例2:组织芯片和免疫组化分析dub1蛋白的差异表达
38.90份石蜡包埋的胃癌样本来自上海超芯生物技术公司(http://www.superchip.com.cn)。该样本的使用已由上海芯超生物技术公司批准,并获得所有患者的书面知情同意。采用针对dub1(sigma,hpa12082)的特异性抗体检测人类样本的染色密度。根据整个组织中阳性肿瘤细胞的强度和百分比计算评分,根据fromowitz标准进行评分。染色强度分级为:无染色,0;弱阳性,1;中度阳性,2,强阳性。阳性细胞的比例分为四类:0-25%染色,1;26-50%染色,2;51-75%染色,3和76-100%染色,4。染色1、2低表达,染色3、4高表达。所有染色在200倍放大下进行评估,每个核心至少计算3个场。
39.结果表明:dub1蛋白在胃癌样本中显著升高(图2)。
40.实施例3:dub1 sirna的干扰效果检测
41.1、细胞培养
42.胃癌细胞系(ags和mgc803)在含有10%胎牛血清(biological industries,bish0744)、1%青霉素/链霉素(dmem)的dmem培养基(thermofisher scientific,cat:11965092)中培养。
43.2、设计sirna
44.dub1sirna序列如下:
45.si dub1#1正义链:3'-ccggcaagcugcgaauauutt-5',如seq id no.3所示;
46.si dub1#1反义链:3'-aauauucgcagcuugccggt-5',如seq id no.4所示;
47.si dub1#2正义链:3'-gcccaccacugaagagauutt-5',如seq id no.5所示;
48.si dub1#2反义链:3'-aaucucuucaguggugugctt-5',如seq id no.6所示;
49.sicontrol(阴性对照)正义链:3'-uucuccgaacgugucacgutt-5',如seq id no.7所示;
50.sicontrol(阴性对照)反义链:3'-acgugacacguucggagaatt-5',如seq id no.8所示。
51.3、转染
52.使用lipofectamine 2000说明书对细胞进行常规转染,转染48小时后,用rt-qpcr以及westernblot检测敲低效率。
53.rt-qpcr:总rna用rneasy plus mini kit(天根,dp451)提取,根据制造商的规格,使用hiscript ii q rt supermix(vazyme,r223-01)进行逆转录。qrt-pcr采用sybr qpcr master mix(vazyme,q511-02)和7500快速实时pcr系统(新加坡应用生物系统),36b4作为内对照。使用的引物如下:
54.dub1-f:3'-gaggccggggctctga-5',如seq id no.9所示;
55.dub1-r:3'-act gggatgtgcagacttgg-5',如seq id no.10所示;
56.36b4-f:3'-ggcgacctggaagaccacct-5',如seq id no.11所示;
57.36b4-r:3'-ccatcagccaccaccttc-5',如seq id no.12所示。
58.western blot:收集细胞,用含有蛋白酶和磷酸酶抑制剂混合物的ripa缓冲液(biomake,#b14001,#b15001)裂解。蛋白质在sds-聚丙烯酰胺凝胶电泳(sds-page)上进行电泳分离,并转移到硝化纤维素膜上(beyotime,#ffn08),使用的抗体为anti-dub1(sigma,hpa12082,1:1000)。
59.结果如图3所示,免疫印迹数据显示,两个sirnas均可显著降低dub1蛋白水平(图3a和图3b)。qpcr检测结果显示,dub1 mirna可以通过两个独立的sirnas有效地进行沉默(图3c和图3d)。
60.实施例4:敲低dub1对胃癌细胞及肿瘤的影响
61.1、细胞活性测定
62.用si-dub1转染mgc803和ags细胞。转染24小时后,收集细胞数量,并将3000个细胞接种到96孔板中。使用cck8试剂盒(biomake,#b34302)在指定的时间点检测细胞活性。
63.2、edu分析
64.在24孔板上,用sidub1或sicontrol转染mgc803和ags细胞。转染24小时后,计算细胞数量,将4000个细胞接种到96孔板中。在指定的时间点测量相对细胞活力。用cck8细胞增殖试剂测定450nm处的吸光度,测定细胞数。采用edu掺入法和流式细胞术进一步分析细胞增殖情况。采用5-乙基-20-脱氧尿苷(edu)检测试剂盒(ribobio,guangzhou,china)检测胃癌细胞。为了对图像进行量化分析,每个数据点代表从三个单独实验中随机选择的至少5个场计算出的正荧光面积。edu掺入facs检测按照制造商的说明进行。这些实验重复进行了三次。
65.3、细胞周期和细胞凋亡分析
66.采用碘化丙啶(pi)染色法测定细胞周期分析。细胞(1
×
107)用pbs洗涤,用70%乙醇室温固定30分钟。用pbs洗涤三次后,细胞用pi结合rnasea(thermo,#f10797)染色。红色信号用facscan(微孔成像仪)测量。fsc数据采用modfitltv3.1软件进行分析。在凋亡检测
中,mgc803和ags采用annexinv和碘化丙啶(pi)双染色,使用annexinv-fitc凋亡检测试剂盒(vazyme,#a211-02)和碘化丙啶(pi)双染色。用facscan(微孔成像仪)测量荧光。fsc数据采用flowjo7.6软件进行分析。
67.4、划痕及迁移实验
68.在划痕试验中,将含有sidub1或sicontrol的mgc803和ags细胞接种在6孔板中,直到融合,然后用无菌尖端损伤。在刮后的指定时间点获取细胞图片。划痕两边之间的距离测量使用imagej软件。transwell实验用(8μm孔径,康宁)用于细胞迁移和侵袭,上室涂上基质(bd生物涂层,美国)24小时后,胃癌细胞迁移到底部的插入膜固定,用结晶紫染色和计数,
×
20物镜下实验计数并重复三次。
69.5、克隆形成分析
70.将含有si-dub1或sicontrol(50nm)的mgc803和ags细胞接种在6孔板过夜。24小时后,用pbs洗涤胃癌细胞,胰蛋白酶化,低密度镀上六孔板上(每孔约5000个细胞)。细胞培养10天,每2天或3天更新一次培养基。10天后,用结晶紫将菌落染色。计算一个给定区域内的克隆数。
71.6、动物实验
72.将shdub1和shcontrol克隆到载体plko.1中与pmd2.g和pspax2包膜质粒进入hek293细胞。48小时后,用含200ul慢病毒的2ml无抗生素培养基培养mgc803细胞。使用的shrna序列如下:
73.shdub1:3'-cctgtgattctcagggaacaa-5',如seq id no.13所示;
74.shcontrol:3'-aacaagatgaagagcacca-5',如seq id no.14所示。
75.皮下注射2
×
106的癌细胞到4周龄雌性balb/c裸微裸鼠的下背部区域,肿瘤形成4周观察肿瘤体积,计算公式:肿瘤体积=0.5
×
最小径
×
最大径的平方,注射5周后处死小鼠,取出肿瘤称其重量。
76.结果:cck8检测表明,dub1缺失显著抑制胃癌细胞生长(图4)。此外,edu试验显示,dub1沉默可以显著降低mgc803和ags细胞中的edu阳性细胞(图5)。通过pi染色和facs分析的细胞周期分析显示,dub1缺失显著导致g1期细胞比例增加(图6)此外,侵袭实验表明,dub1是ags和mgc803细胞中胃癌侵袭能力的必要条件(图7)。伤口愈合实验显示,去除dub1可以降低ags和mgc803细胞中癌细胞的迁移速度(图8)。在体内肿瘤生长实验中,在mg803细胞中稳定沉默dub1可以抑制移植瘤小鼠模型中的肿瘤生长(图9)。
77.尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
78.显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1