一种具有抗氧化活性的龙须菜高纯度低分子量多糖及其制备方法和应用与流程
1.本发明涉及藻类多糖提取技术领域,特别是涉及一种具有抗氧化活性的龙须菜高纯度低分子量多糖及其制备方法和应用。
背景技术:
2.龙须菜是一种可食性的经济型红藻,在我国的主要产地为福建(75.5%)、广东(12.3%)和山东(12.3%),是我国传统的药食两用的海藻类植物。龙须菜不仅可直接食用,还可加工成食品添加剂、保湿剂、凝胶剂、药物等,在食品、化妆品、化工、医药等行业都进行了广泛的应用,创造了极大的经济价值。龙须菜的主要活性物质是多糖,具有抗氧化性、抗癌、降血压和增强免疫力等生理功能。然而,多糖的分子量可以显著影响生物活性,若分子量过大(》1000kda),多糖粘度过高,不利于发挥生物学活性,多糖开发利用率低;而分子量过小(《5kda),多糖往往会丧失生物活性。现有技术提取的龙须菜多糖往往存在分子量大,粘度高,不易开发利用的问题,因此,本发明拟提供一种具有生物活性的龙须菜高纯度低分子量多糖,为其开发利用提供理论基础。
技术实现要素:
3.本发明的目的是提供一种具有抗氧化活性的龙须菜高纯度低分子量多糖及其制备方法和应用,以解决上述现有技术存在的问题,该龙须菜低分子量多糖结构简单,分子量低,粘度小,纯度高,利于开发利用,且具有显著的抗氧化活性,为抗氧化产品的开发和推广应用提供理论依据。
4.为实现上述目的,本发明提供了如下方案:
5.本发明提供一种具有抗氧化活性的龙须菜高纯度低分子量多糖的制备方法,包括以下步骤:
6.(1)提取龙须菜多糖:龙须菜经清洁、干燥、粉碎和乙醇除杂后,进行加热提取,提取液离心、浓缩后,进行醇沉,沉淀复溶后,进行透析和冷冻干燥,得龙须菜多糖;
7.(2)降解龙须菜多糖:向龙须菜多糖溶液中加入维生素c和过氧化氢,搅拌均匀,微波加热辅助降解,之后进行浓缩、醇沉,沉淀复溶后,进行透析和冷冻干燥,得龙须菜低分子量粗多糖;
8.(3)纯化龙须菜低分子量多糖:将步骤(2)所述龙须菜低分子量粗多糖的溶液加入葡萄糖凝胶柱进行分离纯化,得到龙须菜高纯度低分子量多糖。
9.进一步地,在步骤(1)中,提取龙须菜多糖的具体步骤包括:龙须菜经清洁、干燥、粉碎,用95%乙醇除杂,之后烘干,得龙须菜粉末,向其中加入料液比为1g:40-50ml的水,于80-100℃加热提取2-4h,之后离心取上清液,于40-60℃旋蒸浓缩,加入4倍体积无水乙醇进行醇沉,沉淀复溶后进行透析处理48-72h,冷冻干燥48-72h后,得龙须菜多糖。
10.进一步地,所述加热提取还包括超声波辅助提取10-40min;所述醇沉的温度为4
℃,时间为12h。
11.进一步地,在步骤(2)中,所述龙须菜多糖溶液的浓度为2-8mg/ml,所述维生素c和过氧化氢的加入量为1:1,其终浓度均为5-25mm。
12.进一步地,在步骤(2)中,所述微波加热的功率为500-900w,温度为40-56℃,降解时间为0.1-1h;所述浓缩的温度为40-60℃,所述透析和冷冻干燥的时间均为48-72h。
13.进一步地,在步骤(3)中,所述龙须菜低分子量粗多糖的溶液浓度为2-8mg/ml,将其加入葡萄糖凝胶g-75柱子,用0-1m的nacl溶液进行洗脱,收集洗脱组分,采用苯酚-硫酸法检测,收集多糖组分,得龙须菜低分子量多糖。
14.本发明还提供一种根据上述的制备方法获得的具有抗氧化活性的龙须菜高纯度低分子量多糖。
15.进一步地,其分子量为16kda,由半乳糖和葡萄糖组成。
16.本发明还提供一种上述的具有抗氧化活性的龙须菜高纯度低分子量多糖在制备抗氧化产品中的应用。
17.本发明公开了以下技术效果:
18.本发明从龙须菜中提取得到一种低分子量多糖,该多糖结构简单,分子量低,粘度小,纯度高,利于开发利用。同时本发明以水提醇沉法获得安全无毒的龙须菜多糖,再以自由基降解制备龙须菜高纯度低分子量多糖,此方法绿色安全高效,成本低,操作简单,可应用于实际生产。另外经试验验证,本发明制备的龙须菜低分子量多糖相比于未降解的普通多糖纯度高,显著提高抗氧化活性,为抗氧化产品的开发和推广应用提供理论依据。
附图说明
19.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
20.图1是龙须菜多糖降解前后的分子量分布图;
21.图2是龙须菜低分子量多糖纯化的洗脱曲线图;
22.图3是龙须菜多糖降解前后相对粘度的变化;
23.图4是龙须菜多糖降解前后xrd分析结果;
24.图5是龙须菜多糖降解前后扫描电镜图;
25.图6是龙须菜多糖降解前后原子力显微镜图;a:glp;b:glp-hv;c:glp-h;d:glp-v;
26.图7是龙须菜多糖降解前后对氧化损伤hepg2细胞的保护作用;
27.图8是龙须菜多糖降解前后对氧化损伤hepg2细胞活力的影响;
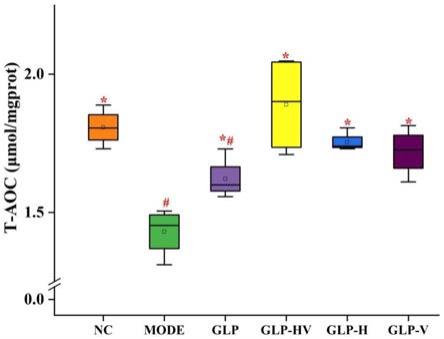
28.图9是龙须菜多糖降解前后对hepg2细胞总抗氧化能力的影响;
29.图10是龙须菜多糖降解前后对hepg2细胞cat活性的影响;
30.图11是龙须菜多糖降解前后对hepg2细胞gsh-px活性的影响;
31.图12是龙须菜多糖降解前后对hepg2细胞sod活性的影响;
32.图13是龙须菜多糖降解前后对hepg2细胞mda活性的影响;
33.图14是龙须菜多糖降解前后对hepg2细胞ca
2+
强度的影响;
34.图15是龙须菜多糖降解前后对hepg2细胞内ros含量的影响。
具体实施方式
35.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
36.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
37.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
38.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本发明说明书和实施例仅是示例性的。
39.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
40.实施例1
41.龙须菜高纯度低分子量多糖的制备方法:
42.(1)龙须菜前处理:龙须菜清洗、烘干、粉碎,利用95%乙醇脱除色素和醇溶性杂质,烘干后得到均匀的龙须菜粉末。
43.(2)龙须菜多糖提取:取步骤(1)所述龙须菜粉末,加入纯水,料液比是1g:45ml,超声波辅助提取30min,90℃加热提取4h后,离心取上清液,60℃旋蒸浓缩后,缓慢加入4倍体积无水乙醇,边加边搅拌,放置于4℃冰箱静置醇沉12h,离心取沉淀,加入纯水复溶后透析处理72h,最后冷冻干燥72h,得到龙须菜多糖粉末(glp)。
44.(3)龙须菜多糖降解:称取18.7mm维生素c溶于同剂量的过氧化氢,加入到5mg/ml的龙须菜多糖溶液中,搅拌均匀后,微波(600w,56℃)降解0.5h,50℃旋蒸浓缩后,缓慢加入4倍体积无水乙醇,边加边搅拌,放置于4℃冰箱静置醇沉12h,离心取沉淀,加入纯水复溶后进行透析处理48h,最后冷冻干燥72h,得到龙须菜低分子量多糖粉末。
45.(4)龙须菜低分子量多糖的纯化:将步骤(3)所述低分子量多糖粉末配制成5mg/ml溶液,加入预先处理好的葡萄糖凝胶g-75柱子,上样体积为柱体积的2%,分别采用0、0.2、0.4、0.6、0.8和1m的nacl溶液对其进行洗脱,洗脱流速为0.5ml/min,收集不同时间段的洗脱液,每个浓度收集50管,每管5ml,采用苯酚-硫酸法对其进行测定,收集多糖组分,得龙须菜低分子量多糖(glp-hv)。
46.实施例2
47.龙须菜高纯度低分子量多糖的制备方法:
48.(1)龙须菜前处理:龙须菜清洗、烘干、粉碎,利用95%乙醇脱除色素和醇溶性杂质,烘干后得到均匀的龙须菜粉末。
49.(2)龙须菜多糖提取:取步骤(1)所述龙须菜粉末,加入纯水,料液比是1g:40ml,超声波辅助提取10min,100℃加热提取3h后,离心取上清液,50℃旋蒸浓缩后,缓慢加入4倍体积无水乙醇,边加边搅拌,放置于4℃冰箱静置醇沉12h,离心取沉淀,加入纯水复溶后透析处理65h,最后冷冻干燥65h,得到龙须菜多糖粉末。
50.(3)龙须菜多糖降解:称取25mm维生素c溶于同剂量的过氧化氢,加入到8mg/ml的龙须菜多糖溶液中,搅拌均匀后,微波(500w,40℃)降解0.1h,60℃旋蒸浓缩后,缓慢加入4倍体积无水乙醇,边加边搅拌,放置于4℃冰箱静置醇沉12h,离心取沉淀,加入纯水复溶后进行透析处理72h,最后冷冻干燥48h,得到龙须菜低分子量多糖粉末。
51.(4)龙须菜低分子量多糖的纯化:将步骤(3)所述低分子量多糖粉末配制成2mg/ml溶液,加入预先处理好的葡萄糖凝胶g-75柱子,上样体积为柱体积的5%,分别采用0、0.2、0.4、0.6、0.8和1m的nacl溶液对其进行洗脱,洗脱流速为0.4ml/min,收集不同时间段的洗脱液,每个浓度收集30管,每管10ml,采用苯酚-硫酸法对其进行测定,收集多糖组分,得龙须菜低分子量多糖(glp-hv)。
52.实施例3
53.龙须菜高纯度低分子量多糖的制备方法:
54.(1)龙须菜前处理:龙须菜清洗、烘干、粉碎,利用95%乙醇脱除色素和醇溶性杂质,烘干后得到均匀的龙须菜粉末。
55.(2)龙须菜多糖提取:取步骤(1)所述龙须菜粉末,加入纯水,料液比是1g:50ml,超声波辅助提取40min,80℃加热提取2h后,离心取上清液,40℃旋蒸浓缩后,缓慢加入4倍体积无水乙醇,边加边搅拌,放置于4℃冰箱静置醇沉12h,离心取沉淀,加入纯水复溶后透析处理48h,最后冷冻干燥48h,得到龙须菜多糖粉末。
56.(3)龙须菜多糖降解:称取5mm维生素c溶于同剂量的过氧化氢,加入到2mg/ml的龙须菜多糖溶液中,搅拌均匀后,放置于微波(900w,50℃)降解1h,40℃旋蒸浓缩后,缓慢加入4倍体积无水乙醇,边加边搅拌,放置于4℃冰箱静置醇沉12h,离心取沉淀,加入纯水复溶后进行透析处理54h,最后冷冻干燥55h,得到龙须菜低分子量多糖粉末。
57.(4)龙须菜低分子量多糖的纯化:将步骤(3)所述低分子量多糖粉末配制成8mg/ml溶液,加入预先处理好的葡萄糖凝胶g-75柱子,上样体积为柱体积的1%,分别采用0、0.2、0.4、0.6、0.8和1m的nacl溶液对其进行洗脱,洗脱流速为1.0ml/min,收集不同时间段的洗脱液,每个浓度收集80管,每管4ml,采用苯酚-硫酸法对其进行测定,收集多糖组分,得龙须菜低分子量多糖(glp-hv)。
58.对比例1
59.与实施例1的区别在于,步骤(3)中省略过氧化氢;最终得到龙须菜低分子量多糖(glp-h)。
60.对比例2
61.与实施例1的区别在于,步骤(3)中省略维生素c;最终得到龙须菜低分子量多糖(glp-v)。
62.效果例1
63.1.多糖化学指标的测定:
64.取上述制备的glp-hv、glp-h和glp-v,分别采用硫酸苯酚法测定其总糖含量,间苯二酚比色法测定3,6-脱水半乳糖,明胶-氯化钡比浊法测定硫酸基含量,羰基试剂盒测定羰基含量。详细操作步骤如下:
65.苯酚硫酸法测定总糖含量:取1ml样品于试管中,加入5%苯酚1ml,混合均匀后,再缓慢加入5ml的浓硫酸,混合均匀,常温放置30min,室温冷却后,在波长为490nm处测定各管的吸光度值。以半乳糖作为标准品,绘制标准曲线,从而计算总糖含量。
66.间苯二酚比色法测定3,6-脱水半乳糖:间苯二酚-乙缩醛工作液配制:分别取9ml间苯二酚溶液,1ml 0.04%乙缩醛溶液,100ml浓盐酸,混合均匀,现配现用。取0.5ml样品(1mg/ml),放置于冰水浴中,分别加入5ml间苯二酚-乙缩醛工作液,振荡摇匀后,80℃反应15min,冰水浴2min后于554nm测定吸光度。以果糖为标准品绘制标准曲线,从而计算3,6-脱水半乳糖含量。
67.明胶-氯化钡比浊法测定硫酸基含量:称取0.01g样品,加入1m hcl溶液,定容至10ml,100℃下水解6h,取水解后的样品0.2ml,以hcl溶液作为空白,每管分别加入3.8ml 3%三氯乙酸及1ml bacl
2-明胶溶液,置于室温下静置15min,于360nm测定吸光度,记为a1;用1ml明胶溶液代替bacl2,同法测吸光度,记为a2;吸光度差值a1-a2即为所需数值,以硫酸钾为标准品,绘制标准曲线,计算硫酸基含量。结果如表1所示:
68.表1龙须菜多糖降解前后的化学指标变化
[0069][0070]
用本发明提取的多糖,总糖含量均在97%以上,用本发明方法降解多糖,3,6-脱水半乳糖、硫酸基和羰基含量均显著增加,说明降解后的低分子量多糖活性基团增加,为其活性的增加提供理论依据。
[0071]
2.多糖的纯化、分子量分布、单糖组分和粘度的测定:
[0072]
取上述制备的glp-hv、glp-h和glp-v,采用高效凝胶渗透色谱法测定其分子量,结果如表1,采用本发明降解多糖后,分子量由1478kda降低为16kda,而另外两个对比例分别为1329kd和1000kda,处理数据得到图1的分子量分布图,结果显示龙须菜多糖降解前可能含有两个主要组分,降解成低分子量多糖后,分子量分布图呈现出一个主要组分,对比例1-2和降解前一样有两个组分。
[0073]
取实施例1制备得到的龙须菜低分子量多糖,通过不同浓度nacl溶液洗脱后,得到图2的洗脱曲线图,结果表明当洗脱液为水时出峰,说明本发明制备得到的低分子量多糖属于中性多糖,且仅有一个主要组分,与分子量分布图相对应,反映了过氧化氢联合维生素c
降解得到的低分子量多糖纯度较高。结合表1总糖含量,图1分子量分布图和图2洗脱曲线图可知,采用本发明制备得到的低分子量多糖纯度高,在后续生产过程中可以不用进一步纯化。
[0074]
取实施例1制备得到的龙须菜低分子量多糖,利用凝胶渗透色谱分析单糖组成,结果表明龙须菜降解前的单糖组分主要为葡萄糖(34.35%)和半乳糖(57.37%),降解后的低分子量多糖的单糖组成也分别是葡萄糖(33.37%)和半乳糖(59.12%)。对比例制备的glp-h的单糖组成主要为葡萄糖(24.63%)和半乳糖(66.39%),glp-v的单糖组成主要为葡萄糖(24.43%)和半乳糖(69.67%),采用乌氏粘度计测定粘度,结果表明当多糖的浓度为5mg/ml时,龙须菜降解前后的相对粘度分别为4.96和1.08,降解明显降低多糖的粘度,对比例glp-h和glp-v的粘度为4.67和2.74(见图3)。
[0075]
3.多糖晶体结果分析:采用xrd衍射仪测定多糖的晶体结构,结果如图4所示,采用本发明方法制备的低分子量多糖结构发生变化,呈现微晶体结构,而对比例1-2的结构介于glp和glp-hv之间。
[0076]
4.多糖粒径和微观结构分析:采用粒径分析仪、扫描电子显微镜和原子力显微镜测定多糖降解前后的粒径和微观结构。结果如表2:
[0077]
表2龙须菜多糖降解前后粒径的变化
[0078]
粒径d
10
(μm)d
50
(μm)d
90
(μm)glp99.90
±
6.67a258.05
±
18.82*569.91
±
35.04αglp-hv25.70
±
0.39c85.14
±
1.42***224.74
±
7.93γglp-h55.45
±
1.98b118.64
±
5.41**247.55
±
15.33βγglp-v57.12
±
1.78b133.53
±
5.55**283.86
±
13.87β
[0079]
采用本发明方法降解多糖后,其平均粒径(d
50
)由258.05μm降低为85.14μm,而对比例分别为118.64μm和133.53μm。扫描电子显微镜和原子力显微镜分析结果如图5和图6(图6中a:glp;b:glp-hv;c:glp-h;d:glp-v;),采用本发明方法降解多糖后,微观结构发生明显变化,多糖片状结构遭到破坏,结构松散且破碎。对比例的微观结构变化介于glp和glp-hv之间。这与分子量和粒径的结果一致。证实了本发明制备的多糖分子量低,粘度低,纯度高。
[0080]
效果例2
[0081]
龙须菜多糖降解前后对氧化损伤的人肝癌细胞(hepg2)的保护作用和抗氧化能力的影响
[0082]
取实施例1制备得到的龙须菜多糖和降解后的低分子量多糖加入按照常规方法培养24h的hepg2细胞继续培养细胞24h,再用100μg/ml过氧化氢诱导hepg2细胞6h,研究其对过氧化氢诱导氧化损伤的hepg2细胞的保护作用,正常组(nc)为按常规方法培养的hepg2细胞;模型组(mode)为:未加入龙须菜多糖且经过氧化氢诱导氧化损伤的hepg2细胞;图7和图8表明龙须菜多糖降解前后对hepg2细胞具有抗氧化损伤的保护作用,龙须菜多糖能显著地修复氧化损伤细胞的形态和活力,采用本发明方法降解后的多糖效果更明显。收集氧化损伤的细胞沉淀,完全裂解细胞后,通过t-aoc、sod、mda、gsh-px、cat等试剂盒测定细胞的抗氧化活性,进一步验证龙须菜低分子量多糖的抗氧化作用。结果如图9-13所示,降解后的龙须菜低分子量多糖具有更显著的抗氧化活性(注:图7-13中,“#”表示与正常组(nc)具有显著性差异,“*”表示与模型组(mode)具有显著性差异(p<0.05))。采用荧光倒置显微镜观察
龙须菜多糖对细胞的ca
2+
强度和ros(活性氧自由基)含量,图14和图15结果显示,采用本发明方法降解龙须菜多糖,能显著降低氧化损伤细胞的ca
2+
强度和ros含量,提高细胞的抗氧化能力。而对比例对细胞的抗氧化能力在glp和glp-hv之间。
[0083]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1