人基因CHD1位点突变和检测CDH1基因的多个位点突变的试剂盒的制作方法
人基因chd1位点突变和检测cdh1基因的多个位点突变的试剂盒
1.本技术是名称为:检测cdh1基因的多个位点突变的引物、方法和试剂盒,申请号为:201911279328.0的分案申请。
技术领域
2.本发明属生命科学和生物技术领域,特别涉及检测cdh1基因位点突变的引物,采用普通pcr结合sanger测序技术,可用于快速检测遗传性胃癌患者体内cdh1基因位点的突变情况。
背景技术:
3.中国是胃癌高发国家,全世界42%的胃癌发生在我国,是第三大常见肿瘤(在男性中排在肺癌和肝癌之后,女性排在乳腺癌和肺癌之后)。胃癌人群中大多数为散发病例,约10%的患者表现有家族聚集性,这种聚集性可能与基因有关,也可能是由于共同的生活环境和饮食习惯所致,而hdgc(hereditary diffusegastric cancer,遗传性弥漫型胃癌)是已知的以胃腺癌为主的癌症综合征,占所有胃癌总数的1-3%。cdh1基因突变是hdgc遗传的主要原因,也是第一个发现的与遗传性胃癌相关的基因。
4.cdh1是一个抑癌基因,位于16q22.1,由16个外显子组成,长度约105kb,转录mrna长4.8kb,编码的e-钙粘蛋白(e-cadherin)分子量为120kd。e-cadherin 是一类ca2+依赖跨膜糖蛋白,由n端信号肽、前肽和成熟蛋白三部分组成,是目前公认的抑癌蛋白和肿瘤转移抑制蛋白,当它表达减少或功能异常时,将导致肿瘤的侵袭和转移。e-钙粘素在弥漫性胃癌中经常表达缺失,但是在其他类型胃癌中并没有这种现象。
5.至今已发现有150多种cdh1基因的突变类型,遍布cdh1基因的所有外显子。其中70%左右为致病型突变,包括截短突变(truncated mutation)、剪接突变(splicing mutation)、无义突变(nonsense mutation);30%左右为错义突变 (missense mutation),其临床意义还有争议。cdh1基因突变率在不同地区、种族的遗传性弥漫型胃癌检出差别很大,提示不同地区胃癌的发病机制可能不同。符合遗传性胃癌诊断标准的家系中,cdh1基因突变携带者一生中患胃癌的概率大约为70%。弥漫性胃癌一旦出现临床症状,大部分已不可治愈,因此遗传性胃癌家系的cdh1基因检测成为必要。其目的是尽可能明确发病原因,并对有发病危险的家族成员提供遗传性检测,以便早期发现突变基因携带者,及时采取干预措施以提高预后。
6.sanger测序法是基因检测的主要手段之一,也是基因检测的金标准。通过测序法对cdh1基因突变进行检测可发现cdh1基因已知和未知的全部类型的异常,为遗传性胃癌患者的诊断提供依据。本发明中发现cdh1基因的c.2076t》c、 c.1937-13t》c、c.2164+66a》c和c.2164+17dupa四个位点的突变在中国人群中普遍存在。因此,临床在利用cdh1基因突变辅助诊断遗传性胃癌时需格外谨慎,加以区别。
技术实现要素:
7.本发明的目的是提供一种检测cdh1基因的c.2076t》c、c.1937-13t》c、 c.2164+66a》c和c.2164+17dupa位点突变的引物,采用pcr技术,可用于快速检测遗传性胃癌家系成员体内cdh1基因的c.2076t》c、c.1937-13t》c、 c.2164+66a》c和c.2164+17dupa位点的突变情况。所述检测cdh1基因的 c.2076t》c、c.1937-13t》c、c.2164+66a》c和c.2164+17dupa位点突变情况的引物,包括:
8.扩增cdh1基因的c.2076t》c、c.1937-13t》c、c.2164+66a》c和c. 2164+17dupa位点的引物,其碱基序列为: cdh1-f:tgtaaaacgacggccagtggcttgcgggtgtctttag cdh1-r:aacagctatgaccatgtccaggaaataaacctcctcc。
9.进一步地,还包括测序引物,其碱基序列为:
10.m13 f:tgtaaaacgacggccagt
11.m13 r:aacagctatgaccatg。
12.本发明还提供了检测cdh1基因的c.2076t》c、c.1937-13t》c、 c.2164+66a》c和c.2164+17dupa位点突变情况的方法,包括以下步骤:
13.1.抽提外周血或肌肉组织中的基因组dna;
14.2.用pcr扩增步骤1中提取的dna;
15.3.对步骤2中的扩增产物进行测序;
16.4.对测序结果进行判断,确定cdh1基因的c.2076t》c、c.1937-13t》c、 c.2164+66a》c和c.2164+17dupa位点是否发生突变;
17.其中pcr扩增引物为:
18.扩增cdh1基因的c.2076t》c、c.1937-13t》c、c.2164+66a》c和c. 2164+17dupa位点的引物,其碱基序列为: cdh1-f:tgtaaaacgacggccagtggcttgcgggtgtctttag cdh1-r:aacagctatgaccatgtccaggaaataaacctcctcc。
19.进一步地,测序引物碱基序列为:
20.m13 f:tgtaaaacgacggccagt
21.m13 r:aacagctatgaccatg。
22.本发明还提供了一种检测cdh1基因的c.2076t》c、c.1937-13t》c、 c.2164+66a》c和c.2164+17dupa位点突变的试剂盒,包括:
23.(i)血液/组织dna抽提试剂;
24.(ii)检测体系pcr扩增反应液:包括扩增cdh1基因的c.2076t》c、 c.1937-13t》c、c.2164+66a》c和c.2164+17dupa位点的引物,其碱基序列为: cdh1-f:tgtaaaacgacggccagtggcttgcgggtgtctttag cdh1-r:aacagctatgaccatgtccaggaaataaacctcctcc;
25.(iii)测序体系试剂:包括测序引物,其碱基序列为: m13 f:tgtaaaacgacggccagt m13 r:aacagctatgaccatg;
26.(iv)阳性对照品和阴性对照品。
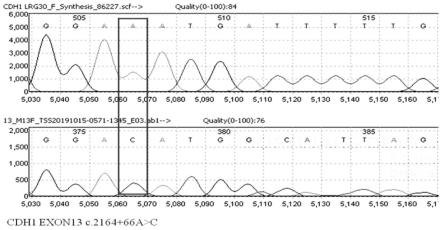
27.有益效果:本发明只用1对引物,可同时检测cdh1基因c.2076t》c、 c.1937-13t》c、c.2164+66a》c和c.2164+17dupa 4个突变,高效简便。其中还发现了c.2164+66a》c这个新突变(未见文献报道,属首次发现),在本次检测中突变率为60%。本发明采用pcr技术,通过调整引物浓度、退火温度等反应条件,可使扩增效率达到最佳,构建了稳定的扩增体系。相比
较荧光定量pcr 法降低了检测的成本和难度,荧光定量pcr法要针对不同的突变类型设计4个探针,成本高,检测难度大。
附图说明
28.图1为扩增引物的琼脂糖凝胶电泳图,m为marker dl 2000,1-20为血液样本1-20,经引物扩增有效,且目的条带清晰,产物大小正确。
29.图2为样本3检测cdh1 c.2076t》c位点的测序截图结果。
30.图3为样本6检测cdh1 c.1937-13t》c位点的测序截图结果。
31.图4为样本11检测cdh1 c.2164+66a》c位点的测序截图结果。
32.图5为样本17检测cdh1 c.2164+17dupa位点的测序截图结果。
具体实施方式
33.实施例1
34.下面结合具体实施例和附图,进一步阐述本发明。应当注意的是,实施例中未说明的常规条件和方法,通常按照所属领域实验人员常规采用方法:譬如,奥斯柏和金斯顿主编的《精编分子生物学实验指南》第四版,或者按照制造厂商所建议的步骤和条件。
35.一种检测cdh1基因的c.2076t》c、c.1937-13t》c、c.2164+66a》c和c. 2164+17dupa位点突变的引物,该引物是针对cdh1基因的c.2076t》c、 c.1937-13t》c、c.2164+66a》c和c.2164+17dupa突变位点所设计的特异性扩增引物,包括:
36.扩增cdh1基因c.2076、c.1937-13、c.2164+66和c.2164+17位碱基的引物,其碱基序列为: cdh1-f:tgtaaaacgacggccagtggcttgcgggtgtctttag cdh1-r:aacagctatgaccatgtccaggaaataaacctcctcc;
37.一种检测cdh1基因的c.2076t》c、c.1937-13t》c、c.2164+66a》c和c. 2164+17dupa位点突变的试剂盒,包括
38.(i)血液/组织dna抽提试剂;
39.(ii)检测体系pcr反应液;
40.(iii)测序体系试剂;
41.(iv)阳性对照品和阴性对照品。
42.其中,血液/组织dna抽提试剂可购自天根dna抽提试剂盒等商品化试剂。
43.检测体系pcr扩增反应液包括:2
×
pcr buffer;2mm dntps;kod fxdna polymerase(1u/μl);cdh1上、下游引物(10μm)。
44.测序体系试剂包括:测序纯化液(exoi:0.6u,cip:1.2u)、edta(125mmol)、无水乙醇、75%乙醇、hidi(高度去离子甲酰胺)、测序引物:检测cdh1基因的c.2076t》c、c.1937-13t》c、c.2164+66a》c和c.2164+17dupa的上、下游引物(3.2μm)。
45.实施例2
46.血液/细胞/组织基因组dna抽提试剂盒(天根生物)的操作流程:
47.(1)抽提血液中的组织dna:1)抽取300μl血液加入900μl红细胞裂解液,颠倒混匀,室温放置5分钟,期间再颠倒混匀几次。12,000rpm离心1min,吸去上清,留下白细胞沉淀,加200μl缓冲液ga,振荡至彻底混匀。2)加入20μl 蛋白酶k溶液,混匀。3)加入200μl缓冲液gb,
充分颠倒混匀,70℃放置10分钟,溶液应变清亮,简短离心以去除管盖内壁的水珠。4)加入200μl无水乙醇,充分振荡混匀15秒,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠。5)将上一步所得溶液和絮状沉淀都加入一个吸附柱cb3中(吸附柱放入收集管中),12,000rpm离心30秒,倒掉废液,将吸附柱cb3放回收集管中。6)向吸附柱cb3中加入500μl缓冲液gd(使用前请先检查是否已加入无水乙醇),12,000rpm离心30秒,倒掉废液,将吸附柱cb3放入收集管中。7)向吸附柱cb3中加入700μl漂洗液pw(使用前请先检查是否已加入无水乙醇),12,000rpm离心30秒,倒掉废液,将吸附柱cb3放入收集管中。8)向吸附柱cb3中加入500μl漂洗液pw,12,000rpm离心30秒,倒掉废液。9)将吸附柱cb3放回收集管中,12,000rpm离心2分钟,倒掉废液。将吸附柱cb3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。10)将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加100μl洗脱缓冲液te,室温放置2-5分钟,12,000rpm离心2分钟,将溶液收集到离心管中。
48.(2)试剂配置:按检测人份数配置检测体系pcr反应液各xμl,每人份18μl分装:
49.x=18μl反应液
×
(n份标本+1份阳性对照+1份阴性对照+1份空白对照)
50.n为检测标本数。
51.(3)加样:加入检测体系pcr反应液中2μldna;阳性对照和阴性对照直接加2μl阳性对照品和阴性对照品;空白对照加2μl生理盐水或不加任何物质。
52.(4)扩增:检测在常规pcr仪上进行,可用仪器包括abiveriti(美国appliedbiosystems公司)等。反应条件如下:
[0053][0054]
pcr扩增体系试剂配制方法如下:
[0055][0056]
其中,引物序列为:
[0057][0058]
注:f为上游引物,r为下游引物
[0059]
(5)电泳:1.5%琼脂糖凝胶电泳,120v,30min,凝胶成像系统观察。
[0060]
如图1所示,即为20例血液样本以相应的引物扩增后所得产物的电泳图谱。通过电泳图的分析表明本发明所述扩增有效,且条带清晰。
[0061]
(6)sanger测序:
[0062]
取9μl pcr产物与2μl纯化体系。按照以下程序进行纯化:
[0063][0064][0065]
将1μl纯化产物分别与上、下测序引物按照如下体系进行混合:
[0066][0067]
测序反应程序:
[0068][0069]
沉淀环节:
[0070]
向完成测序反应的产物中加入2μl 125mmol的edta,静置5min;加入15μl 无水乙醇,漩涡混匀;3700rpm离心30min;倒置离心15sec,加入50ml70%乙醇,漩涡混匀;3700rpm
离心15min;倒置离心15sec,置于95℃金属浴上;加入10μl cbl后进行变性5min,最后-20℃2min上测序仪(abi3730)测序。 (7)结果判断:分别将测序结果与cdh1(ng_008021.1)阴性参考序列进行比对,根据实际突变情况对结果进行报告。
[0071]
实施例3
[0072]
取20例临床外周血样品,按实施例2所述方法提取基因组、配制试剂并检测。每份样品加入检测体系pcr反应液中2μl。同时做阳性,阴性,空白对照各一份。检测结果见下表,琼脂糖凝胶电泳结果如图1所示,测序图如图2-5所示。
[0073] c.2076t》cc.1937-13t》cc.2164+66a》cc.2164+17dupa1+
‑‑‑
2+++-3+
‑‑‑
4+-+-5+-+-6+++-7+
‑‑‑
8+
‑‑
+9+
‑‑‑
10++
‑‑
11+-+-12+
‑‑
+13+-+-14+-+-15+-+-16+-+-17+
‑‑
+18
‑‑
+-19
‑‑
+-20+-+-本次检测突变率90%15%60%15%文献报道突变率71.61%9.64%未见报道2.81%
[0074]
注:+表示阳性突变,-表示无突变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1