用于流体样本中的凝结测定的盒设备识别的制作方法
优先权要求
本申请要求于2014年9月26日提交的美国临时申请no.62/055,922的优先权,其全部内容通过引用并入本文。
本发明涉及包括用于盒设备识别的电阻器的分析测试设备和用于基于盒设备识别来测定流体样本中的凝结(coagulation)的方法,具体地,涉及使用护理点(pointofcare)测试盒中的用于盒设备识别的电阻器来执行凝结测定。
背景技术:
血液凝块(clotting)或止血是身体的重要保护机制,用于密封由身体损伤引起的伤口。止血发生在两个阶段。初期(细胞)止血用来快速停止出血并最小化失血。初期止血涉及内皮的受损伤细胞和发射使得血小板(凝血细胞)积聚在受损伤血管的一个区域中从而形成临时密封伤口的栓子(plug)的信号的细胞的下层。第二期(血浆)止血或凝结与初期止血同时启动并涉及血液凝块的过程。更具体而言,凝结通过相互作用和相互活化的十三个凝结因子组成的信号传导凝结级联来控制。在凝结级联结束时,纤维蛋白原转化为纤维蛋白。纤维蛋白纤维的网络增强伤口闭合,并且血小板和其它血细胞被捕获在这个网络中并形成血凝块(血栓)。最后,血小板和内皮释放控制伤口愈合过程的生长因子。在这些过程结束时,纤维蛋白网络通过酶溶解在血浆中。
止血需要促凝剂和抗凝剂的微妙平衡,使得循环的血液保持是相对低粘度的流体,并且凝结仅仅是为了密封伤口而开始。促凝剂通过阻塞来自伤口或受损害血管的血液流动来防止过度出血,而抗凝剂防止在循环系统中形成凝块,否则凝块会阻塞血管并导致心肌梗塞或中风。
第二期止血的凝结级联是基于纤维蛋白原(可溶性血浆蛋白)催化转化为不溶性纤维蛋白。催化这个反应的酶是凝血酶,凝血酶不是以活性形式在血液中永久循环,而是以凝血酶原(凝血酶的无活性前体(precursor))存在。导致活性凝血酶的凝结级联由两个途径组成,即,外源途径和内源途径,它们融合到共同途径中,共同途径包括催化纤维蛋白原转化为纤维蛋白的活性凝血酶。外源途径是响应于组织因子(因子iii)的释放而在损伤部位处启动的,因此也被称为组织因子途径。组织因子是在因子x(无活性)到因子xa(活性)的因子viia-催化活化中的辅因子(cofactor)。第二个、更复杂的内源途径是通过与血小板相关联的凝块因子viii、ix、x、xi和xii来活化的。还需要蛋白质前激肽释放酶(pk)和高分子量激肽原(hk或hmwk),以及从血小板分泌的钙离子和磷脂。这些成分中的每一个都导致因子x到因子xa的转化。两个途径中的共同点是因子x到因子xa的活化。因子xa是在两个位置(arg-thr,然后是arg-ile键)上切割凝血酶原的酶(例如,丝氨酸内肽酶),其产生活性凝血酶并最终造成纤维蛋白原转化为纤维蛋白。
称为纤维蛋白溶解的血凝块或纤维蛋白网络的分解需要将纤维蛋白转化成可溶性产物。这种裂解由以无活性形式(纤溶酶原)循环的蛋白水解酶纤溶酶催化。组织纤溶酶原活化剂(tpa)、细菌溶血酶(例如链激酶)和在尿液中发现的蛋白水解的人酶(例如,尿激酶)都活化纤溶酶原。这些材料通常用于溶栓疗法(thrombolytictherapy)。
因此,凝结级联是用于诊断和治疗涉及失调的血液凝块或不存在凝块的疾病的合适目标。例如,对在凝结级联中涉及的十三种血液凝块因子中的一种或多种可能是有缺陷的出血性情况(诸如血友病)的诊断可以通过广泛的多种凝结测试来实现。此外,已经开发了若干测试来监测溶栓疗法的进展。已经开发了其它测试来信号传导溶栓前(prethrombolytic)或高凝结状态,或监测在体外循环手术(cardiopulmonarybypasssurgery)期间向患者施用鱼精蛋白的效果。但是,凝结测试的主要价值在于监测口服和静脉注射抗凝疗法。三个关键的诊断性测试是凝血酶原时间(pt)、活化部分凝血活酶时间(aptt)和活化凝血时间(act)。
pt是在加入组织因子(从诸如兔子的动物获得的、或重组组织因子,或来自尸检患者的大脑的)之后血浆凝块所用的时间。这测量凝结的外源途径(以及共同途径)的质量。pt最常用于监测口服抗凝疗法。口服抗凝剂(诸如
aptt是形成纤维蛋白凝块所用的时间。这测量凝结的内源途径(以及共同途径)的质量。aptt最常用于监测静脉注射肝素抗凝疗法。施用肝素具有压制凝块形成的效果。传统的aptt测试包括将血液吸入包含液体柠檬酸钠(其通过结合样本中的钙而充当抗凝剂)的管中。因此,aptt测试是基于向柠檬酸盐血液样本(例如,血小板不足的血浆)中加入活化剂、钙和磷脂,并且测量样本形成纤维蛋白凝块所用的时间。
act是全血暴露于活化剂的情况下凝块所用的时间。内源途径测试评估凝结的内源途径和共同途径。act最常用于监测在需要施用强力抗凝剂的过程(诸如体外循环、心脏血管成形术、溶栓、体外膜式氧合(ecmo)和连续透析)之前、期间和不久之后的高剂量肝素的效果。传统的act测试包括将全血加入到包含表面活化剂(例如,硅藻土、高岭土或玻璃球)的管中,其造成经由内源(因子xii)途径来活化凝结级联。因此,act测试是基于向没有加入外源性抗凝剂的新鲜全血加入内源途径的活化剂,并且测量样本形成纤维蛋白凝块所用的时间。
已知用于分析全血的凝结监测器。例如,在美国专利no.4,756,884中已经描述了一种毛细管流动设备,其中将干燥试剂放置于分析器中,然后在引入血液滴之前将分析器加热至37℃。样本通过毛细管抽吸而与试剂混合。检测机制基于穿过样本的激光。沿着流动路径移动的血细胞产生特定于未凝块的血液的斑点图案。当血块凝块时,移动停下,从而产生特定于凝块的血液的图案。已经设计了一种具有干燥的凝结试剂的吸水性基质,用于在设备中进行单次凝结测试(参见例如美国专利no.5,344,754),该设备具有用于确定在将样本加入到基质中时电阻的改变的集成装置。对反应的检测是基于与设备的吸水区域对准并询问该区域的单独的光学组件。
凝结护理点测定对于分析流体样本或生物样本而言也是已知的。例如,用于响应于流体样本的粘度上的改变而进行多种测定的护理点盒是已知的(参见例如美国专利no.5,447,440和no.5,628,961,其全部内容通过引用并入本文),多种测定包括涉及全血凝结、凝集(agglutination)、纤维蛋白溶解测试的测定以及一般而言用于获得关于凝块或溶解(裂解)过程的信息的测定。此外,已知提供了一种装置的护理点盒,通过这种装置,可以计量血液样本并将其与活化凝结级联的主要或次要途径的试剂定量地混合,用于随后使用微制造传感器检测凝块形成(参见例如美国专利no.6,750,053;no.7,923,256;no.7,977,106和no.6,438,498,其全部内容通过引用并入本文)。
但是,被配置为执行上面提到的流体样本的凝结测定的凝结护理点测定系统一般包括以可溶解形式印刷在护理点盒或测试设备的盖子或基底上的试剂和底物。在分析期间,通过机械过程推动和拉动样本,以将试剂和底物溶解并混合到样本中。由于两个不同的凝结级联途径的交叉活化的可能性,以这种形式印刷试剂和底物的这种布置与将试剂和底物混合到样本中的要求相结合,阻碍了将凝结测试集成到单个护理点盒或测试设备中。因而,存在对允许在单个护理点盒或测试设备上执行凝结测试的组合的改进的护理点盒或测试设备设计的需要。
技术实现要素:
在一个实施例中,本发明针对一种芯片,其包括连接到第一连接引脚的分析物电极、连接到第二连接引脚的参考电极和连接到第二连接引脚和第三连接引脚的电阻器。可选地,分析物电极是电流型电极,第一连接引脚是第一电流型连接引脚。
在一些实施例中,第二连接引脚是低电导率连接引脚,并且第三连接引脚是电阻器连接引脚。可选地,电阻器是导线,并且至少该导线的几何值或该导线的材料是基于可由分析物电极检测的分析物来设定的。
在另一个实施例中,本发明针对用于识别通过芯片测量的分析物的系统。该系统包括连接到第一连接引脚的分析物电极、连接到第二连接引脚的参考电极、连接到第二连接引脚和第三连接引脚的具有预定电阻值的电阻器以及处理器,该处理器被配置为测量第二连接引脚和第三连接引脚之间的电阻,并将所测量的电阻与电子查找表内的已知值进行比较,以识别芯片测量的分析物。
在还有另一个实施例中,本发明针对一种识别通过芯片测量的一组分析物的系统。该系统包括:多个分析物电极,其中每个分析物电极连接到多个连接引脚中的一个;连接到第二连接引脚的参考电极;连接到第二连接引脚和第三连接引脚的具有预定电阻值的电阻器;以及处理器,该处理器被配置为测量第二连接引脚和第三连接引脚之间的电阻,并且将所测量的电阻与电子查找表内的已知值进行比较,以识别芯片测量的该组分析物。
附图说明
考虑到下面的非限制性附图,将更好地理解本发明,其中:
图1示出了根据本发明一些方面的盒示意图;
图2和图3示出了根据本发明一些方面的包括可溶解试剂/底物以及换能器的导管;
图4示出了根据本发明一些方面的可扩散试剂、固定化底物-聚合物层以及换能器;
图5和图6示出了为本发明的各方面提供经验证据的图;
图7a、图7b和图7c例示了根据本发明一些方面的包括(固定在聚合物层中或不在聚合物层中的)试剂和/或底物以及换能器的微环境传感器的操作原理;
图8示出了根据本发明一些方面的盒示意图;
图9示出了根据本发明一些方面的固定化试剂/底物-聚合物层的制造的侧视图;
图10-12示出了为本发明的各方面提供经验证据的曲线图;
图13a、图13b和图13c示出了根据本发明一些方面的对于可扩散试剂、固定化底物-聚合物层以及换能器的多种布置;
图14示出了根据本发明一些方面的传感器的制造的侧视图;
图15和图16示出了根据本发明一些方面的多种传感器配置;
图17示出了根据本发明一些方面的一次性感测设备的俯视图;
图18-20示出了根据本发明一些方面的多种传感器配置;
图21、图22a和图22b例示了根据本发明一些方面的用于电导型传感器的操作原理;
图23示出了根据本发明一些方面的一次性感测设备和读取设备的等距视图;
图24示出了根据本发明一些方面的一次性感测设备的俯视图;
图25和图26示出了根据本发明一些方面的一次性感测设备的一部分的俯视图;
图27-29示出了根据本发明一些方面的先进的微流体系统;
图30示出了根据本发明各方面的独立混合控制的曲线图;
图31示出了根据本发明一些方面的一次性感测设备的一部分的俯视图;
图32和图33示出了根据本发明一些方面的先进的微流体系统;
图34示出了根据本发明一些方面的一次性感测设备的一部分的俯视图;
图35示出了根据本发明一些方面的先进的微流体系统;
图36示出了根据本发明一些方面的一次性感测设备的一部分的俯视图;
图37和图38示出了根据本发明一些方面的先进的微流体系统;
图39示出了根据本发明一些方面的一次性感测设备的一部分的俯视图;
图40、图41a和图41b示出了为本发明的各方面提供经验证据的曲线图;以及
图42和图43例示了根据本发明一些方面的消除接地芯片的操作原理。
具体实施方式
本发明涉及包括用于盒设备识别的电阻器的分析测试设备和用于基于盒设备识别来测定流体样本中的凝结(coagulation)的方法,具体地,涉及使用护理点(pointofcare)测试盒中的用于盒设备识别的电阻器来执行凝结测定。
在一些实施例中,本发明涉及具有一个或多个测试传感器的集成电路芯片,该测试传感器包括涂覆有聚合物层的至少一个换能器,聚合物层包括具有可检测部分(moiety)的凝血酶可切割肽,使得一个或多个传感器以局部方式操作并且能够确定一个或多个诊断性凝块时间(例如,pt、aptt和/或act)。更具体而言,本发明涉及一种样本分析盒,其包括被配置为接纳生物样本(例如,血液、血浆、血清、尿液及其改性和稀释形式)的入口室以及流体连接到入口室并被配置为接纳来自入口室的生物样本的导管。导管可以包括第一微环境传感器和第二微环境传感器,这些传感器被配置为以局部方式操作并且能够分别确定第一诊断性凝块时间(例如,pt)和与第一诊断性凝块时间不同的第二诊断性凝块时间(例如,aptt)。
在一些实施例中,第一微环境传感器可以包括涂覆有基本上肝素中和聚合物层的至少一个换能器和具有信号部分的凝血酶可切割肽。在一些实施例中,第二微环境传感器可以包括涂覆有基本上非肝素中和聚合物层的至少一个换能器和具有信号部分的凝血酶可切割肽。第一和第二微环境传感器还可以分别包括第一和第二诊断性凝结时间试剂,这些试剂在聚合物层内(例如,试剂集成在聚合物层内)、涂覆在聚合物层上方(例如,试剂是在聚合物层顶上配制的单独的层)或者定位成基本上与聚合物层和/或至少一个换能器相邻(例如,试剂被定位在导管内,使得试剂邻接聚合物层和/或至少一个换能器或者在其交互距离内以便仍然彼此结合起作用)。
此外,本发明涉及用于在样本分析盒内控制生物样本的先进的微流体系统。在优选实施例中,样本分析盒设计使得两个物理上分开的测试(例如,pt和aptt)能够同时在相同样本分析盒内的单个生物(例如,全血)样本上进行。在一些实施例中,除了来自分析器(例如,泵)的主动流体特征,先进的微流体系统还可以包括被动流体特征(例如,阀、电阻和流体锁定元件),以将生物样本分离成样本分析盒的分开的导管/区域,使得随后每个样本段可以被移动到特定的传感器(例如,如本文详细讨论的生物传感器或微环境传感器)。在附加或替代实施例中,集成电路芯片可以包括多导管电导型电极(例如,血细胞比容条),其被配置为提供与生物样本的多个接触点,用于对传感器或微环境传感器进行先进的微流控制。
如本文所使用的,术语“微环境传感器”是指被配置为使得以足以在该传感器处实现期望信号的方式紧邻该传感器发生的任何反应在正常使用期间都将不会可检测地干扰(或冲击)在相邻传感器处发生的另一个反应的传感器。
如本文所使用的,术语“肝素中和”是指传感器的一个方面,其使得未分级肝素和低分子量肝素(lmwh)在足以跨越微环境传感器区域的区域中的生物样本中变成生物非活性的。相反,“非肝素中和”是指不冲击/影响未分级肝素或lmwh在微环境传感器区域中的生物活性的传感器的一个方面。
如本文所使用的,术语“固定的”是指在移动上基本上受限的微环境传感器的一个方面,并且因此将微环境的这个方面定位到一般区域。
如本文所使用,术语“底物”是指作为酶反应的目标的分子或形成结构基础的物理实体。
血液凝结的概述
血液凝块以及在受损伤的组织修复之后的凝块随后分解的过程被称为止血。为了让止血发生,血小板必须粘附于暴露的胶原、释放其小颗粒(granule)的内容物并聚集。血小板对暴露于内皮细胞表面的胶原的粘附是由vonwillebrand因子(vwf)介导的。血小板经由凝血酶的活化是血小板因而聚集成血小板栓子所必需的。但是,同样重要的是活性血小板表面磷脂在凝结级联的活化中的作用。
凝结级联的内源途径需要凝块因子viii、ix、x、xi和xii。还需要蛋白质前激肽释放酶(pk)和高分子量激肽原(hk或hmwk),以及从血小板分泌的钙离子和磷脂。这些内源途径成分中的每一个都导致因子x转化为因子xa。当前激肽释放酶、高分子量激肽原、因子xi和因子xii暴露于带负电的表面时,内源途径的启动发生。这被称为接触阶段,并且可以作为与循环脂蛋白颗粒(诸如乳糜微粒、极低密度脂蛋白(vldl)和氧化低密度脂蛋白(ldl))的磷脂(主要是磷脂酰乙醇胺,pe)相互作用的结果发生。这是高脂血症在促进血栓形成前状态中的作用的基础。
内源途径中因子xa的活化需要在活性血小板的表面上组合tenase复合物(ca2+以及因子viiia、ixa和x)。血小板活化的反应之一是在其表面上存在磷脂酰丝氨酸(ps)和磷脂酰肌醇(pi)。这些磷脂的暴露允许tenase复合物形成以及随后因子xa的活化。
凝结级联的外源途径响应于组织因子(因子iii)的释放而在损伤的部位处启动,并因此也被称为组织因子途径。组织因子是因子x的因子viia-催化活化中的辅因子。因子viia,包含丝氨酸蛋白酶的gla残基,以与内源途径的因子ixa一致的方式将因子x切割成因子xa。因子vii的活化通过凝血酶或因子xa的作用发生。因子xa的使因子vii活化的能力创建了内源和外源途径之间的联系。
两个途径中的共同点是因子x到因子xa的活化。因子xa将凝血酶原(因子ii)活化成凝血酶(因子iia)。凝血酶进而将纤维蛋白原转化为纤维蛋白。凝血酶的活化发生在活性血小板的表面上并且需要形成凝血酶原酶复合物。这种复合物由血小板磷脂、磷脂酰肌醇和磷脂酰丝氨酸、ca2+、因子va和xa以及凝血酶原构成。因子v是形成凝血酶原酶复合物的辅因子,类似于因子viii在tenase复合物形成中的作用。像因子viii活化一样,因子v借助于微量凝血酶活化成因子va,并且通过增加凝血酶的水平而灭活。因子va与活性血小板的表面上的特异性(specific)受体结合并与凝血酶原和因子xa一起形成复合物。
凝血酶原是72kda的单链蛋白质,在其n-末端区域中包含十个gla残基。在凝血酶原酶复合物内,凝血酶原在2个部位处被因子xa切割。这种切割生成包含通过单个二硫键保持在一起的a链和b链的2-链活性凝血酶分子。凝血酶结合到一类称为蛋白酶活化受体(par)的g蛋白偶联受体(gpcr),具体而言是par-1、par-3和par-4。par利用独特的机制将细胞外蛋白水解切割的结果转化成细胞内信号传导事件。par携带其自身的配体,在蛋白酶切割(诸如通过凝血酶)“揭露”配体之前保持无活性。在凝血酶切割之后,揭露的配体仍然是par的一部分,但现在能够与par的配体结合域相互作用,从而造成众多信号传导级联的活化。
凝结测试的概述
出血时间测定用于评估与止血相关联的血管和血小板反应。出血时间是对术前患者执行的频繁测定,以确保手术之前对血管损伤有足够的反应。如本文所讨论的,对血管损伤的快速反应(在几秒钟内发生)是血管收缩和血小板粘附到血管壁。用于确定出血时间的ivy方法涉及使用放置在前臂上并充气至40mmhg的血压袖带(血压计)。然后在前臂进行浅层切口并记录出血停止所用的时间。利用ivy方法,出血应当在1-9分钟内停止。超过15分钟的任何出血时间都将指示在血管和血小板对血管损伤的初始反应上有缺陷。较少侵入性的出血时间测定涉及使用刺血针或特殊针,利用该装置,在指尖或耳垂上进行3-4mm深的刺扎。这种出血时间测定被称为duke法,在这种测定中,出血应当在1-3分钟内停下。出血时间受血小板功能上的任何缺陷、血管疾病和血管性血友病的影响(延长),但不受其它凝结因子的影响。通常与增加的出血时间相关联的疾病包括血小板减少症、弥散性血管内凝血(dic)、巨大血小板综合症和血小板无力症。也在具有cushing综合征、严重肝病、白血病和骨髓衰竭的患者体内发现异常出血时间。
与血液凝结途径的因子相关联的缺陷也可以利用特异性测定来评定。凝血酶原时间(pt)是一种设计用于筛选纤维蛋白原、凝血酶原以及因子ii、v、vii和x中的缺陷的测定,从而测量凝结的外源途径的活性。当这些因子中的任何一个有缺陷时,则pt延长。正常的pt为11.0-12.5秒。大于20秒的pt指示凝结功能缺陷。pt通常使用是在除去血细胞之后的血浆测量的。通常将血液样本收集在包含柠檬酸盐的管中,以结合任何钙,从而抑制凝结,然后通过离心来分开细胞。将过量的钙加入等离子体的等分试样,以启动凝血。pt的最常见的测量是将患者血液的凝结时间除以平均正常pt值的时间,随后将该比率提高到与正在使用的试剂的isi(国际灵敏度指数)相对应的幂。所得到的值被称为国际标准化比率(inr)。正常值在0.8-1.2inr范围内。对于存在肝脏疾病或损伤的情况,pt被用来确定香豆素类抗凝药物(例如
活化部分凝血活酶时间(aptt)被用来测定凝结的内源途径中的缺陷。aptt测定包括加入缩短正常的凝块时间以及通常开在具有不明原因出血或凝块的患者的处方中的活化剂。该测定将评估纤维蛋白原,凝血酶原以及因子v、viii、ix、x、xi和xii的功能。在这些因子中的任何一个上的缺陷都将造成延长的aptt。正常的aptt是30-40秒。aptt是用来评定肝素抗凝疗法功效的标准测定。aptt通常是在除去血细胞之后使用血浆来测量的。通常将血液样本收集在包含柠檬酸盐的管中以结合任何钙,从而抑制凝血,然后通过离心分开细胞。向等离子体的等分试样中加入过量的钙,以逆转柠檬酸盐抗凝。延长的aptt与和凝血因子缺乏症、维生素k缺乏症、肝脏疾病、dic、血管性血友病、白血病、血友病和肝素施用期间相关联的获得性或先天性出血性疾病相关联。
活化凝血时间(act)是用来监测高剂量肝素疗法或利用比伐卢定(bivalirudin)的治疗的常见的护理点全血凝块测试。在这些设置中所需的肝素或比伐卢定剂量超出了可以利用aptt测量的范围。通常,将全血收集到包含凝结活化剂(例如,硅藻土、高岭土或玻璃颗粒)和磁力搅拌棒的管或盒中,然后测量血液凝结所用的时间。对于act的参考值通常在70秒到180秒的范围内。对于抗凝的期望范围取决于所使用的指示和测试方法。例如,在体外循环手术期间,利用肝素,期望的act范围可以超过400秒至500秒。相比之下,在接受经皮冠状动脉介入治疗的患者体内,当肝素与糖蛋白iib/iiia拮抗剂联合施用时,提倡200秒的目标act,而在不存在这种辅助疗法的情况下,250秒到350秒之间的act被定为目标。
用于确定诊断性凝块时间的电化学系统
已经使用显色(chromogenic)测定通过开发特定于特别因子的人造可切割肽底物来测量特异性凝块因子的酶活性。应当注意的是,基于凝块时间的测定(诸如aptt、pt和act)是在存在抗凝剂(诸如华法林和肝素)或有缺陷凝结因子的情况下对凝血酶形成和抑制的基本功能测量。因此,可以在基于测量纤维蛋白形成的测定与直接基于通过使用恰当的肽底物来测量凝血酶活性的测定之间作一类比,如在显色测定中。
电化学检测涉及使用工作电极(例如,电流型电极)和参考电极(例如,反参考电极),其中将恒定电位施加到工作电极,从而导致可以被量化为可记录的电流的氧化还原(redox)反应。电化学传感器被广泛应用于护理点(poc)和自测设备的开发,如葡萄糖测试条带的开发所例示的,因为它们与电子仪器的接口很简单,并减少了设备成本。诸如
图1例示了根据本发明一些实施例的用于确定诊断性凝块时间的电化学检测系统10(例如,电流型电化学检测系统)的原理。但是,应当理解的是,虽然本文描述了针对诊断性凝块时间测定(例如,pt、aptt和act测定)的具体实施例,但是本文描述的微环境传感器结构也可以用于检测潜在感兴趣的各种分析物。更具体而言,本发明的电化学检测系统不限于凝结酶的测定。例如,酶切割底物分子以产生电活性部分的任何测定都可以使用本套方法。应当理解的是,在不背离本发明的范围的情况下,可以针对本领域中的各种其它已知的酶(诸如例如葡萄糖氧化酶、乳酸氧化酶和其它氧化还原酶、基于脱氢酶的酶和碱性磷酸酶和其它磷酸酶,以及丝氨酸蛋白酶)来设计测定。例如,本发明的一些方面可以包括磷酸酶测定,其中具有磷酸部分的二茂铁(ferrocene)存在于微环境传感器层中。存在于样本中的酶磷酸酶可以渗透微环境传感器并切割磷酸基团,使得解放的二茂铁分子在电极处被氧化。因而,测得的电流可以是切割反应的速率的函数,因此与样本中的磷酸酶活性成比例。
在示例性分析中,流体样本15(例如,全血)可以被引入本发明的盒25的样本保持室20中。其后,流体样本15可以被引入到盒的分析区域30,例如,传感器区域或者包括一个或多个传感器的盒的一个或多个导管内的一个或多个位置,其中传感器用于凝结检测并且可选地用于检测目标分析物(例如,针对凝血酶原时间和肌钙蛋白i的凝血酶活性)。分析区域30包括一个或多个微环境传感器35,该一个或多个微环境传感器35包括以任何数量的不同可能布置的一个或多个电极或换能器37、一种或多种试剂40以及一种或多种底物45。电极、试剂和底物的形式和取向可以取决于本发明的实施例而广泛变化,这在下文中详细描述。
根据本发明的一些方面,一种或多种试剂40可以包括用于经由内源或外源途径诱导凝结的材料。适于诱导外源途径(例如,pt分析)的材料可以包括选自非重组组织因子、重组组织因子、合成或天然脂质、合成或天然磷脂、合成或天然脂质的组合以及合成或天然磷脂的组合所组成的组中的一种或多种组分。在一些实施例中,多种其它组分可以包括在一种或多种试剂40内,以有助于一种或多种试剂40的稳定化和沉积/分解特点。例如,一种或多种试剂40还可以包括选自诸如牛血清白蛋白(bsa)的载体蛋白、稳定剂、抗菌剂、钙盐、钾盐、水溶性聚合物、糖、明胶、琼脂糖、多糖、糖类、蔗糖、聚乙二醇、磷酸钠、甘氨酸、氨基酸、抗氧化剂、洗涤剂、缓冲盐和缓冲剂(诸如4-(2-羟乙基)-1-哌嗪乙磺酸(hepes)缓冲剂)所组成的组中的一种或多种组分。
根据本发明的不同方面,一种或多种试剂40可以包括适于诱导内源途径的材料。适于诱导内源途径(例如,aptt或act分析)的材料可包括选自鞣花酸、硅藻土、高岭土、硅藻土、粘土、二氧化硅、合成或天然脂质以及合成或天然磷脂的一种或多种组分。在一些实施例中,多种其它组分可以包括在一种或多种试剂40内,以有助于一种或多种试剂40的稳定化和/或沉积/分解特点。例如,一种或多种试剂40还可以包括选自葡聚糖、糊精、表面活性剂(tergitol)、缓冲剂、载体蛋白、氨基酸、稳定剂、抗菌剂、抗氧化剂、洗涤剂、糖类、多糖、蔗糖、聚乙二醇、聚乙二醇衍生物、甘氨酸、明胶、缓冲剂(诸如4-(2-羟乙基)-1-哌嗪乙磺酸(hepes)缓冲剂)、鼠李糖、海藻糖和糖所组成的组中的一种或多种组分。
根据本发明的一些方面,用在起电式测定中的一种或多种底物45可以具有模拟纤维蛋白原中凝血酶切割的酰胺键(amidelinkage)的酰胺键。具体来说,一种或多种底物45可以包括一种或多种凝血酶可切割肽,诸如选自h-d-phe-pip-arg、h-d-chg-abu-arg、cbz-gly-pro-arg、boc-val-pro-arg、h-d-phe-pro-arg、环己基甘氨酸-ala-arg、tos-gly-pro-arg、bz-phe-val-arg、boc-val-pro-arg、ac-val-pro-arg、ac-val-hyp-arg、ac-(8-氨基-3,6,二氧杂辛酰基-val-pro-arg、ac-gly-pro-arg、ac-(8-氨基-3,6,二氧杂辛酰基-gly-pro-arg、ac-gly-hyp-arg和hd-chg-abu-arg所组成的组中的那些。凝血酶通常在精氨酸残基残基的羧基末端(carboxy-terminus)切割酰胺键,因为键结构上与纤维蛋白原中的凝血酶切割的酰胺键相似。凝血酶-底物反应的产物包括电化学惰性化合物,诸如tos-gly-pro-arg、h-d-phe-pip-arg和/或bz-phe-val-arg-以及电活性化合物或可检测部分,优选地选自对氨基苯酚、醌、二茂铁、亚铁氰化物衍生物、其它有机金属物质、对硝基苯胺、邻联茴香胺、4,4′-苯胺、4-甲氧基-2-萘胺、n-苯基-对苯二胺、n-[对甲氧基苯基]-对苯二胺以及吩嗪衍生物所组成的组。选择三肽序列是因为它使得底物与凝血酶以外的血液蛋白酶几乎不反应,并且凝血酶与分子中精氨酸酰胺键的反应性非常类似于凝血酶与纤维蛋白原中的目标酰胺键的反应性。当一种或多种底物45存在于血液或血液衍生物流体样本或生物样本中时,经由一种或多种试剂40从(一个或多个)凝结途径的活化生成的活性凝血酶同时将一种或多种底物45和纤维蛋白原转化为它们的切割产品。电化学物质反应产物由一个或多个换能器37(例如电化学换能器)检测。
微环境传感器结构
如本文所讨论的,微环境传感器结构包括以任何数量的不同布置的一种或多种试剂和一种或多种底物,使得流体样本(例如,全血)向一种或多种试剂和一种或多种底物的引入被局部化到一个或多个传感器。具体地,微环境传感器结构被配置为一旦一种或多种试剂已变成暴露于流体样本就将一种或多种试剂和/或反应产物在物理上彼此分开,以避免级联途径的交叉活化或其它交叉传感器干扰。
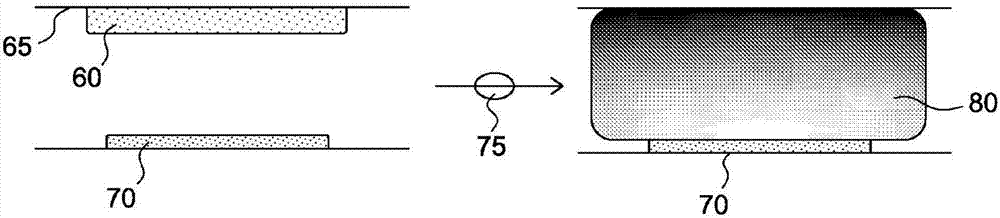
如图2中所示,传统的poc凝结测定已经采用在导管的与传感器70的表面相对的壁65(例如,盖子)上印刷为干燥物的试剂/基底60。流体样本75将需要与干燥物混合,例如通过泵振荡,以将试剂/底物60溶解到流体样本75中并生成混合物80,混合物80可以是从导管顶部到传感器70的梯度形式。但是,这种配置具有至少三个问题或缺点。首先,将仅有经由混合物80生成的电活性产物的一小部分抵达传感器70的表面并被氧化,因此电活性产物中的大部分将没有被利用。作为结果,试剂/底物60的使用不是高效的。另外,流体样本75掺入试剂/底物60,这可能是不期望的,因为试剂/底物60有可能冲击可能与流体样本75接触的其它传感器(例如,交叉传感器干扰)。其次,为了实现足够的分析精度,试剂/底物60应当尽可能快地均匀地分散在流体样本75中。对于空间和混合效率会受限的护理点设备,这可能是一个挑战。尤其是当试剂/底物60为固体形式并且在相对于流体样本75的体积的非常小的空间中时。第三,存在底物干扰试剂和/或凝结因子的可能性。例如,在凝结级联已经启动之前将底物与试剂一起混合到样本75中会显现出这种干扰。
与传统的poc凝结测定相反,本发明的一些实施例(如图3中所示)在传感器95的表面附近给出以局部方式形成的、与底物层90相关联的试剂85。例如,如图3中所示,试剂85和底物90可以在传感器95的表面上直接印刷为干燥物。流体样本100可以与试剂85和底物90反应而不用混合(例如,经由被动扩散)(虽然可能期望一定程度的混合,例如流体振荡),从而以局部方式创建从传感器95到导管顶部的梯度。有利地,直接在传感器表面上给出的试剂和底物的这种布置允许电活性产物中的大部分在传感器的表面处被氧化,并因此被利用。这种传感器布置还由于在即时传感器环境中需要的更小的样本体积而是有益的,并因此产生更集中的试剂到样本测定区。
尽管如此,在传统的poc凝结测定内明显的问题中的一些(例如,交叉传感器干扰和底物干扰的减轻)可能无法被图3中示出的布置克服。例如,紧邻传感器发生的任何反应都会潜在地干扰试剂和/或凝结因子和/或有可能干扰在相邻传感器(即,在相同导管内并且在图3中示出的传感器的大约3mm之内的传感器)处发生的另一个反应。照此,这种类型的传感器布置将不被表征为微环境传感器。但是,这些遗留的问题可以经由如下文中详细讨论的本发明的先进的微流体系统(例如,将单个样本分离成两个或更多个部分并且控制那些部分到两个或更多个导管中的移动)和/或传感器彼此的恰当间隔来克服。例如,在一些实施例中,在相邻传感器被相同的静态样本流体覆盖的情况下,为了防止交叉传感器干扰低于给定阈值,例如低于1%,可能合适的是对干扰物和总体测定时间使用基于已知扩散系数的模型,以确定传感器之间的恰当的分开距离。在其中样本是非静态的其它实施例中,针对动态混合的其它模型对于用来选择恰当的传感器分开距离可能是合适的。
在附加的或替代实施例中,已经意外地证明将衬底90固定在传感器95上解决了以上提及的问题中的许多或全部。根据本发明的这些方面,固定可以通过交联(例如,紫外光、戊二醛等)、包埋、共价结合等来实现。在图4中示出这种微环境布置的一个示例,其中底物90通过使用聚合物层105固定在传感器95的表面上。在一些实施例中,固定可以通过利用包括底物90的聚合物层105来涂覆传感器95,使得底物90经由聚合物层105固定在传感器95的表面上来执行。换句话说,底物90被形成为传感器95的表面上的固定化多孔底物聚合物层,以创建用于维持流体样本100、试剂85和底物90在传感器95的表面上以局部方式的反应的容器。流体样本100可以在传感器上形成的聚合物层105的限制内(或上方,然后扩散到其中)以局部方式与试剂85和底物90反应而不用混合(虽然可能期望一定程度的混合,例如,流体振荡)。
有利的是,直接在传感器表面上给出的固定底物的这种布置允许电活性产物中的大多数在传感器的表面处被氧化,并因此被利用。甚至更有利的是,固定底物的这种布置提供了能够将底物和电活性产品紧邻传感器维持并且因此在正常使用期间减轻了与相邻传感器的交叉传感器干扰的微环境。将底物固定在传感器上的其它潜在益处包括经由将底物与试剂分开来减轻底物干扰、减少材料使用、简化硬件和传感器设计,以及改进产品鲁棒性。
图5和图6提供了固定底物可以显著增加响应电流并提高分析物检测的精度的经验证据。具体而言,图5示出了aptt响应曲线,其中x轴是时间/秒,y轴是电流/pa。在这个示例中,底物被印刷在传感器上,一个用pva固定(aptt响应曲线106),另一个未固定(aptt响应曲线107)。aptt试剂被搀入全血中。在混合大约30秒之后,将样本从样本管中吸出并填充到用于测试的盒中。固定化底物传感器的电流(aptt响应曲线106)超过30na,而未固定化底物传感器的电流(aptt响应曲线107)仅为大约3na。它们的tmid(电流达到其中点时的时间)的变化系数分别为大约1%和2%。这个数据指示,直接在传感器上给出固定化底物使得能够从凝结底物离去基团进行立即、集中的氧化还原反应。这进而产生更快的凝块时间和更可预测的传感器响应。
在图6中示出另一个示例,其中x轴是时间/秒,y轴是电流/pa。pt响应曲线108表示未固定化底物传感器对
如图7a、图7b和图7c中所示,本发明的微环境传感器可以具有以许多不同布置定位的试剂110和固定化底物-聚合物层115,其中组分不用混合就彼此相互作用,尽管可能还是期望一定程度的振荡。例如,如图7a中所示,试剂110可以定位于固定化底物-聚合物层115内或由其封装(例如,试剂集成在固定化底物-聚合物层内)。如图7b中所示,试剂110可以涂覆在固定化底物-聚合物层115上方(例如,试剂是在固定化底物-聚合物层的顶上配制的单独的层)。如图7c中所示,试剂110可以被定位成基本上与固定化底物-聚合物层115以及传感器120的至少一个换能器相邻(例如,试剂被定位在导管内,使得试剂邻接底物-聚合物层和/或至少一个换能器,或在底物-聚合物层和/或至少一个换能器的相互作用距离内,以便仍然彼此结合起作用)。如本文所使用的,相互作用距离意味着小于传感器的最长尺寸,其中的约束是试剂被定位成与传感器在相同的平面内或在导管的相同壁/表面上。在不背离本发明的精神和范围的情况下,其它变型对于本领域技术人员来说也将是清楚的,例如,试剂110可以形成为7b和图7c中所示出的试剂110的组合,或者如图7c中所示,具有图7b中示出的试剂110的仅一部分。
如图8中所示,在一些实施例中,本发明可以针对分析盒125,分析盒125包括被配置为接纳流体样本135的入口室130和流体连接到入口室130并被配置为接纳来自入口室130的流体样本135的导管140。导管140可以包括微环境传感器的阵列,例如,第一微环境传感器145和第二微环境传感器150。第一微环境传感器145可以包括被配置为检测第一诊断性凝块时间的第一试剂155和第一底物160(例如,固定在聚合物层内的底物)。例如,第一微环境传感器145可以是包括第一试剂155和第一底物层160的pt传感器,其中第一试剂155包括如本文讨论的特定于触发外源凝块途径的一种或多种组分,第一底物层160包括如本文所讨论的具有可检测部分的凝血酶可切割肽。第二微环境传感器150可以包括被配置为检测第二诊断性凝块时间的第二试剂165和第二底物170(例如,固定在聚合物层内的底物)。例如,第二微环境传感器150可以是包括第二试剂165和第二底物层170(例如,固定在聚合物层内的试剂和底物)的aptt传感器,其中第二试剂165包括如本文所讨论的特定于触发内源凝结途径的一种或多种组分,第二底物层170包括具有可检测部分的凝血酶可切割肽。应当理解的是,尽管是关于pt传感器和aptt传感器讨论上述分析盒125,但是,在不背离本发明的范围的情况下,传感器(例如,pt传感器、aptt传感器和act传感器)的各种组合和数量是本发明预期的。例如,第一微环境传感器145可以是pt传感器,第二微环境传感器150可以是aptt传感器或act传感器。另一方面,第一微环境传感器145是aptt传感器,第二微环境传感器150是pt传感器或act传感器。另一方面,第一微环境传感器145是act传感器,第二微环境传感器150可以是aptt传感器或pt传感器。在还有其它实施例中,微环境传感器中的一个是pt传感器、aptt传感器或act传感器,另一个传感器是用于检测分析物的、与凝结相关或不相关的传感器。
有利地,本发明的微环境传感器结构被配置为物理上分开一种或多种试剂和底物,以避免一旦一种或多种试剂和底物已经变成暴露于流体样本就引起级联途径的交叉活化和/或干扰。甚至更有利的是,将固定化底物和/或试剂聚合物层结合到凝结测定中,提供了在不需要混合的情况下或在最小化混合(例如,振荡导管中的样本流体)时执行凝结测定的能力,因为凝结活化发生在传感器上方的局部且集中的区域中,随后测试反应传播到固定化层中,从而最终造成在换能器处的氧化。
固定化底物-聚合物层
在优选实施例中,为了将一种或多种测定在物理上彼此分开以避免交叉活化并促进电化学或光学信号在换能器上方的局部化,可以选择性地将固定化底物和/或试剂-聚合物层图案化在传感器上(例如,涂覆在换能器或工作电极/光学检测器上方)。如图9中所示,固定化聚合物层175可以通过旋涂或通过微分配(microdispensing)形成。更具体而言,包括一种或多种试剂和底物以及聚合物(诸如可光成形聚合物(例如,聚乙烯醇(pva))的水性聚合物基质可以被用于在换能器180上或换能器180附近固定一种或多种底物。包括但不限于蛋白质(诸如bsa)、糖或糖醇(诸如蔗糖、山梨糖醇或甘露醇)的添加剂也可以包括在水性基质中。对于聚合物化学领域的技术人员,向(一个或多个)聚合物层中加入一些物质造成对包括但不限于溶胀(swelling)反应、扩散系数、分子稳定性、孔隙率、转运、反应动力学等的许多变动。这些变动可以被用来根据需要调整微环境传感器响应。
根据本发明的一些方面,一种或多种底物可以包括选自以下组成的组中的一种或多种凝血酶可切割肽:h-d-phe-pip-arg、h-d-chg-abu-arg、cbz-gly-pro-arg、boc-val-pro-arg、h-d-phe-pro-arg、环己基甘氨酸-ala-arg、tos-gly-pro-arg、bz-phe-val-arg、boc-val-pro-arg、ac-val-pro-arg、ac-val-hyp-arg、ac-(8-氨基-3,6,二氧杂辛酰基-val-pro-arg、ac-gly-pro-arg、ac-(8-氨基-3,6,二氧杂辛酰基-gly-pro-arg、ac-gly-hyp-arg和hd-chg-abu-arg。可选地,这些底物中的两种或更多种可以混合,以获得在固定化底物和/或试剂聚合物层中期望的凝血酶活性和扩散特性。
根据本发明的一些方面,包含底物的聚合物可以包括可选地以矩阵形式的一种或多种材料。用于聚合物的材料例如可以选自pva、苯乙烯基吡啶聚乙烯醇(sbq-pva)、琼脂糖、聚丙烯酰胺、聚甲基丙烯酸甲酯、n-甲基吡咯烷酮、聚乙烯吡咯烷酮、聚酰亚胺、成膜胶乳、琼脂糖凝胶、聚氨酯、丙烯酸酯、甲基丙烯酸酯、聚乙二醇、聚乳酸、聚(乳酸乙醇酸)、羟丙基纤维素、纤维素、纤维素衍生物、羟丙基甲基纤维素醋酸琥珀酸、菊粉、果聚糖、果聚糖衍生物、聚乙醇酸、elvace、羧甲基纤维素、聚乳酸和聚(乳酸乙醇酸)所组成的组。在其中用于聚合物的材料包括纤维素(例如,羟丙基纤维素)的一些实施例中、诸如增塑剂(例如,柠檬酸三乙酯、乙酰基柠檬酸三乙酯、丙二醇、甘油、三羟甲基丙烷、聚乙二醇、脂肪酸及其衍生物)和/或交联剂(例如,羧酸、乙二醛和与纤维素的可用羟基反应的任何树脂)的添加剂也可以包括在水性基质中。材料的交联也会影响聚合物层的溶胀、渗透性、扩散、反应动力学等,以便根据需要调整传感器响应。
除了用于聚合物的材料的选择,将底物和/或试剂固定的另一个益处还包括使用固定的基质作为局部干扰物中和剂。例如,用于聚合物的材料的选择可以取决于将通过使用固定化聚合物层执行的诊断性凝块测试的类型。例如,已经有利地并且意外地发现,在固定化聚合物层中包括交联或非交联的sbq-pva将肝素中和特性或肝素不敏感性赋予到固定化聚合物层中。因此,在其中将通过使用固定化聚合物层执行的诊断性凝块测试是肝素敏感的测试(例如,已知pt测试对诸如肝素的凝块抑制剂适度敏感)的实施例中,聚合物可以被选择为肝素中和聚合物,诸如交联或非交联sbq-pva。在一些实施例中,pva可以是光活化的茋盐(stilbizoniumsalt)。
图10和图11如下面那样例示了这个概念。凝结传感器直接印刷有大sbq-pva固定化凝结底物(图10)或小sbq-pva固定化凝结底物。随后,pt凝结活化剂被印刷在固定化底物基质的顶上。然后用恰当的流体测试这些传感器,以评定凝结时间。如来自图5和图6的结果那样,印刷更多的固定化底物基质的一个益处是固定化底物基质的数量增加导致pa的增加。而且,当肝素搀入到全血样本中时,凝块时间没有如它们被预期的那样延长(图10和图11(响应曲线181)(肝素搀入)应当更类似于响应曲线182(异常长的对照流体)凝块时间,但实际上表现得更像没有肝素的全血(响应曲线183))。这些结果反映了诸如sbq-pva的聚合物的肝素中和效应。另外,施加更大量的固定的基质造成更大的中和效应(例如,比较图10和图11中的全血与具有肝素的全血之间的偏差)。图10的数据表示大基质印刷,并且显示当加入肝素到1iu/ml时存在14%的延长,而在图11中,当沉积更小印刷数量的中和基质时,存在55%的延长。在图10和图11二者中,搀入肝素的血液表现得更像未改变的全血,而不是像异常长的对照流体,从而反映了存在干扰物/肝素中和效应。这个数据显示,增加pva印刷的面积减少了肝素对pt测定的干扰效应。
图12提供了可以使用交联的sbq-pva向固定化底物pt测定赋予肝素中和特性或肝素不敏感性的进一步的经验证据。具体而言,图12示出在全血样本(响应曲线184)和全血样本(响应曲线185)执行pt测定的结果,其中全血样本搀有0.4iu/ml(响应曲线184)或1.2iu/ml(响应曲线185)的肝素,没有使用肝素酶(常规地包括在pt测试中的用于中和肝素的试剂),但是对相同尺寸的印刷加入数量增加的sbq-pva。数据显示,在肝素存在的情况下增加sbq-pva层的浓度造成相对全血的凝块时间延长的降低。这显示,不用使用昂贵的肝素酶,就可以调整pt微环境传感器响应以减少肝素的干扰。
不受理论的束缚,似乎交联或非交联的sbq-pva赋予的正电荷可以向固定化底物pt测定赋予肝素中和特性或肝素不敏感性。更具体地,sbq侧基(pendentgroup)是阳离子,pva是阴离子,并且肝素是阴离子,因此假设在电极的局部区域中的经由带正电的sbq的排斥力将肝素从固定化传感器微环境中排除,或带正电的sbq与带负电的肝素相互作用,使肝素作用于凝结因子的能力丧失。这个理论通过诸如羟丙基纤维素的阴离子聚合物可用于监测肝素疗法的诊断性凝块时间测试(例如,aptt和act)而不对测定赋予肝素中和特性或肝素不敏感性的事实得以进一步证实。
在附加或替代的实施例中,聚合物可以是非肝素中和聚合物,然后可以对其进行随后的处理或修改,以变成肝素中和聚合物。例如,在其中将通过使用固定化聚合物层执行的诊断性凝块测试是肝素敏感的实施例中,可以选择聚合物以包括至少一种非肝素中和组分,例如选自羟丙基纤维素、elvace、羧甲基纤维素、聚乳酸、聚乳酸、聚(乳酸乙醇酸)、纤维素、纤维素衍生物、羟丙基甲基纤维素醋酸琥珀酸、菊糖、果糖、果聚糖、果聚糖衍生物和聚乙醇酸所组成的组。然后可以对非肝素中和聚合物的一种或多种组分进行处理或修改,以生成肝素中和层。在一些实施例中,处理或修改可以包括改变非肝素中和聚合物的一种或多种组分的电荷、向聚合物基质中加入肝素酶和/或配置聚合物层以优先结合肝素上的硫酸基团。
在附加或替代的实施例中,聚合物可以由非肝素中和聚合物形成。例如,在其中将通过使用固定化聚合物层执行的诊断性凝块测试是用于监测肝素疗法(例如,aptt和act测试)的实施例中,聚合物层可以包括至少一种非肝素中和组分,可选地,选自羟丙基纤维素、elvace、羧甲基纤维素、聚乳酸、聚乳酸、聚(乳酸乙醇酸)、纤维素、纤维素衍生物、羟丙基甲基纤维素醋酸琥珀酸、菊糖、果聚糖、果聚糖衍生物和聚乙醇酸所组成的组。
在包括旋涂的实施例中,固定化底物和/或试剂聚合物层可以通过使用紫外光来交联使用掩模的材料,跟着除去未交联的材料,使得固定化底物和/或试剂聚合物层被选择性地涂覆,来进行光刻图案化。在包括微分配的实施例中(参见例如美国专利no.5,554,339,其全部内容通过引用并入本文),可将恰当数量的每个涂层施加到可选地由配置为容纳边界的附加结构部件所局限的区域。可替代地,可以使用表面处理(例如,暴露于气体等离子体)来控制表面能量,从而控制微分配材料的散布。
在一些实施例中,一种或多种试剂和底物187可以固定在聚合物层175内,如图13a中所示。根据本发明的这些方面,可以利用包括一种或多种底物、诸如可光成形聚合物(例如,pva)的聚合物以及一种或多种试剂的水性底物-聚合物-试剂基质来将一种或多种底物和一种或多种试剂固定在换能器180上或其附近。固定化聚合物层175可以通过旋涂或通过微分配水性底物-聚合物-试剂基质来形成。在优选实施例中,用于aptt或act测试的一种或多种试剂或底物187可以固定在聚合物层175内,并且包括一种或多种试剂或底物187的固定化试剂-底物-聚合物层175的干燥体积可以在大约0.55nl-2.0nl的范围内,优选在大约1.0nl-1.5nl的范围内。在一些实施例中,固定化聚合物层175基本上是平面的,并且具有在大约0.1μm-100μm的范围内的厚度。在附加或替代实施例中,固定化聚合物层175基本上是圆顶状的,并且具有在大约0.1μm-100μm的范围内的圆顶的最大厚度。尽管试剂在图13a中被示为非均一地局部化在聚合物层175的中心区域,但是,在优选实施例中,(一种或多种)试剂均一地分散在整个底物-聚合物层中。
在一些实施例中,一种或多种试剂或底物187可以形成为在固定化聚合物层175上方和/或与其相邻的单独的层,如图13b和图13c中所示。另外,一种或多种试剂或底物可以被局部化/固定化在一起或在分开的位置。根据本发明的这些方面,可以将一种或多种试剂或底物187旋涂或印刷在固定化聚合物层175(例如,pva层)上方和/或与其相邻,以将电化学或光学信号局部化在换能器180上方或其附近。在优选实施例中,用于pt测试的一种或多种试剂或底物187可以与固定化聚合物层175分开地形成,并且固定化聚合物层175的干燥体积可以在1.5nl-2.2nl的范围内,优选地在1.60nl-2.00nl的范围内。在一些实施例中,固定化聚合物层175基本上是平面的并且具有在大约0.1μm-100μm范围内的厚度。在附加或替代实施例中,固定化聚合物层175基本上是圆顶状的,并且具有在大约0.1μm-100μm范围内的圆顶的最大厚度。
传感器和芯片设计
微制造传感器阵列的优选实施例包括至少一个换能器(例如,工作电极或光学检测器)。例如,微制造传感器阵列可以包括一对微环境传感器或换能器,一对微环境传感器或换能器包括第一微环境传感器或换能器(例如,pt传感器)以及可选的第二微环境传感器或换能器(例如,aptt传感器)。在一些实施例中,微环境传感器或换能器可以分别制造为硅芯片上的相邻结构。
在附加或替代实施例中,除了第一微环境传感器或换能器以及可选的第二微环境传感器或换能器,微制造传感器阵列还可以包括一个或多个血液化学传感器。例如,传感器阵列还可以包括被配置为测量钠、钾、钙、氯、二氧化碳、葡萄糖、血液尿素氮(bun)、肌酐、ph、分压力co2、分压力o2、乳酸盐、镁或其它分析物中的一个或多个的一个或多个传感器。
在一些实施例中,换能器可以形成为具有涂覆有光限定的聚酰亚胺层的金表面的电极。例如,可以实现传感器阵列的优选实施例的晶片级微制造,如图14中所示。可以使用平面非导电衬底190作为传感器阵列的基极。导电层195可以通过常规手段(例如导电印刷或本领域技术人员已知的微制造技术)而沉积在衬底190上,以形成至少一个晶体管。导电层195可以包括贵金属,诸如金、铂、银、钯、铱或其合金,但也可以使用其它非反应性金属,诸如钛和钨或其合金,因为也可以使用石墨、导电聚合物或其它材料的许多非金属电极。
例如,基极电极可以包括在15μm中心上的5μm-10μm金盘(例如,7μm金盘)的方形阵列。该阵列可以覆盖区域(例如圆形区域,近似地直径为300μm至900μm,可选地直径为400μm-800μm或大约600μm),并且可以通过光图案化在由包括si、sio2、tiw和/或au或其组合的一系列层制成的衬底上方形成厚度高达1.5μm的聚酰亚胺或光致抗蚀剂的薄层。在一些实施例中,基极电极具有大约130,000平方微米至300,000平方微米的工作面积,样本的直接在传感器上方的体积可以为大约0.1μl-0.3μl,并且样本在芯片上方的体积可以为1μl-3μl。根据本发明的这些方面,在基极电极的区域中的导管的体积与传感器面积之比小于大约6μl比上大约1平方毫米,优选地小于大约50毫米比上大约2平方毫米,更优选地小于大约100μm比上大约500平方微米。因而,微电极阵列提供了作为电活性物质的可检测部分的高收集效率,伴随着来自与暴露的金属的电容相关联的任何电化学背景电流的贡献减少。具体地,绝缘聚酰亚胺或光致抗蚀剂层中的开口限定了金电极的可以氧化(诸如在每分子两个电子反应中)电活性物质(例如,对氨基苯酚)的区域。
微制造技术(例如,光刻和等离子体沉积)可被用于在受限制的空间内构造多层传感器结构。例如,在美国专利no.5,200,051中公开了用于在硅衬底上微制造电化学免疫传感器的方法,该专利全部内容通过引用并入本文,并且包括例如配制方法、用于将底物和试剂附接到包括光成形层的表面的方法,以及用于执行电化学测定的方法。
微制造的传感器阵列还可以包括电连接件195和固定化聚合物层205(如以上关于图4、图7a、图7b和图7c所讨论的),固定化聚合物层205沉积在导电层195和/或非导电衬底190的至少一部分上。在本发明中,固定化聚合物层205可以是包括具有可检测部分的凝血酶可切割肽的多孔聚合物层,可检测部分被配置为通过产生能够被测量的改变来响应活性凝血酶的存在。
如图15和图16中所示,在一些实施例中,微制造的传感器阵列可以包括硅芯片210,硅芯片210包括位于硅芯片210的不同垂直平面(a)和(b)上的微环境电流型传感器或换能器215和220。传感器215可以经由布线225连接到第一电流型引脚230(例如,临时电连接器),并且传感器220可以经由布线235连接到第二电流型引脚240(例如,临时电连接器)。在一些实施例中,传感器215可以被配置为aptt传感器,并且传感器220可以被配置为pt传感器,两者都形成在单个硅芯片210上并且定位在护理点测试盒的一个或多个导管内。如图15中所示,传感器215可以被构造成具有优选地包括在硅芯片210的上部区域中的多个同心环(例如,2、3、4或更多个同心环)的目标分划版设计,并且传感器220可以被构造成具有优选地包括在硅芯片210的下部区域中的多个同心环(例如,2、3、4或更多个同心环)的目标分划版设计。具体而言,芯片210上的传感器215和220的设计和布置是基于针对传感器215和220中的每一个的印刷和性能特点来选择的。但是,本领域普通技术人员应当理解的是,在不背离本发明的精神和范围的情况下,对于传感器的任何设计或布置都是预期的。此外,尽管图15中的示例中的传感器215和220是电流型传感器,但是使用其它电化学或光学传感器(例如光波导和电荷耦合器件(ccd)相机芯片)的其它电化学过程或光学过程可以被使用。例如,可以使用电位型传感器来检测离子物质,诸如na+或k+。
如本文所述,电流型传感器或换能器215和220可以形成为具有金表面的电极,其中金表面暴露(例如,没有聚酰亚胺或光致抗蚀剂覆盖)于导管的内部环境并且配置为直接接触部署在导管内的生物样本。布线225和235可以形成为具有涂覆有光限定的聚酰亚胺或光致抗蚀剂层的金表面,使得布线225和235不会暴露于部署在导管内的生物样本从而与其绝缘。可以将布线225和235形成为包括被配置为容纳固定化试剂-底物-聚合物层的容纳环结构245和250。例如,固定化试剂-底物-聚合物层(如以上关于图4、图7a、图7b和图7c所讨论的)可以沉积在容纳环结构245和/或250内的传感器215和/或220的至少一部分上。布线225和235分别终止在用于与分析器或盒读取器(例如,如美国专利no.4,954,087中描述的
在本发明的优选实施例中,分析器经由第一电流型引脚230和第二电流型引脚240在电流型传感器215和220中的每一个与参考电极(以下关于图17详细描述)之间施加电位,并且测量由经切割的底物生成的电流改变作为电化学信号。该电化学信号与生物样本中的产物的浓度成比例。电流型传感器215和220相对于参考电极具有近似+0.4v的施加电位,并且在另一个优选实施例中,电流型传感器215和220相对于参考电极具有近似+0.1v的施加电位。在近似+0.1v时由酶反应产物生成的信号与在近似+0.4v时由未反应的底物生成的信号是可区分的。
在使用附接到n-苯基-对苯二胺或n-[对甲氧基苯基-]-对苯二胺可检测部分的凝血酶可切割肽tos-gly-pro-arg-、h-d-phe-pip-arg、或bz-phe-val-arg的本发明的实施例中,在电压近似+0.4v时检测完好的底物。在电压近似+0.1v时检测到起电反应产物n-苯基-对苯二胺或n-[对甲氧基苯基-]-对苯二胺。因此,在这些实施例中,分析器通过生成与生物样本中的底物的浓度成比例的电化学信号向电流型传感器215和220施加电位。而且,分析器通过生成与生物样本中产物的浓度成比例的电化学信号向电流型传感器215和220施加电位。在通过凝血酶来水解底物之后,形成在电流型传感器215和220处反应的产物,该产物生成与底物所生成的信号可区分的信号。
应当注意的是,用于电流上检测底物和产物的确切电压将取决于底物和产物的化学结构而变化。重要的是,用于检测底物和产物的电压上的差异大到足以防止读数之间的干扰。对于一些底物,电化学检测底物所需的电压非常高,以至于超出水性缓冲溶液中的实际测量。在这些情况下,仅必需的是产物是电流型可检测的。
在一些实施例中,图15中所示的硅芯片210还可以包括多导管电导型传感器255和260(例如,血细胞比容传感器)。电导型传感器255和260被配置为确定生物样本在电流型传感器215和220处的到达和/或离开。更具体而言,电导型传感器255和260正交于导管或传感器导管的长度,并且针对每个传感器的电极对之间的电阻可以被用来监测生物样本的流体前沿的相对位置。在极端情况下,开路读数指示生物样本已经被推离电流型传感器215和220,闭路读数指示电流型传感器215和220被生物样本覆盖。
如图15中所示,电导型传感器255可以包括位于电流型传感器215的中点的上游的至少两个电极265和270(即,第一电极对)。电极265和270可以分别经由布线275和280连接到电导型低引脚285和ac源或电导型高引脚290(例如,临时电连接器)。布线275和280可以用金表面形成,其中金表面涂覆有光限定的聚酰亚胺或光致抗蚀剂层,使得布线275和280不会暴露于部署在导管内的生物样本从而与其绝缘。电导型传感器260可以包括位于电流型传感器220的中点的下游的至少两个电极295和300(即,第二电极对)。电极295和300可以分别经由布线275和280连接到电导型低引脚285和ac源或电导型高引脚290(例如,临时电连接器)。照此,在一些实施例中,流体在第一流体导管中抵达第一电极对(例如,在到达电流型传感器215之前),然后,随后在第二流体导管中到达第二电极对(例如,在到达电流型传感器220之后)。
如图16中所示,在另一个实施例中,硅芯片210还可以包括第三电导型传感器301,第三电导型传感器301包括至少两个电极302和303。电极302和303可以经由布线304连接到第二ac源或电导型高引脚305(例如,临时电连接器)。根据本发明的这些方面,第三传感器的使用允许两个二进制流体检测事件,例如两者均为断开/接通(off/on),这在具有当前电路系统和软件限制的情况下是可以容易检测的。在(图15中示出的)两个电导型传感器的情况下,当前电路系统和软件依赖于快速连续地检测样本电阻上的两次“下降”的能力。通常,第一次下降大,因为它从干燥状态变为润湿状态并且电路是完整的。当样本到达第二流体导管时的电阻上的第二次下降小得多并且因此更加难以与信号噪声和信号的小改变区别开。另外,每个电阻改变的振幅取决于样本特性而变化。因此并且有利地,在一些实施例中,具有三个电导型传感器的布置允许使用(图15中示出的)电导型传感器255和(图16中示出的)电导型传感器301的两个可切换导电路径。
如图17中所示,在一些实施例中,微制造传感器阵列还可以包括接地芯片306,接地芯片306包括参考传感器或电极307。根据本发明的其中传感器215和220是电流型传感器的方面,参考电极307可以被配置为反电极,以使电路完整。在优选实施例中,参考电极307可以包括沉积在固体衬底上的银金属(ag)及其银盐(agcl)(即,ag/agcl参考电极)。参考电极307可以经由布线308连接到参考引脚309(例如,临时电连接器)。微制造传感器阵列可以被设计为使得接地芯片306位于半导体芯片210的上游,如关于图15和图16所进一步详细讨论的。但是,应当理解的是,在不背离本发明的精神和范围的情况下,对于传感器和接地芯片的其它布置是可能的。例如,传感器阵列还可以包括一个或多个附加的传感器芯片(未示出),它们被配置为检测潜在感兴趣的各种分析物,诸如肌钙蛋白i、肌钙蛋白t、ckmb、降钙素原、bhcg、hcg、ntprobnp、probnp、bnp、肌红蛋白、甲状旁腺激素、d-二聚体、ngal、半乳凝素-3和/或psa以及其它分析物。
如图18中所示,在优选实施例中,微制造传感器阵列可以包括硅芯片310,其中硅芯片310包括位于硅芯片310的相同垂直平面(a)上的微环境电流型传感器或换能器315和320。传感器315可以经由布线325连接到第一电流型引脚330(例如,临时电连接器),并且传感器320可以经由布线335连接到第二电流型引脚340(例如,临时电连接器)。在一些实施例中,传感器315可以被配置为aptt传感器,并且传感器320可以被配置为pt传感器,两者都形成在单个芯片310上并且定位于护理点测试盒的导管内。如图18中所例示的那样,传感器315可以在传感器320的位置的上游位置以环形形状设计进行构造,其中传感器320以包括多个同心环(例如,2、3、4或更多个同心环)的目标分划版设计进行构造。具体而言,芯片310上的传感器315和320的设计和布置是基于针对传感器315和320中的每一个的印刷和性能特点来选择的。但是,本领域普通技术人员应当理解的是,在不背离本发明的精神和范围的情况下,对于传感器的任何设计或布置都是预期的。此外,尽管图18中的示例中的传感器315和320是电流型传感器,但是使用其它电化学或光学传感器的其它电化学过程或光学过程可以被使用。例如,可以使用电位型传感器来检测离子物质,诸如na+或k+。
如本文所述,可以将传感器或换能器315和320形成为具有金表面的电极,其中金表面暴露(例如,没有聚酰亚胺或光致抗蚀剂覆盖)于导管的内部环境并且被配置为直接接触部署在导管内的生物样本。可以将布线325和335形成为具有涂覆有光限定的聚酰亚胺层的金表面,使得布线325和335不会暴露于部署在导管内的生物样本从而与其绝缘。可以将布线325和335形成为包括被配置容纳固定化试剂-底物-聚合物层的容纳环结构345和350。例如,固定化试剂-底物-聚合物层(如以上关于图4、图7a、图7b和图7c所讨论的)可以沉积在容纳环结构345和/或350内的传感器315和/或320的至少一部分上。布线325和335分别终止在用来与分析器或读取器中的连接器(例如,如美国专利no.4,954,087中所述的
在一些实施例中,硅芯片310还包括集成的参考电极355。根据本发明的其中传感器315和320是电流型传感器的方面,参考电极355被配置为反电极,以使电路完整。参考电极355可以包括沉积在固体衬底上的银金属(ag)及其银盐(agcl)(即,ag/agcl参考电极)。参考电极可以经由布线360连接到ac接地和参考引脚365(例如,临时电连接器)。可以将布线360形成为具有金表面,其中金表面涂覆有光限定的聚酰亚胺或光致抗蚀剂层,使得布线360不会暴露于部署在导管内的生物样本从而与其绝缘。在优选实施例中,如图18中所例示的那样,以棋盘图案设计参考电极355,以改进参考电极355的表面的润湿性。具体而言,已经意外地发现,可以通过使用棋盘图案来改进参考电极355的润湿性,因为agcl是相对疏水的,并且会在使用agcl的固体贴片时促进在参考电极355的表面上方形成气泡,这造成电路不良。
如以上关于硅芯片310详细讨论的并且如图19中所示的,在本发明的优选实施例中,分析器经由第一电流型引脚330和第二电流型引脚340在电流型传感器315和320中的每一个与参考电极355之间施加电位,并且测量由经切割的底物生成的电流改变作为电化学信号。该电化学信号与生物样本中的产物的浓度成比例。电流型传感器315和320相对于参考电极355具有近似+0.4v的施加电位,并且在另一个优选实施例中,电流型传感器315和320相对于参考电极355具有近似+0.1v的施加电位。在近似+0.1v时由酶反应产物生成的信号与在近似+0.4v时由未反应的底物生成的信号是可区分的。
返回参考图18,在一些实施例中,硅芯片310还可以包括电导型传感器370和375(其也可以作为血细胞比容传感器起作用)。电导型传感器370和375可以被分离,以形成两个传感器对,在芯片310的每一端处,有一个传感器对。电导型传感器370和375被配置为分别确定生物样本在电流型传感器315和320处的到达和/或离开。更具体而言,电导型传感器370和375位于正交于导管或传感器导管的长度的弧中,并且针对每个传感器的电极对之间的电阻可以被用于监测生物样本的流体前端的相对位置。在极端情况下,开路读数指示生物样本已经被推离电流型传感器315和320,闭路读数指示电流型传感器315和320被生物样本覆盖。
如图20中所示,电导型传感器370可以包括定位成相距彼此预定距离(d1)的至少两个电极380和385(即,第一电极对)。在一些实施例中,可以相对于电流型传感器315的中点(v)在硅芯片310上定位电导型传感器370(例如,中点(x)的上游、下游或与中点(v)对齐)。电极380可以经由布线390连接到ac源引脚395(例如,临时电连接器)。电极385可以经由布线400、参考电极355和布线360连接到ac接地和参考引脚365。可以将布线390和400形成为具有金表面,其中金表面涂覆有光限定的聚酰亚胺或光致抗蚀剂层,使得布线390和400不会暴露于部署在导管内的生物样本从而与其绝缘。
电导型传感器375可以包括定位成相距彼此预定距离(d2)的至少两个电极405和410(即,第二电极对)。在一些实施例中,可以相对于电流型传感器320的中点(x)在硅芯片310上定位电导型传感器375(例如,中点(x)的上游、下游或与中点(x)对齐)。电极405可以经由布线415、参考电极355和布线360连接到ac接地和参考引脚365。电极410可以经由布线420和布线390连接到ac源引脚395。可以将布线415和420形成为具有金表面,其中金表面涂覆有光限定的聚酰亚胺或光致抗蚀剂层,使得布线415和420不会暴露于部署在导管内的生物样本从而与其绝缘。
在优选实施例中,电导型传感器370和375被配置为分别检测导管内的生物样本在电流型传感器315和320处的到达。如图21中所示,可以基于当生物样本抵达电导型传感器370时的第一电阻下降425和当生物样本抵达电导型传感器375时的第二电阻下降430的确定来检测生物样本在电流型传感器315和320处的到达。在附加或替代实施例中,电阻在电导型传感器370和375中的任何一个或两者处的上升或尖峰(未示出)的确定可以被用来检测导管内位于电流型传感器315和320中的任何一个或两者上方的气泡的存在。
对于电导型传感器370和375的电阻分布应当优选地提供两个明确限定的具有大致相等幅度的电阻下降。在一些芯片设计中,如图22a所示,电导型传感器435和440可以被配置为在芯片的在相应的电流型传感器445和450附近的相对端上的分开的条。但是,发现对于这种设计的电阻分布455常常包括附加的步骤460,这归因于样本由于参考电极465的疏水性质而临时停在参考电极465上。应当理解的是,因为参考电极465或到达第二电导型传感器440处的样本的润湿,这会使得难以破解第二电阻下降。此外,两个步骤之间的时间相当短,从而使得定时困难,并且第二次到达的电阻下降相比第一次下降小得多,这使得检测困难。
因此,如图22b中所示,在本发明的优选实施例中实现的芯片设计利用每个分别分离成包括以预定距离(d1)和(d2)间隔开的至少两个电极380、385和405、410的电导型传感器370和375。如电阻分布470中所例示的,主导电阻下降425和430发生在两对电导型传感器370和375处。因此,减少了由参考电极355的润湿观察到的附加的(图22a中所示的)电阻下降460的影响。另外,电导型传感器370和375被放置在芯片的前面和后面,以增加电阻下降425和430之间的时间,以更好地区别开电阻下降425和430。而且,在一些实施例中,在电极380和385之间提供的间隔或预定距离(d1)是比在电极405和410之间提供的间隔或预定距离(d2)大“n”的值,使得第二电阻下降430的幅度在替代芯片设计的(图22a中所示的)电阻下降475之上增加。例如,(d1)可以被构造为(d2)的两倍大,以实现第二电阻下降的幅度的大约1000欧姆的增加。在(d2)之上增加(d1),有效地在对于图22a中所示的芯片设计的电阻下降比之上增加了对于图22b中所示的芯片设计的电阻下降比。有利地,电阻下降的这种增加允许在接通/前向马达或泵位置480期间更好地检测生物样本在电导型传感器370和375处的到达。
在一些实施例中,本发明的过程可以包括以受控的速度将生物样本在芯片上方连续地向前和向后移动。控制电导型传感器370和375保持为开路和闭路的时间,这控制生物样本改变方向的位置。例如,分析器内的气动泵可以被配置为使导管内的生物样本振荡,其中生物样本的后缘(trailingedge)位于电导型传感器370的区域内,以便溶解样本在后缘附近的那部分中的底物。振荡的频率可以处于0.2赫兹至10赫兹的范围内,以得到1秒至100秒范围内的周期。在优选方法中,振荡的频率可以处于大约1.5赫兹的范围内,以得到大约20秒的周期。在另一个优选方法中,振荡的频率可以处于大约0.3赫兹,并且电流型传感器315和320(如图20中所示)可以被配置为在每次振荡时生成信号。如果红细胞存在于生物样本中,则振荡可以处于足够防止红细胞在电流型传感器315和320上沉降的频率。
在一些实施例中,电流型传感器315和320在每次生物样本被振荡经过电流型传感器315和320时确定产物的浓度。例如,对于电流型传感器315和320中的每一个的第一电流型传感器信号可以由分析器存储,并且来自电流型传感器315和320的后续信号可以被存储并与第一和其它存储信号进行比较,以便确定电流型传感器信号的最大改变比。然后可以分析这些数据点,以确定电流型传感器信号的最大改变比的固定分数。因此,这些数据点可以被用来确定对于电流型传感器315和320中的每一个的感兴趣的凝结参数。
在替代实施例中,可以将传感器或换能器形成为光学检测器,例如ccd相机芯片和光波导。光学检测器可以是来自可检测部分的荧光、化学发光或生物发光发射的检测器或者是可检测部分的吸光度的检测器。在这种实施例中,可检测部分可以是光学染料、荧光发射体、化学发光发射体或者生物发光发射体。
在其它实施例中,可以将传感器或换能器形成为测试条带,例如葡萄糖测试条带,如美国专利申请no.13/724,348中所述,该申请的全部内容并入本文。例如,测试条带可以包括在本文所述的盒内。在一些实施例中,样本可以手动地放置在测试条带上,照此,本文所述的微流体系统将不需要被包括在这种实施例中。如本领域中众所周知的,葡萄糖测试条带设备可以包括被动毛细管流体元件,以将样本输送到传感器或传感器阵列。照此,在不背离本发明的精神和范围的情况下,葡萄糖测试条带的元件、特征和功能可以适于本发明。
用于样本分析的系统和过程
如图23中所示,本发明的系统500可以包括自持式(self-contained)一次性感测设备或盒505和读取设备或仪器510(例如,分析器)。在一些实施例中,盒505是被配置为在单次使用之后可丢弃的单次使用设备。要测量的流体样本(例如,全血)被吸入到盒505中的样本入口孔或端口515中,并且盒505可以通过槽状开口520插入读取器510中。读取器510可以包括处理器,处理器被配置为执行分析物浓度的测量、电阻的测量,识别芯片被配置为测量的分析物或分析物集合,和/或确定流体样本内的诊断性凝块时间,如本文进一步详细讨论的。由读取器510执行的测量和确定可以输出到显示器525或经由读取器510上的端口535到计算机端口540而输出到其它输出设备,诸如打印机或数据管理系统530。传输可以经由wifi、蓝牙链接、红外线等。在盒505中的传感器545(例如,微环境传感器)是基于电化学操作原理的实施例中,(例如,第一传感器和可选的第二传感器)可以被配置为经由电连接器550与读取器510进行电接触。例如,连接器可以具有在共同拥有的美国专利no.4,954,087中所公开的设计,该专利全部内容通过引用并入本文。在一些实施例中,pt和aptt传感器可以被配置为经由电连接器550与读取器510内的测试仪表的电连接器连接(参见例如美国专利no.5,096,669和no.4,954,087,其全部内容通过引用并入本文)。读取器510还可以包括用于盒505中的自动流体流动补偿的方法,如在共同拥有的美国专利no.5,821,399中所公开的,该专利全部内容也通过引用并入本文。
在一个实施例中,如图24中所示,自持式一次性感测设备或盒555可以包括盖子560、基底565以及部署在基底565和盖子560之间的薄膜粘合垫圈(未示出)。盒555可以被配置为插入到读取器510中,因此,盒555可以出于这个目的的包括多个机械和电连接件(未示出)。有利地,盒555的特征在于,一旦流体或生物样本被装载在盒555内,流体或生物样本的分析就可以完成,并且盒555可以被丢弃,而不用操作者或其他人接触流体或生物样本。
参考图24,盖子560可以由刚性材料(优选地是塑料)制成,并且能够在柔性铰链区域570、575和580处重复变形而不发生开裂。盖子560可以包括通过柔性铰链570附接到盖子560的主体的盖585。在操作中,在将流体或生物样本通过样本进入端口595引入样本保持室590之后,盖585可以固定在样本进入端口595的入口的上方,从而防止样本泄漏。盖585可以通过钩子600保持就位。盖子560还可以包括相对于盖子560的主体可移动并且可以通过柔性铰链区域575和580附接到盖子560的两个可变形构件605和610。
可变形构件610可以被配置为通过第一泵送装置进行操作,使得力被施用在包括腔615和垫圈的空气气囊上。可变形构件610的操作使盒555的导管内的流体移位。可变形构件605可以被配置为通过第二泵送装置进行操作,使得力被施用在垫圈上,垫圈由于在其中切开的裂缝而可能变形。在一些实施例中,垫圈的变形可以将压力传送到位于腔620中、填充有流体(近似130μl的分析/洗涤溶液、对照流体或校准物流体)的含流体箔包上,从而使箔包破裂,并将流体排出到导管625中,以便在样本分析期间随后在其它导管中使用。应当理解的是,虽然凝结测定形式一般不需要使用这些流体,但是这些流体在将凝结测试与其它测试组合的单个设备中一般可以是需要的,这些流体例如为用于分析物(诸如bnp和肌钙蛋白)的免疫测定中的洗涤流体,以及化学测试(诸如钾、肌酐和葡萄糖)中的校准物流体。在替代实施例中,垫圈的变形可以将压力传送到包括腔620的空气气囊上,用于使盒555的导管内的流体移位。在附加的实施例中,第二泵送装置可以不对腔620进行操作,代替地,腔620可以被配置为废料室。
应用到盒555的由读取器510(关于图23所讨论的)中的机构生成的在盒555中的附加动作可以被用来在样本保持室590和导管630内的受控位置处将一个或多个空气段注入流体或生物样本中。空气段可以被用来以极少量的流体(例如,有限的洗涤循环,其中洗涤体积可以少于流体或生物样本的体积的50倍,和/或少于三个独立循环的清洁洗涤缓冲剂(例如,利用新鲜洗涤缓冲剂的三个独立洗涤步骤))来洗涤传感器阵列的传感器表面和周围的导管630,如免疫测定程序领域的普通技术人员所应当理解的。例如,盖子560还可以包括由薄的柔韧膜覆盖的孔。在操作中,施用在膜上的压力可以通过垫圈中的小孔将一个或多个空气段排出到导管630中。在一些实施例中,导管630的横截面面积可以在大约0.1mm2至大约10mm2的范围内。
在一些实施例中,盖子560的下表面还包括样本保持室590、导管630和另一个导管635(例如,废料导管)。样本保持室590和导管630可以包括通过对流体或生物样本的流动提供阻力件来控制流体流动的一个或多个收缩件或毛细管止动件640和642。可选的例如干燥试剂涂层的涂层(未示出)可以在导管630上提供疏水表面,其与垫圈孔一起控制样本保持室590和导管635之间的流体流动。在组装好的盒555中,样本保持室590可以被配置为将样本进入端口595连接到导管630。
根据本发明的其中有多个芯片(例如,接地芯片和传感器芯片)的各方面,切口645可以收容一个或多个传感器芯片650,该一个或多个传感器芯片650包括至少一个传感器655(例如,pt、aptt或act微环境传感器),或响应性表面,连同可选的一个或多个电导型传感器660。如果需要,则切口665可以收容包括接地电极675的接地芯片670,作为电化学传感器的回路电流路径,并且还可以收容可选的电导型传感器。根据本发明的其中仅有单个芯片(例如,组合的接地和传感器芯片)的各方面,切口665和接地芯片670可以不包括在盒555中。
在一些实施例中,可以提供计量装置,其包括由收缩件或毛细管止动件640划界的样本保持室590,并且沿样本保持室590的长度具有从包括腔615的气囊的空气入口点680。在入口点680处施用的空气压力驱动计量体积的样本经过收缩件或毛细管止动件640。因此,计量体积的样本可以通过空气入口点680和收缩件或毛细管停止件640之间的样本保持室590的体积来预先确定。当可变形构件605移位时,对应于该体积的数量的样本可以移位到导管630中。因此,该布置可以提供用于将计量数量的未计量的样本输送到盒555的各种下游导管的计量装置。如果需要量化分析物,则在一些实施例中计量可能是有利的。因此,操作者可以不必在测量之前准确地测量样本的体积,从而节省时间、精力并提高准确度和再现性。
在优选实施例中,本发明是用于使用盒来确定全血样本中的诊断性凝块时间的过程。该过程可以包括通过样本进入端口595(如图24所示)将未计量的流体样本引入到盒555的样本保持室590中。在这个阶段,毛细管止动件640防止流体样本通入导管630,并且样本保持室590填充有样本。将盖585闭合,以防止流体样本从盒555泄漏。然后,盒555可以被插入读取设备或装置510中,如图23中所示并且在美国专利no.5,821,399中进一步公开的,该专利全部内容通过引用并入本文。在一些实施例中,将盒插入读取装置510中激活一种机构,当将包装压靠在钉(未示出)上时,该机构刺穿位于腔620中的含流体包装。由此,流体可以被排出到一个或多个导管(例如,导管630)中,从而顺序地到达传感器区域处。其后,泵装置(例如,气动泵)的操作对包括腔615的空气气囊施加压力,从而迫使空气通过导管在空气入口点680处进入样本保持室590。毛细管止动件640界定原始流体样本的计量部分。然后,由包括腔615的空气气囊内产生的空气压力将样本的计量部分通过毛细管止动件640排出。样本通入导管630并与一种或多种试剂、一种或多种底物(例如,固定化试剂-底物-聚合物层)和/或包括一个或多个换能器的一个或多个传感器以及可选地位于切口665内的参考电极接触。
也如图24中所示,为了促进(i)一种或多种试剂扩散进入流体样本中,或样本扩散进入包含试剂的聚合物层中(取决于具体的实施例),(ii)通过两种途径之一活化凝结级联,以生成凝血酶,(iii)活性凝血酶扩散通过固定化底物和/或试剂聚合物层,(iv)凝血酶可切割肽的切割,(v)可检测部分的活化,和/或(vi)通过至少一个换能器对可检测部分的检测,可以将流体样本定位在导管630内,
以接触一种或多种试剂和/或底物、一个或多个固定化聚合物层和/或一个或多个传感器(例如,微环境传感器)达预定的时间段。
本文通过在其中确定对于流体样本的诊断性凝块时间的具体的实施例来例示盒的使用,其中流体样本被引入到盒的样本保持室中,跟着盒被插入到盒读取设备中。盒读取设备通过焊盘与电极/传感器电接触,并执行某些诊断性测试。诊断性测试通过使用电导型电极确定导管中是否存在流体或样本;确定电极中是否存在电气短路;并且确保传感器和接地电极在测定循环之前被热平衡至优选37℃。
在优选实施例中,可以使用流体样本的计量部分(优选地在4μl和200μl之间,更优选地在4μl和20μl之间,最优选地是7μl)来执行测定,而其子体积(在0.1ul和3.5ul之间)可以被用来接触电极/传感器。相对于传感器区域定位流体样本,使得流体样本的一部分定位在一种或多种试剂、一种或多种底物(例如,固定化聚合物层)以及包括接地电极和一个或多个换能器的一个或多个传感器上方。在630(或在例如在图24、图25、图26、图31、图34、图36中的测定导管中的任一个)的上部或下部中振荡预定的时间段(例如0-10秒)之后,样本可以移动到第二导管或用于随后的混合或相互作用的区域,或者在信号生成之前变成静止的或变成锁定在(一个或多个)导管或盒内。可以使用传感器芯片上的一个或多个电导型传感器来控制这些过程,如关于图20、图21、图22a和图22b所讨论的。在随后的流体分离或转移过程中,可以有通过压力或尺寸受控的元件的通道。稍后将更详细地描述这些方面。
在样本和传感器之间的接触时间中,(i)修正试剂有时间扩散到流体样本中,或者流体样本有时间扩散到修正试剂中(修正试剂在一些实施例中可以被固定),以便促进通过两种途径之一进行的凝结级联的活化,以生成凝血酶,(ii)活性凝血酶有时间扩散通过底物层(例如固定化底物和/或试剂聚合物层),并且切割凝血酶-可切割肽,以及(iii)活性可检测部分有时间被至少一个换能器检测到。
盒的流体功能和配置
在优选实施例中,提供了一次性盒配置,使得能够同时或随后在相同的一次性盒内的单个全血样本上进行两个物理上分开的测试。一次性盒配置的元件除了来自分析器的主动机构(例如,泵)之外还包括使用被动流体特征件(例如,阀、阻力件和流体锁定元件)将样本分离成分开的导管/区域,使得每个样本段随后可以被移动到特定的传感器。本文讨论了许多分开配置,这些配置允许将样本维持在单个通道中,将样本分离到分开的流体导管中,从而在每个导管中控制流体移动,例如将干燥的试剂和/或底物混合到样本段中,和/或随后将样本停放(并锁定)在传感器上方用于分析。但是,应当理解的是,在不背离本发明的精神和范围的情况下,可以对配置进行各种修改、替换、省略和改变。
在以下的每个实施例中,样本可以由用户插入盒的入口室中。然后将盒闭合并插入分析器。盒中形成为空气气囊的隔膜泵以及分析器中的机械柱塞(如关于图24所讨论的)被用来将样本移动穿过整个盒。
关于图25-图29讨论的本发明的实施例被配置为分离单个生物(例如全血)样本,并允许在两个导管中独立混合控制至少两个样本段,其中特定于每种测试的干燥试剂和/或底物位于两个导管中。根据本发明的各方面,底物可以或可以不被局部化(例如,根据一些实施例,可以或可以不被固定化)在传感器上方。溶解到样本中的试剂和/或底物保留在形成它们的导管内,因此消除了测试之间的任何潜在的交叉干扰。这是对于可能存在化学或物理干扰的任何两个测试(例如,凝结测试)的多路复用的重要元素。
如图25中所示,本发明的一些实施例与用于盒700的接地传感器第一配置有关,其中导管705在接地芯片720之前或其上游在结707处分离成第一导管710和第二导管715。第二导管715可以包括收缩件或毛细管止动件725,并且被配置为在传感器芯片730的包括至少一个分析物检测电极的下部区域(如关于图15和图16所描述的)上方经过。第一导管710被配置为在接地芯片720(例如,如关于图17所描述的具有参考传感器的接地芯片),以及传感器芯片730的包括至少一个分析物检测电极的上部区域(如关于图15和图16所描述的)上方经过。盒700还可以包括定位于第一导管710内的至少一个流体锁定机构735(例如,薄膜海绵阀、微通道毛细管或微阵列阀)和从第一导管710和第二导管715通向腔747的一个或多个导管740(例如,出口)。在这个实施例中,腔747被配置为废料室(如关于图24所讨论的)。但是,本领域技术人员应当理解,一个或多个导管740可以被配置为通向废料导管(如关于图24所讨论的)。
图26示出了用于盒750的替代的接地传感器第一配置,其中导管755在接地芯片775之前或其上游在结760处分离成第一导管765和第二导管770。第二导管770可以包括收缩件或毛细管止动件780,并且被配置为在传感器芯片785的包括至少一个分析物检测电极的下部区域(如关于图15和图16所描述的)上方经过。第一导管765被配置为在接地芯片775(例如,如关于图17所描述的具有参考传感器的接地芯片)以及传感器芯片785的包括至少一个分析物检测电极的上部区域(如关于图15和图16所描述的)上方经过。盒750还可以包括定位于第一导管765内的至少一个流体锁定机构790。以及分别从第一导管765和第二导管770通向废料导管797(如关于图24所讨论的)的一个或多个导管793和795(例如,出口)。
如图27中所示,在盒700和750的操作期间,通过使用双向隔膜泵(如关于图24所描述的)将流体或生物样本从入口或样本保持室移动到导管705/755。生物样本在结707/760(例如,t-结)处被分离成第一部分和第二部分。在优选实施例中,定位在第二导管715/770内的收缩件或毛细管止动件725/780(例如,毛细管爆破阀或流体阻力件/收缩件)引起样本优先填充第一导管710/765并在接地芯片720/775和在传感器芯片730/785的上部区域内的至少一个电极(例如,aptt电极)上方移动。因此,隔膜泵可以在第一导管710/765中来回移动样本的第一部分,以将试剂和/或底物溶解并混合到样本中,而第二导管715/770中的样本的第二部分既不撤出第二导管715/770也不移动到传感器芯片730/785。一旦在第一导管710/765中已经实现了足够的混合,就在传感器芯片730/785上方将样本的第一部分推到流体锁定机构735/790(例如,在模塑塑料部件之一或双面粘合剂中形成的微通道或薄膜“海绵阀”),其提供耐压性并且有效地将样本的第一部分锁定到第一导管710/765中。其后,可以开始第一导管710/765中的分析。当第一导管710/765中的耐压性显著增加时,样本的剩余的第二部分被迫使通过第二导管715/770中的收缩件或毛细管止动件725/780。然后可以将类似的来回混合过程应用于第二导管715/770。一旦试剂和/或底物被混合到样本的第二部分中,样本的第二部分就可以定位于传感器芯片730/785上方,并且可以开始第二导管715/770中的分析。例如,第二部分可以在传感器芯片730/785的下部区域内的至少一个电极(例如,pt电极)上方移动通过第二导管715/770。根据本发明的各方面,传感器芯片730/785的上部和下部区域内的电极可以通过使用如关于图2、图3、图4、图7a、图7b、图7c和图9所讨论的一种或多种布置在有或没有试剂/底物的固定化的情况下形成。
如图28中所示,在盒700和750的附加操作期间,可以通过使用双向隔膜将流体或生物样本从入口或样本保持室移动到传感器芯片730/785(如关于图24所描述的)。此外,一旦试剂和/或底物被混合到样本的第二部分中,就在传感器芯片730/785上方将样本的第二部分推到附加的流体锁定机构745/798(如图25和26中所示)(例如,在模塑塑料部件之一或双面粘合剂中形成的微通道或薄膜“海绵阀”),其提供耐压性并有效地将样本的第二部分锁定到第二导管715/770中。一旦样本的第二部分在传感器芯片730/785上方被锁定就位,就可以开始第二导管715/770中的分析。
如图29中所示,在盒700和750的附加操作期间,可以通过使用双向隔膜将流体或生物样本从入口或样本保持室移动到导管705/755。但是,在使样本移动到结707/760之前,可以使样本移动通过附加的结(例如,t-结)(图25和图26中未示出)。附加的结被配置为将第一导管710/765和第二导管715/770与释放导管(例如,出口)分开,其中释放导管具有收缩件或毛细管止动件(例如,毛细管爆破阀或流体阻力件/收缩件),以将样本流转移通过结707/760。然后,样本的任何残余压力或移动将进入释放导管。在优选实施例中,释放导管中的附加的收缩件或毛细管止动件被设计为使得其具有比第一导管710/765和/或第二导管715/770中的流体锁定特征件更低的耐压性。
如图30中所示,可以在使用多导管电导型传感器的电极上方通过振荡样本的第一和第二部分来执行导管内的混合,以确定和维持如本文所讨论的样本的定位。在一些实施例中,首先将生物样本的第一部分混合,以在第二导管内的、生物样本的第二部分与试剂和/或底物之间的反应的启动之前启动第一导管内的、生物样本的第一部分与试剂和/或底物之间的反应。例如,aptt测试常规地需要比pt测试的测试时间更长的测试时间,因此在第一导管内执行的aptt测试可以比在第二导管内执行的pt测试的开始更早地开始,使得测试在近似相同的时间处完成。
应当理解的是,用于盒700和750的接地传感器第一设计有利地提供了能够同时或随后在两个单独的导管内执行两个独立的测定(例如,pt和aptt)的单个盒。在其中混合是需要的或有利的实施例中,盒700和750的特征允许一旦一种或多种试剂已经暴露于生物样本,就进行第一和第二导管内的独立混合控制,而不用考虑级联路径的交叉活化或其它交叉电极干扰,因为传感器经由使用至少第一和第二导管而物理上彼此分开。
关于图31-图35讨论的本发明的实施例被配置为将单个生物(例如,全血)样本分离成两个导管中的两个段,其中特定于每个测试的干燥试剂和/或底物位于两个导管中。关于图31-图35讨论的配置与关于图25-图29讨论的配置之间的主要区别是,在图31-图35的配置中,样本在传感器上方被推动并被锁定就位,并且位于传感器上的试剂和/或底物被特定地设计成通过被动扩散溶解到样本中或保留在固定层内。在执行凝结分析的示例中,级联途径的活化及其检测发生在紧靠传感器的高浓度区域。溶解到样本中或包含在固定层中的试剂和/或底物保留在它们被印刷所在的导管内,因此消除了测试之间的任何潜在的交叉干扰(数据未示出)。这是对于可能存在化学或物理干扰的任何两个测试(例如,凝结测试)的多路复用的重要元素。
如图31中所示,本发明的一些实施例与用于盒800的集成接地传感器和分离式传感器导管设计有关,其中导管805在接地/传感器芯片825之前或上游在结810处分离成第一导管815和第二导管820。第一导管815被配置为在接地/传感器芯片825的第一区域(如关于图18所讨论的)上方经过,该第一区域包括参考电极的一部分和至少一个分析物检测电极(例如,aptt电极)。第二导管820包括收缩件或毛细管止动件822,并且被配置为在传感器芯片825的第二区域(如关于图18所讨论的)上方经过,该第二区域包括参考电极的另一部分和至少一个其它分析物检测电极(例如,不同的分析物检测电极,诸如pt电极)。根据本发明的各方面,第一导管815和第二导管820内的分析物检测电极可以通过使用如关于图2、图3、图4、图7a、图7b、图7c和图9所讨论的一种或多种布置在有或没有试剂/底物的固定化的情况下形成。
盒800还可以包括分别定位在第一导管815和第二导管820内的至少两个流体屏障机构830和835(例如,流体锁定机构、毛细管止动件或流体收缩件),以及分别从第一导管815和第二导管820通向腔850的一个或多个导管840和845(例如,出口)。在这个实施例中,腔850被配置为废料室(如关于图24所讨论的)。但是,在替代实施例中,一个或多个导管840和845可以被配置为通向废料导管(如关于图24所讨论的)。
如图32中所示,在盒800的操作期间,通过使用双向隔膜泵(如关于图24所描述的)将流体或生物样本从入口或样本保持室移动到导管805。生物样本在结810(例如,t-结)处分离成第一部分和第二部分。在优选实施例中,定位在第二导管820内的收缩件或毛细管止动件822(例如,毛细管爆破阀或流体阻力件/收缩件)引起样本优先地填充第一导管815并在接地/传感器芯片825的第一区域上方移动。样本的第一部分在接地/传感器芯片825上方被推到流体屏障机构830(例如,在模塑塑料部件之一或双面粘合剂中形成的微通道或薄膜“海绵阀”),其提供大于第二导管820的耐压性的耐压性,并且有效地将样本的第一部分锁定到第一导管815中。其后,可以开始第一导管815中的分析。随着第一导管815中的耐压性显著增加,样本的剩余的第二部分被迫使通过第二导管820中的收缩件或毛细管止动件822。类似地,样本的第二部分在接地/传感器芯片825上方被推到流体屏障机构835(例如,在模塑塑料部件之一或双面粘合剂中形成的微通道或薄膜“海绵阀”),并有效地将样本的第二部分锁定到第二导管820中。其后,可以开始第二导管820中的分析。
如图33中所示,在盒800的附加操作期间,可以通过使用双向隔膜将流体或生物样本从入口或样本保持室移动到导管805。但是,在将样本移动到结810之前,可以使样本移动通过附加的结855(例如,t-结)(如图31所示)。附加的结855(例如,t-结)被配置为将第一导管810和第二导管820与具有收缩件或毛细管止动件(例如,毛细管爆破阀或流体阻力件/收缩件)的释放导管860(例如,出口)分开,以将样本流转移通过结810。样本的任何残余压力或移动然后将进入释放导管860。在优选实施例中,释放导管中的附加收缩件或毛细管止动件被设计为使得其具有比第一和第二导管815和820中的流体屏障机构更低的耐压性。
如本领域普通技术人员所应当理解的,用于盒800的集成接地传感器和分离式传感器导管设计有利地提供了能够同时或随后在两个单独的导管内执行两个独立的测定(如应当理解的,测定可以不同或相同,例如pt和aptt、pt和pt、aptt和aptt,等等)而不需要将生物样本与试剂和/或底物混合的单个盒。根据这个实施例的各方面,盒800的特征允许在第一和第二导管815和820内执行两个单独的分析测试,而不用考虑一旦一种或多种试剂已经暴露于生物样本而引起的级联路径的交叉活化或其它交叉电极干扰,因为电极经由使用至少第一和第二导管815和820而物理上彼此分开。而且,用于盒800的集成接地传感器设计提供了比上述的接地传感器第一设计的盒设计更简单、更紧凑的盒设计,因为该设计消除了完全分开接地传感器的空间需要以及将生物样本移动到分开的接地传感器所必需的导管的附加长度。
如图34中所示,本发明的替代实施例与用于盒870的集成接地传感器和分离式导管设计有关,其包括具有结880(例如,t-结)的导管875。结880被配置为将第一传感器导管885和第二导管890与释放导管895(例如,出口)分开。第一传感器导管885被配置为在接地/传感器芯片900的第一区域(如关于图18所讨论的)上方经过,其中该第一区域包括参考电极的一部分和至少一个分析物检测电极(例如,aptt电极)。第二传感器导管890被配置为在传感器芯片900的第二区域(如关于图18所讨论的)上方经过,该第二区域包括参考电极的另一部分和至少一个不同的分析物检测电极(例如,pt电极)。根据本发明的各方面,第一传感器导管885和第二传感器导管890内的分析物检测电极可以通过使用关于图2、图3、图4、图7a、图7b、图7c和图9所讨论的一种或多种布置在有或没有底物的固定化的情况下形成。
盒870还可以包括分别定位在第一传感器导管885和第二传感器导管890内的至少两个流体屏障机构905和910,以及分别从第一传感器导管885和第二导管890通向腔925的一个或多个导管915和920(例如,出口)。在这个实施例中,腔925被配置为废料室(如关于图24所讨论的)。但是,在替代实施例中,一个或多个导管915和920可以被配置为通向废料导管(如关于图24所讨论的)。
如图35中所示,在盒870的操作期间,通过使用双向隔膜泵(如关于图24所描述的)将流体或生物样本从入口或样本保持室移动到导管875并通过结880。释放导管895(例如,出口)具有收缩件或毛细管止动件(例如,毛细管爆破阀或流体阻力件/收缩件),以将样本流转移到第一传感器导管885和第二传感器导管890。样本的第一部分在接地/传感器芯片900上方被推到流体屏障机构905(例如,在模塑塑料部件之一或双面粘合剂中形成的微通道或薄膜“海绵阀”),其有效地将样本的第一部分锁定到第一传感器导管885中。其后,可以开始第一导管885中的分析。样本的第二部分在接地/传感器芯片900上方被推到流体屏障机构910(例如,在模塑塑料部件之一或双面粘合剂中形成的微通道或薄膜“海绵阀”),其有效地将样本的第二部分锁定到第二传感器导管890中。其后,可以开始第二导管890中的分析。样本的任何残余压力或移动然后将进入释放导管895。在优选实施例中,释放导管中的收缩件或毛细管止动件被设计为使得其具有比第一和第二传感器导管885和890中的流体屏障机构更低的耐压性。
如应当理解的,用于盒870的替代的集成接地传感器和分离式导管设计有利地提供了能够同时或随后在两个单独的传感器导管内执行两个独立的测定(如应当理解的,测定可以不同或相同,例如pt和aptt、pt和pt、aptt和aptt,等等)而不需要将生物样本与试剂和/或底物混合的单个盒。根据这个实施例的各方面,盒870的特征允许在第一和第二传感器导管885和890内执行两个单独的分析测试,而不用考虑一旦一种或多种试剂已经暴露于生物样本而引起的级联路径的交叉活化或其它交叉电极干扰,因为电极经由使用至少第一和第二传感器导管885和890而物理上彼此分开。而且,用于盒870的集成接地传感器设计提供了比上述的接地传感器第一设计的盒设计更简单、更紧凑的盒设计,因为该设计消除了完全分开接地传感器的空间需要以及将生物样本移动到分开的接地传感器所必需的导管的附加长度。此外,覆盖整个传感器电路所需的样本体积显著减少。
关于图36-图38讨论的本发明的实施例被配置为将单个生物(例如,全血)样本维持在单个导管中,特定于每个测试的干燥试剂和/或底物位于其中。关于图36-图38讨论的配置与关于图27-图29讨论的配置之间的主要区别在于,在图36-图38的配置中,样本被维持在单个导管中并在传感器上方被串联推动并锁定或保持就位,并且位于传感器上的试剂和/或底物被特定地设计为通过被动扩散而溶解在样本中或者保留在固定层内。在执行凝结分析的示例中,级联途径的活化及其检测发生在紧靠传感器的高浓度区域。溶解在样本中的试剂和/或底物保留在它们被印刷所在的传感器附近,因此消除了测试之间的任何潜在的交叉干扰。这是对于可能存在化学或物理干扰的任何两个测试(例如,凝结测试)的多路复用的重要元素。
如图36中所示,本发明的一些实施例与用于盒930的集成接地传感器和单导管设计有关,其包括具有结940(例如,t-结)的导管935。结940被配置为将单导管传感器导管945与释放导管950(例如,出口)分开。单传感器导管945被配置为在接地/传感器芯片955(如关于图18所讨论的)的包括至少一个分析物检测电极(例如,aptt电极)的第一区域、包括参考电极的至少一部分的第二区域,以及包括至少一个相同或不同的分析物检测电极(例如,pt电极)的第三区域上方经过。根据本发明的各方面,在单导管传感器导管945内的分析物检测电极是通过使用关于图4、图7a、图7b、图7c和图9所讨论的一个或多个布置在有试剂/底物的固定的情况下形成的。
盒930还可以包括定位在传感器导管945内的流体屏障机构960和从传感器导管945通向腔970的导管965(例如,出口)。在这个实施例中,腔970是被配置为废料室(如关于图24所讨论的)。但是,在替代实施例中,导管965可以被配置成通向废料导管(如关于图24所讨论的)。
如图36和图37中所示,在盒930的操作期间,通过使用双向隔膜泵(如关于图24所描述的)将流体或生物样本从入口或样本保持室移动到导管935并通过结940。释放导管950(例如,出口)具有收缩件或毛细管止动件(例如,毛细管爆破阀或流体阻力件/收缩件),以将样本流转移到传感器导管945。样本在接地/传感器芯片955上方被推到流体屏障机构960(例如,在模塑塑料部件之一或双面粘合剂中形成的微通道或薄膜“海绵阀”),其有效地将样本锁定到传感器导管945中。其后,可以开始传感器导管945中的分析。样本的任何残余压力或移动然后将进入释放导管950。在优选实施例中,释放导管950中的收缩件或毛细管止动件被设计为使得其具有比传感器导管945中的流体屏障机构更低的耐压性。
如图36和38中所示,在盒930的替代操作期间,可以通过使用双向隔膜将流体或生物样本从入口或样本保持室移动到导管935。其后,样本在接地/传感器芯片955上方被推到流体屏障机构960(例如,在模塑塑料部件之一或双面粘合剂中形成的微通道或薄膜“海绵阀”),其有效地将样本锁定到传感器导管945。其后,可以开始传感器导管945中的分析。
如应当理解的,用于盒930的集成接地传感器和单导管设计有利地提供了能够同时或随后在单个导管内执行两个独立的测定(如应当理解的,测定可以不同或相同,例如,pt和aptt、pt和pt、aptt和aptt,等等)而不需要将生物样本与试剂和/或底物混合的单个盒。根据这个实施例的各方面,盒930的特征允许在传感器导管945内执行两个单独的分析测试,而不用考虑一旦一种或多种试剂已经暴露于生物样本而引起的级联路径的交叉活化或其它交叉电极干扰,因为分析物检测电极是具有通过使用如本文所详细讨论的一种或多种布置形成的局部化(例如,固定化)试剂/底物的微环境传感器。而且,用于盒930的集成接地传感器设计提供了比上述接地传感器第一设计的盒设计更简单、更紧凑的盒设计,因为该设计消除了完全分开接地传感器的空间需要以及将生物样本移动到分开的接地传感器所必需的导管的附加长度。此外,覆盖整个传感器电路所需要的样本体积显著减少。
关于图39所讨论的本发明的实施例被配置为分离单个生物(例如,全血)样本并允许同时或随后在相同的一次性盒内的单个全血样本上进行多个物理上分开的测试(例如,凝结测试和分析化学测试)。在一些实施例中,在两个导管中为至少两个样本段提供独立的混合控制,其中特定于每个测试的干燥试剂和/或底物可以位于两个导管中。根据本发明的各方面,底物可以或可以不局部化(例如,固定化)在传感器上方。溶解到样本中的试剂和/或底物保留在导管内并靠近它们被印刷或沉积所在的传感器,因此消除了测试之间的任何潜在的交叉干扰。这是对于可能存在化学或物理干扰的任何两个测试(例如,凝结测试和分析化学测试)的多路复用的重要元素。
如图39中所示,本发明的一些实施例与用于盒1000的多传感器配置有关,其包括具有结1010(例如,t-结)的导管1005。结1010可以包括第一收缩件或毛细管止动件1015,并被配置为将第一传感器导管1020与辅助导管1025分开。第一传感器导管1020被配置为在传感器芯片1030的至少一部分上方经过,该至少一部分包括至少一个分析物检测电极(例如,pt电极)。根据本发明的各方面,第一传感器导管1020内的分析物检测电极可以通过使用关于图2、图3、图4、图7a、图7b、图7c和图9所讨论的一种或多种布置在有或没有试剂/底物的局部化(例如,固定化)的情况下形成。第二收缩件或毛细管止动件1035可以定位在第一传感器导管1020内,并且导管1040(例如,出口)可以被配置为从第一传感器导管1020通向废料导管1045(如关于图24所讨论的)。
盒1000还可以包括将腔1055与废料导管1045连接的第二传感器导管1050。辅助导管1025在结1060处连接到第二传感器导管1050。结1060可以包括第三收缩件或毛细管止动件1065。在一些实施例中,第一收缩件或毛细管止动件1015和第三收缩件或毛细管止动件1065被配置为比第二收缩件或毛细管止动件1035更大(例如,
宽度更大),以允许如其后详细讨论的样本的控制。第二传感器导管1050被配置为在一个或多个传感器芯片1070中的每一个的至少一部分上方经过,其中该至少一部分包括至少一个分析物检测电极(例如,钠或氯化物电极)。一个或多个传感器芯片1070可以被配置为执行任何数量的测定,包括电解质、一般化学、血气和血液学(参见例如美国专利no.7,419,821、no.6,379,883、no.5,514,253、no.5,200,051和no.5,096,669,它们全部内容通过引用并入本文)。例如,一个或多个传感器芯片1070可以被配置为执行任何数量的测定,这些测定能够检测选自以下分析物组成的组的一种或多种分析物:氧分压、二氧化碳分压、总二氧化碳、ph、钾、钠、氯化物、葡萄糖、bun、肌酸酐、乳酸盐、镁、血细胞比容、离子钙、肌钙蛋白i、肌钙蛋白t、ckmb、降钙素原、bhcg、hcg、ntprobnp、probnp、bnp、肌红蛋白、甲状旁腺素、d-二聚体、ngal、半乳糖凝集素-3和/或psa,以及其它分析物。在其中利用底物执行测定的实施例中,第二传感器导管1050内的至少一个分析物检测电极可以通过使用关于图2、图3、图4、图7a、图7b、图7c和图9所讨论的一种或多种布置在有或没有试剂/底物的局部化(例如,固定化)的情况下形成。在不利用底物的其它实施例中,第二传感器导管1050内的至少一个分析物检测电极可以在没有任何底物的情况下形成。
如图39中所示,在盒1000的操作期间,由分析器引起的垫圈的变形可以将压力传送到位于腔1055中的填充有流体(例如近似130μl的分析/洗涤溶液、对照流体或校准物流体)的合流体箔包,从而使箔包破裂,并将流体排出到第二传感器导管1050中并且经过第三收缩件或毛细管止动件1065,以便随后在样本分析中使用(如关于图24所讨论的)。在一些实施例中,箔包是容纳校准物溶液的校准物包装(calpak)。事件的典型顺序包括calpak破裂,然后校准物溶液在一个或多个传感器芯片1070上方经过,以润湿一个或多个传感器芯片1070。其后,通过使用双向隔膜泵(如关于图24所描述的)将流体或生物样本从入口或样本保持室移动到导管1005。生物样本在结1010(例如,t-结)处被分离成第一部分和第二部分。在优选实施例中,定位在辅助导管1025内的第一收缩件或毛细管止动件1015(例如,毛细管爆破阀或流体阻力件/收缩件)使得样本的第一部分优先地填充第一传感器导管1020并在传感器芯片1030和至少一个电极(例如,pt电极)上方移动。样本在第一传感器导管1020内的第一部分在第二收缩件或毛细管止动件1035处停止,这使得样本的第二部分推动穿过第一收缩件或毛细管止动件1015以及第三收缩件或毛细管止动件1065。样本的第二部分填充第二传感器导管1050并在一个或多个传感器芯片1070和至少一个分析物检测电极(例如,钠或氯化物电极)上方移动。在一些实施例中,样本的第二部分可以被配置为与存在于第二传感器导管1050内的分析/洗涤溶液、对照流体或校准物流体混合。为了能够混合流体段,特征件(包括保留结构,诸如柱阵列、导管缺口、凹槽或凹坑)可以被设计到第二传感器导管1050中,以保持分析/洗涤溶液、对照流体或校准物流体。可替代地,两个流体段的混合可以通过在结1060处融并来自导管1025和箔包1055的两股流体来完成。在其它实施例中,分析/洗涤溶液、对照流体或校准物可能已经通过第二传感器导管1050被泵送到废料导管1045,使得样本的第二部分不与分析/洗涤溶液、对照流体或校准物混合。此外,为了最小化分析/洗涤溶液、对照流体或校准物的残留,可以以在第一流体和样本的第二部分之间引入空气段的这样的方式设计盒。辅助导管1025的体积应当确定流体段之间的空气间隙的尺寸。
如应当理解的,用于盒1000的多个传感器配置有利地提供了能够同时或随后在两个单独的导管内执行两个独立的测定(例如,pt和分析性化学测定、pt和pt、aptt和pt、aptt和aptt,等等)的单个盒。在其中混合是需要的或有利的实施例中,盒1000的特征允许一旦一种或多种试剂已经暴露于生物样本,就进行第一和第二导管内的独立混合控制,而不用考虑交叉活化或其它交叉电极干扰,因为传感器经由使用至少第一和第二传感器导管而物理上彼此分开。
如图40中所示,其中x轴是时间/秒,y轴是电流/pa,与对盒的两个单独的导管中的样本进行独立混合控制(如图25-图29和图39中所示)并且充分混合试剂/底物(即,没有局部化微环境)有关的实施例能够使用多个样本类型(由响应曲线1071表示的全血,由响应曲线1072和1073表示的两个水平的因子耗尽血液,由响应曲线1075表示的一个水平的对照血浆)得到凝块结果(例如,对于凝块曲线中的每一个上标记的垂直线所指示的pt时间)。如图41a中所示,与没有在盒的一个或多个导管中的固定化或局部化的试剂/底物上进行样本的混合(如图30-图38中所示)有关的本发明实施例也能够使用与图40中使用的那些样本相似的样本(由响应曲线1076表示的全血,由响应曲线1077表示的因子耗尽血液,以及由响应曲线1078和1079表示的两个水平的对照血浆)得到凝块结果。如图41b中所示(由响应曲线1076表示的全血,由响应曲线1077表示的因子耗尽血液,以及由响应曲线1078和1079表示的两个水平的对照血浆),对于与在固定化或局部化试剂/底物上方混合样本有关的实施例的传感器响应也是可实现的,但是,因子耗尽和延长的血浆对照样本的分辨率不如在固定化无混合实施例中(如图41a中所示)那样清楚。另外,优选的是,全血的凝块时间(曲线1071和1076)非常接近正常血浆对照凝块时间(曲线1072和1078);未混合的、固定化/局部化的实施例最好地反映出这一点,进一步肯定它们对图40的系统的改进。尽管实施例的无混合或经混合版本是可能的,但是在实施例的无混合版本(如图41a中所示)中电流(pa)生成更高并且变化性(pa和凝块时间)更低。这些意外的和更一致的结果直接归因于使用如本文关于无混合实施例描述的微环境传感器。无混合实施例与局部化(例如,固定化)试剂/底物印刷结合表示在较高试剂/底物与较低样本的体积比情况下的凝结信号的活化/传播上的系统改进,从而产生更快的测定/传感器响应时间。此外,直接在传感器上方的试剂/底物印刷的局部化(例如,固定化)造成扩散底物离去基团一旦通过活性凝血酶生成就立即周转(氧化)。这最终导致直接在电流型测定传感器处生成更大(和更可再现的)电流信号。最后,具有更高电流和更高再现性的快速凝血酶反应的组合(从与图41b中的较慢升高相比的图41a的曲线快速升高来看是明显的)产生更容易且可再现分析的响应曲线,从而产生对图40或41b中的那些测定中的任何一个的改进的测定(图41a中表示的当前实施例)。
接地芯片消除和盒识别
在优选实施例中,接地芯片可以结合到或集成到传感器芯片中,如本文详细描述的。典型的接地芯片(如关于图17所描述的)可以包括用作传感器芯片的回路的接地电极和用于盒识别的四个接触引脚(参见例如美国专利no.7,419,821,其全部内容并入本文)。因而,将接地芯片集成到传感器芯片中包括将这两个功能移动到传感器芯片中。将接地芯片与传感器芯片集成的优点包括(i)简化的制造过程,因为在晶片制造、金属化、划片和盒组装过程中少了一个要处理的部件,(ii)减少的成本,以及(iii)减少的样本体积,因为传感器导管可以被缩短,如至少图25与图31之间的比较所示。
如图42中所示,分开的接地芯片和传感器芯片布置1080(例如,图17中所示的布置)通常通过使用与接地芯片1090上的接地引脚1085和传感器芯片1100上的电流型引脚1095连接的检测器1082来起作用,以检测参考电极1105和分析物检测电极1110(例如,电流型电极)之间的电流差。为了将参考电极功能赋予单个传感器芯片布置1115(例如,图18中所示的布置),通过将参考电极1105与电导型低引脚1120连接,可以将参考电极1105与传感器芯片1100集成。电子开关1125可以在被配置为连接接地引脚1085和电导型低引脚1120的分析器中实现。因而,参考电极1105可以基本上从接地芯片1090移动到传感器芯片1100。
为了将盒识别功能赋予到单传感器芯片布置(例如,图18中所示的布置)中,可以将附加的机构或装置包括在布置中以用于盒识别。如图42中所示,对于单电极装置1130,例如仅aptt分析物检测电极1110,可以在未使用的电流型引脚1140和电导型低引脚1120之间实现电阻器1135。分析物检测电极1110可以连接到电流型引脚1095,电阻器1135可以连接到未使用的电流型引脚1140和电导型低引脚1120,并且参考电极1105可以连接到电导型低引脚1120。在盒被插入分析器之后(例如,紧随其后),电阻器1135的电阻可以由检测器1145(例如,处理器)通过在未使用的电流型引脚1140和电导型低引脚1120之间施加小电压(例如,1mv)来测量。所测量的电阻的值可以然后用于盒识别。例如,每种盒类型(例如,
在一些实施例中,电阻器1135可以由与接触焊盘和传感器电极同时制造的金属导线(优选地是金导线)构成。金导线可以是小至5μm宽并且0.1μm厚,从而形成0.5μm2的面积。由于金的电阻率为2.44μω-cm,或0.0244ω-μm,因此1000μm长的金导线将具有0.0244ω-μm*1000μm/0.5μm2=48.8ω的电阻。在将盒插入分析器之后,可以施加小电压(例如0.5mv),于是大约10ua的电流可以被生成并由分析器检测。为了最小化功率消耗,可选地,金导线可以更长,所施加的电压可以更低,或者施加电压的时间可以更短。
在替代实施例中,单电极布置1130可以包括仅pt分析物检测电极1110,而不是仅aptt分析物检测电极1110。根据本发明的这个方面,金导线的长度可以增加到大约10cm,这将金导线的电阻增加到大约5000ω,以便区分开pt盒的识别与aptt盒的识别。
在其它实施例中,电阻器可以在电流型算引脚1095和电导型低引脚1120之间实现。如本领域普通技术人员应当理解的,使用电阻器来识别盒的类型的概念可以在本文所述的传感器/盒布置中的任一个中实现。而且,在不背离本发明的精神和范围的情况下,用于电阻器的不同值可以通过变化导线的几何形状或通过使用不同材料的导线(例如,使用tiw而不是金)来获得,然后其可以被用于识别不同的盒。
为了将盒识别功能赋予到多传感器芯片布置(例如,图18中所示的布置)中,可以将附加的机构或装置包括在布置中以用于盒识别。如图43中所示,对于多(例如,两)电极布置1150,例如pt分析物检测电极1155和aptt分析物检测电极1160,可以在未使用的电流型引脚1170和电导型低引脚1175之间实现电阻器1165。pt分析物检测电极1155可以连接到电流型引脚1180,aptt分析物检测电极1160可以连接到电流型引脚1185,电阻器1165可以连接到未使用的电流型引脚1170和电导型低引脚1175,以及参考电极1190可以连接到电导型低引脚1175。在盒被插入分析器中之后(例如,紧随其后),电阻器1165的电阻可以由检测器1195通过在未使用的电流型引脚1170和电导型低引脚1175之间施加小电压(例如,1mv)来测量。然后,所测量的电阻的值可以被用于盒识别。例如,每种盒类型(例如,
如上面所讨论的,电阻器1165可以由与接触焊盘和传感器电极同时制造的金属导线(优选地是金导线)构成。金导线可以小至5μm宽并且0.1μm厚,从而形成0.5μm2的面积。由于金的电阻率为2.44μω-cm,或0.0244ω-μm,因此1000μm长的金导线将具有0.0244ω-μm*1000μm/0.5μm2=48.8ω的电阻。在将盒插入分析器之后,可以施加小电压(例如0.5mv),于是大约10ua的电流可以被生成并由分析器检测。为了最小化功率消耗,可选地,金导线可以更长,所施加的电压可以更低,或者施加电压的时间可以更短。
虽然已经依据各种优选实施例描述了本发明,但是本领域技术人员将认识到,在不背离本发明的精神的情况下,可以进行各种修改、替换、省略和改变。意图是本发明的范围仅受所附权利要求的范围限制。此外,本领域技术人员应当理解,多个如上所述的本发明的各种实施例可以彼此耦合并且结合到单个读取器设备中。
- 还没有人留言评论。精彩留言会获得点赞!