一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法与流程
本发明属于高分子材料和生物医用材料领域,特别是涉及一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法。
背景技术:
天然高分子材料具有来源丰富、具有良好的生物相容性和生物降解性、无毒副作用等性能特点和优点,被广泛用于生物医用材料领域。壳聚糖是一种来源广泛的生物多糖类物质,具有良好的生物相容性、可生物降解性、无毒性等优良性质。并且,壳聚糖是一种阳离子聚电解质氨基多糖,壳聚糖具有pH刺激响应性溶解-不溶转变性能:当溶液的pH<6.0左右时,壳聚糖分子链上的氨基能够质子化使壳聚糖发生溶解,而当溶液的pH升高(pH>6.0),壳聚糖分子链上的氨基去质子化变为不溶状态的凝胶。利用壳聚糖的这种特性,Guo等人将硫化锌量子点与壳聚糖混合制备硫化锌量子点/壳聚糖分散液,分散液被注入一个简单的气-液微流体装置中被剪切成液滴进入氢氧化钠溶液中,得到硫化锌量子点/壳聚糖复合微球[高分子材料科学与工程,2015,31(11):146-150]。另外,海藻酸钠也是一种产量丰富的生物多糖类物质,具有良好的生物相容性、生物可降解性等性能;海藻酸钠是一种阴离子聚电解质天然多糖,它可以与离子交联剂(例如Ca2+)作用形成水凝胶,其中氯化钙是最常用来形成海藻酸水凝胶的离子交联剂之一[Progress in Polymer Science,2012,37,106-126]。Davarci等人将海藻酸钠溶液滴入氯化钙溶液(氯化钙溶于水和甘油混合溶剂中)中形成海藻酸钙微球,并研究了海藻酸钠和氯化钙溶液粘度以及氯化钙溶液表面张力对海藻酸钙微球形成的影响[Food Hydrocolloids,2017,62:119-127]。
相对于单层结构的微球,核-壳结构的微球能提高物质包埋和控制释放性能,甚至可以实现物质分层包埋与分层控制释放,在生物医用领域具有更广阔的应用前景。目前,核-壳结构的微球主要采用两步法进行制备,即第一步首先制备核-壳结构微球的内核,然后第二步再制备核-壳结构微球的外壳,从而得到所需的核-壳结构微球;例如Wang等人采用单乳化法制备了装载对乙酰氨基酚的聚(乳酸-羟基乙酸)核微球,然后将核微球和人血清白蛋白分散在海藻酸钠溶液中,用注射器滴加到氯化钙溶液中形成包埋人血清白蛋白的海藻酸壳,得到了内核包埋对乙酰氨基酚和外壳包埋人血清白蛋白的核-壳结构微球[Carbohydrate Polymers,2010,79:437-444]。另外,有少量研究者为了简化核-壳结构微球的制备方法,开展了采用一步法制备高分子核-壳微球的探索研究;例如Lim等人采用基于溶剂蒸发的双乳化法一步法制备得到了核-壳结构的海藻酸–聚(乳酸-乙醇酸)和海藻酸–聚(L-乳酸)微球,用于水溶性药物的传输[Biomaterials Science,2013,1:486–493],然而该方法的制备过程中引入二氯甲烷/司班80溶液和聚乙烯醇作为乳化剂,需要离心和漂洗等后处理步骤去除乳化剂。还有人通过一步聚合的方法将两种或多种小分子单体在一定条件下引发聚合,制备出高分子核-壳结构微球[Journal of Materials Chemistry C,2013,1:3802-3807],但是该方法聚合条件较为复杂,制备过程难以控制。
综上所述,高分子核-壳结构微球在分层包埋和控制释放方面具有良好的应用前景,而采用一步法制备高分子核-壳结构微球能够有效简化核-壳结构微球制备过程和生产工艺。本发明一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法,该方法具有制备工艺简单,制备步骤简化,设备简易,制备条件温和,易于控制,可重复性好,无需后处理、成本低廉等优点。本发明采用天然高分子材料为制备原料,具有来源丰富、绿色环保、生物相容性良好、无毒性、生物可降解性以及价格低廉等特点和优点,核-壳微球的制备是在室温水溶液环境下进行,经济环保,绿色无毒,这种核-壳结构微球在生物医学领域具有十分良好的应用价值。
技术实现要素:
本发明所要解决的技术问题是:提供一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法,该方法具有制备工艺简单,制备步骤简化,设备简易,制备条件温和,易于控制,可重复性好,无需后处理、成本低廉的优点。
为解决上述技术问题,本发明所采取的技术方案是:一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法,其特征在于包括如下步骤:首先配制氯化钙/壳聚糖混合溶液和海藻酸钠溶液,再通过微量注射器将其氯化钙/壳聚糖混合溶液滴加到海藻酸钠溶液中,并使氯化钙/壳聚糖混合溶液完全浸没在海藻酸钠溶液中,放置形成微球,取出微球,再用蒸馏水清洗,最后得到壳聚糖/海藻酸钠天然高分子核-壳微球。
更进一步地,一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法,其特征在于包括如下步骤:
(1)配制氯化钙/壳聚糖混合溶液:取10g~30g壳聚糖固体粉末,加入到500~600mL去离子水中,常温下搅拌1~2小时,然后加入摩尔浓度为0.5~1.2mol/L的盐酸溶液调节溶液的pH为5.0~5.5,并搅拌5~10小时至壳聚糖充分溶解,再经过砂芯漏斗过滤,配制得到质量体积比浓度为2~5%(w/v)的壳聚糖溶液;取0.222g~3.33g氯化钙固体粉末,加入到50~100mL上述壳聚糖溶液中,室温下搅拌2~3小时至氯化钙完全溶解,配制得到氯化钙摩尔浓度为0.04~0.3mol/L的氯化钙/壳聚糖混合溶液;
(2)配制海藻酸钠溶液:取1g~6g海藻酸钠固体粉末,边搅拌边加入到100~150mL去离子水中,然后搅拌2~3小时至海藻酸钠充分溶解,然后采用摩尔浓度为0.5~1.2mol/L的氢氧化钠溶液,以及摩尔浓度为0.5~1.2mol/L的盐酸溶液调节海藻酸钠溶液的pH为9~11,再经过砂芯漏斗过滤,配制得到质量体积比浓度为1~4%(w/v)的海藻酸钠溶液;
(3)一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球:用容量为1mL的微量注射器取步骤(1)中所配制的氯化钙/壳聚糖混合溶液0.5~1.0mL,将混合溶液以10~20滴/分钟的速度逐滴加入到步骤(2)中所配制的海藻酸钠溶液中,并使氯化钙/壳聚糖混合溶液的液滴完全浸没于海藻酸钠溶液中,然后将其在室温下放置20分钟~2小时后形成微球,最后取出微球用蒸馏水清洗3-6次,制备得到壳聚糖/海藻酸钠天然高分子核-壳微球。
本发明的技术原理:这种壳聚糖/海藻酸钠天然高分子核-壳微球微球的制备方法同时利用海藻酸钠可以与钙离子形成凝胶,以及壳聚糖所具有的pH刺激响应性能形成凝胶,采用简单方便的一步法制备得到一种具有核-壳结构的壳聚糖/海藻酸钠天然高分子微球。壳聚糖是一种阳离子聚电解质氨基多糖,具有pH刺激响应性溶胶-凝胶转变性能,当溶液的pH<6.0左右时,壳聚糖分子链上的氨基能够质子化使壳聚糖发生溶解;当升高溶液的pH(pH>6.0左右),壳聚糖分子链上的氨基去质子化变为不溶状态;因此可以利用壳聚糖的这种pH刺激响应性溶胶-凝胶转变性能,通过改变溶液pH形成壳聚糖微球。海藻酸钠是一种阴离子聚电解质天然多糖,它可以与离子交联剂(例如Ca2+)反应形成水凝胶,可以利用海藻酸钠与氯化钙之间的反应形成海藻酸微球。本发明一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法,首先配制氯化钙/壳聚糖混合溶液和海藻酸钠溶液,再将氯化钙/壳聚糖混合溶液通过微量注射器逐滴滴加到pH为9~11的海藻酸钠溶液中,并使氯化钙/壳聚糖混合溶液的液滴完全浸没于海藻酸钠溶液中,凝胶化20分钟~2小时后,Ca2+与海藻酸钠作用形成外层(壳层)的海藻酸微球,而壳聚糖溶液在碱性环境下形成内层(核层)的壳聚糖微球,从而通过简单方便的一步法制备得到壳聚糖/海藻酸钠天然高分子核-壳微球。
一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法的优点在于:本发明采用的一步法具有制备步骤和制备工艺简单,设备简易,制备条件温和(室温水溶液环境下),易于控制,可重复性好,无需后处理,生产成本低廉等优点。本发明制备的壳聚糖/海藻酸钠天然高分子核-壳微球的外壳厚度是可控的,即可以通过控制氯化钙/壳聚糖混合溶液中的氯化钙浓度或者凝胶化时间,从而控制壳聚糖/海藻酸钠天然高分子核-壳微球的外壳厚度。本发明制备的壳聚糖/海藻酸钠核-壳微球能够在壳层和核层分层包埋各种不同类型的物质,例如药物、纳米粒子、荧光物质和生物物质等,在药物输送、控制释放、生物成像和生物标记等生物医用领域具有良好的应用价值。本发明采用的壳聚糖与海藻酸钠均为天然高分子材料,具有来源丰富、生物相容性良好、无毒性、生物可降解性以及价格低廉等特点和优点,因此也有利于所制备的壳聚糖/海藻酸钠天然高分子核-壳微球在生物医学领域具有良好应用前景和广泛用途。本发明一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法,其在制备其它类型核-壳结构的高分子微球特别是制备天然高分子核-壳微球方面的用途。
本发明的有益效果在于:
(1)本发明一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法,该方法与目前制备核-壳结构微球的主要方法两步法相比,具有制备步骤和工艺简单,设备简易,制备条件易于控制,可重复性好,无需后处理,制备成本低廉等优点。并且,该核-壳微球的制备方法是在室温水溶液环境下进行,绿色无毒,经济环保。
(2)本发明采用的壳聚糖与海藻酸钠均为天然高分子材料,它们作为制备天然高分子核-壳微球的原料,具有来源丰富、生物相容性良好、无毒性、生物可降解性以及价格低廉等特点和优点,因此采用壳聚糖和海藻酸钠制备的核-壳微球在生物医学领域具有良好的应用前景和广泛的用途。
(3)本发明制备的壳聚糖/海藻酸钠天然高分子核-壳微球的外层(壳层)厚度是可控的,即通过控制氯化钙/壳聚糖混合溶液中的氯化钙浓度和凝胶化时间,可以控制天然高分子核-壳微球外层(壳层)的厚度,这将十分有利于所制备的核-壳微球在控制释放方面的应用。
(4)本发明制备的壳聚糖/海藻酸钠核-壳微球能够分层包埋各种不同类型的物质,例如药物、纳米粒子、荧光物质和生物物质等,在药物输送、控制释放、生物成像和生物标记等生物医用领域具有十分广泛的用途。本发明一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法,其在制备其它类型核-壳结构的高分子微球特别是天然高分子核-壳微球方面的用途。
附图说明
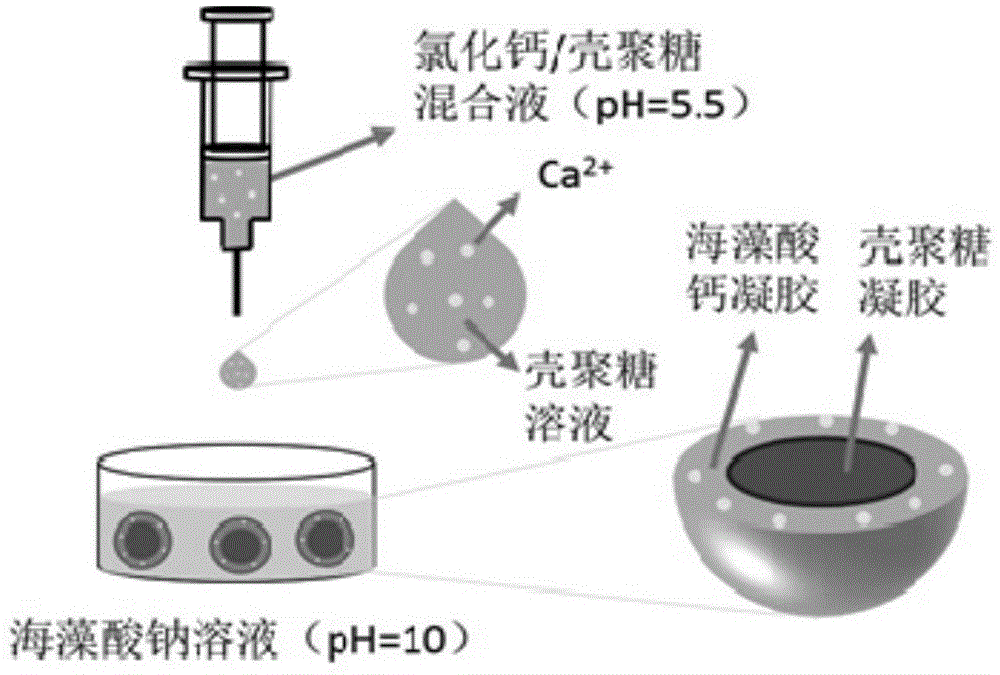
图1为实施例1采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的工艺示意图,以及所制备的核-壳微球结构的示意图。
图2为实施例1采用一步法制备的壳聚糖/海藻酸钠天然高分子核-壳微球的照片。
图3为图2中,核-壳微球的显微照片。
图4为应用实例采用一步法制备的核层包埋磁性Fe3O4纳米粒子的壳聚糖/海藻酸钠核-壳微球的照片。
图5为图4中,该核-壳微球剖开后的照片。
具体实施方式
为了更好地理解本发明,下面结合附图和实施例对本发明作进一步的描述,但下述实施例不应理解为对本发明的限制。
本发明实施例所用壳聚糖为国药集团化学试剂有限公司生产,其脱乙酰度为80~95%,粘度为50~800mPa·s。所用海藻酸钠为国药集团化学试剂有限公司生产。
实施例1
一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法,其制备方法如下:
(1)配制氯化钙/壳聚糖混合溶液:取15g壳聚糖固体粉末,加入到500mL去离子水中,常温下搅拌2小时,然后加入摩尔浓度为1.0mol/L的盐酸溶液调节溶液的pH为5.5,并搅拌8小时至壳聚糖充分溶解,再经过砂芯漏斗过滤,配制得到质量体积比浓度为3%(w/v)的壳聚糖溶液;取1.11g氯化钙固体粉末,加入到100mL上述壳聚糖溶液中,室温下搅拌2小时至氯化钙完全溶解,配制得到氯化钙摩尔浓度为0.1mol/L的氯化钙/壳聚糖混合溶液;
(2)配制海藻酸钠溶液:取2g海藻酸钠固体粉末,边搅拌边加入到100mL去离子水中,然后搅拌3小时至海藻酸钠充分溶解,然后采用摩尔浓度为1.0mol/L的氢氧化钠溶液,以及摩尔浓度为1.0mol/L的盐酸溶液调节海藻酸钠溶液的pH为10,再经过砂芯漏斗过滤,配制得到质量体积比浓度为2%(w/v)的海藻酸钠溶液;
(3)一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球:用容量为1mL的微量注射器取步骤(1)中所配制的氯化钙/壳聚糖混合溶液0.8mL,将混合溶液以15滴/分钟的速度逐滴加入到步骤(2)中所配制的海藻酸钠溶液中,并使氯化钙/壳聚糖混合溶液的液滴完全浸没于海藻酸钠溶液中,然后将其在室温下放置40分钟后形成微球,最后取出微球用蒸馏水清洗3次,制备得到壳聚糖/海藻酸钠天然高分子核-壳微球。
图1为实施例1采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球,以及所制备的核-壳微球结构的示意图。用微量注射器取配制的氯化钙/壳聚糖混合溶液,通过微量注射器将其滴加到配制的海藻酸钠溶液中,并使其完全浸没在海藻酸钠溶液中,40分钟后形成壳聚糖/海藻酸钠天然高分子核-壳微球;这种壳聚糖/海藻酸钠天然高分子核-壳微球在结构上分为内层和外层,其中内层(核层)为壳聚糖,外层(壳层)为海藻酸。
图2、图3为实施例1采用一步法制备的壳聚糖/海藻酸钠天然高分子核-壳微球的照片,以及核-壳微球的显微照片。从图2、图3可以看出发现所制备的壳聚糖/海藻酸钠天然高分子核-壳微球外形比较规则,内核和外壳的微球均呈现规则的圆球形,外层微球透明均一,内层微球半透明;微球的内层与外层之间的界面十分清晰,具有明显分层的核-壳结构。
应用实例:
一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法,其制备方法如下:
(1)配制磁性Fe3O4纳米粒子/氯化钙/壳聚糖分散液:取15g壳聚糖固体粉末,加入到500mL去离子水中,常温下搅拌2小时,然后加入摩尔浓度为1.0mol/L的盐酸溶液调节溶液的pH为5.5,并搅拌8小时至壳聚糖充分溶解,再经过砂芯漏斗过滤,配制得到质量体积比浓度为3%(w/v)的壳聚糖溶液;取1.11g氯化钙固体粉末,加入到100mL上述壳聚糖溶液中,室温下搅拌2小时至氯化钙完全溶解,配制得到氯化钙摩尔浓度为0.10mol/L的氯化钙/壳聚糖混合溶液;取0.1g磁性Fe3O4纳米粒子加入10mL的配制好氯化钙/壳聚糖混合溶液中一同搅拌一个小时,然后超声30分钟,使磁性Fe3O4纳米粒子充分分散在氯化钙/壳聚糖混合溶液中,得到磁性Fe3O4纳米粒子/氯化钙/壳聚糖分散液。
(2)配制海藻酸钠溶液:取2g海藻酸钠固体粉末,边搅拌边加入到100mL去离子水中,然后搅拌3小时至海藻酸钠充分溶解,然后采用摩尔浓度为1.0mol/L的氢氧化钠溶液,以及摩尔浓度为1.0mol/L的盐酸溶液调节海藻酸钠溶液的pH为10,再经过砂芯漏斗过滤,配制得到质量体积比浓度为2%(w/v)的海藻酸钠溶液;
(3)一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球:用容量为1mL的微量注射器取步骤(1)中所配制的磁性Fe3O4纳米粒子/氯化钙/壳聚糖分散液0.8mL,将分散液以15滴/分钟的速度逐滴加入到步骤(2)中所配制的海藻酸钠溶液中,并使Fe3O4纳米粒子/氯化钙/壳聚糖混合溶液的液滴完全浸没于海藻酸钠溶液中,然后将其在室温下放置40分钟后形成微球,最后取出微球用蒸馏水清洗3次,制备得到包埋磁性Fe3O4纳米粒子的壳聚糖/海藻酸钠天然高分子核-壳微球。
图4、图5为实施例2采用一步法制备的核层包埋磁性Fe3O4纳米粒子的壳聚糖/海藻酸钠天然高分子核-壳微球的照片,以及该核-壳微球剖开后的照片。从图4、图5可以看出所制备的核层包埋磁性Fe3O4纳米粒子的壳聚糖/海藻酸钠核-壳微球的外形比较规则,内核和外壳的微球均呈现规则的圆球形,外层微球透明均一,内层微球呈黑色不透明(由于内层包埋了磁性Fe3O4纳米粒子);微球的内层与外层之间的界面十分清晰,具有明显分层的核-壳结构,并且磁性Fe3O4纳米粒子均匀地分散在核-壳微球的内核中,没有扩散进外壳中。因此,本发明所制备的壳聚糖/海藻酸钠天然高分子核-壳微球能够在壳层和核层分层包埋各种不同类型的物质(例如磁性Fe3O4纳米粒子),在药物输送、控制释放、生物成像和生物标记等生物医用领域具有良好的应用价值。
实施例2:
一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法,其制备方法如下:
(1)配制氯化钙/壳聚糖混合溶液:取10g壳聚糖固体粉末,加入到500mL去离子水中,常温下搅拌2小时,然后加入摩尔浓度为1.0mol/L的盐酸溶液调节溶液的pH为5.5,并搅拌8小时至壳聚糖充分溶解,再经过砂芯漏斗过滤,配制得到质量体积比浓度为2%(w/v)的壳聚糖溶液;取0.222g氯化钙固体粉末,加入到50mL上述壳聚糖溶液中,室温下搅拌2小时至氯化钙完全溶解,配制得到氯化钙摩尔浓度为0.04mol/L的氯化钙/壳聚糖混合溶液;
(2)配制海藻酸钠溶液:取1g海藻酸钠固体粉末,边搅拌边加入到100mL去离子水中,然后搅拌3小时至海藻酸钠充分溶解,然后采用摩尔浓度为1.0mol/L的氢氧化钠溶液,以及摩尔浓度为1.0mol/L的盐酸溶液调节海藻酸钠溶液的pH为10,再经过砂芯漏斗过滤,配制得到质量体积比浓度为1%(w/v)的海藻酸钠溶液;
(3)一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球:用容量为1mL的微量注射器取步骤(1)中所配制的氯化钙/壳聚糖混合溶液0.8mL,将混合溶液以10滴/分钟的速度逐滴加入到步骤(2)中所配制的海藻酸钠溶液中,并使氯化钙/壳聚糖混合溶液的液滴完全浸没于海藻酸钠溶液中,然后将其在室温下放置40分钟后形成微球,最后取出微球用蒸馏水清洗3次,制备得到壳聚糖/海藻酸钠天然高分子核-壳微球。
实施例3:
一种采用一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球的方法,其制备方法如下:
(1)配制氯化钙/壳聚糖混合溶液:取30g壳聚糖固体粉末,加入到600mL去离子水中,常温下搅拌1小时,然后加入摩尔浓度为1.2mol/L的盐酸溶液调节溶液的pH为5.0,并搅拌10小时至壳聚糖充分溶解,再经过砂芯漏斗过滤,配制得到质量体积比浓度为5%(w/v)的壳聚糖溶液。取3.33g氯化钙固体粉末,加入到100mL上述壳聚糖溶液中,室温下搅拌3小时至氯化钙完全溶解,配制得到氯化钙摩尔浓度为0.3mol/L的氯化钙/壳聚糖混合溶液;
(2)配制海藻酸钠溶液:取6g海藻酸钠固体粉末,边搅拌边加入到150mL去离子水中,然后搅拌2小时至海藻酸钠充分溶解,然后采用摩尔浓度为1.2mol/L的氢氧化钠溶液,以及摩尔浓度为1.2mol/L的盐酸溶液调节海藻酸钠溶液的pH为11,再经过砂芯漏斗过滤,配制得到质量体积比浓度为4%(w/v)的海藻酸钠溶液;
(3)一步法制备壳聚糖/海藻酸钠天然高分子核-壳微球:用容量为1mL的微量注射器取步骤(1)中所配制的氯化钙/壳聚糖混合溶液1.0mL,将混合溶液以20滴/分钟的速度逐滴加入到步骤(2)中所配制的海藻酸钠溶液中,并使氯化钙/壳聚糖混合溶液的液滴完全浸没于海藻酸钠溶液中,然后将其在室温下放置20分钟后形成微球,最后取出微球用蒸馏水清洗6次,制备得到壳聚糖/海藻酸钠天然高分子核-壳微球。
本发明各原料的上下限、区间取值,以及工艺参数(如温度、时间等)的上下限、区间取值都能实现本发明,在此不一一列举实施例。
需要说明的是,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!