单细胞分析的微流控方法与流程
本发明涉及细胞和分子生物学领域,并且基于用于检测在液滴中由单个细胞产生的目标化合物的方法。本发明还涉及微流体领域,并且包括微流体装置及微流体装置在进行生物学测定中的用途。
背景技术:
在药物发现过程中,步骤之一与基于候选药物的预期生物学作用对候选药物进行验证有关。为此,可以使用体内或体外模型。一方面,体内实验具有解决整个生物体问题的优势。但是,动物模型并不一定能预测人类会发生什么。而且,体内研究是昂贵的,并且其使用受到伦理考虑的限制。另一方面,即使不能复制生物体的精确细胞状态,体外系统也可以对人细胞进行,并且特别适用于需要高通量的筛选过程。这些基于细胞的分析通常对目标细胞进行。但是,在某些情况下,如免疫细胞一样,它们中的每一个都是独特的,因此在单个细胞水平上基于功能性细胞的检测的需求引起了极大的兴趣。实际上,在大量人群中测量免疫应答会增加掩盖每个单个细胞独特行为或贡献的风险,尤其是在免疫应答高度异源或由稀有细胞种群驱动时。因此,需要基于单细胞的分析方法,以更好地了解考虑单个细胞表型的不同细胞之间的潜在差异。
单细胞分析方法的最新进展通过表征种群内细胞之间的关系,改善了单细胞内的生物学理解。因此,通过确定罕见的细胞事件或单个细胞之间的微小变化,有可能解决癌症、免疫学、传染病、干细胞以及发育生物学和神经病学领域尚未解决的问题。
免疫细胞通过产生抗体、趋化因子和细胞因子来保护宿主生物免受疾病侵害。前一类分子是先天性和适应性免疫细胞作为化学信使分泌的一组蛋白质。免疫细胞产生它们的原因是人体能够增强免疫反应,因此具有很高的临床诊断价值。因此,抗体和细胞因子分泌动力学的研究均可为疾病诊断和个性化治疗提供重要信息。
然而,缺乏用于分析单个分泌细胞的定量、单细胞、高通量系统限制了对免疫反应动力学的研究。
近来,基于液滴的微流体系统由于其在细胞生物学中的应用范围以及基于其在单细胞水平上控制机械、生物和流体环境的能力而引起了极大的兴趣。该技术使测定能够非常快速地进行(每秒多达数千个细胞和/或液滴)。此外,该系统还提供了大规模(微微升或纳升容积的样品和试剂)细胞培养实验,其中生物样品被限制在液滴中,从而可以快速检测高浓度的化合物(从pm到μm范围)。此外,该系统最大程度地减少了样品损失和交叉污染,却可以实现快速混合、热传递和化学反应。有趣的是,该技术提供了在单个细胞水平上进行大规模基因型和表型筛选的可能性。
在过去的几年中,已经提出了用于单细胞分析的不同微流体装置和系统(gross等人2015,int.j.mol.sci.16(8):16897-16919;reece等人2016,curr.opin.biotechnol.40:90-96)。
已经提出了用于微流控中的细胞分选的不同方法和技术。分选原理主要分为两类:基于细胞的物理特性(例如大小、可变形性、电学特性或光学特性)的方法,以及基于生物分子特性(尤其是特定表面抗原)的方法。
使用与细胞成分结合的单克隆抗体可以实现高纯度的细胞分离和分选。广泛使用的基于抗体的细胞分析和/或分离技术包括细胞淘选、磁性细胞分选(macs)和荧光活化的细胞分选(facs),包括荧光活化的液滴分选(fads)。
在细胞淘选技术中,表现出特定抗原的细胞可以选择性地附着在抗体包被的表面上。尽管该技术可以提供高纯度,但仍受某些限制(例如高细胞损失或对细胞存活的影响)的影响。
在通过流式细胞术进行单细胞分选的其他细胞淘选技术中,可以通过结合至细胞表面或细胞外基质(如抗体包被的表面)的抗体选择性捕获分泌特定分子的细胞(campbell等,2010j.immunol.185:28-32;manz等,1995,proc.natl.acad.sci.usa92:1921-1925)。尽管此技术可以检测分泌的分子,但在单个细胞水平上,当与流式细胞仪联接时,它会受到某些限制的影响,例如由于细胞浓度的高背景(从而影响细胞纯度)以及缺乏基于分泌的定量分离和缺乏实时定量分泌率测量。
macs使用结合抗体的磁珠在细胞表面捕获特异性抗原。可以在永久磁铁产生的磁场下有选择地收集标记有磁珠的细胞群。与facs相比,macs允许显著更高的产量,但不能进行单细胞分选并且纯度较低。另一个显著的限制是分离后难以分离和除去所述珠,这可能会阻碍后续分析。
细胞分离的另一个示例是使用微流体方法,该方法基于用作珠线的磁珠颗粒的使用。该方法在国际专利申请wo2016/059182a1中公开,其中每个液滴的特征在于形成存在一列磁珠的颗粒聚集体,这些磁珠旨在通过捕获珠线上的所述分子并检测所述珠线上的元素的系统,来检测分泌分子的存在。wo2016/059182a1中提出的方法的优点是能够在单细胞水平上评估分泌的分子。然而,wo2016/059182a1中公开的方法取决于颗粒聚集体的存在,因此阻碍了在同一隔室内需要多个细胞的复杂测定。该测定法具有固有的灵活性限制。另外,敏感性本质上受到颗粒聚集体的结合能力的限制。
通常,影响目前可用的基于分泌分子的分析和/或分离单个细胞的方法的局限性包括就每秒分离的单个细胞而言的效率低或产率/回收率低、分离过程中细胞活性/功能性下降、可靠性差、柔韧性差和/或产量低。因此,显而易见的是,强烈需要用于分析和分离化合物分泌单细胞的改进的微流体方法来解决上述问题。
技术实现要素:
本发明的第一方面涉及一种在微流体系统中检测目标化合物的方法,该方法包括以下步骤:
a.在所述微流体系统中产生至少一个液滴,所述至少一个液滴包括:
i.至少一个单细胞,
ii.一种或多种第一捕获剂,其中所述一种或多种第一捕获剂能够结合所述单细胞以及所述目标化合物,
iii.包含标记的一种或多种第二捕获剂,其中所述一种或多种第二捕获剂能够结合所述目标化合物,
b.培养能够产生可检测事件的所述至少一个液滴,
c.对所述至少一个液滴进行直接检测,
其中,所述可检测事件在所述至少一个液滴中的存在或重新定位确定所述目标化合物的存在。
本发明的第二方面涉及根据第一方面的方法在监测生物事件中的用途。
本发明的第三方面涉及一种用于检测液滴中的目标化合物的方法,该方法包括以下步骤:
a.提供一种微流体系统,其包括:
i.至少一个入口,
ii.至少一个出口,
iii.一个或多个通道,
b.在所述微流体系统中注入液滴流,其中至少一个液滴包括:
i.至少一个单细胞
ii.能够结合所述单细胞以及所述目标化合物的多个第一捕获剂,和
iii.多个第二捕获剂,每个第二捕获剂包含标记,其中所述多个第二捕获剂能够结合所述目标化合物,
c.在允许产生目标化合物的条件下培养所述多个液滴,从而如果目标化合物是由单细胞产生的,所述目标化合物将被所述多个第一捕获剂和所述多个第二捕获剂捕获,
d.通过检测所述标记的存在或重新定位来确定目标化合物的存在。
本发明的第四方面涉及一种微流体系统,其包括:
a.至少一个入口,
b.至少一个出口,
c.一个或多个通道,
d.用于创建至少一个液滴的模块,所述至少一个液滴包括:
i.一个或多个单细胞,
ii.第一捕获剂,
iii.第二捕获剂。
e.检测模块,检测包含产生目标化合物的细胞的液滴
f.分析模块,其被配置为用于信号的分析。
本发明的第五方面涉及根据第四方面的微流体系统在实施根据第一方面或第三方面的方法中的用途。
附图说明
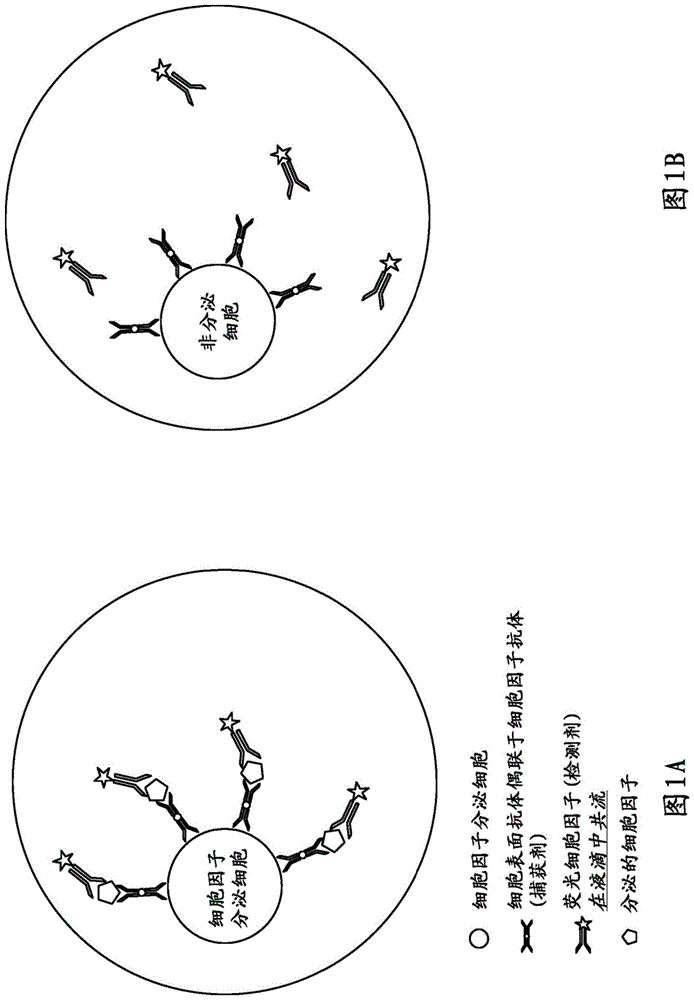
图1.用于细胞因子分泌检测的单细胞液滴分泌测定。
虽然此处介绍的示例着重于使用荧光检测试剂的细胞因子分泌检测和/或抗体分泌检测,但所提供的测定方法可应用于任何目标化合物的分泌检测和使用任何标记的检测试剂。在在芯片上(即在液滴中)或芯片外(即液滴的外部,在单独的容器中)(特异性地使用标记有特定抗原的抗原呈递细胞,或非特定性地,例如通过使用交联抗体或佛波醇酯)刺激pbmc,并使用捕获试剂对pbmc进行预标记(在芯片上或芯片外),并在防止细胞因子分泌的条件下作为单细胞与荧光检测试剂一起包封成液滴。在允许细胞因子分泌的条件下培养液滴后,通过检测试剂在细胞上的存在或重新定位来检测分泌细胞。a)细胞因子分泌细胞:该细胞正在分泌与捕获剂结合的目标细胞因子。检测试剂与分泌的细胞因子结合,从而导致荧光信号在细胞上的存在或重新定位。b)非分泌细胞:被分析的细胞没有分泌目标细胞因子,检测试剂在液滴中保持均质。没有观察到荧光的存在或重新定位。
图2.ifnγ分泌的单细胞液滴检测是灵敏而特异性的。
a)与非活化的细胞相比,由活化的t细胞特异性地基于单细胞液滴检测分泌的ifnγ。通过在液滴中添加
图3.ifnγ分泌的单细胞液滴检测是灵敏的(<1nm)、有效的(>80%)和100%的特异性。
在存在不同浓度的纯化ifnγ的情况下,将已用捕获试剂预标记、并与检测试剂共流的含有单个非活化cd8+t细胞的液滴重新注入微流控装置,并使用专有软件分析每个液滴的荧光。a)选择具有正确宽度以及不同乳液/浓度条件的属性的液滴。b)基于细胞标记选择含有cd8+t细胞的液滴。c)针对每种浓度的细胞因子,检测液滴中的ifnγ。d)针对每种测试浓度的ifnγ,确定检测到的阳性液滴的百分比,并与阴性对照(0nm)比较。在液滴中可检测到低至1nm的细胞因子,使用基于液滴的单细胞分泌测定可检测到约80%的细胞。没有选择假阳性,因为在含有0nmifnγ的条件下观察到0%的细胞/液滴为阳性。
图4.抗原呈递细胞对t细胞的单细胞液滴抗原特异性活化。
a)用特异性肽库脉冲化的抗原提呈细胞(apc)和原代cd8+t细胞(用捕获试剂预标记)共包封在液滴中。将液滴在允许apc活化t细胞的条件下培养过夜,该条件可通过细胞因子分泌来检测。第二天,将液滴重新注入微流控装置中,并分析荧光信号以检测具有分泌的ifnγ和正在分泌ifnγ的活化t细胞。b)目标液滴由共包封的一个t细胞和一个抗原呈递细胞组成。两种细胞都可以用不同的颜色进行荧光标记,以有效选择包含两种细胞的液滴。c)在实验/活化之前或过程中,使用荧光死细胞标记物来控制液滴中细胞的生存力,并排除由于细胞死亡引起的任何假阳性。过夜培养之后,包封进液滴的细胞显示出高活性,因为其中94%被检测为有活性。d)液滴分泌测定用于检测液滴中apc的抗原特异性t细胞活化。如预期的那样,基于响应性t细胞频率,检测到1.2%同时含有活t细胞和活apc的液滴正分泌ifnγ,表明了基于液滴中单个t细胞的ifnγ分泌的成功、高生存力、抗原特异性活化和检测。
图5.适用于任何分泌分子检测的单细胞液滴内分泌测定。
根据本发明的方法是高度可调节的,并且可以适于检测多种生物学事件。虽然此处介绍的示例着重于使用荧光检测试剂的细胞因子和/或抗体分泌检测,但所提供的测定方法可应用于任何目标化合物的分泌检测和使用任何标记的检测试剂。(a)被询问细胞的液滴内检测不同目标化合物的分泌的实例,包括进行多重测定的可能性。在此,提出了抗体和细胞因子分泌的多重测定法,但是本发明可以应用于任何提及的目标化合物。用细胞因子特异性捕获试剂预标记芯片外或芯片上刺激的pbmc,用抗体特异性捕获试剂预标记b细胞。在防止包封为单个细胞之前的细胞因子和抗体分泌的条件下,将两种细胞群与细胞因子特异性荧光检测试剂和抗体特异性荧光检测试剂一起作为单细胞共包封为液滴包封。根据测定明智地选择两种检测试剂的标记物(在该示例中是荧光的,但是可以通过任何方式)。在允许细胞因子和抗体分泌的条件下培养液滴后,通过检测试剂在细胞上的存在或重新定位来检测分泌细胞。分泌的细胞因子与特异性结合至细胞因子分泌细胞的捕获试剂结合,并通过荧光抗细胞因子检测试剂的存在或重新定位进行检测。分泌的抗体和与抗体分泌细胞结合的捕获试剂结合,并通过荧光抗抗体检测试剂在细胞上的存在或重新定位进行检测。抗体特异性捕获试剂可以对所有免疫球蛋白具有特异性,从而可以检测到整体抗体应答,或者可以由目标抗原组成,从而可以检测出抗原特异性抗体应答。(b)使用共流捕获和检测试剂进行液滴内细胞因子分泌检测的示例。在防止细胞因子分泌的条件下,将芯片外或芯片上刺激的pbmc与捕获试剂和检测试剂(可以是此处例示的荧光或可以是任何其他方式)一起作为单细胞包封成液滴。在允许细胞因子分泌的条件下培养液滴后,通过检测试剂在细胞上的存在或重新定位来检测分泌细胞。捕获和检测试剂的浓度均适于产生最高的信号/背景比,并使最大的荧光信号到被询问的细胞上。(c)通过结合至由两个或多个分子组成的细胞的第一捕获试剂的滴内细胞因子分泌检测的示例。芯片外或芯片上刺激的pbmc预标记了由两个或多个分子组成的细胞因子特异性捕获试剂。所述两个或多个分子由对与配体a缀合的目标细胞膜特异的抗体和对与配体b缀合的目标细胞因子特异的抗体组成,其中配体a和b可以相互作用并形成稳定的缔合。在防止细胞因子分泌的条件下,将细胞与荧光检测试剂一起作为单细胞包封成液滴。在允许细胞因子分泌的条件下培养液滴后,通过检测试剂在细胞上的存在或重新定位来检测分泌细胞。(d)使第一捕获剂共流并由两个或更多个分子组成的液滴内细胞因子分泌检测的示例。在防止细胞因子分泌的条件下,芯片外或芯片上刺激的pbmc与捕获剂和荧光检测剂一起作为单细胞包封成液滴。共流的细胞因子特异性捕获试剂由两个或多个分子组成。所述两个或多个分子由对与配体a缀合的目标细胞膜特异的抗体和对与配体b缀合的目标细胞因子特异的抗体组成;其中配体a和b可以相互作用并形成稳定的缔合。在允许细胞因子分泌的条件下培养液滴后,通过检测试剂在细胞上的存在或重新定位来检测分泌细胞。捕获和检测试剂的浓度均适于产生最高的信号/背景比,并使最大的荧光信号到被询问的细胞上。(e)液滴内细胞因子分泌检测的实例,其中第一捕获试剂由两个分子组成,一个部分与细胞结合,另一个部分共流。芯片外或芯片上刺激的pbmc用捕获试剂的第一部分预标记,该第一部分包含与配体a缀合的细胞膜特异性抗体。这些细胞与单核细胞的第二部分一起作为单细胞包封到液滴中在阻止细胞因子分泌的条件下,捕获试剂由与配体b结合的对目标细胞因子具有特异性的抗体组成,还与荧光检测试剂一起组成。配体a和b可以相互作用并形成稳定的缔合。在允许细胞因子分泌的条件下培养液滴后,通过检测试剂在细胞上的存在或重新定位来检测分泌细胞。捕获试剂的第二部分和检测试剂的浓度均适于产生最高的信号/背景比,并使最大的荧光信号到被询问的细胞上。
图6.分泌的受体特异性抗体对t细胞活化的检测。
图7.抗原特异性抗体的分泌和细胞毒性因子分泌检测引起的adcc双重阳性检测。
图8.分泌抗原特异性抗体诱导的adcc的双重阳性检测。
图9.根据本发明的微流体系统和方法的描述。
具体实施方式
根据本发明的方法旨在解决影响当前用于单细胞分析的微流体技术的上述问题。特别地,本方法提供了在单细胞水平上检测、分析和/或定量目标化合物的产生的改进性能。
本文公开的方法的第一个优点是其高灵敏度。这样的性质归因于在液滴中产生目标化合物的单个细胞的空间限制,其中所述单个细胞具有迁移自由度,从而允许高生存力并因此具有高而又生理的代谢活性。另外,在液滴中产生目标化合物的单个细胞的空间限制,其中所述分泌的产物限制在几微微升至纳升的有限体积内,根据所产生的分子,允许在培养的几分钟至几小时内达到高浓度。
因此,通过使用本发明的方法而出现的第二个优点是通过实时监视可检测事件的重新定位和/或强度变化来进行动力学分析的可能性。通过扩展,很容易想到通过使用不同标记的检测试剂扩展到多种分泌的化合物检测。
因此,通过使用本发明的方法出现的第三个优点是通过将两个或多个细胞共包封到液滴中并监测细胞-细胞的作用来进行复杂而灵活的测定的可能性。通过一个、两个或多个细胞产生所述化合物的相互作用。那些共包封两个或更多个细胞的复杂测定法还使得能够检测两个或更多个目标化合物的分泌。
通过使用本发明的方法出现的第四个优点是检测所述分子的产生的高特异性。这种性质归因于在液滴中产生目标化合物的单个细胞的空间限制,其中所述分泌产物被限制在限制的体积内,特别是捕获到所述单个细胞中,因此分泌产物仅被分泌细胞捕获。
在这方面,发明人发现,通过监测液滴内细胞上检测试剂的存在或重新定位,可以有利地检测分泌细胞,并且细胞密度/浓度不影响检测的特异性。
另外,在存在非分泌细胞或非分泌目标化合物的细胞的情况下,检测试剂在液滴中保持均质,从而使假阳性命中率最小。
在第一方面,本发明涉及一种在微流体系统中检测目标化合物的方法,所述方法包括以下步骤:
本发明的第一方面涉及一种在微流体系统中检测目标化合物的方法,该方法包括以下步骤:
a.在所述微流体系统中产生至少一个液滴,所述至少一个液滴包括:
i.至少一个单细胞,
ii.一种或多种第一捕获剂,其中所述一种或多种第一捕获剂能够结合所述单细胞以及所述目标化合物,
iii.包含标记的一种或多种第二捕获剂,其中所述一种或多种第二捕获剂能够结合所述目标化合物,
b.培养能够产生可检测事件的所述至少一个液滴,
c.对所述至少一个液滴进行直接检测,
其中,所述可检测事件在所述至少一个液滴中的存在或重新定位确定所述目标化合物的存在。
在本发明的上下文中,术语“微流体系统”可以指用于执行本文公开的方法的一个或多个集成单元或芯片。所述微流体系统通常以包括一个或多个微通道和一个或多个微流体装置(例如微泵、微阀)的微流体芯片的形式表示。
在本发明的上下文中,“微流体芯片”通常是指通过铣削、蚀刻、烧蚀或模制成材料(诸如聚二甲基硅氧烷(pdms)或聚甲基丙烯酸甲酯(pmma)的聚合材料)、聚碳酸酯(pc)、、环氧树脂、coc、尤其是可光聚合的环氧树脂(例如norlandopticaladhesives(noa)销售的)、玻璃、硅、塑料制成的一组微通道。微流体芯片可包括一起限定至少一个通道的基底和支持物。
如本文所用,术语“液滴”是指流体的隔离部分,其与其周围环境不混溶。在本发明的上下文中,所述“液滴”可以是球形、基本球形或非球形的形状。所述形状可以取决于不同的参数,例如外部环境。
在微流体系统中制备,产生和注入液滴的方法是本领域技术人员已知的。在us2015/0057163a1中公开了一种示例性方法。关于每个液滴中单个细胞的存在,本领域技术人员知道可以使用泊松分布来控制和/或估计该参数。
在本发明的上下文中,表述“至少一个单细胞”是指有活性和无活性的单细胞。所述至少一个单个存活细胞的存活状态可以按照根据本发明的方法的步骤变更或改变。值得注意的是,在根据本方法的液滴的培养步骤之后,在所述液滴中产生可检测事件的能力是指液滴内具有至少一个活的单细胞的可能性。
如本文所用,术语“直接检测”是指在液滴内不存在固相支持物的情况下检测由单个细胞产生的所关注的化合物的可能性,其中固相支持物将用于捕获所关注的化合物。在本发明的上下文中,术语“固体支持物”是指任何非生物基质,例如磁珠、凝胶基质或亲和基质,其对靶分子具有给定的特异性,从而可以将靶分子固定在所述载体上,这允许从液滴中包含的内容物中分离出靶分子。
根据本发明的第一方面的实施方式,单个细胞在液滴内呈现出迁移自由度。
在本发明的上下文中,目标化合物的检测与液滴中产生所述目标化合物的细胞的取向无关。
根据本发明的第一方面的另一个实施方案,单个细胞没有被捕获在固体支持物上。
发明人已经发现具有高迁移率的单个细胞的存在,其不被约束在固体支持物上,由于在细胞表面上的第一捕获剂的改善分布,在检测由细胞分泌的目标化合物的存在方面具有优异的灵敏度检测到的第一分布的改善而在检测方面。
如本文所用,术语“捕获剂”是指对目标化合物具有亲和力的试剂、核酸、蛋白质或肽。在本发明的上下文中,该方法需要第一捕获剂和第二捕获剂的存在。
在本发明的上下文中,术语“第一捕获剂”和/或“第二捕获剂”可以指单个双官能化合物或包含两种或更多种不同化合物的复合物,每种化合物均具有特定的功能性。根据本发明的方法构想的第一捕获剂和第二捕获剂的实例可以是由抗体、抗原、细胞因子、趋化因子、激素或生长因子或它们的组合形成的化合物或复合物。
如本文所用,术语“重新定位”是指在可检测事件的密度和/或浓度的液滴内的空间布置的变化。如本文所用,术语“存在”是指可检测事件的强度的发生或改变。
根据本发明的方法的重要方面涉及液滴内可检测事件的重新定位。在这方面,本领域已知的方法不能实现本文所期望的“重新定位”,但是在进行流式细胞术分析之前,仅冲洗掉过量的局部的浓度结合。因此,该特征的效果使根据本发明的方法具有比现有方法更高的效率。
基于液滴的微流体分析中的另一个重要步骤,是液滴的培养以及液滴的产生、皮下注射、合并和分选。在本发明的上下文中,培养可以在芯片外或芯片上进行。培养步骤也可以在培养液滴所必需的延迟线出现长达一精确的时间,以允许细胞存活并产生目标化合物。在us2012/0121480a1中公开了在延迟线中培养的示例性方法。包封前的典型培养温度范围为0℃至16℃,包封后的典型培养温度范围为16℃至38℃,培养后重新注入以分析分泌的分子的范围为0℃至38℃。典型的培养时间从毫秒(用于动力学分析)到超过24h(用于细胞间相互作用介导的化合物生产调节分析)。
在本发明的第一方面的另一个实施方案中,该方法进一步包括在培养后测量液滴中的细胞存活的步骤。在本发明的上下文中,用于测量细胞存活的优选方法是通过使用仅当在液滴中检测到死细胞时才发射荧光的插层染料来完成的,例如
根据本发明第一方面的另一个实施方案,所述一种或多种第一捕获剂在产生所述至少一个单个液滴之前或之后结合所述至少一个单细胞的表面。
在本发明的第一方面的一个实施方案中,一种或多种第一捕获剂以101至108个分子/细胞的密度结合所述单个细胞。
根据本发明第一方面的另一个实施方案,在液滴中以10pm至100μm的浓度产生目标化合物。
在本发明的第一方面的另一个实施方案中,液滴的体积为2pl至10nl。
在本发明的第一方面的另一个实施方案中,标记选自荧光标记、聚合物、蛋白质、肽、半抗原、化学药品、核酸或条形码标记。如本文所用,术语“条形码”是指可以附着至分析物以传达有关所述分析物的信息的标签。在本发明的上下文中,条形码标签可以是标签、聚合物、荧光标签、肽、半抗原、蛋白质、化学药品、核酸的混合物。
在本发明的第一方面的另一个实施方案中,第一捕获剂和所述第二捕获剂独立地选自蛋白质、肽、寡核苷酸、半抗原、核酸、荧光缀合物、酶偶联物、合成聚合物或条形码或其组合。条形码标签可以是标签、聚合物、荧光标签、肽、庚烯、蛋白质、化学药品、核酸的混合物。
在本发明的第一方面的另一个实施方案中,第一捕获剂是抗体,而所述第二捕获剂是目标抗体的荧光抗化合物。
根据本发明的第一方面的另一个实施方案,第一捕获剂是双功能抗体。
在本发明的第一方面的另一个实施方案中,目标化合物是细胞分泌的化合物,其选自但不限于抗体(igg(igg1、igg2、igg3、igg4)、ige、iga(iga1、iga2)、igm、细胞因子(il-1样、il-1α、il-1β、il-1ra、il-2、il-3、il-4、il-5、il-6样、il-6、il-7、il-9、il-10-样、il-10、il-11、il-12、il-13、il-14、il-15、il-16、il-17、il-18、il-20、共同b链(cd131)、lif、osm、干扰素(ifn-α、ifn-β、ifn-γ)、tnf、tnf-α、tnf-β、cd153、cd154、lt-β、4-1bbl、april、cd70、cd132、cd178、gitrl、light、ox40l、tall-1、trail、tweak、trance、tgf-β、tpo、flt-3l、scf、m-csf、msp)、趋化因子(ccl1、ccl2、ccl3、ccl4、ccl5、ccl6、ccl7、ccl8、ccl9/ccl10、ccl11、ccl12、ccl13、ccl14、ccl15、ccl16、ccl17、ccl18、ccl19、ccl20、ccl21、ccl22、ccl23、ccl24、ccl25、ccl26、ccl27、ccl28、cxcl1、cxcl2、cxcl3、cxcl4、cxcl5、cxcl6、cxcl7、cxcl8、cxcl9、cxcl10、cxcl11、cxcl12、cxcl13、cxcl14、cxcl15、cxcl16、cxcl17、x1l1、xcl2、cx3cl1)、激素(雌激素、孕激素、甲状腺素、类固醇、胰岛素、肾上腺素肾上腺素、褪黑素、三碘甲腺嘌呤、甲状腺素、前列腺素、白三烯、前列环素、therocis、脂联素、促肾上腺皮质激素(或促肾上腺皮质激素)、糊精(或胰岛淀粉样多肽)、血管紧张素和血管紧张素、胰岛淀粉样变抗苗勒管激素(或苗勒管抑制因子或激素)、抗利尿激素(或血管加压素、精氨酸加压素)、心房肽(或心钠素)、降钙素、胆囊收缩素、促肾上腺皮质激素释放激素、皮质抑素、内皮素、脑啡肽、红细胞生成素、促卵泡激素、甘丙肽、胃抑制多肽、胃泌素、胰高血糖素、胰高血糖素样肽-1、促性腺激素释放激素、鸟苷、肝素、人绒毛膜促性腺激素、抑制素、胰岛素、胰岛素样生长因子(或生长激素)、瘦素、脂蛋白、促黑素细胞激素、胃动素、食欲素、骨钙素、催产素、松弛素、肾素、促胰液素、生长抑素、血小板生成素、尿鸟苷、血管活性肠肽、类固醇、雌激素、糖皮质激素、孕激素、类固醇)、生长因子(g-csf、gm-csf、fas-配体、肾上腺髓质素(am)、血管生成素(ang)、自分泌运动因子、骨形态发生蛋白(bmp)、睫状神经营养因子家族、睫状神经营养因子(cntf)、白血病抑制因子(lif)、白介素6(il-6)、集落刺激因子、巨噬细胞集落刺激因子(m-csf)、粒细胞集落刺激因子(g-csf)、粒细胞巨噬细胞集落刺激因子(gm-csf)、表皮生长因子(egf)、e素(a1-a5、b1-b3)、促红细胞生成素(epo)、成纤维细胞生长因子(fgf1-fgf23)、胎牛生长激素(fbs)、gdnf配体家族、神经胶质细胞源性神经营养因子(gdnf)、神经氨酸、persephin、artemin、生长分化因子9(gdf9))、肝细胞生长因子(hgf)、肝癌衍生生长因子(hdgf)、胰岛素、胰岛素样生长因子、胰岛素样生长因子-1(igf-1和igf-2)、白介素;il-3和il-6的il-1辅因子、il-2、il-3、il-4、il-5、il-6、il-7、角质形成细胞生长因子(kgf)、迁移刺激因子(msf)、巨噬细胞刺激蛋白(msp)、也称为肝细胞生长因子样蛋白(hgflp)、肌生长抑制素(gdf-8)、神经调节蛋白(nrg1-nrg4)、神经营养蛋白、脑源性神经营养因子(bdnf)、神经生长因子(ngf)、神经营养蛋白3(nt-3)、神经营养蛋白4(nt-4)、胎盘生长因子(pgf)、血小板衍生生长因子(pdgf)、肾病酶(rnls)–抗凋亡生存因子、t细胞生长因子(tcgf)、血小板生成素(tpo)、转化生长因子α(tgf-α、tgf-β(tgf-β1、tgf-β2、tgf-β3))、肿瘤坏死因子-α(tnf-α)、血管内皮生长因子(vegf))。
本发明的第二方面包括根据所述发明的第一方面的方法在监测一个或多个可能同时发生的生物学事件中的用途。如本文所用,术语“生物事件”是指描述发生在受试者体内并影响活细胞的生理状态的生理过程和/或状态的改变。典型的例子是将化合物的分泌与诱导的死亡联系起来(非限制性例子是adcc、cdc、adcp、细胞因子诱导的细胞溶解、凋亡、铬释放),另一个例子是分泌的化合物活化和/或抑制细胞途径(作为非限制性实例的g蛋白偶联受体活化、b-arrestin、胱天蛋白酶活化、pkc/nfkb途径、map激酶、pi3k、akt途径、ras/mek/erk、plc/ca++)。
在本发明第二方面的实施方案中,生物学事件是免疫应答。典型的示例是检测t细胞诱导化合物分泌的抗原识别,包括通过b细胞诱导化合物分泌的抗原识别,以及由t细胞分泌的化合物监测并由第二种分泌的化合物诱导的t细胞活化(此示例包括通过两种不同的细胞类型进行检测分泌的化合物,并使用特异于每一个的条形码的区分它们),并包括由b细胞分泌的化合物监测并由第二种分泌的化合物诱导的b细胞活化。
本发明的第三方面涉及一种用于检测液滴中的目标化合物的方法,该方法包括以下步骤:
a.提供一种微流体系统,其包括:
i.至少一个入口,
ii.至少一个出口,
iii.一个或多个通道,
b.在所述微流体系统中注入液滴流,其中至少一个液滴包括:
i.至少一个单细胞
ii.能够结合所述单细胞以及所述目标化合物的多个第一捕获剂,和
iii.多个第二捕获剂,每个第二捕获剂包含标记,其中所述多个第二捕获剂能够结合所述目标化合物,
c.在允许产生目标化合物的条件下培养所述多个液滴,从而如果目标化合物是由单细胞产生的,所述目标化合物将被所述多个第一捕获剂和所述多个第二捕获剂捕获,
d.通过检测所述标记的存在或重新定位来确定目标化合物的存在。
本发明的第四方面涉及一种微流体系统,其包括:
a.至少一个入口,
b.至少一个出口,
c.一个或多个通道,
d.用于创建至少一个液滴的模块,所述至少一个液滴包括:
i.一个或多个单细胞,
ii.第一捕获剂,
iii.第二捕获剂。
e.检测模块,检测包含产生目标化合物的细胞的液滴
f.分析模块,其被配置为用于信号的分析。
根据本发明的第四方面的实施例,微流体系统的特征在于存在至少两个彼此连通的模块,该模块选自包括以下各项的组:用于液滴生成的模块、用于液滴检测的模块、用于液滴分析的模块、用于对液滴进行分类的模块、用于对液滴进行标记的模块以及用于回收液滴的模块。在本发明的上下文中,用于回收液滴的模块旨在用于执行额外的程序(例如基因分型、进一步的功能分析)。
在图9中描绘了根据本发明的微流体系统和方法的理想方案。
前述模块中的两个或更多个的组合允许本文公开的微流体系统在高通量方面实现改进的结果(每秒可处理数千个液滴)。
根据本发明的微流体系统的一个重要方面是,根据本发明的第一方面的方法的分泌和检测步骤可以在微流体系统的相同模块中进行。
根据第五方面,根据第四方面的微流体系统用于执行在本发明的第一方面或第三方面中公开的方法。
示例
原理说明
健康的捐献者pbmc在微管中被预标记了过量的双功能抗体,称为“捕获试剂”。捕获试剂对白细胞特异性膜蛋白(cd45)和目标细胞因子均具有特异性。在防止细胞因子分泌的条件下(即在4℃)培养5分钟后,所有白细胞均用捕获试剂均匀标记,过量的白细胞通过大量洗涤被洗去。在防止细胞因子分泌的条件下,将预标记的细胞作为单细胞与最终浓度为1%v/v的荧光标记抗细胞因子抗体一起包封到微微升液滴中(图1)。将含有单细胞的液滴在5%co2控制的培养箱中于37℃培养1h20,以分泌细胞因子。重新注入液滴,并针对每个液滴分析通过检测试剂的荧光信号在细胞上的重新定位所介导的细胞因子的分泌。在含有分泌细胞因子的细胞的液滴中,检测试剂信号会重新定位到细胞上,从而导致液滴中荧光的局部增加。相反,在包含非分泌细胞的液滴中,检测试剂的荧光信号在液滴中保持均匀,并且未观察到荧光的局部增加。
与非活化的pbmc相比,将液滴内分泌测定法用于检测pma/离子霉素活化的pbmc分泌的ifnγ(和tnfα,未显示)(图1)。使用基于液滴的微流控系统和软件观察到的结果与在具有相同细胞和条件的微孔板中产生的流式细胞仪数据进行了比较(图2)。在液滴分泌测定中,流式细胞术中100%的分泌细胞被检测为阳性。假阳性细胞在阴性对照中的计数少于0.15%。与流式细胞术检测相比,活化t细胞对细胞因子分泌的液滴检测非常高效且具有特异性。
量化细胞因子分泌的敏感性和效率
按照液滴分泌测定法,将非活化和未分泌的cd8+t细胞包封在具有一定浓度的纯化ifnγ的液滴中。产生了四种乳剂,每个乳剂都含有作为单个细胞分离的细胞和不同浓度的纯化细胞因子:液滴中ifnγ的最终浓度为0nm、1nm、5nm或10nm(图3)。重新注入所有四种乳液的液滴,并分析荧光信号。使用液滴分泌测定法,检测到低至1nm的细胞因子浓度,没有假阳性事件,显示出高度敏感和100%特异性的测定。由于在液滴中检测到超过80%的阳性细胞,因此分泌测定也显示出了效率。
这些示例显示了通过生成标准曲线样品条件的平均值来校准测定检测液滴中定量、实时细胞因子分泌的方法的可能性。
基于共包封的液滴中apc/t细胞的细胞因子分泌进行抗原特异性t细胞鉴定
当共培养时,负载有特定肽的抗原呈递细胞(apc)可以特异性活化一部分应答性t细胞,从而导致细胞因子分泌。液滴分泌测定法用于检测液滴中apc对t细胞的特异性活化(图4)。在防止细胞因子分泌的条件下,apc和t细胞作为单细胞共流入液滴中。将液滴在5%co2控制的培养箱中以37℃培养过夜,并于第二天重新注入。通过使用嵌入染料
抗原特异性和总抗体分泌检测
通过将被捕获试剂和检测试剂预标记的b细胞共包封在液滴中,可以使用所述的液滴内分泌测定法来评估抗体的分泌。捕获试剂的第一部分能够识别b细胞表面标志物,可以是pan-b标志物或特定的b细胞标志物,典型的示例是用于分泌免疫球蛋白的浆细胞的cd138标志物。捕获试剂的第二部分是特异性捕获抗体,或者由目标抗原组成。在捕获试剂由部分捕获抗体组成的第一种情况下,检测试剂由可检测的标记抗原组成。在捕获试剂由目标抗原组成的第二种情况下,检测试剂由可检测的标记的抗抗体二级抗体组成。b细胞上荧光信号的重新定位(此处标记是荧光的,但可以由本领域技术人员通过任何方法检测)表明存在于被询问液滴中的b细胞分泌了抗原特异性抗体。此处描述的方法可以在预培养或不预培养捕获试剂的情况下进行调整(图5a-e)。这里描述的方法可以适用于前面提到的任何目标化合物。
分泌的受体特异性抗体检测t细胞活化
对给定的t细胞受体特异的抗体的结合可以活化t细胞,导致例如细胞因子的分泌。液滴分泌测定法可以检测液滴中免疫球蛋白表达细胞分泌的t细胞受体特异性抗体对t细胞的活化作用(图6)。典型的例子包括pbmc,该pbmc被捕获试剂预标记,该捕获试剂与表达免疫球蛋白的细胞一起包封在液滴中。在含有标记的检测试剂的情况下产生液滴(这里的标记是荧光的,但可以通过任何方式产生)并且在防止抗体产生的条件下产生。在允许抗体产生的条件下培养液滴后,通过检测例如细胞因子分泌来检测t细胞活化。t细胞受体特异性抗体的结合依次活化t细胞,然后t细胞分泌例如细胞因子。分泌的细胞因子重新定位在与t细胞结合的捕获试剂上,荧光检测试剂重新定位在目标细胞因子上。由于检测试剂在活化的t细胞上的重新定位,含有被分泌的抗体活化的t细胞的液滴随后出现可检测的信号。此处描述的方法可以在预培养或不预培养捕获试剂的情况下进行调整。上述方法的典型示例是检测触发t细胞活化的抗cd3抗体。通过扩展,该系统可以用于鉴定抗检查点抗体。
抗原特异性抗体分泌诱导的adcc双重阳性检测和细胞毒性因子分泌检测
在分泌具有adcc活性的抗原特异性抗体的情况下,滴内分泌测定可用于评估诱导的死亡率(图7)。此处介绍的双阳性试验能够检测杀伤细胞(例如,原发性自然杀伤(nk)细胞、单核细胞、巨噬细胞、嗜中性粒细胞、嗜酸性粒细胞和树突状细胞以及细胞培养细胞系)分泌的细胞毒性因子,并由杀伤细胞分泌的化合物诱导的靶细胞死亡。在非饱和条件下,将杀伤细胞预标记为对目标细胞毒性因子具有特异性的捕获试剂。捕获试剂的非饱和条件是强制性的,以能够通过杀死细胞来捕获和检测所关注的分泌性分泌化合物,并且分泌的尚未捕获的化合物对靶细胞的作用最终导致细胞死亡。然后将靶细胞与产生免疫球蛋白的细胞和杀伤细胞共包封在液滴中。在包封之前,在防止抗体产生的条件下,使包封的细胞与对目标细胞毒性因子具有特异性的检测试剂共流。产生后,在允许产生抗体的条件下培养液滴。特异性抗体重新定位在靶细胞上,并且杀伤细胞通过fc受体与抗体结合。一旦与具有adcc活性的抗体结合,杀伤细胞就会释放细胞毒性因子,导致靶细胞死亡。一些分泌的细胞毒性因子被杀伤细胞上的捕获试剂捕获,并使检测试剂重新定位,从而能够检测出细胞毒性因子的产生。通过从表达目标抗原的垂死靶细胞中释放化合物来监测细胞死亡。或者,通过细胞表面标志物或本领域技术人员已知的任何其他合适的标志物监测细胞死亡。通过扩展,可以将滴内测定法应用于补体依赖性细胞毒性和调理吞噬作用或上述任何其他测定法。
对此示例的替代和/或补充是,在结合或不结合细胞死亡检测的情况下,代替检测分泌的细胞毒性因子,和/或除了检测分泌的细胞毒性因子之外,检测抗体的产生(图8)。
- 还没有人留言评论。精彩留言会获得点赞!