一种微液滴芯片
本发明涉及生物检测的技术领域,特别是涉及一种微液滴芯片。
背景技术:
传统的分子浓度测定通常需要先建立分子浓度(c)与某种物理量强度(a)响应关系或校正函数(如e(c)=f(a)),再将样本物理量强度测量值转换成相应的分子浓度,因此也被称之为“模拟量分析方法”。数字化分析通常是将待测样本分子分散到大量分析单元,使得每个分析单元中至多包含一个分子,根据分析单元有无分子信号将其二值化为“1”或“0”,统计阳性信号“1”的数目或者所占比例即可确定待测样本中的分子数目或浓度。相比于“模拟量方法”,数字化分析信号读取相对简单且拥有更高的分析精度和绝对定量能力,因而在包括核酸、蛋白以及酶活性定量检测在内的定量生物学和生物医学分析中备受青睐。
微液滴技术是实现数字化分析的一种有力工具。现有商业化数字pcr系统大多以微液滴作为数字化分析的基本单元,包括bio-rad的q系列,stillatechnologies的naicacrystal系统。
然而,由于一般的微液滴生成过程需要精密的样本流速或流量控制,这些系统往往需要复杂笨重的流体驱动控制装置。而且,现有数字化分析系统集成度不高,其样本加入、液滴生成、转移、反应及检测往往需要多步移液操作和依赖专用仪器设备(如液滴生成装置、液滴反应装置、液滴信号检测装置),难以实现全过程的封闭操作。这些因素导致现有数字化分析系统面临设备昂贵、操作繁琐、需专人操作与维护,极大的增加了数字化分析广泛应用的难度。
技术实现要素:
为了解决上述问题,本发明的目的是提供一种微液滴芯片,一方面可以解决现有技术中存在的微液滴生成依赖于复杂笨重的流体驱动控制装置,成本较高的问题,另一方面解决现有技术中由于芯片操作集成度不高需要多步操作且存在暴露污染风险的技术问题。
为解决上述技术问题,本发明的实施例采用了如下技术方案:
本发明的实施例提供了一种微液滴芯片,所述微液滴芯片包括:
液滴检测区,用于构建高密度单层液滴阵列以便原位成像分析或形成多个平行的液滴队列以便多通道流式分析;
出样口结构,所述出样口结构连通所述液滴检测区的下游;
液滴发生结构,所述液滴发生结构的第一端连通进样口结构,所述液滴发生结构的第二端连通所述连续相储存池结构,所述液滴发生结构的第三端连通所述液滴检测区;
第一流阻调节通道,第一流阻调节通道的一端接入分散相,所述第一流阻调节通道的下游与所述液滴发生结构的第一端相连通;
以及,第二流阻调节通道,所述第二流阻调节通道的一端接入连续相,所述第二流阻调节通道的一端与所述液滴发生结构的第二端相连通,
所述第一流阻调节通道对所述分散相的流阻进行调节,所述第二流阻调节通道对所述连续相的阻流进行调节,以使进入所述液滴发生结构内的所述分散相的和所述连续相的流阻之比在预设范围内,在同一驱动压强差下在所述液滴发生结构的第三端形成预期尺寸的液滴。
进一步地,所述样本进口结构包括:
所述分散相经第一流阻调节通道调节后进入到液滴发生结构内的流阻rd为:
ld为第一流阻调节通道的长度,wd为第一流阻调节通道的宽度,hd分别为第一流阻调节通道的高度,ηd为第一流阻调节通道的流体动态粘度;
所述连续相经第二流阻调节通道调节后进入到液滴发生结构内的流阻rc为:
lc为第二流阻调节通道的长度,wc第二流阻调节通道的宽度,hc为第二流阻调节通道的高度,ηc为第二流阻调节通道的流体动态粘度。
进一步地,所述流阻rd与流阻rc的之比的范围为0.5-2。
进一步地,所述微液滴芯片还包括:
进口腔,所述第一流阻调节通道的上游与所述进口腔相连通;
连续相储存池,所述第二流阻调节通道的一端与所述连续相存储池相连通。
进一步地,所述微液滴芯片还包括:
液滴分配分支结构,所述液滴分配分支结构的上游连通所述液滴发生结构的第三端,所述液滴分配结构的下游连通所述液滴检测区。
进一步地,所述液滴分配分支结构具有n级分支,其中,第n级分支的分支通道的数量为2n。
进一步地,所述微液滴芯片还包括:
混合结构,所述混合结构设置于所述液滴分配分支结构的任一分支上,用于对所述样本和试剂进行均匀的混合;
其中,所述混合结构为通道宽窄相间的波浪形外沿的通道结构。
进一步地,所述出样口结构:
出口分支结构,所述出口分支结构上游与所述液滴检测区相连通;
以及,
出口腔,所述出口腔与所述出口分支结构的下游相连接。
所述微液滴芯片还包括:
与压强发生器相连接的压强作用腔,所述压强作用腔连通所述进样口结构或所述出样口结构,用于将流体驱动所需的压强作用于所述微液滴芯片内,使得在进样口结构内的压强大于所述出样口结构内的压强。
其中,当存在多个进口腔以承载不同组分液体的情形下,所述的第一流阻调节通道也相应的设有多条,且可根据所述液体物理性质(如粘度等)的不同相应地改变第一流阻通道几何构型(宽度、长度和截面形状等),以保证不同液体在进入液滴发生结构之前的流阻趋于相等,从而确保同步进样。
进一步地,所述微液滴芯片还包括:
第一密封层,
以及,
第一配置层,所述第一密封层和第一配置层相互连接,共同形成所述进样口结构、所述连续相储存池结构、所述出样口结构、所述液滴检测区和所述液滴发生结构;
或者,
第二密封层,
第二配置层,
以及,
中间层,
所述第二密封层、所述中间层板和所述第二配置层依次连接,共同形成所述进样口结构、所述连续相储存池结构、所述出样口结构、所述液滴检测区和所述液滴发生结构。
相比于现有技术,
本发明可实现无需使用复杂笨重的外部流体驱动控制设备对分散相、连续相的流速或流量进行调控即可快速高通量形成大小均一的微液滴,其机理在于:对于水压强剪切形成液滴的结构而言,所产生的液滴大小在一定范围内主要取决于分散相与连续相的流量qd/qc之比,而分散相与连续相的流量大小主要取决于其受到的驱动压强差δpi与各自受到的流阻ri之比,即qi=δpi/ri,因此最终形成的液滴大小
在现有技术体系下,这类液滴芯片在液滴形成过程中需要根据连续相和分散相受到流阻ri的差异来精确控制连续相和分散相的各自的驱动压强差δpi以及δpd/δpc之比,以保证最终液滴大小的均一性。由于连续相和分散相的各自的驱动压强差δpi需要独立调节且需要保证动态平衡(δpd/δpc之比为固定值),不可避免地需要使用精密流体驱动控制装置来实现该效果,或者受制于液滴形成过程中压强条件的波动或偏移(如液滴填充过程造成的驱动阻力增加)而导致液滴尺寸偏差或整体偏移之情形。
对此,本发明做出以下重要改进:(1)通过第一流阻调节通道和第二流阻调节通道来实现调节连续相和分散相的流阻rc/rd之比,使之可在同一驱动压强差δp下形成预期大小的液滴;(2)通过整体增加连续相和分散相受到流阻ri和液滴生成后的流阻rb,以减小驱动压强差δpi发生波动时对流体流量的影响,进而削弱其对最终形成液滴大小的影响,同时该设计还允许使用较宽的操作范围触发驱动压强差来形成尺寸极为相近的微液滴。
另一方面,本发明的实施例所提供的所述微液滴芯片集成有试剂存储、试样混合、液滴发生、孵育/反应、液滴检测等数字化分析的全流程所需的操作单元,无需开管操作、无需液滴转移,使用简单,无污染风险。
综之,本发明的实施例所提供的所述微液滴芯片的有益效果包括:无需使用复杂笨重的外部流体驱动控制设备对分散相、连续相的流速或流量进行调控,即可形成高度均一性微液滴,降低了检测的成本,且无需专业的人员对外部流体驱动控制设备进行控制,以及后期的维护工作中,有效的解决了现有技术中存在的微液滴生成依赖于复杂笨重的流体驱动控制装置,成本较高,而且需要专业的操作以及维护的技术问题。
附图说明
为了更清楚地说明本申请实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
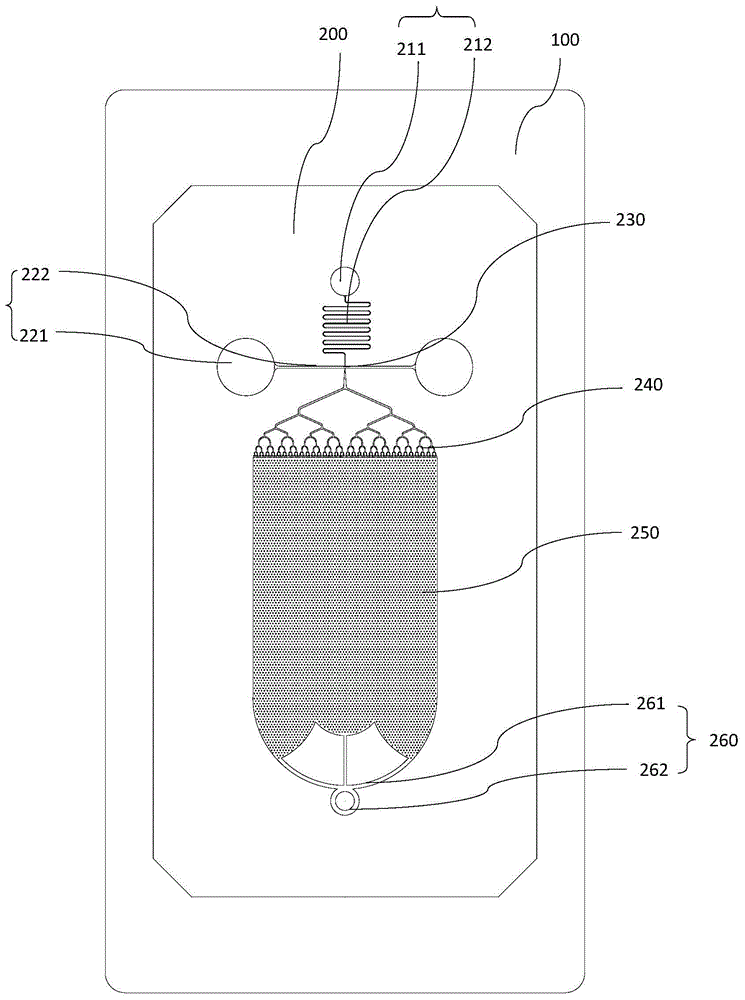
图1是本发明实施例1提供的一种微液滴芯片的俯视图;
图2是本发明实施例1提供的一种微液滴芯片的液滴发生结构的结构示意图;
图3是本发明实施例1提供的一种微液滴芯片的液滴分配分支结构的结构示意图;
图4是本发明实施例1提供的一种微液滴芯片的混合结构的结构示意图;
图5是本发明实施例1提供的一种微液滴芯片的结构示意图;
图6是本发明实施例1提供的一种微液滴芯片的明场显微图像;
图7是本发明实施例1提供的一种微液滴芯片的荧光图像;
图8是本发明实施例2提供的一种微液滴芯片的爆炸图;
图9是本发明实施例2提供的一种微液滴芯片的爆炸图;
图10是本发明实施例2提供的一种微液滴芯片的明场显微图像;
图11是本发明实施例2提供的一种微液滴芯片的荧光图像;
图12是本发明实施例2提供的一种微液滴芯片的荧光图像与明场图像融合后的组合图像。
其中:
100、第一密封层;200、第一配置层;211进口腔;212、第一流阻调节通道;221、连续相储存池;222、第二流阻调节通道;230、液滴发生结构;240、液滴分配分支结构;250、液滴检测区;260、出样口结构;261、出口分支结构;262、出口腔;270、混合结构;280、液滴缓冲池;300、第二密封层;400、第二配置层;500、中间层。
具体实施方式
下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本申请保护的范围。
在本申请实施例的描述中,需要说明的是,术语“中心”、“上”、“下”、“左”、“右”、“竖直”、“水平”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本申请实施例和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本申请实施例的限制。此外,术语“第一”、“第二”、“第三”仅用于描述目的,而不能理解为指示或暗示相对重要性。
在本申请实施例的描述中,需要说明的是,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可更换连接,或一体地连接,可以是机械连接,也可以是电连接,可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本申请实施例中的具体含义。
下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
实施例1
如图1所示,图1为本发明实施例1提供的一种微液滴芯片的俯视图;
如图1-7所示,本发明的实施例1提供了一种微液滴芯片,所述微液滴芯片包括:
进口腔211,所述进口腔211与外部空间直通,用于待分散相样本混合液或待分散相样本及检测试剂的随时加载,以便后续进行反应检测;优选地,所述进口腔211的开口直径为2.5mm;
所述进口腔211的形状可以为圆筒状或上宽下窄的圆锥状,以供样本或者试剂加入。
以及,
第一流阻调节通道212,所述第一流阻调节通道212的上游与所述进口腔211相连通,所述第一流阻调节通道的下游与所述液滴发生结构的第一端相连通,所述第一流阻调节通道用于对进入所述液滴发生结构的样本或试剂的流阻进行调节。
所述第一流阻调节通道212为一段长度为32mm,宽度为35μm的流阻通道,所述流阻通道为多层弯曲叠置的通道,在所述样本或者是试剂进入到所述第一流阻调节通道212时,通过多层弯曲叠置的通道调节样本或者试样的流速以及流阻,使得样本或试剂能够在通道内调节流阻。
其中,所述分散相经第一流阻调节通道调节后进入到液滴发生结构内的流阻rd为:
ld为第一流阻调节通道的长度,wd为第一流阻调节通道的宽度,hd分别为第一流阻调节通道的高度,ηd为第一流阻调节通道的流体动态粘度;
通过调节第一流阻调节通道的长度l1、第一流阻调节通道的宽度w1和第一流阻调节通道的高度h1等能够实现对所述第一流阻调节通道输出至所述液滴发生结构的第一端的流阻即所述分散相经第一流阻调节通道调节后进入到液滴发生结构内的流阻rd的调节,以使其能够满足芯片所需的要求。
其中,所述连续相储存池221结构包括:
连续相储存池221,所述连续相储存池221设置有与外部空间相通且可关闭的开口,用于连续相试剂的加载和存储;
以及,
第二流阻调节通道222,所述第二流阻调节通道222的一端与所述连续相存储池相连通,所述第二流阻调节通道222的另一端与所述液滴发生结构的第二端相连通,用于对进入到所述液滴发生结构的连续相试剂的流阻进行调节。所述第二流阻调节通道222为一段长度为3.5mm,宽度为100μm的流阻通道。
所述连续相经第二流阻调节通道调节后进入到液滴发生结构内的流阻rc为:
lc为第二流阻调节通道的长度,wc第二流阻调节通道的宽度,hc为第二流阻调节通道的高度,ηc为第二流阻调节通道的流体动态粘度。
通过调节第一流阻调节通道的长度l2、第一流阻调节通道的宽度w2和第一流阻调节通道的高度h2等,能够实现对所述第二流阻调节通道输出至所述液滴发生结构的第二端的流阻即所述连续相经第二流阻调节通道调节后进入到液滴发生结构内的流阻rc的调节,以使其能够满足芯片所需的要求;
通过第一流阻调节通道调调节后的分散相的流阻rd和所述第二流阻调节通道调节后的连续相的流阻rc之比,使之可在同一驱动压强差δp下形成预期大小的液滴。
其中,所述流阻rd与流阻rc的之比的范围为0.5-2。具体优选为0.8-1.2。
所述第二流阻调节通道为宽度逐步缩减的通道连接所述连续相存储池一端的宽度最大。
本实施例中的所述连续相储存池221结构220为两个。
液滴检测区250,用于构建高密度单层液滴阵列以便原位成像分析或形成多个平行的液滴队列以便多通道流式分析;
其中,当液滴检测区250用于构建高密度单层液滴阵列时,液滴孵育/反应区与液滴检测区250结构重叠可合二为一,以执行原位孵育、反应、检测一体化;
当液滴检测区250用于形成单一液滴队列时,
所述微液滴芯片还包括:
液滴分配分支结构240,所述液滴分配分支结构的上游连通所述液滴发生结构的第三端,所述液滴分配结构的下游连通所述液滴检测区250。
液滴分配分支结构240位于液滴发生结构230的下游,用于将刚生成的高速液滴减速并平均分配到下游的液滴检测区250。液滴分配分支结构240的主通道由窄渐宽,其起始窄部宽度设置为上游,终点宽度为连续相主通道宽度的1.1-2倍,液滴分配分支结构240的主通道的长度不小于其最大宽度的5倍。
液滴分配分支网络采用二分裂分支级联配置,即所述液滴分配分支结构具有n级分支,其中,第n级分支的分支通道的数量为2n。其中,每一子代的分支通道的宽度为上一级分支通道宽度的0.5-0.875倍,末代分支通道(最后一级的分支通道)的宽度不小于所形成液滴直径的0.95倍。
本实施例中,液滴分配分支结构240的的主通道窄部宽度为20μm,宽部宽度为160μm,总共具有7级,分别为第一级至第七级分支通道的宽度分别为80μm、70μm、60μm、50μm、40μm、30μm、25μm,由此产生的最后一级的分支通道的数量为64。
液滴分配分支结构240,当用于液滴发生之目的时,液滴分配分支结构240的分支通道中的宽通道分支连接压强作用腔,便于提供液滴发生所需的压强差,当用于液滴检测时,液滴分配分支结构240的分支通道中另一分支与液滴检测区250连接,在进口腔211内的压强大于所述出样口结构260内的压强时,使液滴队列流向液滴检测区250。所述液滴分配分支结构240中的最后一级的分支通道的总宽度不小于5倍的液滴直径,液滴分配分支结构240最后一级的分支通道的总宽度与所述液滴检测区250通道的总宽度趋于一致或者相同。
当液滴检测区250用于形成多个平行的液滴队列时,其紧邻上游根据需要设置具备一定延时效果的液滴动态孵育/反应区,以便液滴在流动状态下完成一定时间序列的孵育或反应。
当液滴检测区250用于形成多通道平行液滴队列时,液滴检测区250中各条独立检测通道宽度为上游的液滴分支网络最后一级的分支通道的总宽度的1-1.5倍,以便样本能够均匀的分布在液滴检测区250的各个位置上,使得检测能够更加准确有效。
所述液滴检测池的宽度为9.6mm,长度为14.2mm,且所述液滴检测池设置有微柱阵列,微柱直径60μm,中心间距160μm。
出样口结构260,所述出样口结构260连通所述液滴检测区250的下游;
所述出口腔结构包括:
出口分支结构261,所述出口分支结构261上游与所述液滴检测区250相连通;
出口分支结构261包含若干分支通道,出口分支结构261用于汇合上游流体,出口分支结构261的分支通道总宽度不小于液滴分配网络的主通道宽度,每条独立分支通道宽度不小于液滴直径的1.5倍,且独立分支通道选择合适的长度和宽度参数以确保每条分支通道流阻(长宽比)趋于相等;
以及,
出口腔262,所述出口腔与所述出口分支结构261的上游相连接。出口腔262留有与外部空间直通的可开闭开口,便于对完成芯片检测后液滴的进一步分析与处理。
其中,所述微液滴芯片还包括:
与负压发生器相连接的压强作用腔,所述压强作用腔连通所述进口腔211或所述出样口结构260,用于通过负压发生器作用于所述微液滴芯片内,使得在所述进口腔211内的压强大于所述出样口结构260内的压强。
所述压强作用腔可以为进口腔211或者出口腔262,或者连接在所述进口腔211或者出口腔262上,其中,所述负压发生器可以为简单地注射器或真空吸盘等产生的负压、重力或水压强的装置,通过所述进口腔211内的压强大于所述出样口结构260内的压强产生微液滴形成所需的驱动力,摆脱传统液滴数字化分析所需的精密泵/阀控制系统。
压强作用腔也可根据需要设置于在包含进口腔211和连续相储存池221在内的入口端,或设置于出口腔262,或者在进口腔211和出口腔262同时设置。处于同一压强作用腔的作用下,进口腔211或出口腔262施加的压强趋于相等,且进口腔211或出口腔262的压强差δp在液滴形成过程中趋于恒定,即在所述压强作用腔的作用下,所述进口腔211和出口腔262之间的压强差δp恒定不变。
本实施例的所述出口分支结构261为三条分支通道收集液滴,其中,两侧通道宽度为200μm,长度为3.6mm,中央通道宽度为150μm,长度为2.6mm。所述出口腔262作为压强作用腔,连接负压发生器。所述负压发生器为5ml规格的塑料注射器,出口腔262与注射器针头段通过一段特氟龙管连接。
以及,
液滴发生结构230,所述液滴发生结构230的第一端连通所述进口腔211,所述液滴发生结构的第二端连通所述连续相储存池221结构220,所述液滴发生结构的第三端连通所述液滴检测区250,
所述液滴发生结构230用于在所述进口腔211和所述出样口结构260之间具有压差时,以使样本或者试剂混合所述连续相试剂于所述液滴发生结构的第三端聚焦形成微液滴。
所述液滴发生结构230为流体聚焦结构,所述液滴发生结构230的第一端的宽度为20μm,第二端的宽度为100μm,流聚焦喉部即第三端的宽度为20μm。
本实施例中的所述连续相储存池221结构220为两个,即所述液滴发生结构230的第二端有了两个,两个第二端对称设置,两个所述连续相储存池221结构220对称设置。
其中,所述微液滴芯片还包括:
混合结构270,所述混合结构270设置于所述液滴分配分支结构的任一分支上,用于对所述样本和试剂进行均匀的混合。
当样品与检测试剂分别独立进样时,混合结构270设置在液滴分配分支结构240与液滴检测池之间,以便液滴进入孵育/反应区、液检测区前完成液滴内样本与检测试剂的充分混合。
其中,所述混合结构270为波浪形外沿的通道结构;以实现所述样本与检测试剂具有更多的接触面积进行充分的混合。
当进口腔211进入的样本为样本反应混合液时,根据需要在第一流阻调节通道212的上游增加样本混合结构270以延长样本混合时间,且此时混合结构270所产生的流阻与第一流阻调节通道212的流阻叠加,计入液滴发生前的分散相总流阻rd。
在液滴发生过程中,进口腔211与大气相通即入口端承受的压强为大气压p0,所述压强作用腔作用于所述出口腔262,且压强作用腔提供负压p1≤0.9p0;即液滴发生过程中由大气压提供流体驱动力,且进口腔211与出口腔262的压强差不低于0.1个大气压。
其中,上述压强作用腔也可以为压强作用腔中执行气体体积减小的生化反应,以形成流体驱动所需的压强差。
压强作用腔在液滴形成过程中所产生总体积变化δvd应超过所述微液滴芯片上除此以外的所有内部空间容积总和va的10倍以上,以确保液滴从生成到最终填满液滴检测池过程中液滴大小的均一性。
本发明的实施例提供的所述微液滴芯片,通过芯片结构设计调谐连续相、分散相进入液滴发生结构前以及液滴形成后流阻和流动过程中的压强动态变化,使之可在较宽操作范围和时间跨度内形成尺寸均一的微液滴,以用于原位或在线分析。
本发明提供的微液滴芯片中,液滴生成速度快(khz级别)、液滴均一性度高(cv<2%)、持续稳定生成液滴时间长,且液滴检测方式灵活、适应多种应用场景数字化分析需求。
本实施例的所述微液滴芯片的通道结构的高度统一为液滴直径的1-1.5倍,以便所述微液滴芯片的制作与单层液滴阵列的构建。
本实施例可实现无需使用复杂笨重的外部流体驱动控制设备对分散相、连续相的流速或流量进行调控即可快速高通量形成大小均一的微液滴;
其机理在于:对于水压强剪切形成液滴的结构而言,所产生的液滴大小在一定范围内主要取决于分散相与连续相的流量qd/qc之比,而分散相与连续相的流量大小主要取决于其受到的驱动压强差δpi与各自受到的流阻ri之比,即qi=δpi/ri,因此最终形成的液滴大小
在现有技术体系下,这类液滴芯片在液滴形成过程中需要根据连续相和分散相受到流阻ri的差异来精确控制连续相和分散相的各自的驱动压强差δpi以及δpd/δpc之比,以保证最终液滴大小的均一性。由于连续相和分散相的各自的驱动压强差δpi需要独立调节且需要保证动态平衡(δpd/δpc之比为固定值),不可避免地需要使用精密流体驱动控制装置来实现该效果,或者受制于液滴形成过程中压强条件的波动或偏移(如液滴填充过程造成的驱动阻力增加)而导致液滴尺寸偏差或整体偏移之情形。
对此,本发明做出以下重要改进:(1)通过第一流阻调节通道和所述第二流阻调节通道调谐连续相和分散相受到流阻rc/rd之比,使之可在同一驱动压强差δp下形成预期大小的液滴;(2)通过整体增加连续相和分散相受到流阻ri和液滴生成后的流阻rb,以减小驱动压强差δpi发生波动时对流体流量的影响,进而削弱其对最终形成液滴大小的影响,同时该设计还允许使用较宽的操作范围触发驱动压强差来形成尺寸极为相近的微液滴;
另一方面,本发明的实施例所提供的所述微液滴芯片集成有试剂存储、试样混合、液滴发生、孵育/反应、液滴检测等数字化分析的全流程所需的操作单元,无需开管操作、无需液滴转移,使用简单,无污染风险。
综之,本发明的实施例所提供的所述微液滴芯片的有益效果包括:无需使用复杂笨重的外部流体驱动控制设备对分散相、连续相的流速或流量进行调控,即可形成高度均一性微液滴,降低了检测的成本,且无需专业的人员对外部流体驱动控制设备进行控制,以及后期的维护工作中,有效的解决了现有技术中存在的微液滴生成依赖于复杂笨重的流体驱动控制装置,成本较高,而且需要专业的操作以及维护的技术问题。
本实施例中,所述微液滴芯片还包括:
第一密封层100,
以及,
第一配置层200,所述第一密封层100和第一配置层200相互连接,共同形成所述所述进口腔211、所述出样口结构260、所述液滴检测区250和所述液滴发生结构;
所述第一密封层100为光板玻璃,所述第二配置层400为包含微结构的聚二甲基硅氧烷(pdms)通道层,所述所述进口腔211、所述连续相储存池221结构220、所述出样口结构260、所述液滴检测区250和所述液滴发生结构为设置在第二配置层400上的通道,通过所述第一密封层100进行密封。
本发明提供的一种微液滴芯片使用的一般工作流程:
(1)向连续相储存池221预装填连续相试剂,直至连续相填充所述微液滴芯片内部主要空间;
(2)将样品反应混合液加注在进口腔211,或者将样品和检测试剂分别加注在各自的进口腔211内;
(3)在通过压强器对所述微液滴芯片的出口腔262或进口腔211施加压强,造成压强差,进口腔211内的分散相通过所述第一流阻调节通道212和连续相储存池221内的连续相试剂通过所述第二流阻调节通道222抵达液滴发生结构230开始液滴的发生;
(4)生成的液滴通过液滴分配分支结构240减速并均匀分配到下游的液滴检测区250;
当液滴检测区250填充满时,或撤销压强差使液滴处于静态状态以进行原位孵育/反应及检测,或调节压强差使液滴以合适的流速范围通过孵育/反应区及检测区。液滴检测区250也可包括孵育/反应区及检测区。
在本实施例中,首先,将30微升连续相(由石蜡油+3%abilem90(v/v)+0.1%曲拉通x-100配制而成)分别添加在芯片的连续相入口,借助芯片的通道结构的毛细作用自动填充芯片主要结构。然后,将包含细菌与核酸嵌入型荧光染料混合后添加在进口腔211处。再抽动塑料注射器活塞柄,并用双尾夹将活塞柄固定在容积为约为2ml的刻度处,此时大气压强分别驱动分散相和连续相在流聚焦的液滴发生结构230处快速形成大小均一的微液滴。
在此条件下,所形成的典型液滴直径约为30微米,如图6明场显微图像所示,该视野内的液滴数为n1=3011。对应的荧光图像如图7所示,采集参数如下:激发滤片330-385nm,发射滤片为长通滤片(>420nm),曝光时间500ms,iso200,该视野下的阳性液滴(液滴包含荧光)数目为n1p=49;进一步通过计数图像视野内的总液滴数n和包含荧光信号的阳性液滴数np,结合平均液滴体积v,可由如下公式推算出原始样品中的细菌含量水平c。所述计算公式如下:
即可以得到原始样品中的细菌含量水平c从而能完成检测的目的。
实施例2
如图8-9所示;由于实施例2中采用了实施例1中的部件以及结构,为了方便对读图,在图9中仍然沿用实施例1中的附图标记。
本实施例中的所述微液滴芯片,如实施例1中的结构,具体涉及以下部分做出调整,
所述微液滴芯片包括:
第二密封层,所述第二密封层包含厚度为0.2mm的覆胶铝塑膜第二配置层400,
以及,
中间层500,
所述第二密封层、所述中间层500板和所述第二配置层400依次连接,共同形成所述所述进口腔211、所述出样口结构260、所述液滴检测区250和所述液滴发生结构。
具体为,所述所述进口腔211和所述出样口结构260的腔室设置在聚碳酸酯的中间层500上,如所述进口腔211和出口腔262的部分腔体部分设置在所述中间层500上
第二配置层400为包含微结构的聚甲基丙烯酸甲酯(pmma)通道层。所述所述进口腔211、所述出样口结构260、所述液滴检测区250和所述液滴发生结构的微通道结构设置在所述第二配置层400上,即所述第二密封层、所述中间层500板和所述第二配置层400依次连接,共同形成所述所述进口腔211、所述出样口结构260、所述连续相储存池221结构220、所述液滴检测区250和所述液滴发生结构。
本实施例的所述所述进口腔211为两个,一个用于样本加入,另一个用于检测液加入;两个所述所述进口腔211的进口腔211的开口直径均为2.5mm,所述两个进样口分别连接对应的第一流阻调节通道212,所述第一流阻调节通道212为一段长度为15mm,宽度为35μm的多层弯曲叠置排列的流阻通道。
如实施例1中的,一对连续相储存池221结构220,两个连续相储存池221的直径都为3.5mm,两个连续相储存池221分别通过一段长度为2.2mm宽度为100μm的直线流阻通道;所述液滴发生结构230具有两个第一端、两个第二端和一个第三端,两个所述第一端分别与对应的第一流阻调节通道212相连接,两个所述第二端分别与对应的第二流阻调节通道相连通,所述第三端与所述液滴分配分支结构240相连通,所述液滴发生结构230为流聚焦结构,第一端端部的宽度为25μm,第二端端部的宽度为100μm,第三端(即流聚焦喉部)的宽度为16μm。所述液滴分配分支结构240的主通道窄部宽度为20μm,所述窄部为与所述液滴发生结构230相连接的端部,宽部宽度为150μm,第一级至第七级分支通道的宽度以此为100μm、84μm、60μm、48μm、36μm、30μm,由此产生的最后一级的分支通道的数目为64。所述液滴检测池宽度为9.6mm,长度为14.2mm,且检测池设置有微柱阵列,微柱直径80μm,中心间距320μm。出口分支结构261为三条分支通道收集液滴,其中。两侧通道宽度为200μm,长度为3.6mm,中央通道宽度为150μm,长度为2.6mm。所述出口腔262,用于连接负压发生器。所述液滴缓冲池与液滴检测区末端连通的三支出口分支结构的通道的之间设有一段液滴缓冲池280;出口分支结构261与所述出口腔262之间设置有其长度为10mm,宽度为1.8mm。所有微结构及微通道的高度均为30μm。所述液滴缓冲池用于允许压强发生器预置的操作范围内进行操作,且预置时间内稳定形成均一液滴,即为允许压强发生器较宽的操作范围且可长时间稳定形成均一液滴。
通过增设液滴缓冲池,使液滴填充过程中引起压强改变的体积变化δv远远小于用于产生产生负压差的初始体积v0,以确保液滴形成过程中δp的偏移几乎可忽略不计,最终实现长时间稳定形成高度均一液滴之目的。
如图7所示,所述中间层500高度为3mm,在对应与两个进口腔211和两个所述连续相储存池221的进口的位置分别有直径为2mm和3mm的通孔,用于样品、试剂的添加和连续相试剂的存储,在对应于出口腔262的位置有直径为4mm的通孔,作为压强作用腔和液滴回收池。在出口腔262的通孔靠近第二密封层的一侧设置有直径为20mm的圆形凹槽,用于真空吸盘的定位安置。
所述微液滴芯片处于备用状态时,连续相(组分同实施例1)预存储在芯片连续相储存池221中,第二密封层的铝塑膜与中间层500通过热压方式贴合密封。使用时,撕掉第二密封层薄膜,向一个进口腔211加入2.5μl包含有醋酸镁(28mm)的待测dna样品和2.5μl包含有引物(300nm)、向另一个进口腔211加入重组聚合酶扩增反应体系和1×sybrgreeni的检测液,压平直径为20mm的真空吸盘贴紧在真空吸盘安装位。待液滴填充满芯片孵育/检测区后,从一侧揭起真空吸盘。将芯片孵育/检测池或芯片整体置于42℃的恒温加热装置上,维持恒温30min后,将微液滴芯片的液滴检测区250移入荧光显微成像焦平面上分别采集液滴荧光图像(如图10所示)和对应明场图像(如图11所示),并将其融合成组合图像(如图12所示);分别计数荧光液滴数目和液滴总数,根据阳性液滴比例或数目推算原始样品dna的含量。
以上所述,以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!