多隔室自编码的微球、制备方法、微流控装置及应用
本发明涉及生物分析技术领域,特别涉及一种多隔室自编码的微球、制备方法、微流控装置及应用。
背景技术:
近年来,简单、快速地量化样本中多种蛋白质、细胞因子或核酸序列的能力对于临床检测,生化分析和药物筛选等领域至关重要。研究人员期望能够在单一样本中对多种目标分子进行准确检测,以缩短的分析时间、减少样本量和减少繁杂的操作。目前已经开发出多种多路分析手段用于高通量生物分子分析,主要包括二维平面编码阵列和三维悬浮编码两种形式。其中平面编码阵列通过对二维空间进行编码,从而读取整体信号并对最终结果进行分析。但是平面编码阵列方式受限于分析物浓度和分子反应效率。相比与此,三维的悬浮编码的发展在分析效率和探针修饰方面显示出了巨大的优势。悬浮编码的设计对编码方案提出了要求,目前研究人员通常通过光谱和图形等方式进行编码,尽管如此,对于多重检测来说,三维编码目前受限于单一编码微粒和单一靶标的对应关系,这导致单次多重分析将需要多个不同编码粒子同时使用。
因此,开发单颗粒上编码对应于多靶标的检测方式具有重大意义。
技术实现要素:
为了解决现有技术中存在的问题和满足本领域未来的发展需求,本发明提供了一种对于单个粒子内至少两个隔室的编码的多隔室自编码的微球、制备方法、微流控装置及应用。
本发明提供一种多隔室自编码的微球,所述微球包括多个隔室,至少两个隔室为空间编码隔室,其余隔室为多元分析隔室,用于固定待测物的分析探针。
可选地,所述微球为水溶性微球。
可选地,所述空间编码隔室采用光谱或/和颜色的方式进行三维空间编码,相邻的空间编码隔室采用同一方式进行三维空间编码时,相邻空间编码隔室的材料选自有差异的荧光染料,量子点或光子晶体或相邻空间编码隔室的材料选自具有不同拉曼光谱的分子。
可选地,所述空间编码隔室为相邻的两个隔室。
可选地,所述微球的材料选自海藻酸钙、丙烯酰胺、n-异丙基丙烯酰胺、胶原、壳聚糖、聚乙二醇二丙烯酸酯中的一种或多种。
根据本发明的另一个方面,提供一种微流控装置,用于制备上述多隔室自编码的微球,包括图案化微流控芯片供胶系统和毛细管喷射系统,所述图案化微流控芯片供胶系统包括微流控通道,用于注入形成多个隔室的分散相溶液,形成层流结构,所述毛细管喷射系统用于注入氮气,对层流结构进行切割形成多个隔室,其中图案化微流控芯片供胶系统注入至少两种不同的分散相溶液,通过毛细管喷射系统切割形成至少两个隔室为空间编码隔室的多隔室自编码的微球。
可选地,所述图案化微流控芯片供胶系统根据预制备的微球的多个隔室的分布布置多个微流控通道。
根据本发明的第三个方面,还提供一种上述多隔室结构自编码的微球的制备方法,包括:
组装微流控装置;
根据微球的性质,配置各隔室所需的分散相溶液,在微流控装置的微流控通道内注入分散相溶液,在毛细管喷射系统内通入氮气,多个分散相溶液形成层流进入到毛细管喷射系统,利用气体的剪切作用将层流结构切割,形成分散液滴,其中,至少两个分散相溶液包括编码材料为具有颜色或光谱差异的水溶性溶液最终转化为对应的空间编码区域,其余的分散相溶液携带目标分子的检测探针转化为多元分析区域;
固化分散液滴,形成具有空间编码隔室和多元分析隔室的微球。
可选地,不同所述分散相溶液为不同水溶性性质的物质。
根据本发明的第四个方面,还提供一种上述多隔室结构自编码的微球在多靶标检测中的应用,其中,所述空间编码隔室用于辨别多个隔室的分布方向,所述多元分析隔室用于分析多细胞相互作用及蛋白质、细胞因子、核酸、细菌或/和细胞的多元检测。
本发明所述多隔室自编码的微球具有多个隔室,至少两个隔室为空间编码隔室、能够唯一识别多个隔室的分布方向,通过多个多元分析隔室,可以实现多靶标的检测,也就是说通过单个微球上多编码对应于多个靶标的快速准确检测,可以灵活设计微粒内部结构,例如非对称结构分布,可以实现不同物质的同时检测。上述微球可用于探究多细胞相互作用及在蛋白质,细胞因子,核酸、细菌或细胞的多元检测技术领域中的应用。上述制备方法采用气动切割,避免了液体切割时酸性环境的刺激,离心装置的机械损伤,光刻技术的光速上和电驱动的电刺激,制备方法简易绿色。
附图说明
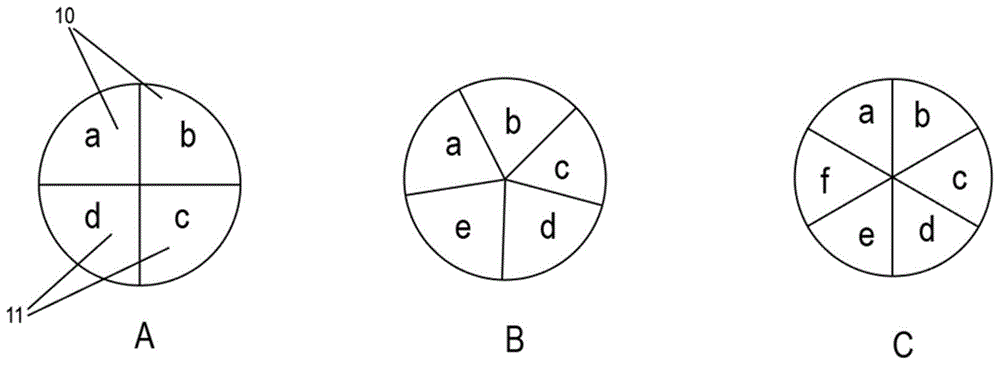
图1为本发明所述多隔室自编码的微球的示意图;
图2为本发明制备所述多隔室自编码的微球的微流控装置的示意图;
其中,1为隔室a对应的微流控通道,2为隔室b对应的微流控通道,3为隔室c对应的微流控通道,4为隔室d对应的微流控通道,5为隔室e对应的微流控通道,6为隔室f对应的微流控通道,7为气体入口,8为内管,9为外管,10为空间编码隔室,11为多元分析隔室,12为氯化钙溶液。
具体实施方式
下面将结合附图对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
图1为本发明所述多隔室自编码的微球的示意图,如图1所示,所述多隔室自编码的微球包括多个隔室,至少两个隔室为空间编码隔室10,其余隔室为多元分析隔室11,用于固定待测物的分析探针,如图1中,四隔室微球a具有a、b、c和d四个隔室,五隔室微球b具有a、b、c、d和e五个隔室,六隔室微球c具有a、b、c、d、e和f六个隔室,a和b隔室为空间编码隔室,其余隔室为多元分析隔室。
可选地,所述微球为多隔室水溶性微球。
可选地,所述空间编码隔室采用光谱或/和颜色的方式进行三维空间编码,相邻的空间编码隔室采用同一方式进行三维空间编码时,相邻空间编码隔室的材料选自有差异的荧光染料,量子点或光子晶体或相邻空间编码隔室的材料选自具有不同拉曼光谱的分子。
可选地,所述空间编码隔室为相邻的两个隔室。
可选地,所述多元分析隔室用于蛋白质,细胞因子,核酸、细菌或/和细胞的多元检测。
可选地,所述多隔室结构微球在探究多细胞相互作用中的应用。
在上述各实施例中,所述微球的材料选自海藻酸钙、丙烯酰胺、n-异丙基丙烯酰胺、胶原、壳聚糖、聚乙二醇二丙烯酸酯中的的一种或多种。
上述微球为复合结构编码微球可以具有多种结构,设计灵活,能够自动识别隔室分布方向,实现不同物质的同时测量。
本发明多隔室自编码的微球的多个隔室并不局限于在微球内通过物理间隔隔成的多个隔室,可以不存在物理间隔,对微球内编码区域和检测区域的标识,形成区域划分的编码隔室和多元分析隔室。也就是说,本发明的隔室不限于隔室形状(隔室可以是圆形、方形、三角形等任意形状,不同隔室的形状也可以不同),个数和物理间隔,是在微球内制作编码区域和检测区域用于整个微球的空间识别。
图2为本发明制备所述多隔室自编码的微球的微流控装置的示意图,如图2所示,所述微流控装置用于制备上述各实施例中的多隔室自编码的微球,为气体切割的微流控装置,包括图案化微流控芯片供胶系统和毛细管喷射系统,所述图案化微流控芯片供胶系统包括微流控通道,用于注入形成多个隔室的分散相溶液,形成层流结构,所述毛细管喷射系统用于注入氮气,对层流结构进行切割形成多个隔室,其中图案化微流控芯片供胶系统注入至少两种不同的分散相溶液,通过毛细管喷射系统切割形成至少两个隔室为空间编码隔室的多隔室自编码的微球。
在一个实施例中,所述图案化微流控芯片供胶系统根据预制备的微球的多个隔室的分布布置多个微流控通道,如图2所示,制备图1中六隔室微球c的六条微通道呈放射状,隔室a对应的微流控通道1,隔室b对应的微流控通道2,隔室c对应的微流控通道3,隔室d对应的微流控通道4,隔室e对应的微流控通道5,隔室f对应的微流控通道6。
在一个实施例中,毛细管喷射系统包括气体入口7、内管8和外管9,图案化微流控芯片供胶系统注入多个分散相溶液,在内管8内形成层流结构,所述气体入口7注入氮气,在外管9内将层流切割得到微球。
利用图2所示微流控装置制备多隔室结构自编码的微球的方法包括:
组装微流控装置;
根据微球的性质,配置各隔室所需的分散相溶液,在微流控装置的微流控通道内注入分散相溶液,在毛细管喷射系统内通入氮气,多个分散相溶液形成层流进入到毛细管喷射系统,利用气体的剪切作用将层流结构切割,形成分散液滴,其中,至少两个分散相溶液包括编码材料为具有颜色或光谱差异的水溶性溶液最终转化为对应的空间编码区域,其余的分散相溶液携带目标分子的检测探针转化为多元分析区域;
固化分散液滴,形成具有空间编码隔室和多元分析隔室的微球。
在一个实施例中,所述组装微流控装置的步骤包括:
根据所需的微球的结构(如,多隔室结构)和材料(如,海藻酸钠等),组装相应的微流控装置;
可选地,可根据对液滴结构需求调节相应的图案化微流控装置,例如,六隔室微球对应放射状六通道的图案化微流控装置,从而调节分散相数量和层流结构,进而改变靶标检测物数目和检测区域。
在一个实施例中,如图2所示,所述固化分散液滴的步骤包括:
采用氯化钙溶液12固化分散液滴。
可选地,还包括清洗固化后分散相液滴的步骤,获得微球。
可选地,所述不同分散相为不同水溶性性质的物质。
可选地,分散相注射顺序与多隔室微球成分顺序有关,以通过空间编码分辨多元检测组分。
在一个实施例中,制备六隔室的海藻酸钙的微球,用于检测dna靶标,具体地,包括:
通过修饰,隔室a所选材料为1%海藻酸钠和0.1%蓝色荧光纳米粒子的混合溶液,隔室b所选材料为1%海藻酸钠0.02%蓝色荧光纳米粒子的混合溶液,隔室c所选材料为1%海藻酸钠修饰有靶标dna1探针的溶液,隔室d为1%海藻酸钠修饰有靶标dna2探针的溶液,隔室e为1%海藻酸钠修饰有靶标dna3探针的溶液,隔室f为1%海藻酸钠修饰有靶标dna4探针的溶液,通入气体为高纯氮气。
将分散相按a-b-c-d-e-f顺时针方向同时注入注入管,将氮气注入毛细管喷射系统,海藻酸钠微球在氯化钙中固定,收集固化后的六隔室的微球。
本发明还提供一种多隔室结构自编码的微球的应用,所述空间编码隔室用于辨别多个隔室的分布方向,所述多元分析隔室用于分析多细胞相互作用及蛋白质、细胞因子、核酸、细菌或/和细胞的多元检测,如上例中,自编码海藻酸钙微球用于接下来的dna靶标检测,包括:
将靶标dna1-fitc加入六孔板中,加入六隔室自编码海藻酸钙微球。
解码:通过荧光显微镜三维成像,根据蓝色区域荧光分割微球,根据强-弱荧光区域相对位置可以分辨a-b相对方向(a强,b弱),进而分辨c、d、e、f。通过c隔室绿色荧光,d、e、f隔室无荧光,判断含有靶标dna1,无靶标dna2、dna3和dna4。
本发明可根据需求通过在不同隔室装配所需探针以提供对靶标物的检测能力,靶标物包括蛋白质、核酸、细胞或细菌。多探针均装配在一个微球内,构成单一颗粒的多元检测。其中由于微球自带空间编码,对于靶标物的信息读取可兼容二维编码读取的优势,同时微球也兼容三维悬浮编码的优势,如此可对多元靶标物的分析提供更多地机会。
本发明多隔室结构自编码微载体及其制备方法和应用,所述微载体为多隔室结构,其中部分特征空间被设计为空间编码隔室,其余部分被设计为多元分析隔室用于固定待测物的分析探针,生成所述多隔室结构自编码微载体的装置为三维微流控装置。制备方法首先,微流控装置的制备;其次,根据多隔室结构自编码微载体的性质注入分散相溶液;再次,固化液滴,清洗后,即可获得微载体。由于微载体自身带有空间编码,可分辨微载体内任一位置所含成分。所述多隔室结构自编码微载体可用于探究多细胞相互作用及在蛋白质,细胞因子,核酸、细菌或细胞的多元检测技术领域中的应用。
尽管前面公开的内容示出了本发明的示例性实施例,但是应当注意,在不背离权利要求限定的范围的前提下,可以进行多种改变和修改。根据这里描述的发明实施例的方法权利要求的功能、步骤和/或动作不需以任何特定顺序执行。此外,尽管本发明的元素可以以个体形式描述或要求,但是也可以设想具有多个元素,除非明确限制为单个元素。
- 还没有人留言评论。精彩留言会获得点赞!