一种用于实现CO2捕获与矿化封存的电化学系统的制作方法
本发明属于碳资源的捕获与存储技术领域,涉及一种用于实现CO2捕获与矿化封存的电化学系统
背景技术:
我国过度排放的CO2主要源于化石燃料的燃烧,如用于发电的设备,也包括一些小型分散源,如汽车发动机以及包括民居和商业建筑中使用的燃炉;除此以外,CO2同样会在某些矿物资源的提炼的过程产生。当前,过度排放的CO2已经导致了日趋严重的温室效应,由于大部分CO2气体被海洋吸收,这使得海洋酸化问题日趋严重。国际社会对气候变化的关注导致了联合国气候变化框架公约的问世,进一步推动了CO2的捕获与封存技术(CCS)技术的发展。
CCS技术一般包括捕获、运输和封存三个主要组成部分。其一、捕获步骤是把CO2从其他气体产品中分离出来。如电厂中的燃烧过程,可以采用分离技术在燃烧后捕获CO2,或者在燃烧前对燃料进行脱碳。其二、为了把捕获的CO2运输到距CO2源较远的合适封存地点,需要采取运输步骤。为了便于运输和封存,捕获的CO2通常由捕获设备进行高浓度压缩。最后的CO2封存工艺是CCS技术的核心,决定着总体的工艺成本与工艺复杂性。当前,CO2封存技术有地质封存、海洋封存和矿化封存三类,其技术与市场的成熟性有很大差别。地质封存技术已相对成熟,当前已有工业示范项目,如:挪威北海Sleipner地质封存项目,已成功向地下注入1000万吨的CO2。然而,地质封存应用区域很有限,其不仅与地质岩层构造密切相关,且后期监测与维护成本较高,若出现泄漏容易引发地质灾害。
海洋封存和矿化封存当前还仅处于研究、开发或示范阶段。其中,矿化封存技术极具发展潜力,其主要利用存在于天然形成的硅酸盐岩中的碱性或碱土氧化物,如氧化镁和氧化钙将CO2固化。这些物质与CO2化学反应后产生诸如碳酸镁和碳酸钙类化合物。矿化封存的优势在于:(1)原料来源广泛。一方面,地壳中硅酸岩的储量巨大,同时这些氧化物还会存在于某些工业废物中,如不锈钢矿渣和矿灰;(2)CO2在矿化后将不会释放到大气中,这相比于地质封存与海洋封存,无需后续的监测、维护成本,封存风险小;(3)矿化的碳酸盐产物用途广泛,不仅可作为建筑材料、防火涂料,而且还是重要的化工原料,广泛应用于化工、玻璃、造纸等工业。
当前,公开的CO2捕获与矿化封存技术主要有两类。一类是通过化学方法实现,而另一类则基于电化学方法。前者大都在高温或高压下进行,系统结构复杂。例如,Olsen Espen公开了在600℃~1600℃,应用金属氧化物盐溶体吸收CO2的技术与工艺(CN 102448581 A,US20120128559)。Terasaka等(Chem.Eng.Technol.2006,29No 9,第1118-1121页)公开了一种使用熔盐浆中的固体颗粒硅酸锂(LiSiO4)作为工作介质来吸收CO2的工艺,矿化产物为Li2CO3和Li2SiO3以悬浮固体颗粒的形式存在。US2005036932公开了一种从废气中吸收和除去CO2的方法,鼓入废气通过含CaO和/或Ca(OH)2的固体颗粒的聚集体,使得废气中的CO2转化成CaCO3。CN 102491795 A公开了在150~350℃、CO2分压不低于1.0MPa的条件下,用钾长石将CO2矿化生产富钾溶液的方法;而CN 102895847A则公开了将CO2通入熔融碱金属、碱土金属、过渡金属的碳酸盐、硅酸盐、硼酸盐、氧化物、氢氧化物、硝酸盐、铝酸盐和它们的混合体中进行吸收电解的捕集方法。CN 103111161 A公开了一种规模较大的CO2捕获工艺,通过具有正压压力的CO2捕获塔中的溶剂捕获CO2,过饱和CO2溶液再进入释放塔进行抽出集中。基于电化学方法的CO2捕获与转化工艺相对简单且运行环境相对温和,CN 101670236 A公开了通过碳酸盐水溶液捕获和电渗析回收CO2的系统和方法,通过水溶液捕获CO2后进行电渗析形成富CO2液流和再生捕获溶液。CN 102351310 A公开了一种微生物电化学CO2捕捉系统,利用有机废水作为微生物营养源,在CO2捕获的同时兼顾污水处理问题。CN 102978653 A公开了一种矿化CO2联产强酸的膜电解方法,其矿化原料为硝酸盐或硫酸盐,产物为碳酸盐和硝酸。CN 105420751 A公开了一种电化学还原二氧化碳制备碳氢化合物的方法,采用碱金属碳酸(氢)盐、硫酸盐、磷酸(氢)盐等作为物及电解质,其特色在于在电解质系统中引入有机溶剂。不同于水相体系的电化学捕获,CN 103590064 A公开了将无水LiF和Li2CO3按摩尔比(0.5~1.5):1混合均匀加入添加剂后制成电解质熔盐,置于电解槽中加热至690~700℃通入CO2电解的捕获方法。其中,阴极材质为Ni或Ti,阳极材质为Pt、Fe-Ni合金或Fe-Ni-Al2O3合金。
技术实现要素:
为了克服现有技术中存在的不足,本发明提出一种用于实现CO2捕获与矿化封存的电化学系统,是通过电化学方法将硅酸盐或存在于蛇纹岩和橄榄石等天然矿石中的硅酸盐岩转化为碳酸盐,实现CO2的矿化封存;系统运行后排放的液流为碱性,同时可在一定程度上实现指定区域海洋酸化问题的治理。
一种可实现CO2捕获与矿化封存的电化学系统的技术方案为:
该系统包括流体动力模块、反应模块和控制与显示模块,其中,流体动力模块与反应模块相连,流体动力模块为反应模块提供含有CO2的原料气和补充电解液与反应物;反应模块为CO2捕获与矿化封存提供反应场所,其包括阳极室、阴极室与隔膜;阳极室内有电极、电解液、硅酸盐和/或含有硅酸盐的矿物,阴极室内有电极、电解液;阳极室与阴极室通过隔膜隔离;控制与显示模块同时与反应模块与流体动力模块相连,控制与显示模块为流体动力模块提供运行的电力,同时为反应模块实现稳态或暂态或者暂态与稳态结合的电化学反应模式,使硅酸盐转化为碳酸盐,实现CO2捕获与矿化封存。
上述反应模块中的隔膜包括阴、阳离子交换膜或微孔膜(如多孔聚四氟乙烯膜);所述电极材料包括含有Pt,Re,Pd,Rh,Mo,Wo,Nb,Ru,Ir,Sn,Mn,Fe,Co,Ni,Cu,Ag,C元素的单质、合金或与其它非金属元素形成的化合物。所述硅酸盐包括所有含硅、氧与其它化学元素(如:铝、铁、钙、镁、锰、钾、钠、钡、铜、锌、铅、锡)的化合物或混合物。含有硅酸盐的矿物包括含有上述硅酸盐成分的橄榄石、蛇纹石、玄武岩,石棉、云母、滑石、高岭石、蒙脱石、沸石,绿帘石、电气石、辉石、角闪石。
上述阳极为平板电极结构或者多孔电极结构。
上述阳极室处理的CO2混合气浓度范围在0.050%~99.995%之间。
上述反应模块运行模式为稳态时,其工作电流密度范围在0.075mA/cm2~2A/cm2之间;反应模块运行模式为暂态时,对系统加载电流或电压的正弦波、方波、三角波信号,该信号的变化频率范围为1000Hz~0.1Hz。
上述控制与显示模块包括传感器件、系统控制器件及显示器件;其中,传感器件包括H2、O2、CO2浓度传感器、温度传感器、液位传感器、压力传感器;显示器件用于显示系统运行中的温度、压力、O2浓度、H2浓度、CO2浓度,液位,电流、电压信息;系统控制器件一方面给上述传感器件提供电力,并依据传感器件的响应控制流体动力模块为反应器提供反应物与补充电解液;另一方面,系统控制器件中有数字信号处理器控制反应器运行,为系统提供稳态、暂态或者稳态与暂态结合的运行模式。
系统处理的CO2气体的浓度范围广,即可实现高浓度CO2(99.99%)的转化也可用于空气中痕量CO2(ppm级)的转化,系统CO2的转化规模可控且易于实现模块化。运行后系统排放产物环境友好且呈碱性,可见系统在实现CO2捕获与矿化封存的同时,还可以同时缓解当前日趋严重的海洋酸化问题。
本发明采用电化学方法实现CO2的捕获与矿化封存,与应用物理方法(包括:地质封存与海洋封存)相比,该技术无需后期监测、无地质灾害风险。与现有应用化学方法实现CO2捕获与矿化封存的技术相比,本发明应用电化学方法无需高温、高压的反应环境,反应可在常温、常压下进行,系统结构简单、能耗低,且易于实现模块化设计,应用前景巨大。
附图说明
图1是CO2电化学捕获与矿化封存系统的结构示意图。
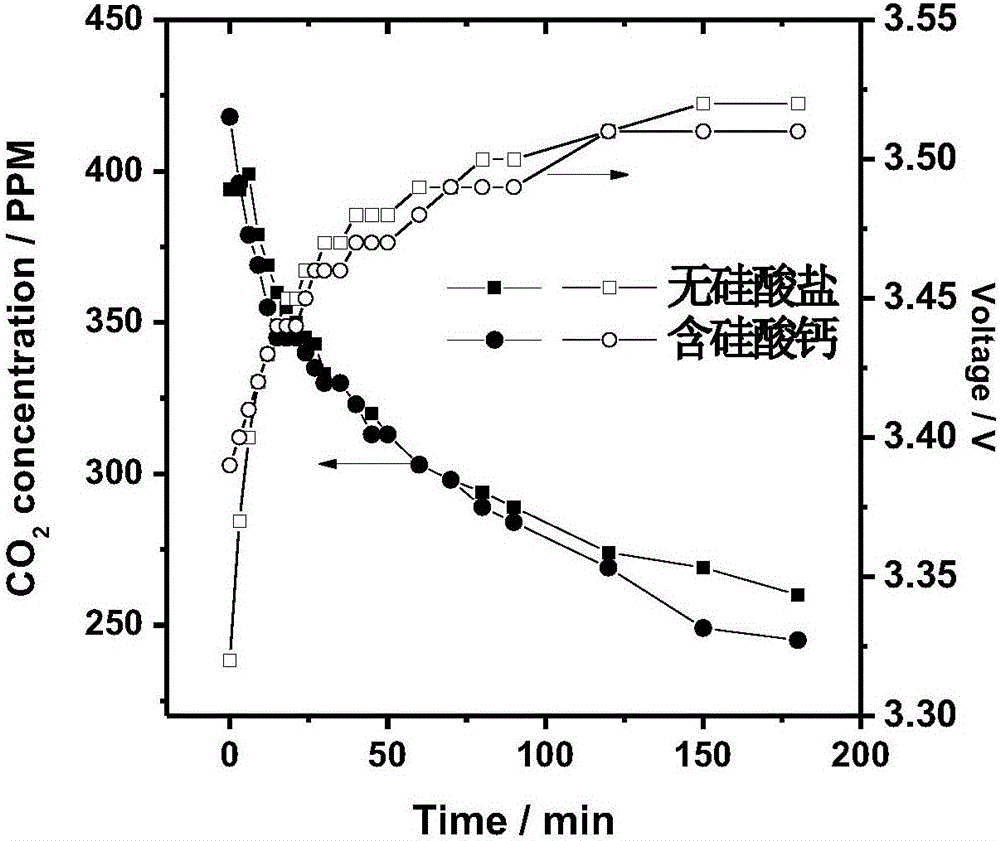
图2是硅酸钙的引入对空气中CO2的吸收效率及系统槽压的影响。
图3是硅酸盐种类对系统空气中CO2的吸收效果的影响。
图4是系统在不同电流密度下对空气中CO2的吸收效果。
其中(a)是CO2随时间的变化曲线;(b)是3小时后,CO2浓度随系统功率的变化曲线。
图5是电极材料对系统在常温4mA·cm-2条件下对空气中CO2吸收的影响。
其中(a)是CO2浓度随时间的变化;(b)是系统槽压随时间的变化。
图6是系统在非稳态电流环境下对于空气中CO2的吸收效果。
其中(a)是系统电流随时间的变化情况;(b)是CO2浓度随时间的变化情况。
图7是系统在小电流密度下对空气中CO2的吸收效果。
图8是系统在大电流密度下对高纯CO2的吸收效果。
具体实施方式
为了进一步说明本发明,列举以下实施例介绍CO2电化学捕获与封存系统,并不限制发明的范围。
实施例1:CO2电化学捕获与封存系统结构
图1给出了CO2电化学捕获与矿化封存系统结构。该系统由流体动力模块、反应模块以及控制与显示模块三部分构成。流体动力模块与反应模块相连,不仅可为其提供含有CO2的原料气,还可为其补充支持电解质与反应物。控制与显示模块同时与反应模块与流体动力模块相连,系统控制器一方面给上述传感器件提供电力,并依据传感器件的响应控制流体动力模块为反应器提供反应物与补充电解液;另一方面,控制器中有数字信号处理器(DSP)可控制反应器运行,为系统提供稳态、暂态、稳态与暂态结合的运行模式以及实现停机操作。反应模块是系统的核心部件,为CO2捕获与矿化封存提供反应场所,其结构由阳极室、阴极室与隔膜构成。阳极室、阴极室内分别置有阳极与阳极电解液、阴极及阴极电解液,其中,在阳极室内含有硅酸盐。
实施例2:CO2电化学捕获与矿化封存系统结构与实施例1相同,该实施例中比较了硅酸盐的加入与否对系统CO2的吸收效率及排放产物的影响。
图2.给出了含与不含硅酸盐矿物的电化学CO2捕获与矿化封存系统,在电流密度为2mA·cm-2条件下,系统对空气中CO2的吸收效果以及系统槽压。可以看出,硅酸钙的引入对于CO2的吸收以及系统功耗影响在100分钟后产生明显效果,含有硅酸钙的系统排出气体CO2浓度相对较低。表1给出了硅酸盐引入与否对于系统运行8小时后排放产物pH的影响,可见硅酸钙的引入显著降低了阳极排放产物的酸化程度。
表1硅酸盐的引入与否对于阳极室与阴极室pH的影响
实施例3:CO2电化学捕获与矿化封存系统结构与实施例1相同,本实施例中比较了硅酸盐种类对系统CO2的吸收效率的影响。
图3给出了在CO2电化学捕获与矿化封存系统在引入硅酸钙、硅酸镁、硅酸铝以及硅酸钠后,室温下系统对空气中CO2吸收效果的比较。系统运行中其反应模块运行为稳态恒电流模式,其电流为2mA·cm-2。可见,硅酸盐的种类影响系统CO2吸收的暂态及稳态行为。在系统启动后的1小时,引入硅酸铝与硅酸镁的系统对CO2吸收效果不及含有硅酸钙与硅酸钠的系统。在运行3小时后,系统已经进入稳态,采用硅酸镁的系统对于CO2的吸收效果不及其它三种硅酸盐。
实施例4:CO2电化学捕获与矿化封存系统结构与实施例1相同,本实施例考察了电流密度对系统CO2吸收效果的影响。
实验考察了电化学CO2捕获与矿化封存系统在不同电流密度在0.5mA·cm-2~6mA·cm-2含有硅酸盐A时对空气中CO2的吸收效果,实验结果如图4(a)所示。可见随着电流密度的增大,排放混合气体中CO2含量降低,系统对与CO2吸收达到稳定的时间增长。然而,系统对于空气中CO2的转化能力并非正比于系统功率的输出,图4(b)给出了系统尾气中CO2的浓度随系统功率的变化,在0.5mA·cm-2~6mA·cm-2电流密度范围内,CO2的处理能力的提高伴随着指数型增加的系统功率。
实施例5:CO2电化学捕获与矿化封存系统结构与实施例1相同,本实施例比较了电极材料对于系统CO2吸收效果的影响。
图5(a)给出了阳极电极材料分别为铜片、铂片、泡沫铜、泡沫镍时系统对空气中CO2吸收效果比较。其中,铜片、铂片为平板电极、泡沫铜、泡沫镍为多孔电极。可见,在电流密度相同的前提下,电极材料的改变对空气中CO2的吸收效果有影响,系统槽压变化显著。具有多孔结构的泡沫镍做阳极时其功耗最小,最为节能。
实施例6:CO2电化学捕获与矿化封存系统结构与实施例1相同,本实施例中反应模块运行为暂态与稳态相结合的运行模式。
图6给出了反应模块在暂态与稳态相结合的运行模式下,系统对与空气中CO2的吸收效果,其中反应模块中阳极采用的电极面积是4cm2。图6(a)给出了反应模块电流随时间的变化情况,在0~5分钟,系统在6mA(1.5mA·cm-2)基础上加载2mA(0.5mA·cm-2)的交变电流,电流变化的频率为1Hz;在随后的25分钟,改变加载交流信号的频率为0.1Hz;在30~55分钟频率变化增为1000Hz,在最后的25分钟,系统为间歇放电模式,即每运行5分钟停1分钟。图6(b)给出了在如图6(a)所示的运行模式下,系统出口CO2的浓度变化。可见,在暂态与稳态相结合的运行模式下,系统仍对于空气中CO2的吸收有明显效果。
实施例7:CO2电化学捕获与矿化封存系统结构与实施例1相同,本实施例考察了小电流运行时对于系统对空气中CO2的吸收效果
图7给出了在反应模块采用0.075mA·cm-2,系统对于空气中CO2的吸收效果。结果表明,系统在该运行模式下,20分钟后对CO2的吸收进入稳定运行状态,稳定后可降低空气中CO2约50ppm.
实施例8:CO2电化学捕获与矿化封存系统结构与实施例1相同,本实施例考察了大电流密度运行时系统对高纯CO2的吸收效果
图8给出了反应模块采用电流密度为2A·cm-2,系统对于高纯CO2(99.995%)的吸收率随时间的变化曲线。这里,吸收率定义为CO2在进入系统前后流速的变化与入口流速的比值。结果表明,系统在该运行模式下稳定时间相对较短,在3分钟系统可实现13%的吸收率,吸收率随时间的增加而增加,在20分钟后达到15%的吸收效率。
- 还没有人留言评论。精彩留言会获得点赞!