一种利用Hoechst33258荧光染料对活细胞内活性氧含量的检测方法与流程
本发明涉及一种利用Hoechst 33258荧光染料对活细胞内活性氧含量的检测方法,属于生物活性细胞检测领域。
背景技术:
体外细胞模型是一种在离体状态下模拟生物体生长环境,检测外界刺激对细胞影响的技术。采用细胞作为试验对象,具有敏感性高、能够大大缩短试验周期、作用机制易于探明等优势,不仅提高了毒理学检测的效率还减少了动物的使用,是生物学评价体系中重要的平台。氧化损伤机制是多种污染物的重要致毒机制。在采用体外细胞模型评价污染物毒性的过程中,常常需要检测细胞内的活性氧(ROS)含量以表征机体受到的氧化损伤。传统的细胞内ROS检测方法通过选择合适的荧光探针对细胞进行孵育,然后通过记录细胞所发射的荧光信号值强弱确定细胞内ROS含量。仪器记录的荧光信号值是由每个细胞所发出的荧光强度和总的细胞数所决定的。但在现有的技术中,常常忽略细胞数量变化所导致的最终荧光强度的改变,从而导致检测结果不准确。在污染物暴露过程中,由于污染物的影响可能会导致处理组和对照组之间活细胞数目的差异,因此有必要对各孔剩余的活细胞数量进行定量以补偿细胞数量不同所造成的荧光信号值的差异。
技术实现要素:
本发明所要解决的技术问题是提供一种利用Hoechst 33258荧光染料对活细胞内活性氧含量的检测方法,该方法能够得到不同浓度下暴露污染物对应的单个活细胞的DCF荧光信号值。
为解决上述技术问题,本发明所采用的技术方案如下:
一种利用Hoechst 33258荧光染料对活细胞内活性氧含量的检测方法,包括如下步骤:
步骤1,选择人肝癌细胞株HepG2作为试验用细胞株,并对试验用细胞株进行消化吹打处理形成细胞悬液;
步骤2,用血球计数板测定细胞悬液中的细胞密度,以每孔10000个细胞的密度将细胞种入96孔板中;
步骤3,种板24h后,对细胞进行染毒暴露,将不同浓度的暴露污染物分别加入不同的孔板中;
步骤4,染毒24h后,将每个孔板中原有培养基采用50μL DCF孵育液替换,于37℃下孵育25min,孵育后用PBS缓冲液清洗,采用酶标仪检测各孔板内细胞的DCF荧光信号值;
步骤5,再向每个孔板加入100μL Hoechst 33258孵育液,于37℃下孵育15min,孵育后用PBS缓冲液洗涤,采用酶标仪检测各孔板内细胞的Hoechst 33258荧光信号值,得到每个孔板中活细胞的数量;
步骤6,将步骤4得到的每个孔板中的DCF荧光信号值除以对应孔板中细胞的Hoechst 33258荧光信号值,得到不同暴露污染物浓度下对应单个活细胞的DCF荧光信号值。
其中,步骤1中,先将试验用细胞株用PBS缓冲液清洗;清洗后用胰蛋白酶-EDTA溶液消化细胞;细胞消化后用含血清的培养基终止消化;最后将得到的细胞悬液吹匀即可。
其中,步骤3中,所述暴露污染物为砷。
其中,步骤4中,所述DCF孵育液的浓度为10μM。
其中,步骤4中,所述DCF孵育液对应的DCFH-DA荧光染料的激发波长为485nm,发射波长为530nm。
其中,步骤5中,所述Hoechst 33258孵育液的浓度为5μg/ml。
其中,步骤5中,所述Hoechst 33258孵育液对应的Hoechst 33258荧光染料的激发波长为630nm,发射波长为710nm。
与现有检测方法相比,本发明利用Hoechst 33258荧光染料对活细胞内活性氧含量的检测方法具有的有益效果为:
本发明对细胞内活性氧含量的检测方法检测结果精确,克服了由于污染物暴露导致细胞数量变化从而使最终荧光强度测量不准确的问题,本发明检测方法能够真实反映在某个浓度下对应的单个细胞荧光信号值,从而能够真实准确反映污染物暴露对细胞的损伤,为体外细胞模型在污染物毒性评价中的应用打下了更为扎实的基础。
附图说明
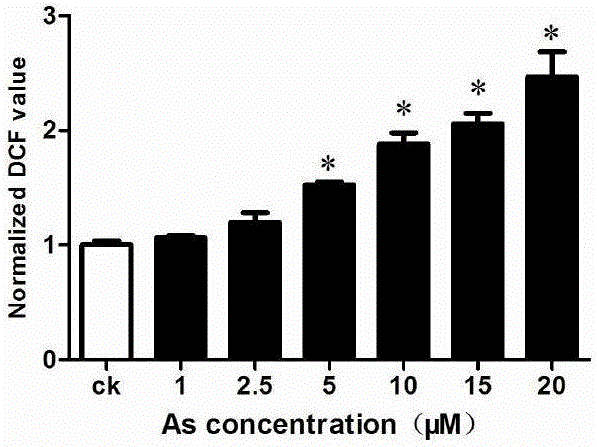
图1为不同浓度的As暴露后各孔板内活细胞的数量变化图;
图2为不同浓度的As暴露后各孔板内细胞DCF荧光信号值变化图;
图3为对比实施例的检测方法得到的不同浓度As暴露下各孔板内细胞DCF荧光信号值变化图。
具体实施方式
下面结合附图对本发明技术方案作进一步说明。
实施例1
一种利用Hoechst 33258荧光染料对活细胞内活性氧含量的检测方法,包括如下步骤:
步骤1,选择人肝癌细胞株HepG2作为试验用细胞株,在显微镜下观察其生长状态,去除原有培养基,用PBS缓冲液清洗细胞1~2次,往培养皿中加入1mL胰蛋白酶-EDTA溶液,对细胞进行消化;待细胞消化结束,加入10mL含血清的新鲜培养基终止消化,将得到的细胞悬液吹匀;
步骤2,用血球计数板测定细胞悬液中的细胞密度,以每孔10000个细胞的密度将细胞种入96孔板中;
步骤3,种板24h后,对细胞进行染毒暴露,将不同浓度的暴露污染物砷分别加入不同的孔板中;
步骤4,利用DCFH-DA探针检测砷暴露诱导下细胞内活性氧自由基(ROS)的含量,染毒24h后,将每个孔板中原有培养基采用50μL终浓度为10μM的DCF孵育液替换,于37℃下孵育25min,孵育后用PBS缓冲液清洗2次,采用酶标仪检测各孔板内细胞的DCF荧光信号值;
步骤5,再向每个孔板中加入100μL终浓度为5μg/ml的Hoechst 33258孵育液,于37℃下孵育15min,孵育后用PBS缓冲液洗涤2次,采用酶标仪检测各孔板内细胞的Hoechst 33258荧光信号值,得到每个孔板中活细胞的数量;
步骤6,将步骤4得到的每个孔板中的DCF荧光信号值除以对应孔板中细胞的Hoechst 33258荧光信号值,得到不同暴露污染物浓度下对应每个活细胞的荧光信号值。
DCFH-DA荧光染料的激发波长为485nm,发射波长为530nm;Hoechst 33258荧光染料的激发波长为630nm,发射波长为710nm。
如图1所示,通过Hoechst 33258荧光信号值可以看出,随着暴露污染物砷(As)浓度的增加,各孔板中活细胞数量出现显著性减少;图2为经过Hoechst 33258荧光信号值标准化后各孔板的DCF信号值,从图2可以看出,从暴露污染物砷(As)浓度为5μM起,暴露污染物砷(As)浓度的增大显著提高了细胞内的ROS含量,并呈现明显的剂量-效应关系。
对比实施例
一种对细胞内活性氧含量的检测方法,包括如下步骤:
步骤1,选择人肝癌细胞株HepG2作为试验用细胞株,在显微镜下观察其生长状态,去除原有培养基,用PBS缓冲液清洗细胞1~2次,往培养皿中加入1mL胰蛋白酶-EDTA溶液,对细胞进行消化;待细胞消化结束,加入10mL含血清的新鲜培养基终止消化,将得到的细胞悬液吹匀;
步骤2,用血球计数板测定细胞悬液中的细胞密度,以每孔10000个细胞的密度将细胞种入96孔板中;
步骤3,种板24h后,对细胞进行染毒暴露,将不同浓度的暴露污染物砷分别加入不同的孔板中;
步骤4,染毒24h后,将每个孔板中原有培养基采用50μL终浓度为10μM的DCF孵育液替换,于37℃下孵育25min,孵育后用PBS缓冲液清洗2次;采用酶标仪检测各孔板内细胞的DCF荧光信号值。
DCFH-DA荧光染料的激发波长为485nm,发射波长为530nm。
如图2~3所示,未经Hoechst 33258荧光信号值标准化的DCF荧光信号和标准化后的呈现很大不同:首先,本应存在显著性差异的暴露污染物砷(As)浓度为5μM时处理组未表现出显著性差异,其原因在于细胞数量的减少使得总的DCF荧光信号值变化不明显;其次,图3的实验结果没有明显的剂量效应关系,其原因同样是忽略了细胞数量变化所导致的。
- 还没有人留言评论。精彩留言会获得点赞!