一种检测血浆中酚酸类物质的方法与流程
本发明涉及一种检测血中药物含量的方法,特别涉及一种检测血浆中酚酸类物质的方法。
背景技术:
中药成分十分复杂,即使是单味药物,其所含的有效成分也达数十种之多。许多中药到目前为止其有效成分和作用机制还不是很清楚,加之中药中的一些有效成分含量很少,并且还有不少结构相似的类似物,给药代动力学的研究带来了许多困难。现代药理学研究已初步证明多成分药效的发挥并非是简单的几个单成分相加或毒性的相减,而是方中药物之间所发生的协同、拮抗或改性等作用,使复方达到预期的治疗目的,用其中一种或几种主要有效成分表征中药的整体药代动力学行为显然不合理。目前,国内对多成分中药的研究中,有相当一部分在药理效应及临床疗效的观察阶段,虽然也引用了一些西药药理学手段,但仅表现在对几个特异性指标的观测上,且重复研究居多,所研究的中药复方组成不稳定,药效重现性差,难以全面而准确地反映出多成分药物的作用机制,这使得国内复方制剂稳定性差,质量标准不高,较难与国际医药市场接轨。
欲做到安全、有效、合理用药,一般应按照具体药物的特性,拟定针对性的给药方案。长期以来中药制剂的给定方案多凭经验而定,这主要是由于中药制剂缺乏药动学参数做参考,因此,研究中药制剂在体内的吸收、分布、代谢和排泄,求出药动学参数,能有此拟定出包括给药方式、给药间隔时间、给药剂量等内容的合理给药方案。特别是用生物效应法求出的表观半衰期等药动学参数更对复方制剂具有整体代表性,可以指导临床拟定给药方案。
注射用丹参多酚酸是由丹参水溶性成分经柱层析技术分离提纯的多种酚酸类化合物加工而成的冻干粉针。主要含丹酚酸b(salb,59%),丹酚酸d(sald,2.3%),迷迭香酸(ra,3.3%),紫草酸(la,2.9%)等活性成分。具有改善微循环、细胞能量代谢、抗氧化应激、神经保护等多种药理作用,临床应用于慢性脑卒中,缺血再灌注损伤,心绞痛等疾病。
目前关于丹参多酚酸的研究报道较多。陈平等应用液相色谱-质谱联用技术检测血浆样品中丹酚酸类成分的浓度,其中流动相为15%甲醇(含0.02‰的甲酸)等梯度洗脱,血浆用抗坏血酸水溶液、盐酸,再加入乙酸乙酯处理。(陈平等,应用液相色谱-质谱联用技术检测血浆样品中丹酚酸类成分的浓度,中国临床药理学与治疗学杂志,2007,12(7):748-755);林晓雯等采用lc-ms/ms分析大鼠血浆中丹参提取物中5种酚酸类成分,流动相为0.1%甲酸水溶液(a)-甲醇和乙腈等体积混合液(含0.1%甲酸)(b)梯度洗脱,血浆用抗坏血酸、乙酸乙酯处理。(林晓雯等,丹参提取物中5种酚酸类成分在大鼠血浆中的lc-ms/ms分析,中国实验方剂学杂志,2015年4月,21(8):93-96);李小川等采用lc-ms/ms同时检测人血清中六种丹酚酸(丹酚酸b,紫草酸,咖啡酸,原儿茶醛,丹参素,迷迭香酸)含量,以氯霉素为对照品,以56%0.5%甲酸水和44%50%甲醇乙腈为流动相,前处理采用乙酸乙酯萃取法,并加入适量甲酸以保障样品的稳定。(李小川等,采用液质联用法同时检测人血清中六种丹酚酸含量,journalofchromatographyb,2005年3月,820(2005)41-47);宋俊科等采用lc-ms法以大鼠为实验对象,对丹酚酸d进行了药物动力学研究。实验采用0.05%甲酸水和0.05%乙腈为流动相,乙酸乙酯萃取进行前处理,并加了适量盐酸。(宋俊科等,采用液质联用法研究丹酚酸d在大鼠体内的药物动力学,actapharmaceuticasinicab,2015年2月,5(5)246-156。
虽然关于丹参多酚酸的研究众多,但多为丹酚酸b、丹参素等主要单体成分的研究,而对于以中药制剂一个整体的形式作为对象的研究非常匮乏。而由于丹参多酚酸中酚酸类成分众多,入血成分研究相对复杂,但在中药众多的成分中,只有入血的成分才能发挥作用。因此,研究入血成分能够明确药理作用机制,更好的指导临床用药。
注射用丹参多酚酸作为一种中药制剂,并无研究报道其药物动力血的研究。由于其有效成分含量差异甚大,对于同时检测各成分在体内含量提出了挑战。因为成分的巨大差异,所建立的检测方法不仅需要有较高的灵敏度,而且对于含量较高的成分不超载。而且这些化合物性质相近,保留行为也相近,使得分离对于这些化合物的更加困难。
本发明旨在建立一种简便灵敏、专属性强的lc-ms/ms法测定注射给药后哺乳动物(以wistar大鼠为例)血浆中各有效活性成分,明确入血成分,并且研究不同剂量的注射用丹参多酚酸尾静脉注射后主要有效成分在大鼠体内的药代动力学过程,是否存在线性依赖关系,并阐明其在体内动态变化规律,为注射用丹参多酚酸的临床合理用药提供依据。
技术实现要素:
针对现有技术的缺点,本发明提供一种同时测定血浆中四种酚酸类物质的方法。
本发明提供了一种同时测定血浆中四种酚酸类物质的方法,该方法为lc-ms/ms(液相色谱串联质谱)法,该方法包括以下步骤:
步骤1,标准对照溶液的配制;
步骤2,内标溶液的配制;
步骤3,质控(qc)样品的配制;
步骤4,含药血浆样品处理;
步骤5,检测。
上述步骤1-4的顺序不是时间顺序上的限制,可以相互置换。
其中,步骤1所述标准对照溶液的配制方法为:取迷迭香酸、sald、紫草酸、salb,分别用甲醇配成浓度为1.8-2.2mg·ml-1的一级储备液,进一步的将迷迭香酸、sald的一级储备液用甲醇稀释成浓度为1,2,5,20,50,200,500,1000,5000ng·ml-1系列标准对照溶液,将紫草酸、salb的一级储备液用甲醇稀释成浓度为5,10,25,100,250,1000,2500,5000,25000ng·ml-1系列标准对照溶液;
其中,步骤2所述内标溶液配制方法为:取氯霉素(is)用甲醇溶解配成浓度为0.04-0.06mg·ml-1一级储备液,进一步的将一级储备液用甲醇稀释成浓度为1-3μg·ml-1二级储备液;
优选的,所述内标溶液配制方法为:精密称取氯霉素(is)对照品用甲醇溶解配成浓度为0.05mg·ml-1一级储备液,用甲醇稀释成浓度为2μg·ml-1二级储备液,-20℃保存;
其中,步骤3所述质控(qc)样品的配制方法为:将迷迭香酸、sald一级储备液用甲醇稀释成浓度为2,200,4000ng·ml-1系列标准对照溶液,将紫草酸、salb一级储备液用甲醇稀释成浓度为10,1000,20000ng·ml-1的系列质控(qc)样品溶液。
其中,步骤4所述含药血浆样品处理方法为:取80-120μl血浆样本,加入甲醇溶液80-120μl,加入1-3μg·ml-1的内标溶液8-12μl,5%甲酸溶液8-12μl,混匀,加入冰乙腈160-200μl,混匀,13000rpm离心5-8min,取上清液,再13000rpm离心3-6min,得到上清液。
优选的,所述含药血浆样品处理方法为:取100μl血浆样本,加入甲醇溶液100μl,加入2μg·ml-1的内标溶液二级储备液10μl,5%甲酸溶液10μl,混匀,加入冰乙腈180μl,混匀,13000rpm离心7min,取上清液,再13000rpm离心5min,得上清液。
其中,步骤5是将上述方法得到的系列标准对照溶液,系列质控(qc)样品溶液,上清液注入lc-ms/ms色谱仪,得到色谱图,根据色谱图,计算出含药血浆样品中酚酸类物质的含量。
所述色谱/质谱检测的条件如下:
色谱条件:色谱柱:cortecstmuplcc18柱(2.1×100mmi.d.,1.6μm,美国water公司),流动相:0.05-0.3%甲酸水(a),乙腈(b),流速:0.2-0.6ml·min-1,梯度:0min:95%a,2min:95%a,2.01min:67%a,5min:67%a,5.01min:95%a,5.5min:95%a,5.51min:50%a,7.5min:50%a,7.51min:95%a,8.0min:95%a,柱温30℃,进样量1-4μl。
质谱条件:离子源:电喷雾离子源(esi);离子喷射电压:-4500v;温度:550℃;气帘气(curtaingas):25psi;加热器:55psi;辅助加热器:55psi;负离子检测方式;扫描方式:多反应离子监测(mrm);工作站:analystsoftware.(version1.6.2)(美国ab公司);
优选的,色谱/质谱条件如下:
色谱条件:色谱柱:cortecstmuplcc18柱(2.1×100mmi.d.,1.6μm,美国water公司),流动相:0.1%甲酸水(a),乙腈(b),流速:0.4ml·min-1,梯度:0min:95%a,2min:95%a,2.01min:67%a,5min:67%a,5.01min:95%a,5.5min:95%a,5.51min:50%a,7.5min:50%a,7.51min:95%a,8.0min:95%a,柱温30℃,进样量3μl。
质谱条件:离子源:电喷雾离子源(esi);离子喷射电压:-4500v;温度:550℃;气帘气(curtaingas):25psi;加热器:55psi;辅助加热器:55psi;负离子检测方式;扫描方式:多反应离子监测(mrm);工作站:analystsoftware.(version1.6.2)(美国ab公司);
在检测过程中的血浆为注射丹参多酚酸后的血浆,检测时间根据需要进行不同时间的检测。
血浆为哺乳动物的血浆,适用范围为人、大鼠等。
本发明的有益效果
1、发明人通过一种简便灵敏、专属性强的lc-ms/ms法测定注射丹参多酚酸后,大鼠血浆中丹酚酸b、丹酚酸d、迷迭香酸、紫草酸的血药浓度,研究不同剂量的注射用丹参多酚酸尾静脉注射后主要有效成分在大鼠体内的消除关系。
另外,由于给药方式不同,检测目标不同,检测方法与现有技术也有差异。如通过灌胃给药,因为在胃肠道中吸收,其在血浆中检测的成分与直接注射给药有差异;检测单个成分与检测四种成分也有不同,检测单个成分更容易,但是针对制剂来说,检测多种成分更有意义,且方法较之单个成分更复杂。
2、与现有技术相比(流动相、内标和前处理方法):
本文所采用的流动相与文献报道相近(pharmacokineticstudyofsalvianolicaciddafteroralandintravenousadministrationinrats,journalofchromatographyb,2005年3月,820(2005)41-47)。测定丹酚酸类化合物时,大部分研究在流动相都会加入适量的酸,因为酸的加入会使得色谱峰型更好。这可能是因为少的酸可以抑制酚酸类化合物的电离。然而在一定范围内,酸的加入量对于化合物分离效果影响并不大。通过试验对比,本试验发现分别在水相和有机相中加入0.1%甲酸效果最好。区别于该文献所报道的lc-ms方法,本研究采用lc-ms/ms法,通过特定离子对对化合物进行定量分析。对于色谱柱的分离要求较低。因为酚酸类化合物性质相近,在色谱柱上较难分离,因而采用lc-ms/ms方法对其进行分析结果更为可靠。
内标:与下面的文献相同(developmentandvalidationofauflc-ms/msmethodfordeterminationof7-(z)-(8-s,8-s)-epi-salvianolicacide,(7-r,8-r,8-s,8-s)-epi-salvianolicacidbandsalvianolicacidbinratplasmaanditsapplicationtopharmacokineticstudies,journalofchromatographyb,2016年3月,1022(2016)6-12)。本研究也试图尝试用该方法进行样品测定,然后由于该实验分析的是单个化合物,而本试验分析的是四个化合物,采用该试验所用的等度液相洗脱方法分析时间长,且峰展宽较为严重。表明该方法不适合多个化合物的分析。
前处理方法采用乙腈沉淀蛋白法。
现有的文献报道研究中前处理方法大多都需要进行浓缩、复溶处理,而本试验采用上清液直接进样。操作简单,处理时间短,且不受吹干复溶等步骤的限制,可以同时对大批量样品进行处理。
3、可对性质相近保留行为相近的化合物进行定量分析:
由于丹酚酸类化合物性质相近,保留行为相似,因而对其进行分析时尤其是定量分析时需要化合物之间达到一定的分离度。本研究采用lc-ms/ms法,通过离子对(母离子和子离子)对化合物进行检测,由于母离子或子离子的不同,这些化合物就具有了各自特殊的特征。即使不进行色谱分离,也可以将它们进行准确的定量。
4、研究表明静脉滴注给药低、中、高三个剂量组的注射用丹参多酚酸后,迷迭香酸、sald、la、salb在大鼠体内半衰期无显著性差异,四种化合物在大鼠体内消除半衰期不受剂量影响。auc0-∞,cmax都呈线性相关,r均大于0.95,表明该四种化合物在大鼠体内均呈线性消除。本试验所建立的lc-ms/ms方法快速、稳定,试验结果可以为注射用丹参多酚酸临床给药提供参考依据。
附图说明
图1为多反应监测母离子和子离子图;
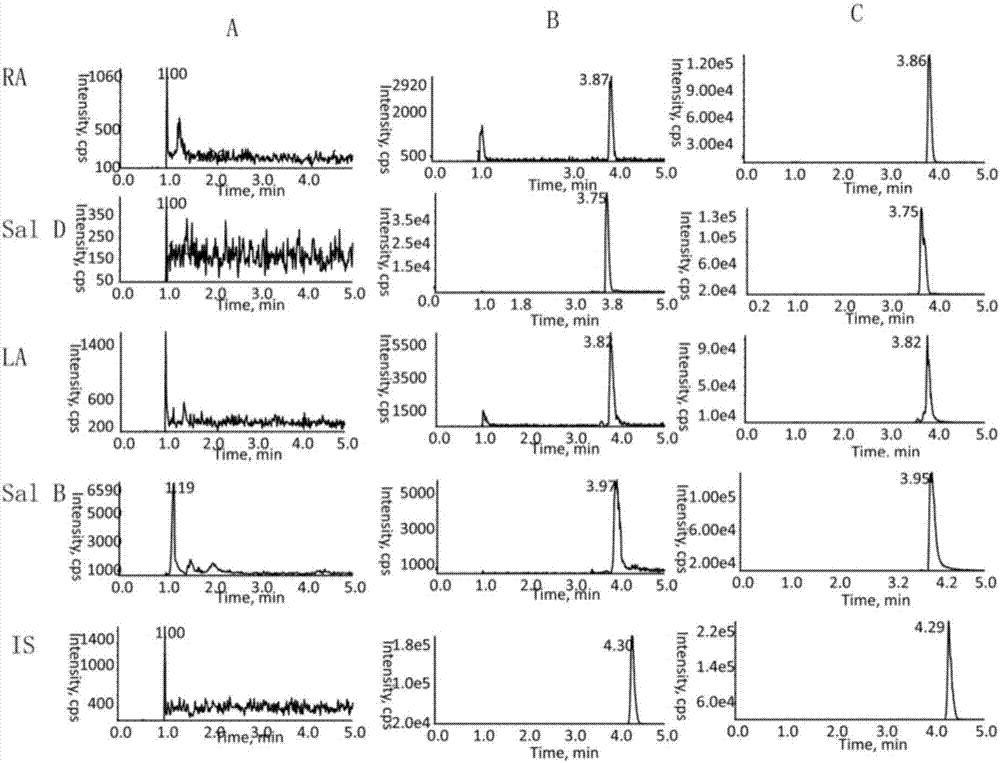
图2为多反应监测五种化合物离子流色谱图。其中a为空白血浆样品,b为模拟血浆样品,c为血浆样品;
图3为四种化合物药时曲线图,图中剂量(dose)单位为mg/kg;
图4为四种化合物剂量关系图,图中:auc剂量(dose)单位为mg/kg。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
本文实施例涉及的仪器与试剂如下:
1.1仪器
shimadzuuflc(日本岛津公司,包括lc-30ad二元高压梯度泵、dgu-20真空脱气机、sil-30ac自动进样器、cto-30ac柱温箱);
注射用丹参多酚酸(批号:20150302,天津天士力之骄药业有限公司提供);迷迭香酸对照品(纯度98.8%,批号:111871-201203,中国食品药品检定研究院);紫草酸对照品(纯度95.37%,批号:1209280l,天津天士力制药集团);丹酚酸d对照品(纯度98.7%,批号:bp002s,天津一方科技有限公司);丹酚酸b对照品(纯度95.4%,批号:111562-201212,中国食品药品检定研究院);氯霉素(纯度99.3%,批号:130303-200614,中国食品药品检定研究院)。
乙腈、甲醇(质谱级,omni);甲酸(色谱纯,sigma);乙酸乙酯(分析纯,天津康科德科技有限公司);盐酸(分析纯,天津市化学试剂三厂);肝素钠注射液(北京双鹤药业股份有限公司);医用生理盐水(河北天成药业股份有限公司);纯水(milli-q超纯水系统自制)。
1.3动物与饲养
wistar大鼠,雄性,体重240~260g,购自北京维通利华实验动物技术有限公司,许可证号:scxk(京)2012-0001。由天津天士力研究院药理毒理研究所实验动物中心饲养,饲养温度22~25℃,湿度30%~70%,昼夜自然光照。每笼5只,笼内保持清洁干燥,定时向饲料盒内添加足量啮齿类动物标准颗粒饲养(由北京维通利华实验动物技术有限公司提供),饮用水为采用经高压蒸汽灭菌系统处理后聚乙烯塑料瓶装消毒饮用水。每日清洗饮水瓶,并更换饮用水1次。实验环境中适应性饲养一周后进行实验。
实施例1:分析方法的建立
1溶液的配制
1.1系列标准对照溶液配制
精密称迷迭香酸、sald、紫草酸、salb对照品10.00mg于5ml容量瓶中,用甲醇溶解并定容,配成浓度为2.00mg·ml-1的一级储备液,迷迭香酸、sald储备液用甲醇稀释成浓度为1,2,5,20,50,200,500,1000,5000ng·ml-1系列标准对照溶液,紫草酸、salb储备液用甲醇稀释成浓度为5,10,25,100,250,1000,2500,5000,25000ng·ml-1系列标准对照溶液,-20℃保存。
1.2内标溶液配制
精密称取氯霉素(is)对照品0.5mg于10ml容量瓶中,用甲醇溶解并定容,配成浓度为0.05mg·ml-1一级储备液,用甲醇稀释成浓度为2μg·ml-1二级储备液,-20℃保存。
1.3质控(qc)样品的配制
将迷迭香酸、sald储备液用甲醇稀释成浓度为2,200,4000ng·ml-1系列标准对照溶液,紫草酸、salb储备液用甲醇稀释成浓度为10,1000,20000ng·ml-1系列标准对照溶液,-20℃保存。
2色谱/质谱条件
色谱条件:色谱柱:cortecstmuplcc18柱(2.1×100mmi.d.,1.6μm,美国water公司),流动相:0.1%甲酸水(a),乙腈(b),流速:0.4ml·min-1,梯度:0min:95%a,2min:95%a,2.01min:67%a,5min:67%a,5.01min:95%a,5.5min:95%a,5.51min:50%a,7.5min:50%a,7.51min:95%a,8.0min:95%a,柱温30℃,进样量3μl。
质谱条件:离子源:电喷雾离子源(esi);离子喷射电压:-4500v;温度:550℃;气帘气(curtaingas):25psi;加热器:55psi;辅助加热器:55psi;负离子检测方式;扫描方式:多反应离子监测(mrm);工作站:analystsoftware.(version1.6.2)(美国ab公司)。用于定量分析的离子及质谱条件如下(表1):
表15种化合物的多反应监测条件
3血浆样品处理
血浆融化后,取100μl标准血浆样本置于1.5ml的离心管中,加入甲醇溶液100μl,加入2μg.ml-1的内标工作溶液10μl,5%甲酸溶液10μl,涡旋混匀30s,加入冰乙腈180μl,涡旋混匀5min,13000rpm离心7min,取上清液转移至新的1.5ml离心管中,13000rpm离心5min,取上清液至进样小瓶中,吸取上清液3μl,进行lc-ms/ms分析。
实施例2分析方法的确证
1、质谱分析
分别配制一定浓度的迷迭香酸、sald、紫草酸、salb、氯霉素在esi离子化方式下,迷迭香酸、sald、紫草酸、salb、氯霉素主要生成[m-h]-准分子离子峰分别为m/z359.0、m/z417.1、m/z537.0、m/z717.0、m/z321.1,主要碎片离子分别为m/z161.1、m/z175.0、m/z493.1、m/z519.1、m/z152.0,结果见图1。
2、方法专属性
分别取6只wistar大鼠的空白血浆各100μl,于1.5ml离心管中,除以10μl甲醇代替内标外,按“血浆样品处理”项下依法操作,进行lc-ms/ms分析,具体见图2,获得空白血浆样品的色谱图,如图2a;将一定的标准溶液加入空白血浆和内标溶液,依同法操作,得色谱图,如图2b,其中ra的保留时间约为3.87min,sald的保留时间为3.69min,la的保留时间为3.83min,salb的保留时间为3.93min,内标氯霉素的保留时间为4.30min;取健康wistar大鼠给药后1h血浆样品,依同法操作,得色谱图2。样品中并没有杂质峰的出现,且血浆样品和模拟血浆样品中化合物的保留行为没有明显差异,表明,空白血浆中内源性物质不干扰待测物及内标的测定。
3、标准曲线与定量下限
取各标准系列溶液100μl,空白血浆100ul,置于1.5ml离心管中,除加入甲醇溶液100μl外,其余按“血浆样品处理”项下依法操作,配制迷迭香酸、sald浓度为1,2,5,20,50,200,500,1000,5000ng·ml-1系列标准对照溶液,紫草酸、salb为5,10,25,100,250,1000,2500,5000,25000ng·ml-1系列标准对照溶液,每一浓度进行双样本分析,进样3μl,记录色谱图;以待测物浓度为横坐标,待测物与内标物的峰面积比值为纵坐标,用加权最小二乘法进行回归计算,求得的直线回归方程即为标准曲线。迷迭香酸、丹酚酸d、紫草酸和丹酚酸b的标准曲线分别为y=0.00546x+0.00837(r=0.9988),y=0.00135x+0.0416(r=0.9981),y=0.000233x+0.00373(r=0.9985)和y=0.000584x+0.001(r=0.9992)。结果表明,迷迭香酸、丹酚酸d、紫草酸的线性范围为1.0~5000ng·ml-1,定量下限为1.0ng·ml-1;丹酚酸b的线性范围为5.0~25000ng·ml-1,定量下限为5.0ng·ml-1。
4、方法的准确度与精密度
取各标准质控工作溶液100μl,按“标准曲线与定量下限”项下的方法配制迷迭香酸、sald低、中、高三个浓度(分别为2.0、250、4000ng·ml-1)的质量控制(qc)样品,紫草酸、salb低、中、高三个浓度(分别为10、1000、20000ng·ml-1)的质量控制(qc)样品,每一浓度6样本,随行标准曲线,计算qc样品的浓度,连续测定三天,与qc样品配制浓度对照,求得本法的准确度与精密度,结果见表2。
表2结果实现:上述方法测得的日内和日间精密度的相对标准偏差(rsd)分别小于12.45%和11.90%,准确度在95.16%-108.11%和95.15%-108.88%,符合生物样品分析方法指导原则中的有关规定。
5、基质效应和回收率
取各质控工作溶液100μl,除不加标准系列溶液和内标外100ul甲醇外,按“血浆样品处理”项下的方法配制各化合物低、中、高三个浓度的质量控制(qc)样品(a),每一浓度6样本分析。取6种不同来源的空白血浆100μl,除不加标准系列溶液和内标外,按“血浆样品处理”项下操作,向获得的上清液中加入低、中、高浓度的质控样品溶液和内标溶液各10μl(b),涡旋混合后取5μl进lc-ms/ms分析,每一浓度进行6样本分析。同时各质控样品工作溶液各100μl,除以50μl水代替50μl空白血浆外,按“血浆样品处理”项下操作(c),每一浓度进行6样本分析。以每一浓度血浆基质的峰面积与水基质的峰面积均值的比值计算基质效应(100%*a/b)和回收率(100%*b/c)。结果见表3。
表3四个化合物的基质效应和回收率(n=6,mean±sd)
表3结果显示:物种化合物的基质效应在87.49%-111.99%,提取回收率在92.71%-108.76%
6、血浆样品稳定性考察
本试验考察了血浆样品在室温放置24h、血浆样品经历3次冻融循环以及血浆样品-20℃放置20d的稳定性。稳定性考察时,取质控样品工作溶液100μl,加入空白大鼠血浆100μl,按“血浆样品处理”项下操作,每一浓度进行3样本分析,结果见表4。
表4结果表明:迷迭香酸、sald、la、salb血浆样品在室温放置24h、3次冻融循环以及-20℃放置20d都稳定。
7、稀释效应
5倍稀释效应试验样品的制备:精密量取迷迭香酸一级储备液400ul于2ml容量瓶,甲醇定容(400ug·ml-1),取该溶液100ul,紫草酸和丹酚酸b一级储备液100ul于2ml容量瓶,加1800ul空白血浆获得模拟血浆样品(迷迭香酸浓度为20μg·ml-1,紫草酸和丹酚酸b浓度为100μg·ml-1),取该模拟血浆样品400ul,加入1600空白血浆,获得稀释后血样(迷迭香酸浓度为4μgg·ml-1,紫草酸和丹酚酸b浓度为20μg·ml-1),取此血浆100μl,按“血浆样品处理”项下操作,每一浓度进行6样本分析。结果见表5。
表53个化合物的稀释效应(n=6).
表5结果显示:所有样品的rsd不超过4.39%,准确度在95.27%-108.14%之间,满足生物样品测定需求。
2.4.8残留效应(carry-overeffect)
结果显示,空白生物样品中待测物峰面积的响应值不超过定量下限的20%,并且不超过内标的5%,表明残留效应可忽略,不影响方法的准确度和精密度。
实施例3:条件优化
1、色谱柱选择
本试验考察了watersacquityuplchsst3(1.7μm,2.1×100mm)t3,acquityuplchssc18(1.7μm,2.1×100mm),cortecstmuplcc18(1.6μm,2.1×100mm)3款色谱柱。watersacquityuplchsst3和cortecstmuplcc18对于四种化合物的分离效果,柱效更高。cortecstmuplcc18色谱柱时内边氯霉素出峰位置较为靠后,但是使用t3色谱柱样品残留更为严重,因此选择cortecstmuplcc18作为本试验色谱柱。
2、流动相选择
比较了甲醇和乙腈,发现采用乙腈作为有机相时色谱峰峰型更好且响应较甲醇高。研究还发现,在水相中加入0.1%甲酸,色谱峰型更好。由于采用梯度洗脱方法样品残留比较严重,所以考虑用等度方法来避免残留。然而,采用等度时,色谱峰展宽现象比较严重,salb的峰宽超过了1min。本研究尝试采用减少梯度变化来解决这个问题。即在极短的时间内(0.01s)改变流动相比例,且用等度洗脱,在样品洗脱出来后再进行一次冲洗。采用此方法发现样品的响应较高,低浓度进样时样品没有残留,高浓度进样时样品残留低于最低定量限的5%。符合生物样品测定需求。
3、质谱条件优化
本实验中,质谱检测采用负离子扫描模式。因为对于酚酸类成分来讲,负离子模式比正离子更加灵敏。采用对照品溶液直接进样法对质谱参数进行优化,包括dp(去簇电压)、ep(碰撞能量)、ce(入口电压)、exp(出口电压)以获得最大响应的母离子和子离子。
4、内标物的选择
本实验中,选择氯霉素作为内标物。它的保留时间与待测物相近,且内源性物质不干扰其测定,基质效应小,回收率稳定,能够满足内标物的要求。
5、血浆样品前处理方法的优化
本实验对液液萃取法、沉淀蛋白法常进行生物样品前处理方法考察。结果表明,液液萃取法回收率较低,基质干扰严重,不利于实际样品的测定。采用沉淀蛋白法时回收率和基质效应都符合要求,而且操作步骤简单,前处理效率高。研究发现在沉淀过程中加入一定的酸会使样品稳定性更好,可以抑制待测物的解离。通过比较不同的酸种类(甲酸,盐酸)及酸加入量(1%,5%,10%),确定加入5%甲酸10μl效果最佳。直接采用上清液进样与浓缩后再进样相比,效果更好。通过文献调研发现采用冰乙腈进行沉淀,回收率更高。
实施例4:注射用丹参多酚酸在大鼠体内血浆中的含量测定及药动学研究
1、给药溶液的制备
精密称取注射用丹参多酚酸适量,以医用生理盐水(0.9%氯化钠)为溶剂配制成质量浓度为7mg·ml-1,14mg·ml-1,28mg·ml-1的尾静脉注射溶液。
2、血浆样品的采集
取18只雄性健康wistar大鼠,随机分成3组,每组6只,实验前禁食12h,自由饮水。低、中、高给药剂量分别为14.0、28.0、56.0mg·kg-1,分别于给药(尾静脉注射)后0.033,0.083,0.167,0.33,,0.5,1,2,4,6,8和12h从眼眶后静脉丛取血约0.5ml,放入涂有肝素的离心管中,于4500rpm条件下离心10min后,分离血浆,置于-20℃保存。
3、血浆中四种酚酸类成分的含量测定
按照上述血浆样品的处理方法进行处理,并进行液相及质谱的分析,得到给药后(注射给药)各时间段的四种酚酸类成分在血浆中的含量。迷迭香酸的含量在第8小时就低于检测下限,salb在第12小时的时候就低于检测下限,见下表表6(单位ug/l)。
表6四个化合物在不同时刻血浆药物的含量
4、药物动力学研究结果与讨论
注射用丹参多酚酸的成分较多,但检测到主要入血成分为迷迭香酸、丹酚酸d、紫草酸和丹酚酸b,可能是其他成含量过低或者消除速度过快。用das3.0数据软件计算静注注射用丹参多酚酸后迷迭香酸、丹酚酸d、紫草酸和丹酚酸b的药物浓度实测数据进行计算,四种化合物都符合二室模型,动力学参数见表7,物药-时间曲线如图3所示。
表7四个化合物药动参数(n=6)
*p<0.05,与高剂量组比较;#p<0.05,与中等剂量比较
静脉滴注给予大鼠低、中、高三个剂量组的注射用丹参多酚酸后(表7),迷迭香酸的t1/2分别为1.413、0.983和0.989h,sald的t1/2分别为2.329、2.52和2.657h,la的t1/2分别为1.825、2.104和2.055h,salb的t1/2分别为2.061、1.943和1.82h,三个剂量组之间没有显著差异(p>0.05),表明四种化合物的消除半衰期不受给药剂量影响。迷迭香酸的cmax分别为1425.00、2600.00和5307.5ug/l、auc0-∞分别为227.828、418.945、911.53μg/l*h,sald的cmax分别为644.75、1045.00和1605.00ug/l、auc0-∞分别为961.78、1667.73、2338.305μg/l*h,la的cmax分别为4182.50、7365.00和12900.00ug/l、auc0-∞分别为4515.235、8897.28、13537.97μg/l*h,salb的cmax分别为14525.00、32746.83和59041.67ug/l,auc0-∞分别为3424.51、6902.37、12456.54μg/l*h。cmax和auc0-∞与给药剂量呈线性相关(图4),r均大于0.97,表明注射用丹参多酚酸尾静脉滴注给药后,在14-56mg.kg-1的剂量范围内,四种化学物呈线性消除。
药时曲线(图3)表明注射不同剂量药物30min后,迷迭香酸、salb在血浆中消除速都度趋于平稳,2h后,sald和la在血浆中消除速都度趋于平稳,这表明迷迭香酸和salb在大鼠体内的消除速度要大于la和sald,四种化合物低、中、高三剂量消除趋势无显著性差异。而auc0-∞和auc(0-t)表明,虽然在注射用丹参多酚酸中,四种化合物含量差异很大,salb的含量几乎是紫草酸的18倍,但是紫草酸具有更大暴露量(图4),相对于salb,推测它有更大的半衰期。
5、结论
静脉滴注给药低、中、高三个剂量组的注射用丹参多酚酸后,迷迭香酸、sald、la、salb在大鼠体内半衰期无显著性差异,表明该四种化合物在大鼠体内消除半衰期不受剂量影响。auc0-∞,cmax都呈线性相关,r均大于0.97,表明该四种化合物在大鼠体内均呈线性消除。本试验所建立的lc-ms/ms方法快速、稳定,试验结果可以为注射用丹参多酚酸临床给药提供参考依据。
- 还没有人留言评论。精彩留言会获得点赞!