一种丝氨酸129位磷酸化alpha‑突触核蛋白聚集体的ELISA检测方法与流程
一种丝氨酸129位磷酸化alpha-突触核蛋白聚集体的ELISA检测方法技术领域本发明涉及聚集化的丝氨酸129位磷酸化alpha-突触核蛋白(α-syn)检测方法的建立。
背景技术:
帕金森病(Parkinson’sDisease,PD)作为最常见的神经退行性疾病之一,分别影响65岁和85岁年龄中1%和5%的人口,alpha-突触核蛋白(α-syn)作为2014年新修订的对PD定义的核心蛋白,已引起人们高度重视α-syn在PD早期诊断、病程和药物疗效检测中的实际应用。因此,现在急需一种或多种灵敏且特异的检测方法,检测各种形式的α-syn随着PD的发生发展在人体液中的变化趋势,这就要求这种检测方法要客观、可行,并易于在临床上得以推广。路易体(Lewy’sBody,LB)作为PD主要的病理标志物,其主要成分由α-syn组成,而在LB中有90%的α-syn在129位发生了磷酸化(pS129-α-syn)。为了研究PD病程的进展,人们利用了多种方法监测α-syn在体内的变化趋势,纵观近几年的检测α-syn的文献,报道PD患者体液中的α-syn含量不尽相同,但是磷酸化α-syn和α-syn聚集体的含量增加是基本一致的报道。在上述有意义的研究报道中,检测的磷酸化α-syn是单体形式和α-syn的聚集体形式,而没有明确聚集体中α-syn是磷酸化形式还是非磷酸化形式,更没有检测聚集状态的磷酸化α-syn,因为目前尚没有检测聚集化pS129-α-syn的方法。而聚集的磷酸化α-syn在PD发生发展过程中发挥更关键的作用。而且有文献报道,活性醛类——包括ONE(4-oxo-2-nonenal),HNE(4-hydroxynonenal)——在PD患者的脑脊液中的含量随疾病进展而不断升高,它们作为脂质过氧化的产物,可以与α-syn的第50位组氨酸发生加合(如下)。而促使α-syn更易发生聚集。考虑到建立标准曲线所需使用的标准抗原的单一性,本专利使用HNE的氧化副产物(OxidativeCounterpart)ONE促进人源α-syn和pS129-α-syn发生聚集,建立基于夹心法ELISA的检测方法,以便将来观察临床脑脊液、血浆、大脑匀浆中聚集化的pS129-α-syn随病程的变化趋势。HNE和蛋白质的组氨酸通过1,4-Michael加合对蛋白进行翻译后修饰因此,我们发明的聚集化丝氨酸129位磷酸化α-突触核蛋白的检测方法具有重要意义。为临床PD的血液及脑脊液样品及基础研究的PD模型的聚集化丝氨酸129位磷酸化α-突触核蛋白的检测提供了检测手段,也有可能通过此方法建立PD的诊断试剂盒。ELISA的基础是抗原或抗体的固相化及抗原或抗体的酶标记。结合在固相载体表面的抗原或抗体仍保持其免疫学活性,酶标记的抗原或抗体既保留其免疫学活性,又保留酶的活性。受检标本与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与液体中的其他物质分开。加入酶标记的抗原或抗体,通过反应也结合在固相载体上。加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,根据呈色的深浅进行定性或定量分析。酶的催化效率很高,间接地放大了免疫反应的结果,使测定方法达到很高的敏感度。双抗体夹心法是检测抗原最常用的方法,操作步骤如下:1)将特异性抗体与固相载体联结,形成固相抗体,洗涤除去未结合的抗体及杂质,2)加受检标本,保温反应,标本中的抗原与固相抗体结合,形成固相抗原抗体复合物,洗涤除去其他未结合物质,3)加酶标抗体,保温反应,固相免疫复合物上的抗原与酶标抗体结合,彻底洗涤未结合的酶标抗体,此时固相载体上带有的酶量与标本中受检抗原的量相关,4)加底物显色,固相上的酶催化底物成为有色产物,通过比色,测知标本中抗原的量,这种双位点夹心法具有很高的特异性。在临床检验中,双抗体夹心法法适用于检验各种蛋白质等大分子抗原,例如HBsAg,HBeAg,AFP,hCG等.只要获得针对受检抗原的异性抗体,就可用于包被固相载体和制备酶结合物而建立此法。如抗体的来源为抗血清,包被和酶标用的抗体最好分别取自不同种属的动物。如应用单克隆抗体,一般选择两个针对抗原上不同决定簇的单抗,分别用于包被固相载体和制备酶结合物。本专利提供了可以用于ELISA实验的特异性捕获α-syn的N段蛋白(氨基酸1-60)的兔多克隆抗体-SN16和特异性检测pS129-α-syn的小鼠单克隆抗体C140S,并探索出抗体用于检测的最适浓度,分别为1ug/ml的SN16捕获抗原,0.02ug/ml的C140S检测目的抗原。本专利首次明确提出用于检测聚集化pS129-α-syn的双抗体夹心ELISA,验证检测抗体C140S的反应性标准,即纯化为干粉状态的C140S抗体在配制为4mg/ml浓度的蛋白溶液后,对于1000ng/ml的阳性抗原OP(oligomerized129-serinephosphorylatedhumanalpha-synuclein,聚集化的129位丝氨酸磷酸化的人源alpha型突触核蛋白)和阴性抗原OW(Oligomerizedwild-typehumanalpha-synuclein,聚集化的野生型人源alpha型突触核蛋白),使用0.125ug/ml的C140S,和1:10000稀释的m-HRP做间接法ELISA时,在背景信号和阴性对照组490nm波长吸光光度值信号均小于0.2的情况下,阳性组的490nm波长吸光光度值要达到2.0-2.5之间,该批次纯化的C140S抗体方可用于双抗体夹心ELISA。
技术实现要素:
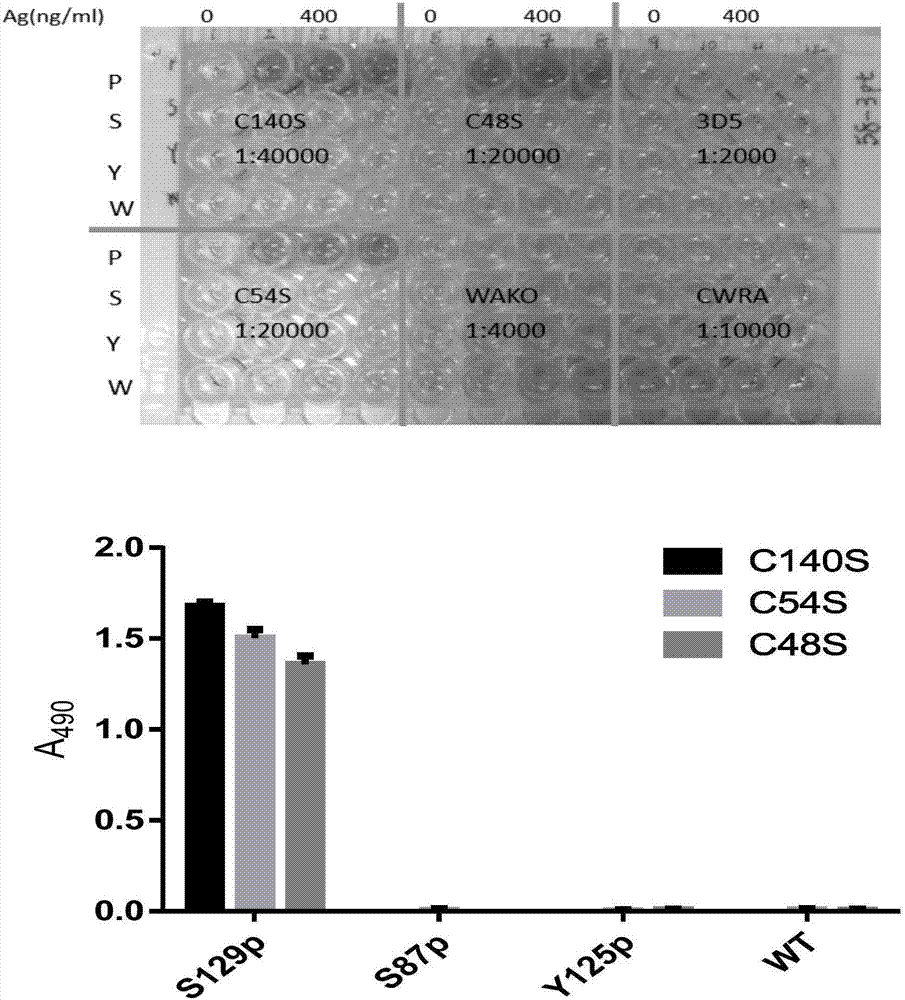
本发明提供一种丝氨酸129位磷酸化alpha-突触核蛋白聚集体的夹心ELISA检测方法,所述方法包括使用单克隆抗体C140S,和多克隆抗体SN16进行夹心法ELISA,以测定人血液样本中的丝氨酸129位磷酸化alpha-突触核蛋白聚集体的含量。本发明还提供一种细胞株,保藏编号为CGMCC12993。本发明还提供一种单克隆抗体C140S,由上述细胞株制备得到。本发明还提供一种用于ELISA方法的捕获alpha-突触核蛋白抗原的兔多克隆抗体SN16。本发明还提供一种抗原,为通过hPLK3激酶催化的丝氨酸129位磷酸化的α-syn标准蛋白。本发明还提供一种丝氨酸129位磷酸化alpha-突触核蛋白聚集体的夹心ELISA检测方法的建立方法,包括如下步骤:1)制备人源α-syn;2)将人源α-syn129位的丝氨酸磷酸化;3)使用ONE将步骤1)中的人源α-syn和步骤2)中129位磷酸化的人源α-syn(pS129-α-syn)聚集化;4)制备可识别人源pS129-α-syn的单克隆抗体C140S;5)制备特异性捕获α-syn的兔多克隆抗体SN16;6)使用单克隆抗体C140S和兔多克隆抗体SN16做夹心法ELISA;优选的,所述的建立方法,包括如下步骤:1)制备人源α-syn,并使用谷胱甘肽琼脂糖珠-4B纯化人源α-syn;2)使用hPLK3催化步骤1)中得到的人源α-syn使其在129位丝氨酸发生磷酸化;3)使用ONE使步骤1)中的人源α-syn和步骤2)中129位磷酸化的人源α-syn聚集化;4)用斑点印迹实验筛选可识别人源pS129-α-syn的免疫Balb/c小鼠的腹水C140S,获得单克隆抗体C140S,使用蛋白G琼脂糖珠FF亲和层析柱纯化单克隆抗体C140S;5)制备特异性捕获α-syn的兔多克隆抗体SN16;6)确定检测抗体的浓度;7)使用单克隆抗体C140S和特异性捕获α-syn的兔多克隆抗体SN16做夹心法ELISA。本发明还提供一种试剂盒,其中包括以下试剂:小鼠源单克隆抗体C140S,和兔源多克隆抗体SN16。本发明的的试剂盒,还包括以下试剂:磷酸化试剂,和试剂ONE。本发明的试剂盒,还包括以下试剂:ELISA酶标板,PBS,NaHCO3缓冲液,封闭液,PBST等,所述试剂盒,各试剂分别包装,每个包装中装入试剂的量以够一个样本使用量为基本量,可以扩大到10个,100个,1000个样本的使用量。本发明所述的ELISA检测方法,需要用到标准曲线来确定有关物质的含量,所述标准曲线的制作方法如下:使用OP建立标准曲线,在各个浓度点使用OW作为阴性对照,显色方法为AP(碱性磷酸酶)催化pNPP(p-nitrophenylphosphate,p-硝基苯基磷酸盐,SurModics,货号PNPS-1000-01)延迟显色,即从30分钟为第一次扫描,每隔10分钟扫描一次选取反应性和灵敏度范围满意的时间点用作最终的标准曲线的建立。将建立标准曲线使用的各浓度OP和OW的A405(405nm处的吸光度值)输入到Excel表格中,选中用于建立标准曲线的数据,单击插入菜单,选择散点图,在生成的散点图中,右键单击任一一个数据点,在弹出的菜单中选择“添加趋势线”,在窗口中选择趋势线选项为“线性”,并勾选“显示公式”和“显示R平方值”。采用本发明的ELISA检测方法,可以得到吸光度数据,将得到的吸光度数据用上述标准曲线比对,可以计算出样本中的OP含量,本发明检测方法的具体操作见本发明实施例。以下为本发明方法中的名称术语的解释:样本为建立标准曲线使用的纯蛋白样本。人源α-syn人源α型突触核蛋白,广泛分布于中枢神经系统神经末梢,现认为此蛋白与维持神经元可塑性有关。谷胱甘肽琼脂糖珠-4B为琼脂糖珠上包被有谷胱甘肽,在纯化大肠杆菌表达GST-α-syn融合蛋白时,利用融合蛋白N端上的GST(谷胱甘肽转移酶)标签,与其结合,达到纯化的目的,之后再使用人凝血酶将此标签切除,即得到纯化的人源α-syn纯蛋白。hPLK3为人源Polo样激酶家族(Polo-LikeKinaseFamily)中的一个亚型,在体外实验中显示,hPLK3可以将全部的人源α-syn催化磷酸化,在本专利中的质谱实验部分也确认了磷酸化的位点仅发生在第129位丝氨酸。ONE:4-oxo-2-nonenal,4-氧代壬烯醛人体内脂质过氧化(lipidperoxide)产物之一,还包括HNE(4-hydro-2-nonenal,4-羟代壬烯醛),是HNE的氧化副产物(oxidativecounterpart)。人源α-syn聚集体,英文缩写OW(OligomerizedWild-Typehα-syn)由ONE对人源α-syn第50位组氨酸翻译后修饰,形成ONE-蛋白加合物(ONE-proteinadduct),当人源α-syn收到这种翻译后修饰后,会更容易形成聚集体,且文献中HPLC结果显示,其分子量集中在2000kD。129位磷酸化的人源α-syn(pS129-α-syn)聚集体,英文缩写OP(Oligomerized129-serine-phosphorylatedhα-syn)由ONE对129位磷酸化的人源α-syn第50位组氨酸翻译后修饰,形成ONE-蛋白加合物(ONE-proteinadduct),促进形成聚集体。斑点印迹实验中使用硝酸纤维素膜(NC膜),在其上点1μl蛋白样本,并使用抗体与其反应,用于检测抗体反应的特异性和灵敏性。免疫Balb/c小鼠Balb/c小鼠是用于生产抗体的最常用的实验动物品系,将目的肽段免疫这种小鼠,为后期提取脾脏做融合细胞做准备。腹水C140S在初步使用间接法ELISA筛选出抗体的其中一个克隆号,根据所处孔板的位置命名为C140S,由于是腹水,还没有纯化,因此命名为腹水C140S和纯化后的抗体相区分。蛋白G琼脂糖珠FF在从腹水C140S和其他克隆号中纯化抗体使用的琼脂糖珠,其上包被有G蛋白,可以结合抗体,从而通过结合、洗柱等流程除去腹水中非抗体的成分,得到纯化抗体。为建立本发明所述的ELISA检测方法,特制备了一种针对129位磷酸化的人源α-syn的小鼠源单克隆抗体C140S,该单克隆抗体的制备方法如下:使用P1(M18631-1hz-1-1,Ac-CEAYEMP(pS)EGG-NH2,人源129位丝氨酸磷酸化α-syn的123-131肽段)肽段免疫balb-c小鼠,取脾制备融合骨髓瘤细胞系,间接法ELISA筛选出克隆号为C140S的细胞系,使用该细胞系注射入4只balb-c/nu小鼠腹腔,间接法ELISA验证腹水反应特异性后纯化抗体,再次使用间接法ELISA验证纯化的抗体的反应性后(即0.125ug/ml的抗体识别1000ng/ml的阳性组490nm波长吸光光度值高于阴性组至少30倍,且背景和阴性组读数小于0.2),方可用作本方法中的检测抗体,最终浓度为4mg/ml。(该细胞株已经保藏在中国微生物菌种保藏管理委员会普通微生物中心,编号为CGMCC12993,保藏日期2016年9月14日,分类命名:杂交瘤细胞株,地址北京市朝阳区北辰西路1号院3号)。为建立本发明所述的ELISA检测方法,特制备一种针对人源α-syn的N端(1-60位氨基酸)的兔源多克隆抗体SN16;该多克隆抗体的制备方法如下:使用α-syn的N端(1-60位氨基酸)肽段免疫2只新西兰白兔,颈动脉放血收集血清后纯化抗体,最终浓度为192ug/ml。由于本发明效果的优越性,本发明人根据上述方法制备了一种检测试剂盒,所述试剂盒包括以下试剂:小鼠源单克隆抗体C140S兔源多克隆抗体SN16本发明所述试剂盒,必要时还可包括以下试剂:磷酸化试剂(包括hPLK3激酶和催化磷酸化反应的缓冲液);试剂ONE本发明所述试剂盒,根据需要,所述试剂盒还可包括任何一种适合本发明方法的辅助试剂:如,ELISA酶标板,PBS(磷酸盐缓冲液),NaHCO3缓冲液,封闭液,PBST(PBS中加入0.2%的Tween-20)等。本发明的上述试剂盒的使用是以血浆中重组人α-突触核蛋白聚合体作为标准蛋白,以该聚集体浓度与吸光度值的关系曲线作为标准曲线,通过测定样本中的血浆-重组人α-突触核蛋白聚合体的浓度以及形成率达到诊断帕金森病的目的。本发明的试剂盒,各试剂分别包装,优选使用包装管,每个包装管中装入试剂的量以够一个样本使用量为基本量,可以扩大到10个,100个,1000个样本的使用量。本发明的试剂盒的使用是根据上述检测血浆中重组人α-突触核蛋白聚集体的方法进行的,使用时将试剂盒中的试剂根据需要配制成相应的浓度,按照所述方法测定即可。为研究本发明,还进行了重复性试验,精密度试验,检测方法的筛选等试验以确保本发明的应用性。质谱分析PLK3催化人源α-syn磷酸化位点的特异性2010年MartialK.Mbefo等人使用同位素标记蛋白质观察PLK3磷酸化α-syn时发现,在30℃反应时间达到2.5小时,所有的α-syn均发生了磷酸化,本专利使用这一方法将制备的人源Pα-syn做质谱分析发现,PLK3使α-syn仅在129位丝氨酸发生了磷酸化(图3),而S87位和Y125位均没有发生磷酸化(图4),证实PLK3对于α-syn的磷酸化位点具有特异性。本发明的灵敏度实验:制备C140S抗体使用的免疫肽段:P1(M18631-1hz-1-1,Ac-CEAYEMP(pS)EGG-NH2,人源129位丝氨酸磷酸化α-syn的123-131肽段)对照包括:P2(M18631-1hz-2-1,Ac-EMP(pS)EEGYQDC-NH2,人源129位丝氨酸磷酸化α-syn的126-135肽段),W(Z18631-1hz-3-1,Ac-CEAYEMPSEEGYQD-NH2,人源α-syn的123-135肽段),ASWT(hα-syn-FL,FL代表全长),SE(hα-syn/S129E,为模拟磷酸化突变体)实验结果如下表:抗体名称体积(ml)理论灵敏度(ng)实际稀释比例使用体积(μl)C140S0.10.011:50010显示C140S抗体可以特异性识别100ng的P1肽段(图1)。间接法ELISA(Enzyme-LinkedImmunosorbentAssay,酶联免疫吸附测定)筛选抗体识别磷酸化位点特异性α-syn在S87,Y125,S129位点是三个磷酸化翻译后修饰位点,C140S抗体仅可以识别S129位磷酸化的肽段,对于S87、Y125磷酸化的肽段和野生型肽段均不识别(图2)。使用的抗原列表:编码全称序列浓度检测抗体P①P1CEAYEMP(pS)EEG4mg/mlC140S&C54SP②P2EMP(pS)EEGYQDC4mg/mlC48SS22667-1-1KTVEGAGS(p)IAAATG8mg/mlY22667-1-2VDPDNEAY(p)EMPSEE8mg/mlWZ18631-1hz-3-1CEAYEMPSEEGYQD4mg/ml本发明的优点在于:本发明使用捕获抗体SN16和检测抗体C140S,可以特异性检测出聚集体形式的129位丝氨酸磷酸化的人源α-syn,而不识别其单体形式,亦不识别野生型α-syn单体和聚集体;识别的信号显著高于非磷酸化的聚集体、磷酸化单体、野生syn单体。本发明可以自行调整pNPP的显色时间,以控制背景,并得到检测所需的灵敏度范围,对于聚集体形式的129位丝氨酸磷酸化的人源α-syn,最大灵敏度可达10ng/ml。附图说明图1是Dotblot结果提示1:500稀释的C140S腹水对于P1肽段的灵敏度为100ng,对于P2肽段、野生型肽段W、野生型α-syn蛋白全长(ASWT)、α-syn-S129E突变体(SE)则没有反应性。图2表示C140S,C48S,C54S为Dot-Blot筛选出的功能相同的三株抗体,间接法ELISA提示三株抗体对于免疫肽段P均有反应性,对于87位磷酸化肽段(S)、125位磷酸化肽段(Y)、野生型肽段(W)则没有反应性,间接法ELISA结果中使用的3D5抗体为宣武医院于顺教授制备的小鼠单克隆抗hα-syn115-121抗体,WAKO为日本制造的小鼠单克隆抗129位磷酸化hα-syn抗体(pSyn#64),CWRA为本室制造的兔源多克隆抗hα-syn-FL抗体,结果提示后三者对于四种肽段均无反应性。图3显示Glu-C切割的肽段之一α-syn124-131质谱显示129位丝氨酸发生了磷酸化,而125位酪氨酸没有发生磷酸化。图4显示Trypsin切割的肽段之一α-syn84-104质谱显示87位丝氨酸未发生磷酸化。图5是在间接法实验中,C140S腹水对于129位磷酸化α-syn全长蛋白的反应性和WAKO抗体没有显著性差异,且反应性显著高于C48S和C54S腹水,3D5抗体对于野生型α-syn全长(W)、S129E(模拟磷酸化α-syn蛋白突变体,E)、S129A(阻断磷酸化α-syn蛋白突变体,A)均有反应性,且无显著性差异,3A5抗体为本室前期自制小鼠源单克隆抗磷酸化α-syn抗体,在ELISA中可特异性识别129位模拟磷酸化α-syn蛋白突变体(E)。图6在同一张PVDF膜(polyvinylidenedifluoride,聚偏二氟乙烯)先后孵育两种抗体观察,左侧C140S抗体仅识别17kD的129位磷酸化hα-syn(P),洗膜后孵育BD抗体可见129位磷酸化hα-syn(P)和野生型hα-syn(W)上样量一致。图7为间接法ELISA筛选出符合应用标准的纯化抗体批次。图8使用Santa的多克隆抗磷酸化α-syn抗体(SantaCruz,sc-135638)为捕获抗体,生物素化3D5单克隆抗人α-syn115-121为检测抗体,发现不识别磷酸化(P)和野生型α-syn单体(W),以及α-syn聚集体(OW),仅识别聚集化Pα-syn(OP)。图9为本室自制SN16为多克隆抗人α-syn-N端抗体做捕获抗体,C140S抗体做检测抗体,发现不识别磷酸化(P)和野生型α-syn单体(W),以及α-syn聚集体(OW),仅识别聚集化Pα-syn(OP)。图10为使用SN16/C140S抗体建立OP的标准曲线,抗原浓度包括64000,32000,16000,8000,4000,2000,1000,500pg/ml的OP和OW的A405读数,AP-pNPP显色时间60分钟。图11为间接法ELISA验证SN16抗体的对于α-syn的N端可以特异性识别。具体实施方式以下通过实施例进一步说明本发明。实施例1α-syn的表达和纯化:实验材料:质粒:pGEX-4T-1-hαsyn-WT(4969bp+423bp)AMP(Ampicillin,氨苄霉素)抗性,表达GST-hαsyn-WT融合蛋白,分子量26kD+16kD;...
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1