原细纤维结合抗体及其治疗和诊断帕金森氏症、路易体痴呆和其他α‑共核蛋白病的应用的制作方法
技术领域
本发明涉及具有对人类α-突触核蛋白(α-synuclein)原细纤维(protofibrils)高的亲和力和α-突触核蛋白单体低的结合的抗体或其片段,其中抗体或片段具有特定的互补决定区(CDR)序列。本发明也涉及包含这样的抗体或片段的组合物,并涉及利用这样的抗体或片段检测α-突触核蛋白原细纤维的方法。在进一步的实施例中,本发明涉及通过给予这样的抗体或片段预防、推迟具有α-突触核蛋白病理的神经退化性疾病(neurodegenerative disorder)的发作或治疗所述疾病的方法,并涉及在制备治疗具有α-突触核蛋白病理的神经退化性疾病的药物组合物中应用这样的抗体或片段。本发明也涉及在诊断或监测具有α-突触核蛋白病理的神经退化性疾病的发展中应用这样的抗体或片段,并涉及通过这样的抗体或片段的给予减少或抑制α-突触核蛋白聚集的方法。
背景技术:
帕金森氏症(PD)和路易体痴呆(dementia with Lewy bodies)(DLB)是具有α-突触核蛋白脑病理的神经退化性疾病的两个最普遍的实例。PD是最普遍的运动紊乱,且PD的特点是僵化、运动功能减退、颤动和姿势不稳定(postural instability)。认为大约四到六百万的世界人口患PD。DLB代表所有痴呆的5-15%。除了健忘和经常波动的其他疯狂的症状之外,DLB病人一般遭受反复出现的跌伤和视幻觉。
α-突触核蛋白的神经元内(Intraneuronal)积聚导致路易体的形成,球形的嗜曙红玻璃质10-20μm大的内含物,或路易神经突的形成,拉长的线状的畸形的轴突和树突。在PD脑中,路易体和路易神经突的沉积物通常限于连接纹状体和黑质(substantia nigra)的神经细胞。这些细胞对于运动和姿势功能的完成、说明PD症状的本性来说是至关重要的。在DLB脑中,在中脑和皮质区域中都发现路易体和路易神经突的广泛分布的沉积物。
α-突触核蛋白是主要地发现的神经内的蛋白质。在神经细胞内,α-突触核蛋白主要地位于突触前(presynaptically),且因此推测它在突触的活性的调节中扮演的作用。识别了α-突触核蛋白的三个主要的亚型,它的最长的和最普通的形式包含140个氨基酸。这种亚型已被应用,根据本发明的抗体的α-突触核蛋白(α-突触核蛋白)有关的特征涉及α-突触核蛋白的这种亚型。
除了α-突触核蛋白之外,路易体由多种分子组成,其中一个分子是4-羟基-2-壬烯醛(4-hydroxy-2-nonenal)(HNE)、α,β-不饱和的羟基烯烃(hydroxyalkenal)(Qin等人,2007)。在体外已经显示HNE能修饰α-突触核蛋白,且因此促进α-突触核蛋白的寡聚化(oligomerization)。特别地是,已经显示HNE增加和固定原细纤维的形成,例如,α-突触核蛋白的可溶解的较大的寡聚形式(Qin等人,2007;WO 2009/133521,包括在此以供参考)。
在许多由错误折叠的α-突触核蛋白的病理的积聚表征的神经退化性疾病中已经暗示了氧化应激(Oxidative stress)。各种活性氧组分能诱导脂质的过氧化,如细胞膜或脂蛋白,且也导致来自多不饱和脂肪酸的高度地活性醛的产生(yoritaka等人,1996)。
在具有DLB大约50%病例中可看到阿尔茨海默氏病(AD)的脑病理指征,例如,淀粉样斑块(amyloid plaques)和神经原纤维缠结(neurofibrillary tangles)。不清楚的是,平行的病理的存在是否暗示两种不同的疾病或者仅仅代表每一个各自紊乱的变体。有时将共病理的病例描述为具有AD的路易体变体(Hansen等人,1990)。
近来的研究暗示了在AD和唐氏综合征(Down's syndrome)中α-突触核蛋白的作用,如已经证明了α-突触核蛋白蛋白质在这些紊乱中的边缘区中的积聚(Crews等人,2009)。
HNE对半光氨酸、组氨酸和赖氨酸的侧链起反应并修饰所述侧链,充分地改变这些侧链的结构和物理性能。因此,HNE能与C-3碳或与醛基或其组合起反应。因此,HNE能作用于分子间地或作用于分子内共价地修饰蛋白质。
帕金森氏症和路易体痴呆的遗传学
能通过α-突触核蛋白基因的点突变或重复形成PD和DLB的稀有的主要地遗传的形式。已经描述了引起家族PD的致病突变A30P和A53T(Kruger等人,1998)(polymeropoulos等人,1998)和基因的重复(chartier-Harlin等人,2004),然而已经报道了引起PD或DLB的一个其他的α-突触核蛋白突变,E46K(Zarranz等人,2004)和α-突触核蛋白基因的三倍体(triplication)(Singleton等人,2003)。
仅部分地了解α-突触核蛋白突变种的致病的结果。然而,体外数据已经显示,A30P和A53T突变种增加聚集率(Conway等人,2000)。多种不同组成的α-突触核蛋白种类(单体、二聚体、寡聚体,包括原细纤维)都涉及聚集过程,所有这些可具有不同的毒性。不清楚的是,哪一个分子种类在脑中有毒性作用。然而,最近的研究表明,α-突触核蛋白的寡聚的形式是显著地神经毒性的。通过引起遗传的帕金森氏症的某些α-突触核蛋白突变种(A30P和A53T),导致寡聚化增加率的观察给出关于寡聚物的作用的另外的证据。
还没有完全地了解α-突触核蛋白聚集级联是如何开始的。可能,在这些中间大小种类在路易体中作为不可溶解的原纤维沉积之前,单体的α-突触核蛋白的改变的构造开始二聚体和三聚体的形成,其继续形成较大的可溶解的寡聚体,包括原细纤维。也应该理解,α-突触核蛋白寡聚体,一旦它们形成,则能结合新的单体和/或α-突触核蛋白较小的多聚体,因此加速原纤维(fibrils)形成过程。这样的播种(seeding)作用可能也能在细胞外空间中发生,如最近的证据表明α-突触核蛋白病理可在患病的脑中从神经细胞传播到神经细胞。
除了在α-共核蛋白病(synucleinopathies)中的神经病理的改变之外,α-突触蛋白的水平通常在受侵袭的脑区域中增加(Klucken等人,2006)。
α-共核蛋白病的主要的病理是细胞内的,其引起免疫治疗途径的挑战。然而,可能,活跃诱导的片段或被动给予的抗体也能在神经元内结合它们的靶抗原。此外,血浆和脑脊髓液两者中的α-突触核蛋白的识别(El-Agnaf等人,2006)说明,不仅仅在神经细胞内发现所述蛋白质。减少的这样的细胞外α-突触核蛋白可改变细胞内和细胞外蛋白质集合之间的平衡,且也导致减少细胞内的α-突触核蛋白。证据表明,在溶液中的α-突触核蛋白能渗透细胞膜中的脂质双分子层,并因此内在化或输出细胞。最近的发现证明,α-突触核蛋白在细胞外的空间中有毒性作用,因此,提供关于α-突触核蛋白病理如何作为疾病发展传遍脑的似乎真实的解释。研究显示,在移植的PD病人中路易病理传播给移植的神经细胞(Li等人,2008)。此外,通过内吞作用(endocytosis)将α-突触核蛋白传播给邻近的神经细胞,且α-突触核蛋白聚集体的细胞到细胞的传播已经与PD和其他α-共核蛋白病中的神经细胞死亡和病态发展联系(Desplats等人,2009)。
PD和DLB的诊断
需要改进的诊断工具和方法,从而识别具有α-突触核蛋白病理的神经退化性疾病的风险。现今,在对脑的真实的伤害已经发生之前,没有生物化学的方法能帮助临床医生诊断在疾病的早期阶段中的病人的临床症状。
精确的诊断分析变得比新治疗的可能性出现更加重要。截至今天,只有症状治疗(通过取代脑中活性的多巴胺的损失)对PD病人可用。对于DLB,甚至更少的治疗选择是可用的。然而,临床医生经常地评价对于AD的标准治疗对DLB病人的可能的有益的影响,例如,胆碱酯酶抑制剂。在任一方法中,对于α-共核蛋白病的现有的治疗策略没有一个可针对潜在的疾病过程。另外,也需要监测疾病发展和治疗效果。对于改变帕金森氏症的发展的不同的方法的评价,参见George等人,2009。
考虑到上述提及的参与几种神经退化性疾病中的α-突触核蛋白,需要能消除或减少有毒的α-突触核蛋白种类的影响的新的治疗,并需要好的生物标志物,以监测新的干涉并提供好的预测特异性。
技术实现要素:
本发明涉及具有对人类α-突触核蛋白原细纤维高的亲和力和α-突触核蛋白单体的低的结合的改进的抗体和它的片段。本发明也涉及包含这样的抗体或片段的组合物和涉及利用这样的抗体或片段检测α-突触核蛋白原细纤维的方法。在进一步地实施例中,本发明涉及通过给予这样的抗体或片段预防、推迟具有α-突触核蛋白病理的神经退化性疾病的发作或治疗所述疾病的方法,并涉及制备在具有α-突触核蛋白病理的神经退化性疾病的治疗的药物组合物中使用的这样的抗体或片段。本发明也涉及在具有α-突触核蛋白病理的神经退化性疾病的发展的诊断或监测中这样的抗体或片段的应用,并涉及通过这样的抗体或片段的给予减少或抑制α-突触核蛋白聚集的方法。
在一个实施例中,抗体或其片段具有对人类α-突触核蛋白原细纤维高的亲和力和α-突触核蛋白单体的低的结合,和具有三个可变的重链(VH)CDR序列(VH-CDR-1、VH-CDR-2、和VH-CDR-3和三个可变的轻链(VL)CDR系列(VL-CDR-1、VL-CDR-2、和VL-CDR-3),其中抗体或其片段的六个CDR序列选自下列各组:
VH-CDR-1 SEQ ID NOS:22,23,24,25,26或者27
VH-CDR-2 SEQ ID NOS:28,29,30,31,32,33或者34
VH-CDR-3 SEQ ID NOS:35,36,37,38,39或者40
VL-CDR-1 SEQ ID NOS:41,42,43,44,45或者46
VL-CDR-2 SEQ ID NOS:47,48或者49
VL-CDR-3 SEQ ID NOS:50,51,52,53,54或者55
在另一个实施例中,抗体或其片段具有对人类α-突触核蛋白原细纤维高的亲和力和α-突触核蛋白单体的低的结合,和具有三个可变的重链(VH)CDR序列(VH-CDR-1、VH-CDR-2、和VH-CDR-3和三个可变的轻链(VL)CDR系列(VL-CDR-1、VL-CDR-2、和VL-CDR-3),其中抗体或其片段的六个CDR序列选自下列各组,和与任何一个各自组的所述序列具有大于70、80、90、95或98%的相似性的序列:
VH-CDR-1 SEQ ID NOS:22,23,24,25,26或者27
VH-CDR-2 SEQ ID NOS:28,29,30,31,32,33或者34
VH-CDR-3 SEQ ID NOS:35,36,37,38,39或者40
VL-CDR-1 SEQ ID NOS:41,42,43,44,45或者46
VL-CDR-2 SEQ ID NOS:47,48或者49
VL-CDR-3 SEQ ID NOS:50,51,52,53,54或者55
其中抗体或其片段结合到模型系统中的固定的线性α-突触核蛋白的氨基酸区域113-140内的表位上,例如,113-131,具体地,表位125-131、121-124、121-127、121-131、113-123或136-140上,其中所述模型系统中的固定的线性α-突触核蛋白包含具有11个氨基酸重叠的15-merα-突触核蛋白肽。
根据本发明的抗体、片段、组合物和方法在具有和/或在发展这样的疾病的风险上的个体中,在诊断、监测、预防、推迟具有α-突触核蛋白病理的神经退化性疾病的发作和/或治疗中提供改进。
通过具体的说明,本发明的各种实施方式的另外的方面、实施例和优势将更加明显。
附图说明
通过附图,将更加充分地理解具体实施方式,其中:
图1显示如通过竞争性ELISA测定的原细纤维特异性单克隆抗体的性能。如实例4中描述的利用HNE-固定(stabilized)的α-突触核蛋白原细纤维进行试验。
图2A和图2B显示通过如实例4中描述的竞争性ELISA分析原细纤维特异性抗体mAb49/G的性能。图2A显示原细纤维特异性单克隆抗体mAb49/G以高亲和力结合到通过HNE或ONE固定的人类α-突触核蛋白原细纤维上。图2B显示单克隆抗体也以高亲和力结合到α-突触核蛋白的人类突变的形式的HNE-固定的原细纤维上,A30P和A53T。
图3A-图3C显示通过如实例4中描述的竞争性ELISA分析的原细纤维特异性抗体的性能。原细纤维特异性单克隆抗体以高亲和力结合到通过HNE(PF-HNE)或ONE(PF-ONE)固定的野生型人类α-突触核蛋白原细纤维上。单克隆抗体也以高亲和力结合到α-突触核蛋白的人类突变的形式的HNE-固定的原细纤维上,A30P(A30P-HNE)和A53T(A30P-HNE)。
图4A和图4B涉及通过如实例5中描述的三明治式ELISA(夹心ELISA,sandwich ELISA),α-突触核蛋白原细纤维的量化。图4A显示用作捕获抗体和检测抗体两种作用的原细纤维特异性抗体mAb49/G的示意图。图4B显示利用HNE-固定的α-突触核蛋白原细纤维产生的标准的曲线。试验性能达到LOQ=9pM的量化的限制。
图5A和图5B显示利用如实例6中描述的α-突触核蛋白原细纤维特异性三明治式ELISA,患病的(DLB)和对照的人类脑提取物的分析的结果。
图6显示如实例7中描述的对照组小鼠(ntg,非转基因的)和来自Khale转基因的(tg)小鼠PD模型的5月大的小鼠的脑提取物的分析。利用tris缓冲盐(TBS)和含有Triton的TBS提取脑组织。利用如实例5中描述的α-突触核蛋白原细纤维三明治式ELISA进行分析。原细纤维特异性抗体mAb49/G用作捕获抗体和检测抗体。在图表中,y轴代表在OD450上的吸光率。
图7A-图7F显示如实例8中描述的组织的免疫组织化学(IHC)分析。图7A显示路易体的38E2/7结合,且PD黑质中的神经突和阳性α-α-突触核蛋白对照。图7B显示路易体的38E2/7结合和在DLB皮质和黑质中的神经突以及阳性α-α-突触核蛋白对照。图7C显示多种抗体结合路易体和在DLB皮质和黑质中的神经突和阴性对照。图7D显示多种抗体结合路易体和在PD黑质中的神经突和阴性对照。图7E显示在非疾病相关的黑质中38E2/7没有结合且阳性α-α-突触核蛋白对照。图7F显示38E2/7结合和在阿尔茨海默氏症病人的皮质中的阳性α-Aβ对照的比较。
图8A和图8B显示利用如实例9中描述的脑提取方案,提取的具有原细纤维选择性的单克隆抗体38E2/7的人类脑提取物的免疫沉淀反应。
图9A和图9B显示利用如实例10中描述的装备FITC落射荧光(epifluorescence)滤光器的Axiovert 200显微镜测量的荧光数据。图9A显示处理过的细胞,而图9B显示与抗体未处理的α-突触核蛋白过表达的细胞相比较,将其设定为100%,以在荧光强度中相对%减少计算的数据。
考虑到下面列出的实施例,将更充分地理解各个图。
具体实施方式
在第一个实施例中,本发明涉及具有对人类α-突触核蛋白原细纤维高亲和力和α-突触核蛋白单体的低的结合的改进的抗体和它的片段。在具体的实施例中,抗体是一类IgG抗体或它的变体。在本公开内,对人类α-突触核蛋白原细纤维的高的亲和力意味着,抗体或片段对人类α-突触核蛋白原细纤维表现小于10-7M的分离常数Kd。如本领域已知的,原细纤维是α-突触核蛋白的可溶解的寡聚物。典型的原细纤维具有的分子量范围从大约1000到大约5000kDa,以球状蛋白为参考,利用尺寸排阻色谱适当地测量,但是本发明不限于这样的典型的原细纤维。另外,在本公开内,α-突触核蛋白单体的低的结合意味着,根据本发明的抗体或片段对α-突触核蛋白单体的结合至少小于对α-突触核蛋白原细纤维的结合的100倍。在具体的实施例中,根据竞争性ELISA,例如,如实例4中描述的,测量这些结合亲和力。
本发明进一步涉及在预防、推迟具有α-突触核蛋白病理的神经退化性疾病的发作、所述疾病的治疗、监测和/或诊断中用于改进的这样的抗体和片段的方法和应用,所述疾病包括,但不限于,帕金森氏疾病(PD)、路易体痴呆(DLB)、阿尔茨海默氏症的路易体变体(the Lewy body variant of Alzheimer’s disease)、多发性系统萎缩症、精神病、精神分裂症和克雅二氏病(Creutzfeldt-Jakob disease)。在α-共核蛋白病中,作为路易体和路易神经突的聚集的α-突触核蛋白在脑中,在某些指征中,也在其他器官中积聚。
已经通过经典的杂交瘤细胞技术揭露了根据本发明的抗体的实例。抗体可以是多克隆抗体或单克隆抗体。在具体的实施例中,抗体是单克隆抗体。在很多场合中本公开涉及抗体和它的片段时,为了方便的目的,在本公开中的术语“抗体”包括它的片段,意味着它的活性片段,例如,片段具有根据本发明的抗体定义的相同的特征,即对α-突触核蛋白寡聚体/原细纤维具有高亲和力和α-突触核蛋白单体低的结合。在病理形式的α-突触核蛋白的清除中,抗体和它的片段表现出高效率。
发明的抗体结合聚集的形式,具体地是原细纤维,包括未修饰的或结合的α-突触核蛋白,例如,结合到4-羟基-2-壬烯醛(HNE)或4-氧-壬烯醛(4-oxo-2-nonenal)(ONE)、或其他α,β-不饱和的羟基烯烃、或多-不饱和脂肪酸,这种结合固定致病的原细纤维/寡聚α-突触核蛋白表位。所述表位在构象改变的或修饰的α-突触核蛋白上出现,例如,在患有α-共核蛋白病的病人的脑中出现的α-突触核蛋白原细纤维和寡聚体,如,但不限于,帕金森氏症、DLB,等等。发明的抗体也结合到通过α-突触核蛋白突变种形成的致病的原细纤维/寡聚结构上,例如,已经描述了引起家族PD的A30P和A53T(Kruger等人,1998)(Polymeropoulos等人,1997)。本发明的抗体的这种靶目标的另一个实例是通过引起PD或DLB的突变种α-突触核蛋白E46K形成的原细纤维。
在本发明的一个具体的实施例中,提供用于区分、诊断、识别与α-突触核蛋白病理有关的疾病的发展的风险、和/或治疗所述疾病的单克隆抗体,包括,但不限于,例如,帕金森氏症、路易体痴呆、阿尔茨海默氏病的路易体变体、阿尔茨海默氏病、唐氏综合征、多发性系统萎缩症、精神错乱、精神分裂症、克雅二氏病(Creutzfeldt-Jakob disease)和其他神经退化性疾病。
本发明的抗体或片段包括在抗体的可变的轻链(VL)和可变的重链(VH)链上的CDR1-3区域限定的氨基酸序列,其中所述抗体对含有“PD和/或DLB疾病的表位”的可溶解的α-突触核蛋白原细纤维具有高的亲和力。在具体的实施例中,CDR区域与Fc区域的变型结合,以便调节效应器功能,如,但不限于,Fc受体结合(Fc receptor binding)、补体因子C1q结合(complement factor Clq binding)、有效的半衰期(effecting half-life)、补体的激活(complement activation)和炎症过程。抗体的恒定区具有许多重要的功能,显著地结合Fc-受体和补体因子C1q。能阻止后面的功能激活,以便避免炎症反应。
如与其他已知的免疫治疗的治疗药比较,具有对α-突触核蛋白原细纤维高的亲和力和对α-突触核蛋白单体低的结合的本发明的抗体和片段具有下列独特的优势:
1)本发明的抗体和片段例如,通过抑制寡聚化(参见实例10)或通过其他机制,靶向和灭活或至少减少疾病引起的α-突触核蛋白原细纤维。
2)通过本发明的抗体和片段表现的对α-突触核蛋白原细纤维的高的亲和力减少治疗需要的有效的临床剂量。
3)与活性的免疫方法例如疫苗比较,本发明的抗体和片段提供在老年病人中精确剂量的模式。
4)在边缘区/全身中对α-突触核蛋白单体的低的结合,因此允许更多的抗体/片段可用于脑中α-突触核蛋白寡聚形式的结合和清除。
5)抗体和片段通过对补体因子C1q低的或没有的结合减少炎症副作用的风险,例如,脑膜脑炎(meningioencephalitis)。
本发明的一个方面是CDR区域的抗体氨基酸序列的发现,其中所述CDR区域对于人类野生型和突变体α-突触核蛋白原细纤维的结合扮演重要的作用。通过对野生型人类α-突触核蛋白寡聚体/原细纤维的高的亲和力表征具有根据本发明的结合位点(CDR区域)的抗体,以便用作治疗或诊断。
免疫球蛋白(IgG)分子的基础结构包括通过二硫桥连接在一起的两个同样的轻链和两个同样的重链。轻链,其是λ或κ,具有每一个大约110个氨基酸残基的可变区域(VL)和恒定区域(CL)。重链具有大约110个氨基酸残基的可变区域(VH),但是具有300-400个氨基酸残基的更大的恒定区域(CH),包括CHγ1、CHγ2和CHγ3区域或结构域。
恒定区(Fc)激活补体系统并结合到巨噬细胞、小神经胶质细胞和嗜中性细胞上的Fc受体上,其吸收和破坏感染的微生物或外源的/非自身的抗原。这种功能是重要的,因为它是抗体的治疗原则的部分,例如,Fc受体介导小神经胶质细胞的吞噬作用和α-突触核蛋白原细纤维的清除。已经证明了通过溶酶体降解途径调节的α-突触核蛋白寡聚体的清除(Lee等人,2004)。这个过程涉及,在其中降解α-突触核蛋白原细纤维的溶酶体的融合之后,受体依赖的或非受体依赖的抗体/原细纤维复合物的内吞作用(Masliah等人,2005)。已经表明了控制这个过程的受体包括Thy1.1受体和与脂蛋白受体有关的蛋白质(LPR)。
也可能操作其他的抗α-突触核蛋白的清除机制。可溶解的α-突触核蛋白原细纤维的清除是根据本发明的治疗的重要的机制,认为α-突触核蛋白原细纤维是高度地毒害神经的,启动和加快了疾病过程。脑中α-突触核蛋白原细纤维的清除是重要的临床评价的机制。除了α-突触核蛋白原细纤维的清除之外,将通过α-突触核蛋白原细纤维如,α-突触核蛋白原细纤维、二聚体、三聚体、四聚体和更高的寡聚形式的前体形式的清除间接地简化包括α-突触核蛋白原纤维的其他α-突触核蛋白聚集的形式。包括原细纤维和原纤维的不同的α-突触核蛋白形式保持平衡状态。利用高的亲和力的原细纤维结合抗体的治疗并通过所述抗体对α-突触核蛋白原细纤维的清除也具有间接地简化其他α-突触核蛋白聚集的或寡聚的形式的优势。还有另一个抗体的作用机制是通过结合到毒性的α-突触核蛋白种类和阻止它们的与神经细胞的相互作用阻断或抑制α-突触核蛋白的毒性。
重链和轻链的各自的可变区含有称作互补决定区或CDR的三个高变区(hyper variable regions)。CDR区域是位于VL和VH区域中的,大约7-23个,例如,13-23个氨基酸的短的延伸。抗体的一个“臂”上的六个CDR区域形成结合抗原的“口袋”。在文献中使用CDR-序列的几个定义。SEQ ID NOS:1-21利用第一识别系统定义发明的CDR-序列,因而在表格1中(参见实例2)通过下划线区域在人类野生型和突变体α-突触核蛋白原细纤维特异性单克隆抗体中的VL和VH中显示识别的CDR序列。SEQ ID NOS:22-55利用已知的Kabat系统识别发明的CDR-序列,因而在表格2中(参见实例2)通过下划线区域在人类野生型和突变种α-突触核蛋白原细纤维特异性单克隆抗体中的VL和VH中显示识别的Kabat CDR序列。在本公开中使用根据Kabat(SEQ ID NOS:22-55)发明的CDR-序列的识别。
因而,一个实施例中,通过具有六个CDR序列(VH-CDR-1、VH-CDR-2、VH-CDR-3、VL-CDR-1、VL-CDR-2、和VL-CDR-3)表征根据本发明的抗体,其中所述CDR序列选自以任意组合的方式的CDR序列的每个下列各自组。
VH CDR-1
VH CDR-2
VH CDR-3
VL CDR-1
VL CDR-2
KVSNRFS SEQ ID NO:17(SEQ ID NO:47)
RTSNLAS SEQ ID NO:18(SEQ ID NO:48)
WASTRES SEQ ID NO:49
VL CDR-3
排除了为了某些感兴趣的特征最初选择的一个抗体,因为它不能满足根据本发明的标准的定义的抗体。这种排除的重要的参数是具有由这种抗体暴露的五个氨基酸的相当短的VH CDR-3序列。因此,推断,VH CDR-3序列需要超过5个氨基酸。在具体的实施例中,VH CDR-3序列是9、10、11或12个氨基酸。
在具体的实施例中,根据本发明的抗体和片段具有选自下列组合的六个CDR序列:
SEQ ID NOS:22,28,35,41,47和50,
SEQ ID NOS:23,29,36,42,47和50,
SEQ ID NOS:24,30,37,43,48和51,
SEQ ID NOS:25,31,38,44,47和52,
SEQ ID NOS:26,32,39,45,47和53,
SEQ ID NOS:23,33,37,43,48和54,和
SEQ ID NOS:27,34,40,46,49和55。
在另外的具体的实施例中,在满足此处定义的其他重要的特征时,提供关于α-突触核蛋白原细纤维的期望的特异性的抗体具有选自下列下列各组的抗体或片段的六个CDR序列:
VH CDR-1 SEQ ID NOS:23,24,25或者26
VH CDR-2 SEQ ID NOS:29,30,31或者32
VH CDR-3 SEQ ID NO:36
VL CDR-1 SEQ ID NOS:42,43,44或者45
VL CDR-2 SEQ ID NOS:47或者48
VL CDR-3 SEQ ID NOS:50,51,52或者53
或选自下列各组:
VH CDR-1 SEQ ID NOS:23,24,25或者26
VH CDR-2 SEQ ID NOS:29,30,31或者32
VH CDR-3 SEQ ID NO:37
VL CDR-1 SEQ ID NOS:42,43,44或者45
VL CDR-2 SEQ ID NOS:47或者48
VL CDR-3 SEQ ID NOS:50,51,52或者53
或选自下列各组:
VH CDR-1 SEQ ID NOS:23,24,25或者26
VH CDR-2 SEQ ID NOS:29,30,31或者32
VH CDR-3 SEQ ID NO:38
VL CDR-1 SEQ ID NOS:42,43,44或者45
VL CDR-2 SEQ ID NOS:47或者48
VL CDR-3 SEQ ID NOS:50,51,52或者53
或选自下列各组:
VH CDR-1 SEQ ID NOS:23,24,25或者26
VH CDR-2 SEQ ID NOS:29,30,31或者32
VH CDR-3 SEQ ID NO:39
VL CDR-1 SEQ ID NOS:42,43,44或者45
VL CDR-2 SEQ ID NOS:47或者48
VL CDR-3 SEQ ID NOS:50,51,52或者53。
如先前提到的,通过对靶目标的高的亲和力表征α-突触核蛋白原细纤维结合的根据本发明的抗体和片段。高亲和力,以分离常数Kd表示,小于10-7M。在另外的实施例中,对于人类α-突触核蛋白原细纤维的分离常数Kd小于10-8M、小于10-9M、小于10-10M、或甚至小于10-11M。与具有10-6M周围或更高的亲和力的抗体比较,这些抗体和片段具有它们能够以较低的剂量给予的优势。如这些能通过注射给予的高亲和力抗体,能皮下给予,因为为了达到功效只需要低量的抗体,这具有重要的临床优势。给予方式不限于皮下的或静脉注射。此外,功效需要较低的剂量将减少用于抗体生产的物质的成本。
除了抗体对α-突触核蛋白原细纤维的高的亲和力之外,抗体和片段对α-突触核蛋白单体表现低的结合,和可选地对α-突触核蛋白原纤维表现低的结合。如上述提到的,对α-突触核蛋白单体的低的结合意味着,根据本发明的抗体或片段对α-突触核蛋白单体的结合小于对α-突触核蛋白原细纤维的结合的至少100倍。在更具体的实施例中,根据本发明的抗体或片段对α-突触核蛋白原细纤维的结合超过对α-突触核蛋白单体的结合的500倍或甚至超过1000倍。
在另一个实施例中,抗体和片段对α-突触核蛋白原纤维表现低的结合。在更具体的实施例中,根据本发明的抗体或片段对α-突触核蛋白原细纤维的结合超过对α-突触核蛋白原纤维的结合的100倍、500倍、或甚至超过1000倍。
在本发明的还有的另一个实施例中,抗体和片段对β淀粉样(Aβ)原细纤维表现低的结合(例如,Kd>10-5M)且对β淀粉体单体表现低的结合(例如,Kd>10-5M)。
在本发明的还有的另一个实施例中,抗体和片段对β-突触核蛋白单体、γ-突触核蛋白单体、IAPP(胰岛淀粉样多肽(islet amyloid polypeptide))、和/或Medin多肽表现低的结合,例如,抗体和片段对一个或更多这些肽/蛋白质的结合至少小于对人类α-突触核蛋白原细纤维的结合的100倍。
根据本发明的另一个实施例,能通过在模型系统中对氨基酸(aa)区域113-140内的α-突触核蛋白中的线性表位的结合限定为根据本发明的抗体或片段,例如,aa区域113-131,具有aa 125-131、121-124、121-127、121-131、113-123和136-140作为特定的表位的实例。在这种模型系统中,使用具有11个氨基酸序列重叠的15-merα-突触核蛋白肽(参见下列实例3)。
根据本发明的另外的实施例,提供抗体或片段,所述抗体或片段具有对人类α-突触核蛋白原细纤维高的亲和力和α-突触核蛋白单体低的结合,且包含选自SEQ ID NO:22-27、28-34、35-40、41-46、47-49和50-52的每一个六个CDR序列组的一个CDR-序列的组合,且序列与每一个各自组中的所述序列的任何一个具有大于70、80、90、95或98%的相似性。抗体或片段结合到氨基酸(aa)区域113-140内的表位上,例如,aa区域113-131,和具体地模型系统中的固定的线性α-突触核蛋白的表位aa125-131、121-124、121-127、121-131、113-123或136-140,其中所述系统包含具有11个氨基酸重叠的15-merα-突触核蛋白。
根据本发明的另一个具体的实施例,高亲和力α-突触核蛋白原细纤维结合的抗体能减少或抑制α-突触核蛋白聚集,因此减少脑中可溶解的寡聚α-突触核蛋白形式的水平。
根据本发明的另一个具体的实施例,高亲和力α-突触核蛋白原细纤维结合的抗体也能结合CNS外面的α-突触核蛋白寡聚体/原细纤维,因此以这样的方式改变血脑屏障上的所述α-突触核蛋白形式的平衡,以便降低所述α-突触核蛋白形式的CNS水平(排除)。
根据本发明的另一个具体的实施例,抗体是IgG类型的抗体,适于能经过血脑屏障的治疗应用。可设计高亲和力α-突触核蛋白原细纤维结合的IgG抗体,以便减少结合到IgG1的CH2结构域上的补体因子C1q,并减少补体激活和炎症的风险。能以几种不同的方式完成这种修饰。一种方式是制造嵌合抗体,其中删除了IgG1恒定区的CHγ2结构域并换成IgG4的相应的结构域或赋予C1q结合的部分结构域。很确定,IgG4不结合C1q,因此不激活补体级联反应。为了完成这个,以这样的方式设计重链(CH)的恒定区,以使IgG1上的高亲和力Fc-受体结构域(CHγ3)与IgG4对补体因子C1q不具有结合的结构域(CHγ2)结合。含有嵌合的恒定的重链(IgG1:CHγ1、CHγ2:IgG4、CHγ3:IgG1)的这种新的抗体具有通过Fc-受体介导的吞噬作用使α-突触核蛋白原细纤维有效的清除的重要的性能并减少副作用的风险,例如炎症如脑膜脑炎的副作用的风险。
减少炎症的风险的还有的另一个方式是改变抗体的寡聚糖结构,其将减少补体因子C1q结合和补体激活作用。已经描述了人类IgG1中Asn-297上的合成的杂合的寡聚糖的三十个不同的结构。认为CH2关联的糖类的缺失引起抗体的“铰链”区中的构象的改变,减少与效应器分子的相互作用的功效和补体激活功能和C1q结合的损失。
高亲和力人类α-突触核蛋白原细纤维结合抗体通过Asn-297的位置定点突变成任意其他的氨基酸的修饰将产生具有较少的C1q结合的保留Fc-受体结合的抗体,因此减少炎症的风险,具体地是在血脑屏障上的炎症的风险。抗体上可替换地修饰糖基化是在其中已经抑制了N-乙酰葡糖胺(acteylglucosaminyl)转移酶的细胞类型中表达抗体。这将产生在Asn-297上具有改变的碳水化合物结构的抗体。形成Man5GlcNAc2的结构,但不限于这个结构。这种碳水化合物修饰将减少补体因子C1q结合和抑制炎症(Wright等人,1998)。可替换地,能通过在含有衣霉素的情况下培养表达抗体的细胞获得无糖基化的(aglycosylated)原细纤维结合抗体,其中所述衣霉素抑制糖基化。这些抗体已经改变了补体激活活性和改变Fc-受体功能(Leatherbarrow等人,1985)。具有低的补体激活和高的Fc-受体结合的表达抗体的克隆表达的筛选将产生原细纤维结合抗体,其表现α-突触核蛋白原细纤维的高的Fc-介导的清除和低的C1q结合。
在另一个实施例中,高亲和力人类α-突触核蛋白原细纤维结合抗体是IgG亚型,例如,IgG1或IgG4,其中以这样的方式已经修饰了补体因子C1q结合位点,例如,Pro331>Ser331(Xu等人,1994),以便减少或抑制补体因子C1q的结合。这样的抗体特别地适合于,例如,用于治疗、预防或推迟具有α-突触核蛋白病理的神经退化性疾病的发作,对患有这样的疾病或在发展这样的疾病的风险上的个体给予这样的抗体,例如,但不限于,患有或具有发展成PD的风险的个体。也能将人类IgG1中的位置331上的脯氨酸残基改变成苏氨酸或甘氨酸或任何其他极性氨基酸。能通过标准的分子生物学技术如定点突变或DNA缺失完成这种修饰。
本发明的还有的另一个方面是关于具体地测定人类或动物组织中的原细纤维水平的高亲和力人类α-突触核蛋白原细纤维结合抗体的应用,例如,脑脊髓液(CSF)、血、尿、唾液、脑组织中,作为诊断工具或生物标志用于,或用于监测,患有α-突触核蛋白病理的神经退化性疾病。帕金森氏症(PD)、路易体痴呆(DLB0、阿尔茨海默氏病的路易体变体、多发性系统萎缩症、精神错乱、精神分裂症、和克雅二氏症仅仅是患有α-突触核蛋白病理的这样的神经退化性疾病的例证。例如,如与不具有帕金森氏症或任何其他α-共核蛋白病的匹配的老年的对照组相比,PD病人的CSF或血中的人类α-突触核蛋白原细纤维的水平可能是不同的。与对照的受试者相比,发展帕金森氏症或任何其他α-共核蛋白病的人可能改变了CSF或血液中的α-突触核蛋白原细纤维的水平。因此,CSF或血液中α-突触核蛋白原细纤维水平的测定能提供所述疾病的早期诊断。对于以根据本发明的新的高亲和力的α-突触核蛋白原细纤维结合抗体完成所述测定是可能的,且,在具体的实施例中,可结合三明治氏ELISA方法完成所述测定(参见实例5),其中已经测定了降至9pM水平的α-突触核蛋白原细纤维。可以忽略其他α-突触核蛋白形式的干扰,具体地α-突触核蛋白单体,和可选地α-突触核蛋白原纤维和试验中的α-突触核蛋白片段的干扰。
利用抗-α-突触核蛋白原细纤维抗体分析这些组织和细胞培养基中的α-突触核蛋白原细纤维的适当的方法的实例包含免疫分析如ELSA、RIA、蛋白质印迹或斑点印迹(dot blotting)。这些方法适合于如通过临床试验中原细纤维减少测量和/或如诊断检验的下列治疗功效。因为CSF和血中的α-突触核蛋白原细纤维水平是非常低的,本发明的高亲和力α-突触核蛋白原细纤维结合抗体用于诊断检验是有利的,例如,基于ELISA方法的诊断检验,以允许低水平的α-突触核蛋白原细纤维的测量。
根据这样的方法,将根据本发明的抗体或片段加入到包含或怀疑包含α-突触核蛋白原细纤维的生物样品上,且检测在α-突触核蛋白原细纤维和抗体或片段之间形成的复合物(complex)的存在。可定性地检测复合物,例如,检测复合物的存在,或定性地,例如,如期望的,可检测复合物的浓度或复合物的阈值浓度。
在另外的实施例中,本发明包括在用于人类和动物组织中的α-突触核蛋白原细纤维的检测、定位和定量的成像中高亲和力原细纤维特异性抗体和片段的应用。可利用可检测的标签标记抗体或片段,例如,放射性的配体如I131、C14、H3或镓68,但不限于这些放射性同位元素,且与样品接触或为了检测目的给予。这样的方法适于用作具有α-突触核蛋白病理的神经退化性疾病的诊断工具,所述疾病包括,但不限于,帕金森氏症、路易体痴呆和其他α-突触核蛋白有关的神经退化性疾病。在具体的实施例中,这样的方法可指导监测没有或在药物治疗或其他可能的治疗下的受试者中的α-突触核蛋白有关的疾病的发展。
因此,在本发明的一个方面中,将抗体加入到包含或怀疑包含α-突触核蛋白原细纤维的生物样品中,测量所述原细纤维和所述抗体之间形成的复合物的浓度,用于样品中原细纤维的检测和/或定量化。在具体的实施例中,检测方法包含免疫分析和邻位连接技术(proximity ligation assay)。生物样品可以是从受试者获得的体外样品和体内液体。
本发明的还有的另一个方面是制造在兽医中应用的特定的抗体种类。列出的诊断方法也适合于兽医应用。
本发明的另一个方面是所述抗体的人源化,以便避免副作用,例如,以避免当用作治疗或诊断试剂时对抗人类中的抗体的免疫响应。这样的人源化技术在本领域的一个普通技术人员的能力内。
根据本发明的药物组合物包含此处描述的抗体或片段,和药物学上可接受的载体。在治疗应用的具体的实施例中,组合物是生理学上可接受的配制剂,其包含在适于人类和/或动物给予的生理学上的缓冲液中根据本发明的抗体或片段的治疗上的活性量,所述缓冲液例如,但不限于,PBS。为了更好的固定性,能冻干抗体或片段。冻干的配制剂可含有任何适当的传统的赋形剂,包括固定剂、冻干支持剂(lyoprotectants)、缓冲液等等,如,但不限于,甘露醇,用于在冻干和/或后来的存储期间和/或之后,保护和/或固定产品。
可选择地,抗体配制剂可含有抗菌试剂或其他防腐剂或不干扰原细纤维结合抗体或片段的功能或功效的添加剂。
实施例
下列实施例用于说明,并不应理解为限制本发明的这些具体的实施例。
实施例1
α-突触核蛋白原细纤维抗体
免疫/多克隆抗体
在免疫方案中,利用Balb/C小鼠。如抗原,使用HNE固定的α-突触核蛋白原细纤维。如上面描述的生产这些,除了使用HNE和α-突触核蛋白之间60:1的比率(WO 2009/133521,包括在此以供参考)。对于免疫,用HNE固定的α-突触核蛋白原细纤维和佐剂(例如,3-6倍)注射小鼠。在处死小鼠之前,进行含有HNE-修饰的α-突触核蛋白原细纤维的一个加强注射(booster injection)。分析对α-突触核蛋白原细纤维和α-突触核蛋白单体反应性的免疫的小鼠的血液。通过直接的ELISA分析多克隆抗体响应的特异性。在典型的实验中,利用单体的α-突触核蛋白(未修饰的或利用HNE或其他醛修饰的)、原细纤维/寡聚α-突触核蛋白(未修饰的或利用HNE或其他醛修饰的)或纤维状的α-突触核蛋白,以400ng/孔的最终浓度包被在平底高度结合的96-孔聚苯乙烯微滴定板上。利用2%BSA封闭所述板,利用0.05%Tween-20/PBS洗涤板,并将来自研究的多克隆抗体的细胞培养基上清液(未稀释的或利用磷酸盐缓冲的盐1:1稀释的)作为初级抗体加入到孔中。将1/1000的稀释的碱性的磷酸酶-结合的山羊-抗鼠鼠IgG/IgM抗体(Pierce Biotechnology,Rockford,IL,USA)用作第二抗体。利用p-硝基苯磷酸盐(p-nitrophenyl-phosphate)(Sigma-Aldrich,MO,USA)可视化显示免疫反应性。
在血清中,检测特异性地识别α-突触核蛋白原细纤维/寡聚体的抗体。另外,能发现识别α-突触核蛋白单体的抗体。阴性对照代表未免疫的小鼠。
杂交瘤细胞/单克隆抗体
鼠B-细胞杂交瘤细胞用于生产单克隆α-突触核蛋白原细纤维结合抗体。分离脾细胞且将其放置在消过毒的磷酸盐-缓冲的盐(PBS)中,以及在1200×g上离心10min,以便收集细胞富集的颗粒状物。进一步利用PBS洗涤细胞,且在1200×g上离心10min。在以1%抗生素补充的达尔伯克氏改良伊格尔培养基(DMEM,Invitrogen,La Jolla,CA,USA)中重悬细胞颗粒状物。在DMEM中将脾细胞与Sp2/0细胞(鼠骨髓瘤细胞系)以1:1比率混合。为了促进细胞融合,将1ml聚乙二醇(Sigma-Aldrich,St.Louis,MO,USA)加入到细胞混合物中,且添加DMEM终止反应。收集细胞,且在以10%(v/v)胎牛血清(Cambrex,Charles City,IA,USA)补充的和也含有1%(v/v)丙酮酸钠(Cambrex,Charles City,IA,USA)、1%(v/v)抗生素(Sigma-Aldrich,St.Louis,MO,USA)和1%(v/v)L-谷氨酸(Cambrex,Charles City,IA,USA)、5%(v/v)BM条件介质(BM condition media)(Roche Diagnostics Scandinavia,Bromma,Sweden)和2%(v/v)HAT介质补充物(Sigma-Aldrich,St.Louis,MO,USA)的DMEM中重悬颗粒状物。将细胞平铺在96孔细胞培养板上,且允许保留并生长2周。
在直接的ELISA中分析杂交瘤细胞细胞上清液。在典型的实验中,利用单体的α-突触核蛋白(未修饰的或利用HNE或其他醛修饰的)、寡聚/原细纤维α-突触核蛋白(未修饰的或利用HNE或其他醛修饰的)或纤维状的α-突触核蛋白包被在平底高度结合96-孔聚苯乙烯微滴定板上。利用1%BSA封闭所述板,利用PBS-Tween 20(0.05%)洗涤板,并将来自研究的杂交瘤细胞的细胞培养基上清液(未稀释的或利用PBS-Tween 20(0.05%)1:2或1:5稀释的)作为初级抗体加入到孔中。将1/5000稀释的辣根过氧化物酶-结合的HRP-连接结合的山羊抗鼠Ig(Southern Biotechnology,prod.No.1010-05)用作第二抗体。利用K-蓝色水性TMB基底液(K-Blue Aqueous TMB substrate)(Neogen Corp.prod.No.331177)可视化显示免疫反应性。
实施例2
α-突触核蛋白原细纤维特异性单克隆抗体重链(VH)和轻链(VL/Vkappa)的可变区的氨基酸序列
通过mRNA模板的RT PCR,随后通过DNA测序测定抗体的重链(VH)和轻链(VL)的可变区的氨基酸序列,包括抗体的CDR区域的氨基酸序列。在表格1中显示选择性的抗体的可变重链区域(VH)和可变轻链区域(VL)的氨基酸序列。在CDR区域1-3的位置下划线并显示。CDR区域的氨基酸序列形成结合人类野生型和组成α-突触核蛋白的“致病的表位”的突变的α-突触核蛋白原细纤维的结构基础。
在表格1中显示根据本发明的原细纤维特异性抗体的各自的VL和VH链的CDR区域1-3的氨基酸序列。在表格2中,包括根据本发明的一系列另外的抗体的CDR-序列。
VH和VL链的CDR1-3区域的组合的氨基酸序列形成以高亲和力和特异性结合人类α-突触核蛋白野生型原细纤维的分子“口袋”。这种“口袋”形成“PD/DLB表位”的结构基础。在VH链和VL链两种链中都观察到CDR氨基酸序列长度中的变化,且所述变化与对人类α-突触核蛋白原细纤维的结合一致。较短的CDR区域提供更加有限的三维结构的抗体结合口袋,然而较长的CDR区域更灵活。
如在表格1和2中示出的CDR序列是本发明的实施例,因为它们是VH和VL链的“鼠框架”区域中的氨基酸序列,例如,CDR区域外面的,和原细纤维特异性抗体的人类VL和VH框架区域,但不限于那些。
与在表格1和2中示出的相比较,CDR区域中的其他氨基酸置换与高亲和力和高特异性结合人类α-突触核蛋白原细纤维相同。其中极性氨基酸在能通过一个极性氨基酸置换的具体的氨基酸的CDR区域中的具体的位置中出现,对α-突触核蛋白原细纤维具有保留的或改进的高亲和力和特异性结合。同样地,如果非极性或负或正带电荷的氨基酸在某些位置中出现,能通过来自相同的极性组的相似的氨基酸置换某些位置上的氨基酸。
如通过功能等效物在CDR区域中的任何位置中交换具体的氨基酸,其中功能的等效物赋予关于α-突触核蛋白原细纤维亲和力的抗体充分地相同的功能和结构,这样的构造当然在本发明的范畴内。在这点上,与一个先前指示的各自组的VH CDR和VL CDR序列具有大于70、80、90、95或98%的相似性的抗体和片段,具有在本文中描述的维持的表位结合,都在本发明的范畴内。
表格1.来自人类野生型和突变α-突触核蛋白原细纤维特异性的四个不同单克隆抗体的重链(VH)和轻链(VL/Vκ)的可变区的氨基酸序列。在VL和VH中的各种CDR区域(1-3)的位置有下划线。抗体BA1-BA4是根据本发明的高亲和力原细纤维特异性抗体的实例。
表格2.来自人类野生型和突变α-突触核蛋白原细纤维特异性的八个不同抗体的重链和轻链的可变区的氨基酸序列。标记根据Kabat系统的各种CDR-区域的位置。抗体是根据本发明的高亲和力原细纤维特异性抗体的实例。重链分别是SEQ ID NO:64-71和轻链分别是SEQ ID NO:72-79。
重链
轻链
突出CDR1-3。
实施例3
α-突触核蛋白原细纤维特异性单克隆抗体的表位测定(Epitope mapping)
通过在Pepspots膜上的蛋白质印迹进行抗体的表位测定。通常通过JPT Peptide Technologies(Sigma Aldrich,UK的子公司)合成生成人类α-突触核蛋白的全部序列(氨基酸1-140)的合成的多肽,且固定在Pepspots膜上。以11个氨基酸序列重叠设计33合成的15-mer肽。所述肽通过C-末端共价地连接到Whatman 50纤维素膜上(Whatman,England),且由于对于降解的更高的稳定性通常乙酰化N-末端。未改变的N-ac较好的代表天然的抗原中的区域,然后使NH3+-集团带电荷。在表格3中列出结果。
表格3
人类α-突触核蛋白(SEQ ID NO:80)
可替换地,通过在Pepspots膜(Sigma Aldrich)上的蛋白质印迹进行抗体的表位测定,如下:习惯合成生成从氨基酸100到140的人类α-突触核蛋白的C-末端序列的合成的肽,且在Pepspots膜(Sigma Aldrich)上固定。以9个氨基酸重叠设计30合成的10-mer多肽。在表格4中显示结果。
表格4:
因此,表位的长度和精确位置依赖用于测定的方法。
实施例4
通过竞争性ELISA显示高亲和力人类α-突触核蛋白原细纤维结合的单克隆单体的特征
这个实施例显示四个抗体(mAb49/G、mAb38E2/7、mAb38Fl l/2_8和mAb48Bll/8)。如依靠下面描述的竞争性ELISA分析测量的,这些抗体对α-突触核蛋白原细纤维显示高的亲和力,且对α-突触核蛋白单体显示低的交叉反应性(结合)。简要地,允许要检验的抗-α-突触核蛋白抗体在溶液中与α-突触核蛋白单体或原细纤维相互作用,其后,将混合物加入到预包被有α-突触核蛋白原细纤维的微滴定板中。如果抗体结合到预孵育步骤中的抗原上,较少的抗体将结合到微滴定板上的固定的抗原上。通过碱性磷酸酶(APL)结合的第二抗体检测结合到固定的抗原上的抗体。利用产生黄色的ALP基质(pNPP)孵育结合物,所述黄色能在微滴定板读取器中在405nm上检测。因此,低OD值反应溶液中抗体对抗原的高亲和力。
具体地,以100μl/孔的在1×PBS中稀释的1μg/ml的α-突触核蛋白原细纤维包被在高度结合的ELISA微滴定板上,利用带粘性的密封层密封且在+4℃孵育过夜。然后,丢弃包被溶液,且通过添加200μl/孔的PBS-Tween 20(0.05%)封闭板的残余的结合能力。将密封板在室温下(R.T.)通过900rpm的摇动孵育60min。
同时,在1×PBS-Tween 20(0.05%)中,通过将α-突触核蛋白单体或原细纤维稀释成140nM的浓度制备多肽溶液。在圆底的、低蛋白结合的微滴定板中,在50μl的体积中进行α-突触核蛋白单体和原细纤维的10步的3×稀释系列。关于这种溶液,加入在PBS-Tween 20(0.05%)中稀释成100ng/ml的50μl的检验的抗体,且允许其在R.T.下通过在900rpm上摇动60min相互作用。随后,将这些预孵育的样品加入到洗涤过的(3×洗涤)包被的高结合的板上,且允许在R.T.下,而没有摇动的情况下孵育15min。然后洗涤ELISA板,以便清除未结合的抗体。利用在PBS-Tween20(0.05%)中以1/1000稀释的100μl ALP-连接结合的抗-鼠-IgG检测结合的抗体,且在R.T.下通过在900rpm上摇动孵育60min。
最终,洗涤ELISA板,以便清除未结合的抗体并将100μl ALP-基质加入到每孔中。在R.T.孵育期间将板保持黑暗,直到形成黄色。每隔15min到120min,在405nm的波长上在连续的模式上测量吸光值。如果时间和吸光率之间存在线性关系,测量结果可用于IC 50测定。
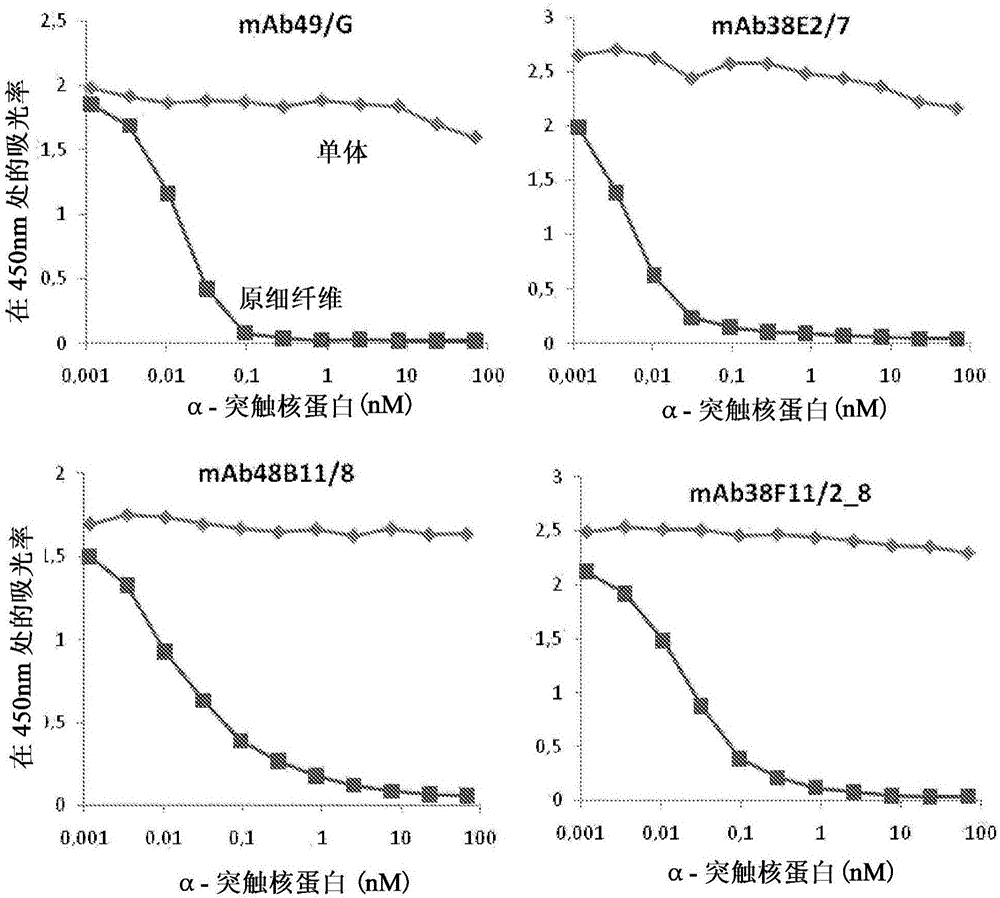
以需要达到ELISA中的一半的信号的单体或原细纤维的浓度计算IC50值。通过方法UV-SEC,利用作为参考的商业的α-突触核蛋白标准(cat.S-1001-1,rPeptide,USA,0.5mg作为利用BCA的检测)检测这种方法中使用的α-突触核蛋白单体或原细纤维的浓度。图1显示如通过描述的竞争性ELISA检测的四个原细纤维特异性单克隆抗体在450nm上的吸光率。利用HNE-固定的α-突触核蛋白原细纤维进行试验。
进一步的ELISA实验显示,候选的抗体对通过HNE或ONE固定的人类α-突触核蛋白原细纤维显现相同的亲和力。如依靠竞争性ELISA证明的,抗体也结合通过HNE固定的A30P或A53Tα-突触核蛋白突变种组成的α-突触核蛋白原细纤维/聚集体。
特异性地,图2A和2B显示通过竞争性ELISA分析的原细纤维特异性抗体mAb49/G的结果。原细纤维特异性单克隆抗体mAb49/G以高亲和力结合到通过HNE或ONE固定的人类α-突触核蛋白原细纤维上(图2A)。单克隆抗体也以高亲和力结合到α-突触核蛋白的人类突变的形式的HNE-固定的原细纤维,A30P和A53T上(图2B)。如通过尺寸排阻色谱定义的,利用ONE的α-突触核蛋白单体的聚集产生两个截然不同的复合物种群。分别地洗脱这两个截然不同的峰并标记为FP-ONE_大和FP-ONE_小。
另外,图3A-3C显示通过竞争性ELISA分析的另外的原细纤维特异性抗体38E2/7、38F11/2_8和48B11/8的结果。原细纤维特异性单克隆抗体以高亲和力结合到通过HNE(PF-HNE)或ONE(PF-ONE)固定的野生型人类α-突触核蛋白原细纤维上。单克隆抗体也以高亲和力结合到α-突触核蛋白的人类突变的形式的HNE-固定的原细纤维A30P(A30P-HNE)和A53T(A30P-HNE)上。
实施例5
α-突触核蛋白原细纤维特异性三明治氏ELISA的建立
为了能够测量生物样品中的α-突触核蛋白原细纤维,建立作为捕获抗体和检测抗体的具有mAb49/G的三明治式ELISA。这个试验测量具有量化LOQ=9pM的限制的α-突触核蛋白原细纤维(参见图4B)。由于关于在标准的曲线中使用的α-突触核蛋白原细纤维的大小的不确定,pM中的浓度基于一个α-突触核蛋白单体的分子量(14000g/mol)。因为通过尺寸排阻色谱,已经评价了至少1,000,000g/mol的原细纤维的分子量,如摩尔α-突触核蛋白原细纤维计算的检测的限制能低至0.13pM。
通过HNE固定的α-突触核蛋白原细纤维和单体的α-突触核蛋白用于验证ELISA的构造特异性。
由两个同一的抗体组成的ELISA需要蛋白质的至少二聚体,以便产生信号。然而,大量过量的单体的α-突触核蛋白,其可在生物样品中自然地出现,能通过占据捕获抗体包被的结合位点干扰α-突触核蛋白原细纤维结合,因此抑制原细纤维结合。通过将增加的过量的α-突触核蛋白单体加入到固定浓度的α-突触核蛋白原细纤维(500pM,表示成单体单元)中研究这种问题,且利用mAb49/G ELISA分析。如期望的,因为α-突触核蛋白单体很少结合到捕获抗体上,如与α-突触核蛋白原细纤维(500pM)比较,30000-倍摩尔过量的α-突触核蛋白单体(15μM)不扰乱利用mAb49/G三明治式ELISA的测量。
图4A显示通过三明治式ELISA关于α-突触核蛋白原细纤维量化的ELISA结合的示意图。图4B显示利用HNE-固定的α-突触核蛋白原细纤维产生的标准的曲线。试验性能达到量化LOQ=9pM的限制。
实施例6
利用α-突触核蛋白原细纤维特异性三明治式ELISA进行患病的和对照组人类脑提取物的分析
利用不同的洗剂进行脑提取方案,产生三个不同的提取物:TBS提取物(图5A,白色柱),包含细胞外和细胞质α-突触核蛋白种类;Triton提取物(图5A,条纹柱),包含膜-关联的α-突触核蛋白种类;和SDS提取物(图5B,黑色柱),包含SDS-可溶解的α-突触核蛋白种类。分析诊断的患有α-共核蛋白病路易体痴呆(DLB)的病人的脑提取物。分析皮质和黑质的脑组织。作为对照,也分析没有可检测的免疫组织化学的路易体病理的受试者的脑组织。三明治式ELISA基于作为捕获抗体和检测抗体的α-突触核蛋白原细纤维特异性mAb49/G。图5A和5B显示利用α-突触核蛋白原细纤维特异性三明治式ELISA,患病的和对照的人类脑组织提取物的分析的结果。试验允许在大于9pM的水平上的原细纤维的量化(量化限制;LOQ=9pM)。
实施例7
PD转基因的小鼠模型的脑提取物中的α-突触核蛋白原细纤维的测量
尽管迄今为止不存在关于生物样品中的α-突触核蛋白原细纤维的直接的分析方法,但已经表明了细胞和小鼠模型中的α-突触核蛋白原细纤维的存在。mAb49/G三明治式ELISA因此提供测量α-共核蛋白病的生物样品和小鼠模型中的α-突触核蛋白原细纤维的首次机会,所述α-共核蛋白病由聚集的α-突触核蛋白的积聚表征。
将过表达人类α-突触核蛋白A53T突变体的转基因的小鼠的脑提取物样品与来自野生型小鼠的样品比较。在TBS或TBS+tween中使脑组织均匀,且在分析之前离心,以便重新获得可溶解的α-突触核蛋白片段。非转基因的小鼠脑匀浆的TBS-可溶解的片段中的α-突触核蛋白原细纤维水平的测量与转基因的小鼠中的比较(Kahle模型)(图6)。为了确保这个试验中测量的所有的α-突触核蛋白原细纤维是在可溶解的状态中,在分析之前,将所有的样品在16000×g上离心5min。测量具有α-突触核蛋白病理的5个月大的转基因的小鼠的脑中的α-突触核蛋白原细纤维的水平。
图6显示对照组小鼠(ntg,非转基因的)和5个月大的Kahle转基因的(tg)小鼠PD模型的脑提取物的分析的结果,其中,y轴代表在OD450上的吸光率。
实施例8
人类脑组织的免疫组织化学(IHC)分析
如描述的,来自PD和DLB病人的皮质和黑质用于进行免疫组织化学(IHC)分析(Oinas等人,2010)。作为对照,使用来自年龄匹配的非患病的病人的皮质和黑质。α-突触核蛋白的阳性抗体对照是鼠抗-α-突触核蛋白mAb(BD 610787)。
如下评价Aβ噬菌斑的结合:处理来自AD病人的皮质的两个连续的载玻片,以便显示抗原,且利用阳性抗-AβmAb(mAbl58,BioArctic)或利用每一个候选的抗体孵育。通过连接到辣根过氧化酶(HRP)上的第二抗-种类特定的抗体检测结合的抗体。然后利用HRP基质DAB孵育结合物,产生有色的沉淀物,其可通过光显微镜方法检测。在利用候选的抗体处理的载玻片中的共分别的区域分析通过阳性对照中的有色的沉淀检测Aβ噬菌斑的区域。视觉上评价有色的沉淀的缺失,且解释为通过候选的抗体对于Aβ噬菌斑的结合的缺失。
图7A显示路易体的38E2/7结合和PD黑质中的神经突和阳性α-α-突触核蛋白对照。图7B显示路易体的38E2/7结合和DLB皮质和黑质中的神经突和阳性α-α-突触核蛋白对照。图7C显示各种抗体结合的路易体和DLB皮质和黑质中的神经突和阴性对照。图7D显示各种抗体结合的路易体和PD黑质中的神经突和阴性对照。图7E显示在非疾病有关的黑质中没有38E2/7的结合和阳性α-α-突触核蛋白对照。图7F显示阿尔茨海默氏症病人的皮质中的38E2/7结合和阳性α-Aβ对照的比较。
实施例9
利用免疫沉淀反应(IP)和蛋白质印迹进行人类脑提取物的分析
利用蛋白质印迹指导人类脑提取物和原细纤维结合的单克隆抗体38E2/7的免疫沉淀反应。利用四个不同的洗剂进行脑提取实验,产生四个不同的提取物:TBS提取物,包含细胞外和细胞质α-突触核蛋白种类;Triton提取物,包含膜-相关的α-突触核蛋白种类;和SDS提取物,包含SDS-可溶解的α-突触核蛋白种类和FA提取物,包含不可溶解的α-突触核蛋白。利用抗体38E2/7或对照抗体15P能连接到其上的磁性珠使这些提取物免疫反应。抗体15P能同样地结合到α-突触核蛋白原细纤维和单体上,且期望结合(pull down)出现的所有的种类。图8A显示DLB病人的黑质的SDS提取物,而图8B显示DLB病人的黑质的Triton提取物。如看到的,在图8A和8B中,mAb38E2/7只捕获来自DLB黑质的α-突触核蛋白原细纤维,两者都在Triton和SDS提取物中,然而mAb 15捕获所有提取物中的α-突触核蛋白单体。
实施例10
α-突触核蛋白寡聚化抑制的分析
这个实施例显示抗体mAb49/G利用以2个载体转染神经细胞的体外方法抑制α-突触核蛋白单体的寡聚化,两者都含有与GFP的N-末端或C-末端片段融合的α-突触核蛋白的一个拷贝(aa 1-140)。只有那些细胞中,α-突触核蛋白在其中寡聚,引起两个GFP片段连接在一起,将产生能利用荧光显微镜检测的绿色荧光。与没有抗体添加的对照组比较,能通过比较这些培养基中的荧光评价能抑制和/或破坏寡聚化的抗体的存在。
具体地,利用FuGENE6转染试剂(Roche Diagnostics,Basel,Switzerland)将含有利用GFP(aa1-155)的N-末端片段融合的α-突触核蛋白(aa1-140)或利用GFP(aa 156-238)的C-末端片段融合的α-突触核蛋白(aa 1-140)的等摩尔比率的DNA-构造,转染H4神经胶质瘤细胞。同时地,对照抗-α-突触核蛋白单克隆抗体(mAb5C2,Santa Cruz Bio)和mAb49/G以1μg/ml的终浓度细胞外地加入到细胞中。将细胞在37℃5%CO2中孵育24小时。在24小时之后,将细胞移动到30℃,以便GFP-荧光的完全的重组,且孵育另外的24小时的时间。利用装备FITC落射荧光滤光器的Axiovert 200显微镜测量荧光。如与将其设为100%的抗体未处理的α-突触核蛋白过表达的细胞相比较,相对%荧光强度计算所有的数据。
如图9A中看到的,利用mAb49/G处理在α-突触核蛋白寡聚化中显示显著的(*p<0.05)减少(与未处理的细胞比较在荧光强度中42%减少)。图9B显示与设为100%的未处理的α-突触核蛋白过表达的细胞相比较,百分比荧光强度的用图表表示的结果。
此处描述的特定的实例和实施例在本质上仅作为例证,并不意在限制由权利要求限定的本发明。考虑到这个说明书,进一步的实施例和实例及其优势对于本领域的一个技术人员来说是显而易见的,且它们都在所要求保护的发明的范畴内。
参考文献
Chartier-Harlin,MC,et al.2004.Alpha-synuclein locus duplication as a cause of familial Parkinson's disease.Lancet 1,364,1167-1169.
Conway,K.,et al.,2000.Acceleration of oligomerization,not fibrillization,is a shared property of both a-synuclein mutations linked to early-onset Parkinson's disease:Implications for pathogenesis and therapy.Proc Natl Acad Sci USA 97,571-576.
Crews,L.,et al.,2009.Role of synucleins in Alzheimer's disease.Neurotox Res.16,306-317.
Desplats,P.,et al.,2009.Inclusion formation and neuronal cell death through neuron-to-neuron transmission of alpha-synuclein.Proc Natl Acad Sci U S A.4,106,13010-13015.Erratum in:Proc Natl Acad Sci USA.2009,106,17606.Comment in:Proc Natl Acad Sci U S A.2009,106,12571-12572.
El-Agnaf,O.M.,et al.,2006.Detection of oligomeric forms of a-synuclein protein in human plasma as a potential biomarker for Parkinson's disease.Faseb J 20,419-425.
George,J.L.,et al.2009.Targeting the progression of Parkinson's disease.Curr Neuropharmacol.7,9-36.
Hansen,L,et al.,1990.The Lewy body variant of Alzheimer's disease.A clinical and pathologic entity.Neurology 40,1-8.
Klucken,J.,et al.,2006.Clinical and biochemical correlates of insoluble a-synuclein in dementia with Lewy bodies.Acta Neuropathol(Berl)111,101-108.
Kruger,R.,et al.,1998.Ala30Pro mutation in the gene encoding a-synuclein in Parkinson's disease.Nat Genet 18,106-108.
Leatherbarrow,R.J.,et al.1985.Effector functions of a monoclonal aglycosylated mouse IgG2a:binding and activation of complement component CI and interaction with human monocyte Fc receptor.Mol Immunol 22,407-415.
Lee,H-J.,et al.2004.Clearance of a-synuclein oligomeric intermediates via the lysosomal degradation pathway.Journal of Neuroscience 24,1888-1896.
LiJ.Y.,et al Li et al.2008.Lewy bodies in grafted neurons in subjects with Parkinson's disease suggest host-to-graft disease propagationNature Med.,14,501-503.
Masliah,E.,et al.2005.Effects of alpha-synuclein immunization in a mouse model of Parkinson's disease.Neuron.46,857-868.
Oinas,M.,et al.2010.alpha-Synuclein pathology in the spinal cord autonomic nuclei associates with alpha-synuclein pathology in the brain:a population-based Vantaa 85+study.Acta Neuropathol.119,715-722.
Polymeropoulos,M.H.,et al.,1997.Mutation in the oc-Synuclein Gene Identified inFamilies with Parkinson's Disease.Science 276,2045-2047.
Qin,Z.,et al.,2007.Effect of 4-hydroxy-2-nonenal modification on a-synuclein aggregation.J Biol Chem 282,5862-5870.
Singleton,AB.,et al.,2003.alpha-Synuclein locus triplication causes Parkinson's disease.Science 302:841.
Wrigth,A.,1998.Effect of C2-associated carbohydrate structure on Ig effector function:studies with chimeric mouse-human IgGl antibodies in glycosylation mutants of Chinese hamster ovary cells.J Immunol 160,3393-3402.
Xu,Y.,et al.1994.Residue at position 331 in the IgGl and IgG4 CH2 domains contributes to their differential ability to bind and activate complement.J Biol Chem.269,3469-3474.
Yoritaka,A.,et al.,1996.Immunohistochemical detection of 4-hydroxynonenal protein adducts in Parkinson disease.Proc Natl Acad Sci USA 93,2696-2701.
Zarranz,J.,et al.,2004.The new mutation,E46K,of a-synuclein causes Parkinson and Lewy body dementia.Ann Neurol.55,164-173。
- 还没有人留言评论。精彩留言会获得点赞!