一种检测禽蛋中胆固醇含量的酶比色法的制作方法
本发明涉及生化分析
技术领域:
,尤其涉及一种检测禽蛋中胆固醇含量的酶比色法。
背景技术:
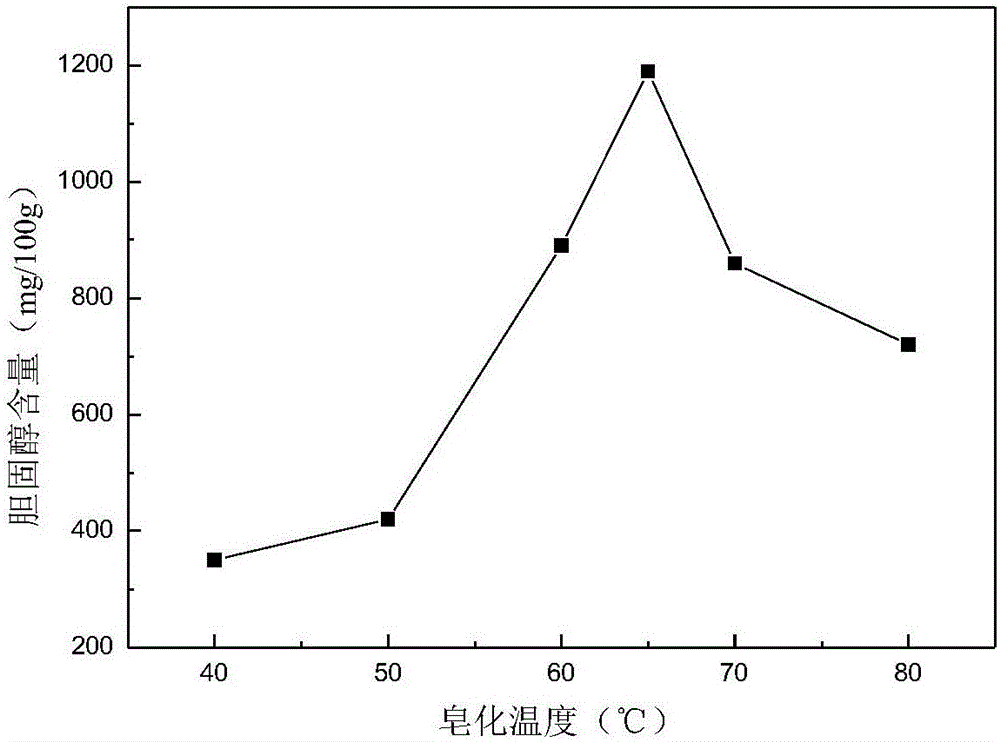
:胆固醇存在于动物的所有组织中,是细胞的组分,也是维生素和前列腺素的前体和血中脂类的转移因子,是动物体维持正常生理活动所必需的。然而,过多的摄入胆固醇可引起高血脂、血栓进而引发动脉粥样硬化等一系列心血管疾病。禽蛋是自然界中营养最为丰富的食品之一,但是蛋黄中的高胆固醇也引起人们的高度关注,鉴于胆固醇类组分对人体的影响,人们不断采取各种各样的手段来控制胆固醇摄入量。因而测定禽蛋中胆固醇含量即显得十分重要。目前胆固醇的测定方法主要有:化学比色法、色谱法等。化学比色法是测定胆固醇含量的传统方法,包括抽提法和直接测定法。该方法重现性良好,但比色比较耗时,即使连续操作也需要16个小时以上,一般当天不可能完成试验,所用化学试剂毒性大且比较昂贵,并且测定结果偏高;色谱法如:薄层层析法、气相色谱法和液相色谱法。这些方法都需要特殊设备,并且维持费用也很昂贵,普通实验室一般都难以承受,并且操作步骤复杂,对试剂和仪器的要求很高,因此难于推广使用;而酶测定法敏感、特异、快速,并能自动化分析。技术实现要素:本发明所要解决的技术问题是针对上述现有技术的不足,提供一种检测禽蛋中胆固醇含量的酶比色法。本发明解决上述技术问题的技术方案如下:一种检测禽蛋中胆固醇含量的酶比色法,包括如下步骤:步骤1:制备待分析试液;步骤2:绘制胆固醇溶液的吸光度随浓度变化的标准变化曲线;步骤3:在待分析试液中加入显色剂,进行显色反应,测量其吸光度;步骤4:根据待分析试液的吸光度与所述标准变化曲线计算待分析试液的胆固醇含量;其中,所述步骤1具体包括:步骤1.1:制备禽蛋样品,并对其进行皂化;步骤1.2:对皂化后的所述禽蛋样品进行萃取,得到萃取液;步骤1.3:将所述萃取液制备成待分析试液。本发明的有益效果是:本发明的检测禽蛋中胆固醇含量的酶比色法,可以准确的检测出禽蛋中的胆固醇含量水平,稳定性较好,可以适用于给禽蛋和蛋制品中胆固醇含量的检测,通用性较强,检测效率较高,耗时短,成本低,无需昂贵的检测设备即可准确完成检测,适合大面积推广。在上述技术方案的基础上,本发明还可以做如下改进:进一步:所述步骤1.1中,所述禽蛋样品为全蛋样品,所述全蛋样品的制备过程包括:选取禽蛋,去掉蛋壳,将蛋黄和蛋清充分混匀。进一步:所述步骤1.1中,所述禽蛋样品为蛋黄样品,所述蛋黄样品的制备过程包括:选取禽蛋,去掉蛋壳和蛋清,用滤纸吸干蛋黄表面的蛋清,再将蛋黄充分混匀。进一步:所述步骤1.1中,对所述禽蛋样品进行皂化的过程包括:取禽蛋样品1.00-2.00g,并加入皂化剂,在60-70℃的温水中水浴50-70min;其中,所述皂化剂由体积为5-15mL、浓度为600g/L的氢氧化钾溶液和体积为15-25mL的甲醇混合组成。进一步:所述步骤1.2中,将皂化后的所述禽蛋样品冷却至室温,加入15-25mL水,加入萃取剂萃取,得到萃取液。进一步:所述步骤1.2中,得到所述萃取液后,还向所述萃取液加入浓度为50g/L的氯化钠溶液3-4mL,再将所述萃取液水洗至酸碱中性。进一步:所述步骤1.3中,将所述萃取液转至鸡心瓶中,在45-55℃的温水中水浴旋转蒸干,用无水乙醇溶解定容至10mL,制得待分析试液。进一步:所述步骤2中,配置一系列已知浓度的胆固醇溶液,加入所述显色剂并进行显色反应,分别测量其吸光度,并绘制胆固醇溶液的吸光度随胆固醇浓度标准变化曲线。进一步:所述步骤2和步骤3中,所述显色剂包含80~100U/L胆固醇酯酶、40~60U/L胆固醇氧化酶、1000~1500U/L过氧化物酶、170.0-175mg胆酸钠、10.0-10.5mg4-氨基安替比林、30.0-35.0mg苯酚和280.0-320mg聚乙二醇辛基苯基醚的浓度为0.3mol/L的磷酸盐缓冲溶液,且所述显色反应的显色时间为10-20min,显色温度为35-40℃。进一步:所述步骤4中,根据待分析试液的吸光度在所述标准变化曲线上读取待分析液中胆固醇的浓度,并根据待分析液中胆固醇浓度计算待分析试液的胆固醇含量,具体公式为:其中,X表示待分析液中胆固醇含量,单位为mg/100g;C表示由标准曲线查得的待分析试液中胆固醇的浓度,单位为mg/mL;V表示待分析试液的体积,单位为mL;M表示待分析试液的质量,单位为g。附图说明图1为本发明中加入氢氧化钾浓度与胆固醇提取量的关系曲线示意图;图2为本发明中皂化温度与胆固醇提取量的关系曲线示意图;图3为本发明中皂化时间与胆固醇提取量的关系曲线示意图;图4为本发明中胆固醇溶液的吸光度随胆固醇浓度标准变化曲线示意图;图5为本发明中胆固醇溶液的吸光度随波长的变化曲线示意图。具体实施方式以下结合附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。一种检测禽蛋中胆固醇含量的酶比色法,包括如下步骤:步骤1:制备待分析试液;步骤2:绘制胆固醇溶液的吸光度随浓度变化的标准变化曲线;步骤3:在待分析试液中加入显色剂,进行显色反应,测量其吸光度;步骤4:根据待分析试液的吸光度与所述标准变化曲线计算待分析试液的胆固醇含量;其中,所述步骤1具体包括:步骤1.1:制备禽蛋样品,并对其进行皂化;步骤1.2:对皂化后的所述禽蛋样品进行萃取,得到萃取液;步骤1.3:将所述萃取液制备成待分析试液。本实施例中,所述步骤1.1中,所述禽蛋样品可以为全蛋样品,所述全蛋样品的制备过程包括:选取禽蛋,去掉蛋壳,将蛋黄和蛋清充分混匀。实际中可以选取2-3个禽蛋样品,如鸽蛋等小蛋可适当增加样品数量,去壳,将蛋黄和蛋白于匀浆机或粉碎机中充分混匀,装入清洁容器内,作为全蛋样品。本实施例中,所述步骤1.1中,所述禽蛋样品也可以为蛋黄样品,所述蛋黄样品的制备过程包括:选取禽蛋,去掉蛋壳和蛋清,用滤纸吸干蛋黄表面的蛋清,再将蛋黄充分混匀。实际中可以选取2-3个禽蛋样品,如鸽蛋等小蛋可适当增加禽蛋样品数量,去壳和蛋清,用滤纸吸干蛋黄表面的蛋清,将蛋黄于匀浆机或粉碎机中充分混匀,装入清洁容器内,作为蛋黄样品。所述步骤1.1中,对所述禽蛋样品进行皂化的过程包括:取禽蛋样品1.00-2.00g,并加入皂化剂,在60-70℃的温水中水浴50-70min;其中,所述皂化剂由体积为5-15mL、浓度为600g/L的氢氧化钾溶液和体积为15-25mL的甲醇混合组成。优选地,称取全蛋样品2.00g(精确到0.01g)或蛋黄试料1.00g(精确到0.01g)于50mL烧杯中,加入浓度为600g/L的氢氧化钾溶液10mL和甲醇20mL,摇匀,在65℃水浴1h。每隔20min~30min振摇一次使其皂化完全。本实施例中,选用鸡蛋黄作为皂化实验样品,在不同的氢氧化钾浓度(300g/L、400g/L、500g/L、600g/L、700g/L),不同的皂化温度(60℃、70℃、80℃、85℃、90℃、95℃)及不同的皂化时间(30min、40min、50min、60min、70min、80min)条件下,测定胆固醇的含量,得到胆固醇含量随氢氧化钾浓度的变化曲线,如图1、2和3所示。由图1氢氧化钾浓度与胆固醇含量的关系可知,胆固醇的提取量随着氢氧化钾浓度的增加而增大,但超过600g/L时反而下降,因此选择氢氧化钾浓度为600g/L。由图2皂化温度与胆固醇含量的关系可知,随着提取温度的提高,胆固醇提取量先增大后减小,在65℃时胆固醇提取量达到最大,说明皂化程度最完全。为了减少皂化温度引起的误差,本试验选择65℃为最佳皂化温度。由图3皂化时间与胆固醇含量的关系可知,胆固醇的提取量随着皂化时间的延长而增加,当皂化时间达到60min时胆固醇提取量达到最大,说明此时皂化已基本完成,超过60min后胆固醇的含量反而减少,因此选择60min为最佳皂化时间。所述步骤1.2中,将皂化后的所述禽蛋样品冷却至室温,加入15-25mL水,加入萃取剂萃取,得到萃取液。这里,所述萃取剂选用有机溶剂,比如正己烷、乙醚和石油醚等有机溶剂。优选地,所述萃取剂选用乙醚。在实际中,在皂化后的所述禽蛋样品冷却至室温后,向皂化后的所述禽蛋样品中先后分三次加入等量的萃取剂,并收集三次萃取后的萃取液,这样可以确保将皂化后的所述禽蛋样品中的胆固醇完全萃取出来,提高检测结果的精度。优选地,所述步骤1.2中,得到所述萃取液后,还向所述萃取液加入浓度为50g/L的氯化钠溶液3-4mL,再将所述萃取液水洗至酸碱中性。通过上述步骤加入氯化钠并水洗,可以去除萃取液中的氢氧化钾等碱性物质,使得所述萃取液成中性,这样避免对后续的检测结果产生影响。本实施例中,所述步骤1.3中,将所述萃取液转至鸡心瓶中,在45-55℃的温水中水浴旋转蒸干,再用无水乙醇溶解定容至10mL,制得待分析试液。优选地,水浴蒸发温度选取为50℃。本实施例中,所述步骤2中,配置一系列已知浓度的胆固醇溶液,加入所述显色剂并进行显色反应,分别测量其吸光度,并绘制胆固醇溶液的吸光度随胆固醇浓度标准变化曲线。实际中,分别准确吸取0.00mL、2.00mL、4.00mL、6.00mL、8.00mL胆固醇标准溶液于10mL的容量瓶中,用无水乙醇稀释至刻度(10mL),配制成浓度为0.0mg/mL、0.4mg/mL、0.8mg/mL、1.2mg/mL和1.6mg/mL胆固醇系列标准工作溶液。按表1加入试剂,混匀后置于37℃水浴中恒温反应15min,取出冷却至室温。在波长505nm处,测定吸光值。以胆固醇标准溶液的浓度为横坐标,以标准溶液的吸光值减去试剂空白的吸光值为纵坐标,绘制标准曲线,如图4所示。表1制作标准曲线时试剂添加量单位为毫升试剂管A管1管2管3管4管5管6标准工作溶液1(0.0mg/mL)—0.060—————标准工作溶液2(0.4mg/mL)——0.060————标准工作溶液3(0.8mg/mL)———0.060———标准工作溶液4(1.2mg/mL)————0.060——标准工作溶液5(1.6mg/mL)—————0.060—标准溶液(2.0mg/mL)——————0.060无水乙醇0.060——————显色剂3.0003.0003.0003.0003.0003.0003.000由图4可知,胆固醇标准溶液在0mg/mL~2.0mg/mL范围内符合郞伯-比尔定律,曲线回归方程为Y=0.3207X+0.0891,相关系数良好(R2=0.9992)。为了减少酶试剂用量,不再增设>2.0mg/mL的标准工作溶液,如果实测待分析试液吸光值超过此范围,可以对其进行稀释。在测量吸光度时,准备2支离心管(管B,管C),按表2加入试剂,混匀后置于37℃水浴中恒温反应15min,取出冷却至室温。在波长505nm处,测定吸光值,如表5所示。表2测定试料时试剂添加量单位为毫升试剂管B管C待分析试液0.0600.060水3.000—显色剂—3.000吸光度的计算公式如下:A=Atot-Abl-Aex其中,Atot表示总吸光值(管C);Abl表示试剂空白吸光值(管A);Aex表示试料空白吸光值(管B),Abl和Aex不应该大于总吸光值的20%,对于标准曲线,Aex为零。本实施例中,所述步骤2和步骤3中,所述显色剂包含80~100U/L胆固醇酯酶、40~60U/L胆固醇氧化酶、1000~1500U/L过氧化物酶、170.0-175mg胆酸钠、10.0-10.5mg4-氨基安替比林、30.0-35.0mg苯酚和280.0-320mg聚乙二醇辛基苯基醚的浓度为0.3mol/L的磷酸盐缓冲溶液,且所述显色反应的显色时间为10-20min,显色温度为35-40℃。实际中,取80~100U/L的胆固醇酯酶、50U/L的胆固醇氧化酶、1250U/L的过氧化物酶、172.0mg胆酸钠、10.2mg4-氨基安替比林、33.0mg苯酚、300.0mg聚乙二醇辛基苯基醚置于100mL的容量瓶中,用0.3mol/L磷酸盐缓冲溶液(4.2.5)稀释至刻度处(100mL)。为了找到酶比色反应的最优显色温度和显色时间,我们分别检测了不同显色温度与吸光度以及不同显色时间与吸光度的关系,如表3和表4所示。表3显色时间与吸光度的关系表4显色温度与吸光度的关系由表3可见,显色12min后吸光度趋于恒定,在15min时吸光度达到最大值,说明此时反应已基本完全,故显色时间取15min。由表4可见,当显色温度达到30℃时吸光度明显变大,说明温度越高越利于反应进程,到37℃时吸光度趋于平稳,说明反应已基本完全,故显色温度取37℃为宜。为了找到合适的检测波长,取2.0mg/mL胆固醇标准溶液60μL,按本试验方法显色,用分光光度计进行全波长扫描测定吸光度值,结果如图5所示,可知波长在505nm处有最大吸收,因此本试验选择505nm为检测波长。本实施例中,所述步骤4中,根据待分析试液的吸光度在所述标准变化曲线上读取待分析液中胆固醇的浓度,并根据待分析液中胆固醇浓度计算待分析试液的胆固醇含量,具体公式为:其中,X表示待分析液中胆固醇含量,单位为mg/100g;C表示由标准曲线查得的待分析试液中胆固醇的浓度,单位为mg/mL;V表示待分析试液的体积,单位为mL;M表示待分析试液的质量,单位为g。本实施例中,选用鸡蛋、鸭蛋、鹅蛋、鸽蛋和鹌鹑蛋分别制成全单样品和蛋黄样品进行检测,每个样品取6个平行试样,按本试验方法提取胆固醇并测其吸光度,计算批内相对标准偏差(RSD),结果见表5。按照同样方式进行6个批次实验,计算批间相对标准偏差,结果见表6。表5批内精密度(n=6)表6批间精密度(n=6)由表5和表6可知,相对标准偏差RSD均低于2.1%,远低于GB/T27404(2.7%)的要求,说明试验具有很好的重复性,精密度高。在全蛋样品及其蛋黄样品中分别添加一定量的标准溶液,配制100mg/100g,200mg/100g和400mg/100g三个浓度的试样溶液,每一浓度6次平行,计算批内添加回收率相对标准偏差,结果见表7。按照同样方式进行6个批次实验,计算批间添加回收率相对标准偏差,结果见表8。表7批内添加回收率精密度续表7表7批内添加回收率精密度表8批间添加回收率精密度续表8表8批间添加回收率精密度由表7和表8可知,相对标准偏差均低于GB/T27404(2.7%)的要求,说明试验具有很好的重复性,精密度高。本发明的检测禽蛋中胆固醇含量的酶比色法,可以准确的检测出禽蛋中的胆固醇含量水平,稳定性较好,可以适用于给禽蛋和蛋制品中胆固醇含量的检测,通用性较强,检测效率较高,耗时短,成本低,无需昂贵的检测设备即可准确完成检测,适合大面积推广。以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1