一种肉眼可辨比色检测乐果的方法与流程
本发明涉及一种检测乐果的方法,特别是一种肉眼可辨比色检测乐果的方法。
背景技术:
乐果属于一种重要的有机磷类农药,其对生物体内胆碱酯酶有很强的抑制作用,使得胆碱酯酶失去分解乙酰胆碱的能力,导致乙酰胆碱大量蓄积,从而阻断了神经传导,引起中枢神经系统中毒。目前,乐果被广泛使用在蔬菜、果树、茶、桑、棉、油料、粮食等农作物。然而,乐果的大肆使用导致了水果及油料作物中大量的农药残留,其对人体健康造成了严重的危害。因此,建立一种快速检测乐果的方法非常重要。
目前检测乐果的方法主要有仪器分析法,酶抑制法,免疫学方法等。应用于检测乐果的仪器分析法主要有气相色谱法(gc)、气相色谱-质谱法(gc-ms)、高效液相色谱法(hplc)。仪器分析法的样品前处理繁杂,检测时间长,需要专门的操作人员及昂贵的大型仪器,因此并不利于现场的实时监测。酶抑制法是一种基于分析物对于动物体内的乙酰胆碱酯酶(ache)具有抑制作用,使其失去分解乙酰胆碱的能力,从而建立的分析检测方法。酶抑制法虽然具有操作简便、快速、不需要大型的昂贵仪器等优点,但其灵敏度低、特异性差、易出现假阳性,且酶的来源易受到限制,导致成本较高,因此并不利于普及使用。免疫学方法是一种基于抗原与其抗体之间特异性结合的原理来检测乐果的方法。免疫学方法因其具有特异性强、灵敏度高、简单便捷等特点,受到了国内外普遍的重视。免疫学方法虽然方便快捷,但由于其制备抗体的时间较长且成本较高,在一些检测领域易受到限制。因此需要开发更可靠便捷的分析检测乐果方法。
综上所述,现有的检测方法存在处理繁杂、灵敏度低、特异性差、成本高、检测时间长的缺点。
技术实现要素:
本发明的目的在于,提供一种肉眼可辨比色检测乐果的方法。其具有肉眼可辨、灵敏度高、特异性强、操作便捷,检测快速、成本低的优势,可快速检测农产品中的乐果残留。
本发明的技术方案:一种肉眼可辨比色检测乐果的方法,包括有以下步骤:
a:绘制乐果吸光度变化量标准曲线
a1:制备已知乐果浓度的检测溶液,得a1品;
a2:制备空白对照溶液,得a2品;
a3:取a1品和a2品进行吸收光谱扫描,测定其在450nm波长处的吸光度值,获得其吸收光谱;
a4:根据吸收光谱绘制得到乐果吸光度变化量标准曲线;
b、根据乐果吸光度变化量标准曲线建立有关乐果浓度与乐果吸光度值之间相互关系的线性回归方程;
c:制备未知乐果浓度的待测溶液,得c品;
d:取c品进行吸收光谱扫描,测定其在450nm波长处的吸光度值,计算c品与a2品的吸光度差值,将该吸光度差值代入线性回归方程中,即可获得c品中乐果的浓度。
前述的肉眼可辨比色检测乐果的方法,所述a:绘制乐果吸光度变化量标准曲线的具体方法为:
a1:制备已知乐果浓度的检测溶液,包括:
a1-1:取多支刻度离心管,分别加入ssdna母液和aunps溶液,混匀后孵育,然后每支刻度离心管对应加入一种已知浓度的乐果标准液,混匀后再孵育,得a1-1品;
a1-2:在a1-1品中加入乙酸钠缓冲液,然后再加入h2o2溶液和opd溶液混匀即可制备得到检测溶液,为a1品;
a2:取1支刻度离心管,用三蒸水替代已知浓度的乐果标准液,按照a1-1和a1-2的方法即可制备得到空白对照溶液,为a2品;
a3:取a1品和a2品进行吸收光谱扫描,测定其在450nm波长处的吸光度值,获得其吸收光谱;
a4:根据吸收光谱,将不同浓度的a1品与a2品之间的吸光度差值作为纵坐标,乐果浓度作为横坐标绘制乐果吸光度变化量标准曲线;
所述步骤b中的线性回归方程为,y=0.00245c+0.02291,y为吸光度差值=含乐果的待测品的吸光度值-a2品的吸光度值,c为乐果浓度;
所述的制备未知乐果浓度的待测溶液c品的具体方法为:
c、用实际样液替代已知浓度的乐果标准液,按照a1-1和a1-2的方法即可制备得到未知乐果浓度的待测溶液,为c品。
前述的肉眼可辨比色检测乐果的方法,所述的ssdna母液中ssdna的序列组成为:5’-agcttgctgcagcgattcttgatcgccacagagct-3’,其浓度为3μm。
前述的肉眼可辨比色检测乐果的方法,所述的aunps溶液的浓度为56.4nm;h2o2溶液的浓度为5m;opd溶液的浓度为800mm。
前述的肉眼可辨比色检测乐果的方法,所述的乙酸钠缓冲液ph值为4.5,其浓度为8mm。
前述的肉眼可辨比色检测乐果的方法,所述的步骤a3及步骤d中,吸收光谱扫描为:取待测品置于96孔酶标板中,用酶标仪进行吸收光谱扫描,扫描波长范围为300-800nm,测定待测品在450nm波长处的吸光度值,获得其吸收光谱。
前述的肉眼可辨比色检测乐果的方法,所述的a1品、a2品或c品制备过程中:加入ssdna母液和aunps溶液混匀后置于25—35℃条件下孵育25—35min,然后加入10μl的已知浓度的乐果标准液、三蒸水或实际样液,混匀后置于25—35℃条件下孵育25—35min,之后加入乙酸钠缓冲液,最后再加入h2o2溶液和opd溶液混匀。
前述的肉眼可辨比色检测乐果的方法,所述的线性回归方程,检测乐果浓度范围为10-500ppb。
前述的肉眼可辨比色检测乐果的方法,所述的ssdna母液的用量为4.0—6.0μl;所述的aunps溶液的用量为47.5—52.5μl;h2o2溶液的用量为8.5—11.5μl;opd溶液的用量为8.5—11.5μl;所述的乙酸钠缓冲液的用量为405—425μl。
前述的肉眼可辨比色检测乐果的方法,所述的ssdna母液的用量为5.0μl;所述的aunps溶液的用量为50.0μl;h2o2溶液的用量为10.0μl;opd溶液的用量为10.0μl;所述的乙酸钠缓冲液的用量为415μl。
本发明的有益效果:与现有技术相比,本发明基于乙酸钠缓冲液中,ssdna能包裹在aunps表面,在h2o2存在下可以催化氧化opd,产物在450nm处呈现特征吸光度值,溶液由无色变为橙褐色。加入乐果后aunps的催化活性被抑制,导致溶液的颜色和特征吸光度值发生变化,且特征吸光度值的变化幅度与乐果的浓度成正比,从而建立了一种比色检测乐果的方法,该方法实施过程中不需要依赖大型仪器设备,具有检测灵敏度高,选择性好,且操作简单快速,肉眼可辨、检测成本低等优势,可快速检测农产品中的乐果残留。
如附图4所示,用本发明方法测定3份不同地点取得的废水-1、废水-2和西红柿汁,往样品中分别加入60ppb和500ppb的乐果,得到的回收率为在88.5%以上,证明本方法可靠。
而从附图3中可以看出,本发明建立的方法可以特异性地检测出乐果,其他竞争性的有机磷农药对乐果的检测几乎无干扰。
附图说明
附图1为检测体系加入乐果前后的颜色和吸光度变化示意图;
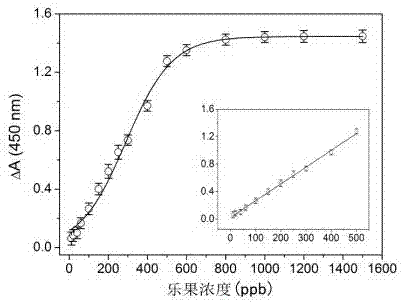
附图2为乐果吸光度变化量标准曲线;
附图3为其它有机磷农药对乐果检测的影响示意图;
附图4为应用于实际样品中乐果残留的检测示意图。
具体实施方式
下面结合附图和实施例对本发明作进一步的说明,但并不作为对本发明限制的依据。
本发明的实施例1:一种肉眼可辨比色检测乐果的方法,包括有以下步骤:
a:绘制乐果吸光度变化量标准曲线
a1-1:制备已知乐果浓度的检测溶液:取16支1.5ml刻度离心管,分别加入5.0μl的浓度为3μm的ssdna母液和50.0μl的浓度为56.4nm的aunps溶液,充分混匀后置于30℃条件下孵育30min,然后每支刻度离心管对应加入10μl的一种已知浓度的乐果标准液,充分混匀后置于30℃条件下孵育30min后,得a1-1品;
a1-2:在a1-1品中加入415μl的浓度为8mm的乙酸钠缓冲液,最后再加入10.0μl的浓度为5m的h2o2溶液和10.0μl的浓度为800mm的opd溶液充分混匀得到500μl的检测溶液,为a1品。
a2:制备空白对照溶液:另取1支刻度离心管,分别加入5.0μl的浓度为3μm的ssdna母液和50.0μl浓度为56.4nm的aunps溶液,充分混匀后置于30℃条件下孵育30min,然后加入10.0μl的三蒸水,充分混匀后置于30℃条件下孵育30min,再加入415μl的浓度为8mm的乙酸钠缓冲液,最后再加入10.0μl的浓度为5m的h2o2溶液和10.0μl的浓度为800mm的opd溶液充分混匀得到500μl的空白对照溶液,为a2品;
a3:取16支不同乐果浓度的a1品,每支200μl,和200μl的a2品,分别置于96孔酶标板中,用酶标仪进行吸收光谱扫描,扫描波长范围为300-800nm,测定a1品、a2品在450nm波长处的吸光度值,获得其吸收光谱。附图1即为检测溶液加入乐果前后的颜色和吸光度变化示意图,从附图1中可以证明用该方法检测乐果是可行的。附图1中,
(1)为:aunps+h2o2+opd的吸光度变化曲线;
(2)为:aunps+500ppb乐果+h2o2+opd的吸光度变化曲线;
(3)为:ssdna+aunps+h2o2+opd的吸光度变化曲线;
(4)为:ssdna+aunps+500ppb乐果+h2o2+opd的吸光度变化曲线;
(5)为:h2o2+opd的吸光度变化曲线;
(6)为:500ppb乐果+h2o2+opd的吸光度变化曲线;
a4:根据吸收光谱,将不同浓度的a1品,和a2品的吸光度差值作为纵坐标,乐果浓度作为横坐标绘制乐果吸光度变化量标准曲线。该标准曲线如附图2所示;
b、根据乐果吸光度变化量标准曲线建立有关乐果浓度与乐果吸光度值之间相互关系的线性回归方程,线性回归方程为,y=0.00245c+0.02291,其中y为吸光度差值,=含乐果的待测品的吸光度值-a2品的吸光度值,c为乐果浓度。
c:制备未知乐果浓度的待测溶液c品
另取1支刻度离心管,分别加入5.0μl的浓度为3μm的ssdna母液和50.0μl的浓度为56.4nm的aunps溶液,充分混匀后置于30℃条件下孵育30min,然后加入10.0μl的含有乐果的样品,即实际样液,如待测废水样本、西红柿汁等,充分混匀后置于30℃条件下孵育30min后,再加入415μl的浓度为8mm的乙酸钠缓冲液,最后再加入10.0μl的浓度为5m的h2o2溶液和10.0μl的浓度为800mm的opd溶液充分混匀得到500μl的待测溶液,为c品。
d:取200μl的c品置于96孔酶标板中,用酶标仪进行吸收光谱扫描,扫描波长范围为300-800nm,测定c品在450nm波长处的吸光度值,计算c品与a2品的吸光度差值,将该吸光度差值代入线性回归方程中,即可获得c品中乐果的浓度。例如,当计算得到c品和a2品的吸光度差值y为0.7时,根据线性回归方程y=0.00245c+0.02291,即可得出c品中乐果的浓度c是276.4ppb。
ssdna母液中ssdna的序列组成为:5’-agcttgctgcagcgattcttgatcgccacagagct-3’,乙酸钠缓冲液的ph值为4.5。
线性回归方程可检测乐果浓度范围为10-500ppb。
测定已知乐果浓度的检测溶液(a1品)、空白对照溶液(a2)品以及未知乐果浓度的待测溶液(c品),各溶液中,ssdna母液的终浓度为30nm,aunps溶液的终浓度为5.643m,h2o2溶液的终浓度为100mm,opd溶液的终浓度为16mm,乙酸钠缓冲液的终浓度为6.64mm。
本发明的实施例2:一种肉眼可辨比色检测乐果的方法,包括有以下步骤:
a:绘制乐果吸光度变化量标准曲线
a1-1:制备已知乐果浓度的检测溶液:取16支1.5ml刻度离心管,分别加入4.0μl的浓度为3μm的ssdna母液和47.5μl的浓度为56.4nm的aunps溶液,充分混匀后置于25℃条件下孵育35min,然后每支刻度离心管对应加入10μl的一种已知浓度的乐果标准液,充分混匀后置于25℃条件下孵育35min后,得a1-1品;
a1-2:在a1-1品中加入405μl的浓度为8mm的乙酸钠缓冲液,最后再加入8.5μl的浓度为5m的h2o2溶液和8.5μl的浓度为800mm的opd溶液充分混匀得到检测溶液,为a1品。
a2:制备空白对照溶液:另取1支刻度离心管,分别加入4.0μl的浓度为3μm的ssdna母液和47.5μl浓度为56.4nm的aunps溶液,充分混匀后置于25℃条件下孵育35min,然后加入10.0μl的三蒸水,充分混匀后置于25℃条件下孵育35min,再加入405μl的浓度为8mm的乙酸钠缓冲液,最后再加入8.5μl的浓度为5m的h2o2溶液和8.5μl的浓度为800mm的opd溶液充分混匀得到空白对照溶液,为a2品;
a3:取16支不同乐果浓度的a1品,每支200μl,和200μl的a2品,分别置于96孔酶标板中,用酶标仪进行吸收光谱扫描,扫描波长范围为300-800nm,测定a1品、a2品在450nm波长处的吸光度值,获得其吸收光谱。
a4:根据吸收光谱,将不同浓度的a1品,和a2品的吸光度差值作为纵坐标,乐果浓度作为横坐标绘制乐果吸光度变化量标准曲线。该标准曲线如附图2所示;
b、根据乐果吸光度变化量标准曲线建立有关乐果浓度与乐果吸光度值之间相互关系的线性回归方程,线性回归方程为,y=0.00245c+0.02291,其中y为吸光度差值,=含乐果的待测品的吸光度值-a2品的吸光度值,c为乐果浓度。
c:制备未知乐果浓度的待测溶液c品
另取1支刻度离心管,分别加入4.0μl的浓度为3μm的ssdna母液和47.5μl的浓度为56.4nm的aunps溶液,充分混匀后置于25℃条件下孵育35min,然后加入10.0μl的含有乐果的样品,即实际样液,如待测废水样本、西红柿汁等,充分混匀后置于25℃条件下孵育35min后,再加入405μl的浓度为8mm的乙酸钠缓冲液,最后再加入8.5μl的浓度为5m的h2o2溶液和8.5μl的浓度为800mm的opd溶液充分混匀得到待测溶液,为c品。
d:取200μl的c品置于96孔酶标板中,用酶标仪进行吸收光谱扫描,扫描波长范围为300-800nm,测定c品在450nm波长处的吸光度值,计算c品与a2品的吸光度差值,将该吸光度差值代入线性回归方程中,即可获得c品中乐果的浓度。例如,当计算得到c品和a2品的吸光度差值y为0.7时,根据线性回归方程y=0.00245c+0.02291,即可得出c品中乐果的浓度c是276.4ppb。
ssdna母液中ssdna的序列组成为:5’-agcttgctgcagcgattcttgatcgccacagagct-3’,乙酸钠缓冲液的ph值为4.5。
线性回归方程可检测乐果浓度范围为10-500ppb。
本发明的实施例3:一种肉眼可辨比色检测乐果的方法,包括有以下步骤:
a:绘制乐果吸光度变化量标准曲线
a1-1:制备已知乐果浓度的检测溶液:取16支1.5ml刻度离心管,分别加入6.0μl的浓度为3μm的ssdna母液和52.5μl的浓度为56.4nm的aunps溶液,充分混匀后置于35℃条件下孵育25min,然后每支刻度离心管对应加入10μl的一种已知浓度的乐果标准液,充分混匀后置于35℃条件下孵育25min后,得a1-1品;
a1-2:在a1-1品中加入425μl的浓度为8mm的乙酸钠缓冲液,最后再加入11.5μl的浓度为5m的h2o2溶液和11.5μl的浓度为800mm的opd溶液充分混匀得到检测溶液,为a1品。
a2:制备空白对照溶液:另取1支刻度离心管,分别加入6.0μl的浓度为3μm的ssdna母液和52.5μl浓度为56.4nm的aunps溶液,充分混匀后置于35℃条件下孵育25min,然后加入10.0μl的三蒸水,充分混匀后置于35℃条件下孵育25min,再加入425μl的浓度为8mm的乙酸钠缓冲液,最后再加入11.5μl的浓度为5m的h2o2溶液和11.5μl的浓度为800mm的opd溶液充分混匀得到空白对照溶液,为a2品;
a3:取16支不同乐果浓度的a1品,每支200μl,和200μl的a2品,分别置于96孔酶标板中,用酶标仪进行吸收光谱扫描,扫描波长范围为300-800nm,测定a1品、a2品在450nm波长处的吸光度值,获得其吸收光谱。
a4:根据吸收光谱,将不同浓度的a1品,和a2品的吸光度差值作为纵坐标,乐果浓度作为横坐标绘制乐果吸光度变化量标准曲线。该标准曲线如附图2所示;
b、根据乐果吸光度变化量标准曲线建立有关乐果浓度与乐果吸光度值之间相互关系的线性回归方程,线性回归方程为,y=0.00245c+0.02291,其中y为吸光度差值,=含乐果的待测品的吸光度值-a2品的吸光度值,c为乐果浓度。
c:制备未知乐果浓度的待测溶液c品
另取1支刻度离心管,分别加入6.0μl的浓度为3μm的ssdna母液和52.5μl的浓度为56.4nm的aunps溶液,充分混匀后置于35℃条件下孵育25min,然后加入10.0μl的含有乐果的样品,即实际样液,如待测废水样本、西红柿汁等,充分混匀后置于35℃条件下孵育25min后,再加入425μl的浓度为8mm的乙酸钠缓冲液,最后再加入11.5μl的浓度为5m的h2o2溶液和11.5μl的浓度为800mm的opd溶液充分混匀得到待测溶液,为c品。
d:取200μl的c品置于96孔酶标板中,用酶标仪进行吸收光谱扫描,扫描波长范围为300-800nm,测定c品在450nm波长处的吸光度值,计算c品与a2品的吸光度差值,将该吸光度差值代入线性回归方程中,即可获得c品中乐果的浓度。例如,当计算得到c品和a2品的吸光度差值y为0.7时,根据线性回归方程y=0.00245c+0.02291,即可得出c品中乐果的浓度c是276.4ppb。
ssdna母液中ssdna的序列组成为:5’-agcttgctgcagcgattcttgatcgccacagagct-3’,乙酸钠缓冲液的ph值为4.5。
线性回归方程可检测乐果浓度范围为10-500ppb。
- 还没有人留言评论。精彩留言会获得点赞!