回收稀有细胞的方法与流程
本公开涉及细胞回收或检测方法、以及回收系统。本公开尤其涉及回收或检测血液中的稀有细胞的方法、以及其中使用的稀有细胞回收系统。
背景技术:
血液中含有红细胞、白细胞和血小板等各种各样的成分。以疾病的早期发现和诊断等为目的,进行着对血液中所含的这些成分的检查。
血液中含有血中循环肿瘤细胞/circulatingtumorcell(ctc)和免疫细胞等稀有细胞,它们是医学上重要的细胞。ctc是从原发肿瘤组织或转移肿瘤组织游离,沿着血流循环的癌细胞(肿瘤细胞)。据信,ctc通过沿着血流循环,运输到其他脏器等,由此引起转移。因此,血液中的ctc由于被认为作为转移性的癌的治疗效果的判定或预后预测的因子有用,因此积极进行ctc的解析。
wo2011/108454中公开了如下方法:用过滤器处理血液,使过滤器捕获血液中的稀有细胞(ctc),对其进行分析。plosone,april2013,volume8,issue4,e61770中公开了如下方法:制备含有白细胞和稀有细胞的细胞悬浮液,将该细胞悬浮液中所含的全部细胞在设置了多个孔的观察区域中展开,基于光学拍摄而得到的图像来检测稀有细胞。
技术实现要素:
但是,上述的方法中存在如下问题:由于非目标细胞(例如,白细胞)的分离不充分,残留很多非目标细胞,因此目标细胞(例如,稀有细胞)的分析中需要花费很多时间和劳动力。另外,存在如下问题:由于非目标细胞来源的噪音,不能正确得到目标细胞的分析结果。
进一步,存在如下问题:在进行稀有细胞的分析时,由于待测体中的稀有细胞的浓度非常稀薄,因此需要处理几ml的待测体,但是在之后的分析中处理少数的细胞时,需要用少量来进行处理。另外,存在如下问题:由于待测体中的稀有细胞的浓度稀薄,因此不能正确得到目标细胞的分析结果。
稀有细胞的基因解析中存在需要以高纯度回收少量且不妨碍基因解析的状态的样品的问题。
本公开在一个或多个实施方式中,能够提供一种能够从含有目标细胞和非目标细胞的待测体中以高纯度回收目标细胞的方法和其中使用的系统。
本公开在一种方式中,涉及一种回收待测体中的稀有细胞的方法:包括:
通过能够捕获目标稀有细胞的过滤器来过滤含有所述目标稀有细胞和非目标细胞的待测体的步骤(过滤步骤);
在所述过滤器上对通过过滤步骤被所述过滤器捕获的稀有细胞和非目标细胞中的所述非目标细胞进行标记的步骤(标记步骤);
从标记步骤后的过滤器回收含有所述稀有细胞和标记的非目标细胞的溶液,从所述溶液中去除所述标记的非目标细胞,回收含有所述稀有细胞的溶液的步骤(分离回收步骤);以及
从含有所述稀有细胞的溶液中捕获所述稀有细胞的步骤(捕获步骤)
根据本公开,在一个或多个实施方式中,能够提供一种能够从含有目标细胞和非目标细胞的待测体中以高纯度且少量的液量回收目标细胞的方法。即,根据本发明,能够以足以进行基因检查的水平的纯度和液量来获得目标细胞。另外,根据本发明,在一个或多个实施方式中,能够在不进行核酸精制步骤的情况下,仅通过最少四个步骤(过滤步骤、标记步骤、分离回收步骤和捕获步骤等),即可得到上述效果。
附图说明
图1是示出本公开的回收方法的一个实施方式中的动作例的例子的流程图;
图2是实施例中使用的细胞捕获/染色装置的结构示意图;
图3是实施例中使用的磁分离装置的结构示意图;
图4是实施例中使用的介电泳装置的结构示意图;
图5是示出实施例的结果(检测稀有细胞和白细胞的结果)的例子的图像;
图6是示出实施例的结果(检测egfr的基因突变的结果)的例子的图表。
具体实施方式
为了正确分析待测体中的目标细胞,要求从待测体以高纯度回收目标细胞。在一般的细胞的情况下,由于待测体中含有较多的目标细胞,因此通过反复进行纯化步骤,能够提高目标细胞的纯度。然而,在ctc等稀有细胞的情况下,由于血液等的待测体中所含的量非常少(例如,血液8ml中含有数个左右),除此之外,还含有大量的非目标细胞(例如,白细胞等)。因此,在反复进行纯化步骤的情况下,即使能够去除非目标细胞,也存在稀有细胞损失的风险。因此,在稀有细胞的回收中,不光要求纯度,还要求减少目标稀有细胞的损失。另外,由于稀有细胞的分析通过显微镜等观察或通过pcr等基因解析等来进行,因此,要求纯化步骤后回收的液量为少量。
本公开在一个方式中,基于如下见解:通过一系列的流程进行以下至少三个步骤,来从含有目标稀有细胞(以下也称目标细胞)、以及含有比目标细胞多的非目标细胞(例如,白细胞)的待测体回收目标细胞,能够以高纯度且少量回收目标细胞;纯化步骤和浓缩步骤(例如,过滤器过滤步骤);增加的纯化和增加的浓缩步骤(例如,分离回收步骤和捕获步骤);以及在全部步骤中的任意步骤中(优选,过滤步骤后),为了在该步骤之后进行的纯化或浓缩步骤而对细胞进行的标记步骤。
这里,本公开的回收方法中,至少包含两次“纯化步骤和浓缩步骤”的步骤对,且也可以含有其他的处理步骤,上述的“全部步骤”是指该回收方法中进行的任何步骤,是指在这样的全部步骤中的任一步骤中进行上述标记处理。即,上述标记处理的实施可以在所述纯化步骤和浓缩步骤中进行,也可以在除此之外的步骤中进行。
作为纯化步骤和浓缩步骤,在一个或多个实施方式中,可举出根据利用目标稀有细胞和非目标细胞的物理特性的差异的方法而进行的处理,例如,可举出使用过滤器的物理分离、以及使用密度梯度的分离等。作为增加的纯化步骤和浓缩步骤,在一个或多个实施方式中,可举出根据利用目标稀有细胞和非目标细胞的生物学特性的差异的方法和/或利用目标稀有细胞和非目标细胞的物理特性的差异的方法而进行的处理,例如,可举出磁分离、吸引、流式细胞仪和介电泳等。作为增加的浓缩步骤,在一个或多个实施方式中,可举出介电泳、磁分离、吸引和流式细胞仪等。但是,本公开不限定于上述例子。
另外,本公开在一个方式中,基于以下本发明的发明人发现的新的见解:如前述那样从含有目标细胞、以及含有比目标细胞多的非目标细胞(例如,白细胞)的待测体中回收目标细胞,并且,通过在所述过滤器上进行针对被过滤器捕获的细胞中的非目标细胞标记的所述标记处理,能够以高纯度回收目标细胞。
本公开在一个方式中,基于如下本发明的发明人发现的新的见解:将含有目标稀有细胞和非目标细胞的待测体通过能够捕获所述目标稀有细胞的过滤器来过滤,在捕获了稀有细胞和非目标细胞的过滤器上对非目标细胞进行标记,从过滤器回收标记的非目标细胞和稀有细胞,使用该标记选择性分离非目标细胞和稀有细胞并回收含有稀有细胞的溶液,接着捕获该溶液中的稀有细胞,由此能够大幅度减少处理中的损失并能够以高纯度且高残留率回收待测体中仅以微量含有的稀有细胞理。此外,在本公开中,作为“在过滤器上标记”,是指在不从上述的过滤器回收通过过滤器过滤而捕获的细胞的情况下(稀有细胞实质上被过滤器捕获的状态下),进行非目标细胞标记。
通过本公开的方法,能够从上述待测体以高纯度回收目标细胞的机理不明,但是可以如下推测。
通过进行如下原理不同的至少两阶段的纯化步骤,能够提高目标细胞和非目标细胞的分离效率:过滤器过滤等、利用目标细胞和非目标细胞的物理性质的差异而去除待测体中的非目标细胞的一部分来进行纯化的纯化步骤和浓缩步骤;以及通过磁分离和介电泳等、利用目标稀有细胞和非目标细胞的生物学特性的差异的方法和/或利用目标稀有细胞和非目标细胞的物理特性的差异的方法中的至少一者,来进行的增加的纯化步骤和浓缩步骤。另外,尤其通过在在先的纯化步骤中使用的过滤器上进行非目标细胞的标记,能够减少各处理之间的目标细胞的损失。另外,即使在目标细胞存在多种、在它们中表达的抗原不同的情况下,通过对非目标细胞进行标记,也能够在不限定目标细胞的抗原的情况下,通过标记分离来分离非目标细胞和目标细胞,能够选择性回收目标细胞。另外,由于按上述顺序以一系列流程的形式进行这些步骤,因此能够减少目标细胞的损失,并能够分离、去除非目标细胞,最终以高纯度回收目标细胞。但是,本公开可以不限于这些机理而解释。
在本公开中,“目标细胞”是指进行回收、检测、分析或解析的对象的细胞。在本公开中,“非目标细胞”是指进行回收、检测、分析或解析的对象的细胞以外的细胞。
在一个或多个实施方式中,本公开的回收方法优选用于待测体中所含的细胞的数量中的、目标细胞显著少于非目标细胞的待测体。本公开的方法在一个或多个实施方式中,尤其优选用于待测体是血液试样、目标细胞是ctc等稀有细胞、非目标细胞是白细胞的情况。
作为血液试样,在一个或多个实施方式中,为含有构成血液的成分的试样,在不特别限定的一个或多个实施方式中,可举出血液、含有血球成分的血液来源物、血液或血液来源物混合存在的体液或尿、以及由它们制备的试样等。作为血液,可举出从活体采集的血液,作为所述活体,可举出人或人以外的动物(例如,哺乳类)。作为含有血细胞成分的血液来源物,可举出从血液分离或制备的、含有血细胞成分的、或它们的稀释物/浓缩物,例如,包括去除了血浆的血细胞成分、或血细胞浓缩物、血液或血细胞冷冻干燥物、对全血溶血进行处理并去除了红细胞成分的试样或溶血试样、离心分离血液、自然沉降血液、清洗血细胞、特定的成分等。其中,在不限定的一个或多个实施方式中,从简便且迅速处理的观点和抑制对血液中的稀有细胞的损伤的观点出发,作为含有所述血液的试样,优选含有血液或血细胞成分的血液来源的待测体。
作为稀有细胞,在不特别限定的一个或多个实施方式中,为选自癌细胞、循环肿瘤细胞、血管内皮细胞、血管内皮前体细胞、癌干细胞、上皮细胞、造血干细胞、间充质系干细胞、胎儿细胞、干细胞以及它们的组合构成的组的细胞。
本公开中的“纯化”是指,在含有目标细胞和非目标细胞的待测体中提高目标细胞的比例,或减少非目标细胞的数量或比例。
本公开中的“浓缩”是指,提高试样中的目标细胞的比例或将目标细胞集中到特定的区域。
另外,本公开中涉及“全部步骤中的任何步骤中”、或者“纯化步骤和浓缩步骤中进行”,“步骤中”包含从该步骤的准备到结束为止的期间。
根据本公开的方法,在一个或多个实施方式中,即使在待测体中的目标细胞的数量为10个以下的情况下,也能够回收目标细胞。另外,根据本公开的回收方法,在一个或多个实施方式中,能够从相对于待测体10ml仅含100个以下的少量的目标细胞的待测体中检测目标细胞,进而,能够从相对于待测体10ml仅含10个以下的少量的目标细胞的待测体中检测目标细胞。另外,能够将处理前(待测体)目标细胞相对于待测体中的全部细胞的比例(目标细胞/全部细胞)为0.00000001%~0.0003%,例如,处理后得到的回收液中的目标细胞相对于全部细胞的比例设为0.1%以上、或多于0.1%,例如,设为1%以上。通过本公开的回收方法,在一个或多个实施方式中,能够将8ml的待测体,例如,能够将含有增加的浓缩步骤中得到的目标细胞的悬浮液的液量浓缩至100μl以下、或少于100μl,例如,能够浓缩至50μl以下。
本公开中,“少量”是指,在用于基因解析时的反应液为少量时,含有目标细胞的成分的样品的液量也为少量。即,一般而言,基因扩增以50μl~100μl的液量进行,含有目标细胞的成分的样品的液量少于所述液量的量。另外,一般而言,含有目标稀有细胞和非目标细胞的血液待测体被利用1ml~10ml,因此本公开的“少量”是指,与过滤步骤中处理的血液待测体的液量相比显著地少。
[本公开的回收方法]
本公开在一个方式中,涉及一种回收含有目标稀有细胞和非目标细胞的待测体中的稀有细胞的方法(本公开的回收方法)。
本公开的回收方法包括以下的过滤步骤、标记步骤、分离回收步骤和捕获步骤。
过滤步骤:通过能够捕获目标稀有细胞的过滤器来过滤含有所述目标稀有细胞和非目标细胞的待测体的步骤。
标记步骤:在所述过滤器上对通过所述过滤步骤被所述过滤器捕获的稀有细胞和非目标细胞中的所述非目标细胞进行标记的步骤。
分离回收步骤:从所述标记步骤后的过滤器回收含有所述稀有细胞和标记的非目标细胞的溶液,从所述溶液中去除所述标记的非目标细胞,回收含有所述稀有细胞的溶液的步骤。
捕获步骤:从所述回收步骤中回收的含有所述稀有细胞的溶液中捕获所述稀有细胞的步骤。
根据本公开的回收方法,依次进行上述过滤步骤、标记步骤、分离回收步骤和捕获步骤,因此在一个或多个实施方式中,能够产生以下的效果。
由于在标记处理前进行过滤器过滤处理,能够去除待测体中的杂质且减少非目标细胞的量,因此能够提高非目标细胞和标记物质的反应性,能够减少标记所需的成本。另外,由于能够通过过滤处理而在捕获细胞的同时更换细胞周围的液体,因此能够在减少目标细胞的损失并且适合于非目标细胞和标记物质的反应的环境中进行标记处理。
在捕获细胞的过滤器上进行标记处理,即,在过滤步骤和标记步骤之间不包含从过滤器回收目标细胞的步骤,因此能够减少从过滤器回收时可能产生的目标细胞的损失。
在目标细胞的捕获(或浓缩)之前,分离标记的非目标细胞并选择性回收目标细胞,因此能够高效分离标记的非目标细胞,能够提高最终得到的回收液(例如浓缩液)的纯度。
[纯化步骤和浓缩步骤]
纯化步骤和浓缩步骤例如能够通过利用目标稀有细胞和非目标细胞的物理特性的差异的方法来进行。作为这样的方法,例如包括:用具有多个贯通孔、且能够捕获所述目标稀有细胞的过滤器过滤所述待测体的步骤;用具有多个贯通孔、且能够选择性捕获所述目标稀有细胞的过滤器过滤所述待测体,并去除所述待测体中的非目标细胞的一部分的步骤;通过密度梯度法而将待测体分离为含有所述目标稀有细胞的层和除此之外的层的至少两层,从而得到含有所述目标稀有细胞的细胞悬浮液的步骤。作为前者的例子,可举出通过具有多个贯通孔、且能够捕获目标稀有细胞的过滤器,来对含有目标细胞和非目标细胞的待测体进行过滤,从而去除待测体中的非目标细胞的一部分的步骤,优选通过能够选择性捕获目标细胞的过滤器来过滤,从而去除待测体中的非目标细胞的一部分的步骤。这种情况下,在纯化步骤和浓缩步骤中,待测体中的目标细胞被过滤器捕获。另外,在一个或多个实施方式中,待测体中的非目标细胞的一部分也可以被过滤器捕获。作为后者的例子,能够适当使用利用本领域公知的密度梯度法的步骤。
以使用上述过滤器进行纯化步骤和浓缩步骤的情况(本公开的回收方法中的过滤步骤)为例进行说明。作为具有多个贯通孔、且能够捕获待测体中的目标细胞的过滤器,在一个或多个实施方式中,可举出具有多个贯通孔的狭缝状的过滤器。作为贯通孔的形状,在一个或多个实施方式中,可举出圆角矩形、或椭圆形。过滤器的材质在一个或多个实施方式中,可举出聚对二甲苯、聚碳酸酯等塑料材料,镍、sus(steelusestainless,不锈钢)、金、银、铜、铝、钨、或铬等金属。
作为过滤器,在一个或多个实施方式中,可举出能够捕获待测体中的稀有细胞的过滤器,例如可以适当利用能够利用目标细胞和非目标细胞二者的变形能力甚至粘弹性上的差异而对二者进行过滤分离的过滤器。另外,关于过滤器,在一个或多个实施方式中,优选使大部分白细胞通过、并且能够捕获稀有细胞的过滤器,更优选能够捕获待测体中的ctc的过滤器,例如可举出至少能够捕获snu-1、sw620或这两者的过滤器,但不限于此。作为过滤器,在一个或多个实施方式中,可以使用现有公知或今后开发的能够捕获稀有细胞的过滤器。作为过滤器,在一个或多个实施方式中,可举出wo2011/108454中记载的过滤器、以及日本专利特愿2016-057313中记载的过滤器等。另外,例如,可以举出含有大量短轴直径为1~50μm的椭圆、正圆、矩形或圆角矩形、狭缝状等贯通孔的片状的单膜,优选无纺布之外的物质。
关于短轴直径,从提高小型稀有细胞的捕获率的观点出发,在一个或多个实施方式中,为5μm以上、大于5μm、或6μm以上,从相同观点出发,为10μm以下、8μm以下、或7μm以下。关于长轴直径,从提高变形能力高的稀有细胞的捕获率的观点出发,在一个或多个实施方式中,为10μm以上、20μm以上、30μm以上、40μm以上、50μm以上、60μm以上、70μm以上、或80μm以上,从抑制过滤器的弯曲或变形等的产生、且提高稀有细胞的捕获率的观点出发,为5000μm以下、4000μm以下、3000μm以下、2000μm以下、1000μm以下、500μm以下、400μm以下、300μm以下、200μm以下、或100μm以下。
过滤器的过滤面积不特别限定,在一个或多个实施方式中,为5mm2以上或10mm2以上,或10,000mm2以下、2,000mm2以下、1,000mm2以下、500mm2以下、200mm2以下、150mm2以下、100mm2以下、80mm2以下、50mm2以下、40mm2以下、30mm2以下或25mm2以下。本公开中的“过滤器的过滤面积”是指,在过滤器的整体面积中,待测体或回收液接触的(流通的)部分的面积。
过滤器中的贯通孔的孔数不特别限定,在一个或多个实施方式中,能够根据试样通过的区域中的每孔的血液量而适当设定。过滤器在一个或多个实施方式中,以40个/mm2以上2000个/mm2以下的孔密度包含贯通孔。从进一步提高变形能力高的稀有细胞的捕获率的观点、以及抑制过滤面积的观点、和/或从过滤器高效回收稀有细胞的观点出发,孔密度(每1mm2的孔数)为45个/mm2以上、60个/mm2以上、70个/mm2以上、90个/mm2以上、200个/mm2以上、300个/mm2以上、400个/mm2以上、500个/mm2以上、600个/mm2以上或700个/mm2以上,从同样的观点出发为40000个/mm2以下、10000个/mm2以下、4000个/mm2以下、1500个/mm2以下、1000个/mm2以下、900个/mm2以下或800个/mm2以下。
在一个或多个实施方式中,过滤器的厚度为1~1000μm、1~100μm、1~50μm、1~20μm,并且优选1~10μm,更优选1~8μm。
从进一步提高稀有细胞的捕获率的观点、抑制过滤面积的观点、和/或从过滤器高效回收稀有细胞的观点、在一个或多个实施方式中,过滤器的开口率为10%以上60%以下。从同样的观点出发,过滤器的开口率为15%以上、20%以上、25%以上、30%以上、31%以上、35%以上或40%以上,从同样的观点出发为55%以下或45%以下。
从提高细胞的捕获率的观点出发,在一个或多个实施方式中,待测体的流速为每开口面积0.01mm/秒以上、0.05mm/秒以上或0.1mm/秒以上,从同样的观点出发为100mm/秒以下、50mm/秒以下、25mm/秒以下、10mm/秒以下、5mm/秒以下或2mm/秒以下。
待测体的流通量(通过过滤器的血液待测体的量)例如相对于5mm2~10000mm2的过滤面积为0.07ml以上、0.25ml以上、0.5ml以上、1ml以上、比1ml多的量、2ml以上、3ml以上或4ml以上。另外,在一个或多个实施方式中,从维持稀有细胞的捕获率的观点出发,待测体的流通量相对于5mm2~10000mm2的过滤面积,为6l以下、4l以下、2l以下、400ml以下、200ml以下、100ml以下、80ml以下、50ml以下、30ml以下、25ml以下、12ml以下、11ml以下、10ml以下、9ml以下、或8ml以下。或者,在一个或多个实施方式中,从一次处理很多试样的观点、捕获容易变形的细胞的观点和维持稀有细胞的捕获率的观点出发,过滤器容量相对于15mm2~200mm2的过滤面积为多于0.2ml,或低于130ml或130ml以下,从同样的观点出发为0.8ml~90ml、0.8ml~60ml、2ml~50ml、2ml~40ml。
从提高细胞的捕获率的观点出发,在一个或多个实施方式中,待测体的流通压力为0.1kpa以上或0.2kpa以上,或2.6kpa以下、1.5kpa以下、1.3kpa以下、1.0kpa或0.5kpa以下。本公开中的“待测体的流通压力”是指从系统的入口到出口的体统整体的压力差,例如,是指包括包含从配置了待测体的容器到废液容器在内的流路的系统的压力差。因此,根据流路结构,也可以是记载以上的压力。流通压力(系统的压力差)能够以公知的方法使用市售的压力计测定,或基于流量和流路结构的关系而计算。
通过以过滤器的每个孔(1个)1mm/min以上600mm/min以下的平均流速输送血液待测体,能够捕获稀有细胞。在一个或多个实施方式中,血液待测体的输送条件为2mm/min以上300mm/min以下的流速、3mm/min以上100mm/min以下的流速、4mm/min以上80mm/min以下的流速、或4mm/min以上40mm/min以下的流速。也可以从平均流量换算而设定输送条件。作为计算方法,测定每单位时间的过滤废液出口的流量(全部孔总计平均流量)或每单位量的过滤时间而求出平均流量,并将其除以孔数,由此得到每个孔的平均流量。另外,能够将该平均流量除以孔面积而求出平均流速。并且,只要在前述的每孔的平均流速、或平均流量的范围之内输送即可。在一个或多个实施方式中,可以将过滤废液出口的流量(全孔总计平均流量)除以全孔面积而计算。
过滤处理优选以使血液成为过滤步骤或过滤步骤和标记步骤后回收的细胞悬浮液中所含的非目标细胞的总数为100000个以下、50000个以下、10000个以下、或6000个以下的方式进行。
[标记步骤(标记处理)]
对标记步骤而言,例如,在先的纯化步骤(例如,过滤步骤)中可以在过滤器上对与目标细胞一起被过滤器捕获的非目标细胞标记。作为标记方法,在一个或多个实施方式中,可举出磁标记。
在一个或多个实施方式中,磁标记可以通过使非目标细胞的结合分子和固定在磁粒子的表面的物质(与非目标细胞的结合分子特异性反应的物质)结合从而将磁粒子固定在非目标细胞上的方式进行。在一个或多个实施方式中,固定在磁粒子上的物质可以根据非目标细胞的结合分子而适当决定。作为磁粒子,在一个或多个实施方式中,可举出表面固定有亲和素的磁粒子、表面固定有链霉亲和素的磁粒子、表面固定有中性亲和素的磁粒子、表面固定有生物素的磁粒子、表面固定有生物素衍生物的磁粒子、表面固定有抗体的磁粒子、表面固定有抗原的磁粒子等。磁粒子的大小不特别限制。
从提高磁粒子的标记效率的观点出发,在一个或多个实施方式中,标记步骤如下的方式进行:将含有磁粒子的悬浮液供应给捕获了目标细胞的过滤器面,例如,使用泵等输送单元将被供应的悬浮液的一部分从过滤器面向另一个过滤器面输送。即,在本公开的标记步骤中,在将悬浮液的一部分朝向与粒子捕获面相反侧的过滤器面(过滤器的下面)侧积极地输送这一点上,与液体不经意地浸透或扩散到过滤器,该液体到达过滤器下面附近的现象不同。本公开的标记步骤例如优选如下方式:通过将向捕获了目标细胞的过滤器面供应、将被供应的悬浮液的一部分从过滤器面向另一个过滤器面输送,来形成含有磁粒子的液体接触过滤器的两面的状态,然后,将含有磁粒子的液体从另一个过滤器面向捕获了目标细胞的过滤器面的方向逆向输送。在一个或多个实施方式中,该悬浮液的输送可包括以含有磁粒子的液体的上部液面和下部液面夹着过滤器的方式,将悬浮液的一部分向过滤器的下面侧输送。该输送在一个或多个实施方式中,可以通过以含有磁粒子的液体被保持在相反侧的过滤器面(过滤器的下面)附近的方式进行。该输送在一个或多个实施方式中,以悬浮液通过过滤器、含有磁粒子的液体接触过滤器的两个面的方式,从相反面(过滤器下面)侧用泵吸引来进行。
在一个或多个实施方式中,标记步骤可以包括在含有磁粒子的悬浮液的输送之前,进行在非目标细胞上固定结合分子的处理。
[增加的纯化]
在一个或多个实施方式中,增加的纯化包括将含有在先的纯化步骤和浓缩步骤所得的目标细胞和非目标细胞的悬浮液分离、得到含有目标细胞的悬浮液的步骤。
增加的纯化步骤能够通过利用目标稀有细胞和非目标细胞的生物学特性的差异的方法和/或利用目标稀有细胞和非目标细胞的物理特性的差异的方法来进行。作为这样的方法,可举出将磁标记的细胞从未磁标记的细胞分开的方法、将目标稀有细胞从除此之外的细胞吸引分开的方法、用流式细胞仪将目标稀有细胞从除此之外的细胞分开的方法、以及使用介电泳的方法中的至少一种。作为所述增加的纯化步骤,作为利用生物学特性的差异的方法和利用目标稀有细胞和非目标细胞的物理特性的差异的方法,例如,在一个或多个实施方式中,可举出使用使目标稀有细胞和非目标细胞在流路中向不同方向偏转的技术的步骤。这样的增加的纯化步骤例如为将标记的粒子和未标记的粒子分离的方法,其包括:从流路的一端供应含有标记的粒子和未标记的粒子的悬浮液;在所述流路内使所述标记的粒子向与所述未标记的粒子不同的方向偏转;将所述标记的粒子固定在流路内壁面;以及在所述标记的粒子被固定在流路内壁面的状态下,从所述流路的一端向流路内导入气相,从所述流路的另一端排出所述流路内的悬浮液,并回收所述未标记的粒子。例如,能够通过将标记步骤后回收的悬浮液向流路内供应、并将标记的非目标细胞固定在流路内壁面来进行。
在一个或多个实施方式中,增加的纯化步骤可以通过磁分离而进行(本公开的回收方法中的分离回收步骤的一个方式)。增加的纯化(例如,本公开的回收方法中的分离回收步骤)在一个或多个实施方式中包括通过磁分离从含有标记步骤中磁标记的非目标细胞和目标细胞的溶液去除标记的非目标细胞,选择性回收目标细胞。
从能够以高精度分离未磁标记的目标细胞和磁标记的非目标细胞的观点出发,在一个或多个实施方式中,增加的纯化步骤(本公开的回收方法中的分离回收步骤)优选包括向产生磁场的流路内供应标记步骤后回收的悬浮液,将磁标记的非目标细胞固定在流路内壁面。从能够进一步提高分离精度的观点出发,增加的纯化步骤优选包括流路内使磁标记的非目标细胞向与目标细胞不同的方向偏转、以及将磁标记的非目标细胞固定在偏转方向的流路内壁面。另外,从减少目标细胞的损失的观点出发,优选通过从流路的一端向流路内导入气相、从流路的另一端排出流路内的悬浮液而进行。
本公开中的“气相”是指由气体构成的相。在一个或多个实施方式中,气相的导入可以如下方式进行:通过被导入的气相的压力来将流路内的悬浮液与未标记的粒子一起从流路的另一端侧排出。关于气相的导入,在一个或多个实施方式中,可以以在流路内的悬浮液和导入的气相之间形成气液界面的方式进行,进一步,可以以该气液界面从流路的一端(流入口)向另一端(流出口)移动的方式进行。在一个或多个实施方式中,气液界面在与流路的内壁面之间具有非点乃至非线形的一定区域。另外,在一个或多个实施方式中,气液界面和流路的内壁面的接触点形成连续的线。作为气体,在一个或多个实施方式中,可以使用空气、氧气、氮气、氩气、二氧化碳等。
在一个或多个实施方式中,气相可以通过配置在流路的一端的压力产生机构等而导入。作为压力产生机构,在一个或多个实施方式中,可举出注射泵、管式泵、加压泵、真空泵等。
从形成稳定的气液界面、进一步提高未标记的细胞的分离精度的观点出发,以及从维持流路内壁面上固定的标记粒子的固定的观点出发,在一个或多个实施方式中,气相的流量为25μl/分以上、50μl/分以上或75μl/分以上,或者为500μl/分以下或250μl/分以下。
[增加的浓缩步骤]
增加的浓缩步骤例如也可以在增加的纯化步骤之后进行。增加的浓缩步骤例如对增加的纯化步骤中得到的悬浮液进行浓缩。这样的增加的浓缩步骤可以通过利用目标稀有细胞和非目标细胞的生物学特性的差异的方法和/或利用目标稀有细胞和非目标细胞的物理特性的差异的方法来进行。作为这样的方法,可举出将磁标记的细胞从未磁标记的细胞分开的方法、将目标稀有细胞从除此之外的细胞吸引分开的方法、用流式细胞仪将目标稀有细胞从除此之外的细胞分开的方法、以及使用介电泳的方法中的至少一种。作为所述浓缩步骤,作为利用生物学特性的差异的方法和/或利用目标稀有细胞和非目标细胞的物理特性的差异的方法,例如可举出利用介电泳的方法(本公开的回收方法中的捕获步骤的一个方式)。
即,悬浮液的浓缩(例如,本公开的回收方法中的捕获步骤)由于能够将目标细胞集中在小空间内,因此在一个或多个实施方式中,优选通过介电泳来进行。在一个或多个实施方式中,通过介电泳的浓缩可以通过向产生介电泳的腔内导入由增加的纯化步骤所得的悬浮液、以及通过介电泳在腔内捕获目标细胞来进行。
从抑制目标细胞中的极化的产生的减少的观点、减少电流流过对目标细胞的损伤的观点、或者进一步提高介电泳的捕获率的观点出发,增加的纯化步骤(分离回收步骤)中获得的悬浮液的介质优选电导率(导电率)尽可能低。从同样的观点出发,在一个或多个实施方式,介质优选电解质的含量少。从同样的观点出发,在活细胞的情况下,一个或多个实施方式中,介质优选蔗糖等张液等、非电解质的等张液。另外,从减少对基因扩增的妨碍的观点出发,优选蔗糖等张液等、非电解质的溶液。
在本公开中,在一个或多个实施方式中,作为纯化步骤和浓缩步骤,进行通过具有多个贯通孔且能够选择性捕获所述目标稀有细胞的过滤器来对所述待测体进行过滤、去除所述待测体中的非目标细胞一部分的步骤a;接着,作为增加的纯化步骤,进行将磁标记的细胞从未磁标记的细胞中分开的方法的步骤b;接着,作为增加的浓缩步骤,进行使用介电泳的方法的步骤,在所述步骤a中,对用于所述步骤b的细胞进行标记处理。通过该方式,仅通过这四个步骤,就能够以高纯度且少量从含有目标稀有细胞和非目标细胞的待测体中回收目标细胞。
[本公开的分析或检测方法]
本公开在一个方式中,涉及用于从含有目标细胞和非目标细胞的待测体中对目标细胞进行分析或检测的方法(本公开的分析或检测方法)。
在一个或多个实施方式中,本公开的分析或检测方法的特征在于,包括:在本公开的回收方法的实施中或完成之后、分析或检测细胞的步骤。
在一个或多个实施方式中,本公开的分析或检测方法与本公开的回收方法同样地进行。
本公开的分析或检测方法包括对浓缩步骤(捕获步骤)所得的悬浮液中的细胞进行分析或检测的分析或检测步骤。分析或检测步骤包括对所述悬浮液中的目标细胞进行拍摄、以及对拍摄所得的图像进行解析。另外,分析或检测步骤包括:对所述浓缩步骤所得的悬浮液进行回收、以及对所述悬浮液中的细胞的基因进行解析或检测。作为基因,在一个或多个实施方式中,可举出egfr、alk、ras、braf、pik3ca、syt-ssx、idh1、jak2、calr、mpl、bcr-abl、c-kit、npm1、myd88、rhoa、abcg2、her2、ret、ros1、eml4-alk、mek1、met、kif5b-ret或它们的组合。
[本公开的回收系统]
本公开在一种方式中,涉及用于回收稀有细胞的系统(本公开的回收系统)。
在一个或多个实施方式中,本公开的回收系统包括:实施纯化步骤和浓缩步骤(过滤步骤)的纯化浓缩单元(过滤单元);针对所述纯化步骤和浓缩步骤,增加地实施纯化步骤和浓缩步骤(分离回收步骤和捕获步骤)的增加的纯化浓缩单元(分离回收单元和捕获单元),本公开的回收系统构成为,在由所述系统实施的任一步骤中,能够实施对用于在该步骤之后进行的纯化步骤或浓缩步骤的细胞进行的标记处理。
上述“增加”是指至少实施两次纯化步骤和浓缩步骤的步骤对,并不是指在在先的纯化步骤和浓缩步骤、以及在后的纯化步骤和浓缩步骤之中区分主从。
在一个或多个实施方式中,本公开的回收系统中,所述纯化浓缩单元具有利用目标稀有细胞和非目标细胞的物理特性的差异的物理分离单元,所述增加的纯化浓缩单元具有检测目标稀有细胞和非目标细胞的生物学特性的差异的生物学分离单元和/或检测目标稀有细胞和非目标细胞的物理特性的差异的物理分离单元。
在本公开的回收系统中,纯化浓缩单元中,进行纯化的部分和进行浓缩的部分可以相同,或者是一体化的,也可以是分开的。另外,增加的纯化浓缩单元中,进行纯化的部分和进行浓缩的部分可以相同,或者是一体化的,也可以是分开的。
纯化浓缩单元例如可以配置分离单元,根据情况,分离单元上也可以具有能够输送待测体的输送单元。另外,纯化浓缩单元也可以包括能够输送含有标记步骤中使用的磁粒子等标记的悬浮液和清洗液的输送单元。在一个或多个实施方式中,纯化浓缩单元能够进行本公开的回收方法中的纯化浓缩步骤,另外,根据要求,可以进行标记步骤。
在一个或多个实施方式中,增加的纯化浓缩单元例如具有能够供应悬浮液的流路;配置在流路的上部和侧面的至少一者上的磁场照射体;以及用于将流路内的悬浮液向流路外排出的导入单元。通过从磁场照射体产生磁场,能够在与配置了磁场照射体的部位对应的流路内壁面固定磁标记的白细胞。在一个或多个实施方式中,磁场照射体可以沿流路的长边方向配置,也可以沿流路的长边方向的至少一部分配置。在一个或多个实施方式中,磁场照射体的数量可以为一个,也可以为两个以上的多个。作为磁场照射体,在一个或多个实施方式中,可举出磁铁、电磁铁等。在一个或多个实施方式中,导入单元可以是能够导入液相的,也可以是能够导入气相的。作为气相的导入单元,在一个或多个实施方式中,可举出注射泵、管式泵、加压泵、真空泵等压力产生机构等。
在一个或多个实施方式中,捕获单元(增加的纯化浓缩单元)例如具有能够供应悬浮液的流路腔、以及用于产生介电泳的电场产生单元,电场产生单元被配置在流路腔中。从提高观察的容易性(视觉辨认性)的观点出发,电场产生单元优选配置在流路腔的底面。作为电场产生单元,在一个或多个实施方式中,可举出用于介电泳的对电极。
在一个或多个实施方式中,捕获单元的腔可以以从回收单元的流路排出的悬浮液能够直接供应给该腔的方式,与回收单元的流路连接。
以下,针对本公开的回收/检测方法,对非限定的一个实施方式进行说明。
图1是示出本公开的回收/检测方法的一个实施方式的流程图。
首先,在过滤步骤(第一纯化浓缩步骤)(s01)中,使用具有多个贯通孔的过滤器,进行血液中的稀有细胞(目标细胞)和其他细胞(非目标细胞)的粗分离。粗分离可以通过将血液输送给具有多个贯通孔的过滤器而进行。过滤器形成有多个能够捕获稀有细胞的贯通孔。输送条件如上述所述。另外,该过滤器能够捕获稀有细胞,但是,血液中含有大量(每10ml中3千万~7千万个)的白细胞,并且白细胞的直径和稀有细胞同等程度或比稀有细胞更大,因此,通过该过滤器处理,可将待测体中的一部分白细胞与稀有细胞一起捕获在过滤器上。在该例子中,通过过滤器处理,含有目标稀有细胞和白细胞等的非目标细胞的待测体中的目标稀有细胞的比例提高,并且,过滤器上能够累积待测体中的目标稀有细胞,因此,该例子是通过一个单元进行本发明中的过滤步骤(纯化浓缩步骤)的例子。
在标记步骤(s02)之前,从提高试剂对白细胞的反应性的观点出发,也可以通过供应溶血剂而处理,来去除过滤器上残留的红细胞。
在标记步骤(s02)中,针对过滤步骤(s01)中被过滤器上捕获的白细胞进行磁粒子的磁标记。从减少稀有细胞的损失、提高回收率的观点出发,磁标记在过滤器上进行。
从提高磁粒子和白细胞的反应性的观点出发,也可以在供应悬浮液之前,通过抗体对白细胞进行免疫染色。作为抗体,例如可举出与结合分子结合的抗体等。作为结合分子,在一个或多个实施方式中,可举出生物素等。另外,作为磁粒子,例如也可以使用固定有与上述结合分子特异性反应的物质的磁粒子。作为特异性反应的物质,在一个或多个实施方式中,可举出链霉亲和素和中性亲和素等蛋白质。
然后,将含有磁粒子的悬浮液向捕获了稀有细胞和白细胞的过滤器输送,由此进行磁标记。磁标记通过如下方式进行:以过滤器的两个主面被含有磁粒子的悬浮液的上部液面和下部液面夹着的方式输送该悬浮液,之后逆方向输送,此后在过滤器上搅拌,接着使磁粒子和白细胞反应。从提高磁粒子和白细胞的反应性的观点出发,也可以反复进行这些操作。
从提高分离回收后的稀有细胞的检测效率的观点出发,也可以在磁标记之后,通过抗体来对稀有细胞进行免疫染色。作为抗体,例如可举出cytokeratin(细胞角蛋白)之类的、识别ctc的细胞内表达的抗原的抗体等。从使抗体与稀有细胞内的抗原反应的观点出发,也可以在抗体标记之前,进行固定处理和膜渗透处理。
在分离回收步骤(第二纯化步骤)(s03)中,进行标记步骤s02所得的悬浮液的磁分离。磁分离如下方式进行:通过将回收的悬浮液供应给产生了磁场的流路内,在流路内壁面固定磁标记的白细胞,在该状态下将稀有细胞向流路外排出。从提高稀有细胞的排出效率的观点出发,磁场优选以白细胞被固定在流路的底侧以外的壁面上的方式产生。稀有细胞的排出可以通过向流路导入液相或气相来进行。从进一步提高稀有细胞和白细胞的分离效率的观点出发,优选通过导入气相来进行。稀有细胞的排出可以以由流路排出的稀有细胞被直接供应给后述的捕获步骤(第二浓缩步骤)(s04)中使用的腔的方式进行。
在捕获步骤(第二浓缩步骤)(s04)中,对含有经过分离回收步骤(第二纯化步骤)(s03)的稀有细胞的悬浮液进行浓缩。关于浓缩,由于能够将目标细胞集中在小空间中,因此通过介电泳来进行。利用介电泳的浓缩如下方式进行:通过向产生了介电泳的腔内导入分离回收步骤(s03)所得的悬浮液,通过介电泳在腔内捕获目标细胞,将液体(悬浮液的介质)排出腔外。
本公开可以涉及以下的一个或多个实施方式。
[1]一种回收方法,其特征在于,
用于从含有目标稀有细胞和非目标细胞的待测体中以高纯度、少量地回收目标稀有细胞,包括:
纯化步骤和浓缩步骤、以及增加的纯化步骤和增加的浓缩步骤,
在全部步骤中的任意步骤中,对用于在该步骤之后进行的纯化步骤或浓缩步骤的细胞进行标记处理。
[2]根据[1]所述的回收方法,所述纯化步骤和浓缩步骤根据利用目标稀有细胞和非目标细胞的物理特性的差异的方法而进行,
所述增加的纯化和浓缩步骤根据利用目标稀有细胞和非目标细胞的生物学特性的差异的方法和/或利用目标稀有细胞和非目标细胞的物理特性的差异的方法而进行。
[3]根据[1]或[2]所述的回收方法,其中,
所述纯化步骤和浓缩步骤包括以下步骤中的至少一者:
用具有多个贯通孔、且能够选择性地捕获所述目标稀有细胞的过滤器对所述待测体进行过滤,并去除所述待测体中的非目标细胞的一部分的步骤;
通过密度梯度法将待测体分离为含有所述目标稀有细胞的层和除此之外的层的至少两层,并得到含有所述目标稀有细胞的细胞悬浮液的步骤。
[4]根据[1]至[3]中任一项所述的回收方法,其中,
所述增加的纯化和浓缩步骤根据将磁标记的细胞从未磁标记的细胞分开的方法、将目标稀有细胞从除此之外的细胞吸引分开的方法、用流式细胞仪将目标稀有细胞从除此之外的细胞分开的方法、以及使用介电泳的方法中的至少一种而进行。
[5]根据[1]至[4]中任一项所述的回收方法,其中,
所述标记处理在所述过滤器上对被过滤器捕获的细胞中的非目标细胞进行标记。
[6]根据[1]至[5]中任一项所述的回收方法,其中,
所述标记处理在所述纯化步骤和浓缩步骤中进行。
[7]根据[1]至[6]中任一项所述的回收方法,其中,
由所述标记处理标记的细胞是白细胞。
[8]根据[1]至[7]中任一项所述的回收方法,其中,
所述待测体中的所述目标稀有细胞以相对于所述待测体10ml而以1个以上、100个以下的比例存在。
[9]根据[1]至[8]中任一项所述的回收方法,其中,
所述待测体中的所述目标稀有细胞以相对于所述待测体10ml而以1个以上、10个以下的比例存在。
[10]根据[1]至[9]中任一项所述的回收方法,其中,
所得到的回收液中的所述目标稀有细胞相对于全部细胞的比率为0.1%以上、100%以下。
[11]根据[1]至[10]中任一项所述的回收方法,其中,
所得到的回收液中的所述目标稀有细胞相对于全部细胞的比率为1%以上、100%以下。
[12]根据[1]至[11]中任一项所述的回收方法,其中,
所得到的回收液的量为1pl以上、100μl以下。
[13]根据[1]至[12]任一项所述的回收方法,其中,
所得到的回收液的量为1pl以上、50μl以下。
[14]一种分析或检测方法,包括:
在[1]至[13]中任一项所述的回收方法的实施中或完成之后,对细胞进行分析或检测的步骤。
[15]根据[14]所述的分析或检测方法,其中,
所述分析或检测的步骤包括:对所述目标稀有细胞进行拍摄;以及对拍摄所得的图像进行解析。
[16]根据[14]或[15]中任一项所述的分析或检测方法,其中,
所述分析或检测步骤包括对所述目标稀有细胞的基因进行解析或检测。
[17]一种稀有细胞回收系统,其特征在于,
所述系统用于从含有目标稀有细胞和非目标细胞的待测体中以高纯度、少量地回收目标稀有细胞,包括:
纯化浓缩单元,所述纯化浓缩单元实施纯化步骤和浓缩步骤;以及
增加的纯化浓缩单元,所述增加的纯化浓缩单元对所述纯化步骤和浓缩步骤,增加地实施纯化和浓缩步骤,
所述稀有细胞回收系统构成为,在所述系统实施的任意步骤中,能够实施对用于在该步骤之后进行的纯化或浓缩步骤的细胞进行的标记处理。
[18]根据[17]所述的稀有细胞回收系统,其中,
所述纯化浓缩单元具有利用目标稀有细胞和非目标细胞的物理特性的差异的物理分离单元,
所述增加的纯化浓缩单元具有利用目标稀有细胞和非目标细胞的生物学特性的差异的生物学分离单元和/或利用目标稀有细胞和非目标细胞的物理特性的差异的物理分离单元。
[19]根据[17]或[18]所述的稀有细胞回收系统,其中,
所述纯化浓缩单元包括:具有多个贯通孔且能够选择性捕获所述目标稀有细胞的过滤器、以及密度梯度装置中的至少一者。
[20]根据[17]至[19]中任一项所述的稀有细胞回收系统,其中,
所述增加的纯化浓缩单元包括磁场产生装置、介电泳装置、吸引装置和流式细胞仪中的至少一者。
[21]根据[17]至[20]中任一项所述的稀有细胞回收系统,
所述纯化浓缩单元构成为,能够在所述过滤器上对被过滤器捕获的细胞中的非目标细胞进行标记。
示例
以下,使用实施例来对本公开进一步说明。但是,本公开不限定于以下的实施例而解释。
[细胞捕获/染色装置]
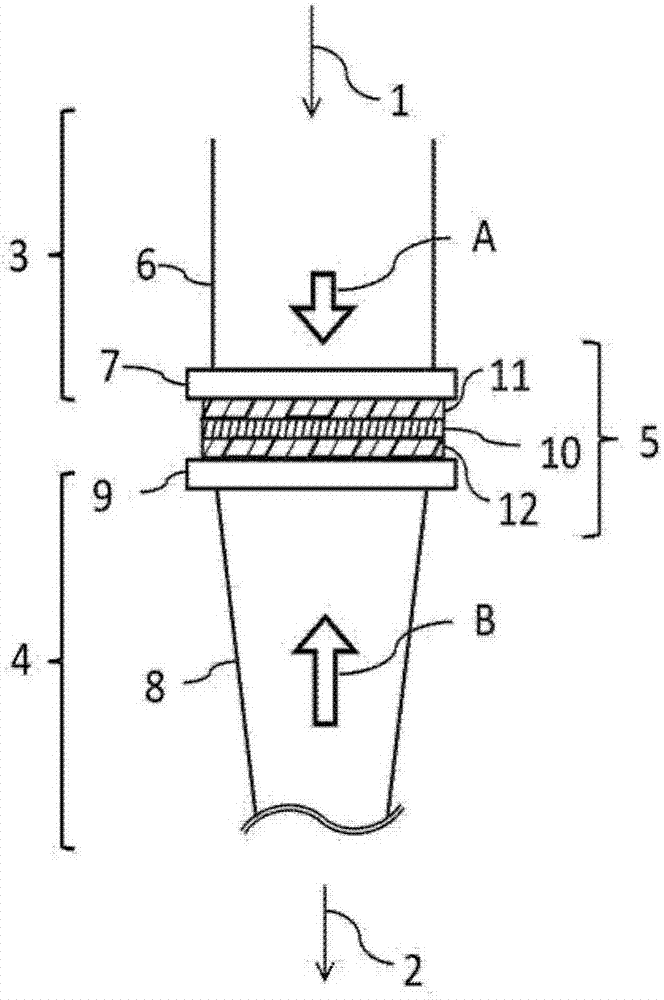
准备图2所示的细胞捕获/染色装置。图2的细胞捕获/染色装置包括:用于供应含有磁珠的悬浮液、清洗液以及染色液等的供应口1,用于排出清洗液等废液的排出口2,设备上部3,包含过滤器10的过滤器部5,设备下部4,以及能够向箭头a方向和箭头b方向输送的输送机构(未图示)。设备上部3具有流路6、以及用于固定过滤器部5的支承部件7,流路6与供应口1连通。设备下部4具有流路8、以及用于固定过滤器部5的支承部件9,流路8与排出口2连通。过滤器10被配置在设备上部3和设备下部4之间,且通过双面胶11、12而被固定。过滤器10使用具备多个贯通孔、且具有下述特性的过滤器。
<过滤器的特性>
·孔:短轴直径:6.5μm,长轴直径:88μm,面积:572μm2,形状:狭缝
·孔的中心间的间距:14μm×100μm(短轴直径侧×长轴直径侧)
·孔密度:714个/mm2
·开口率:41%
·膜厚:5μm
·材质:镍
·过滤面积:28mm2
[磁分离装置]
准备图3所示的磁分离装置。
safido(商标)管21(内径3.1mm、管长26cm、容积2cm3)的一端26上经由管24和注射器(10ml)连接有注射泵23,且另一端27上配置有用于回收从safido(商标)管排出的液体的容器25。管24上配置有三通阀28。safido(商标)管的侧面配置有磁铁(钕磁铁(n40、角型、200x15x5(mm)、5mm方向、表面磁通密度229mt))。
[介电泳装置]
准备图4所示的介电泳离装置。图4中的(a)是从介电泳装置31上面的示意图,图4的(b)示出腔32底面的梳形电极35的配置状态。
在图4的介电泳装置中,微装置31包括流入口33、腔32、流出口34和梳形电极35。流入口33和流出口34被形成在介电泳装置31的上面,并且与沿着介电泳装置31的底面以长边方向形成的腔32连通。梳形电极35被形成在构成腔32的底面的基板的上面。
按照如下顺序制作图4所示的介电泳装置。
1)在ito(铟锡氧化物,indiumtinoxide)基板上通过湿法蚀刻形成电极图案。
2)在硅晶片上,使用光刻技术通过su-8制作流路的模型。
3)使用上述模型,用pdms(二甲基聚硅氧烷,dimethylpolysiloxane)制作流路。
4)用氧气等离子体将形成了电极图案的ito基板和由pdms制作的流路表面活化,使在ito基板上形成图案的电极与流路对向贴合。
另外,腔体积为约4μl。
(实施例1)
使用上述的装置,按照以下的顺序进行在先的纯化步骤和浓缩步骤、以及增加的纯化步骤和浓缩步骤,进行从血液的稀有细胞的回收和回收的稀有细胞的解析。
[在先的纯化步骤和浓缩步骤]
使用图2的细胞捕获/染色装置,按照下述步骤1~6的步骤,通过磁粒子标记血液中所含的细胞(白细胞)。
步骤1:向细胞捕获/染色装置导入含有稀有细胞的血液8ml,过滤器过滤血液并且大小选择地捕获白细胞等细胞(过滤流量:1000μl/分、流速:1.444mm/秒)。
步骤2:将包含针对cd45和cd50的抗体的染色液1、和包含识别所述抗体的biotin(生物素)标记抗体、alexa594标记抗体和hoechst33342的染色液2依次添加到过滤器并与细胞反应,对cd45和cd50表达细胞(例如,白细胞)进行biotin标记。
步骤3:在过滤器上面添加neutravidin(中性亲和素)标记磁粒子悬浮液,与细胞反应,用biotin进行neutravidin标记磁粒子标记。
步骤4:将含有pfa(paraformaldehyde,多聚甲醛)的固定液和含有tween20的膜渗透液依次添加到过滤器上并与细胞反应,进行细胞的固定和细胞膜的渗透。
步骤5:将含有fitc标记抗cytokeratin抗体的染色液3添加到过滤器上面,与细胞反应,在cytokeratin表达细胞(例如,稀有细胞)上进行fitc标记。
步骤6:将介电泳液添加到过滤器上面并充分输送,将溶液更换为介电泳液,得到过滤器上部的细胞悬浮液600μl。
另外,得到的细胞悬浮液(600μl)中所含的白细胞(非目标细胞)的数量为5000个左右。
[增加的纯化步骤]
使用上述步骤6中得到的细胞悬浮液,按照下述步骤7~11的顺序通过图3所示的磁分离装置进行纯化。
步骤7:通过三通阀(三通旋塞阀)将步骤6中回收的细胞悬浮液600μl导入至没有液相的、填满空气的气相状态的safido(商标)管的前半部分为止,在safido(商标)管内构建由细胞悬浮液构成的液相。
步骤8:通过三通阀关闭导入了细胞悬浮液的导入口,由此将从注射泵内至细胞悬浮液的末端界面为止形成连续的气相。
步骤9:之后,使safido(商标)管靠近钕磁铁(n40、角型、200x15x5(mm)、5mm方向),在室温下静置15分钟。
步骤10:从注射泵以流量100μl/min向safido(商标)管导入空气,将safido(商标)管内的液体移动到管的后半部分,进一步在室温下静置15分钟。
步骤11:从注射泵以流量100μl/min向safido(商标)管导入空气,将safido(商标)管内的全部液体从safido(商标)管排出。
[增加的浓缩步骤]
使用上述步骤11中得到的细胞悬浮液,按照下述步骤12的顺序进行图4所示的介电泳装置的浓缩。
步骤12:在填充了介电泳液的介电泳装置中,在向梳形电极施加20vp-p、1mhz、正弦波的交流电流而产生介电泳力的状态下,将步骤12所得的细胞悬浮液600μl以流量20μl/min输送,由此在梳形电极上捕获和浓缩细胞悬浮液中的细胞。
[解析]
用荧光显微镜(奥林巴斯公司)对被处理至上述步骤12为止的介电泳装置进行拍摄。用荧光过滤器组1检测hoechct33342,用荧光过滤器组2检测fitc标记抗cytokeratin抗体,用荧光过滤器组3检测alexa594标记抗cd45抗体和alexa594标记抗cd50抗体。
<荧光过滤器组>
·荧光过滤器组1的波长:ex(激发波长)365±5nm、dm400n以上、ba(荧光波长)470±20nm。
·荧光过滤器组2的波长:ex(激发波长)477.5±17.5nm、dm505nm以上、ba(荧光波长)525±10nm。
·荧光过滤器组3的波长:ex(激发波长)580±10nm、dm600nm以上、ba(荧光波长)625±15nm。
使用图像解析软件(产品名:nis‐elements,尼康公司),对获取的图像进行解析,将fitc阳性、alexa594阴性、hoechct33342阳性的细胞检测为稀有细胞,alexa594阳性、hoechct33342阳性的细胞检测为白细胞。
[回收]
解析后按照下述步骤13的顺序从介电泳装置回收细胞悬浮液。
步骤13:在未施加交流电流、即未产生介电泳力的状态下,从介电泳装置的流出口,导入下述步骤14所述的试剂20μl,回收流入口挤出的细胞悬浮液。
[基因检测]
将上述步骤13回收的细胞悬浮液按照下述步骤14~17的顺序进行egfr的基因解析。
步骤14:混合非离子型表面活性剂(np-40)和含有蛋白质分解酶(proteinasek)的试剂,56℃下加温5分钟。
步骤15:进一步在95℃下加温15分钟。
步骤16:在不进行核酸精制的情况下直接与含有tm解析用荧光探针的pcr反应液混合。
步骤17:在由两阶段构成的两步的pcr之后,通过tm解析来判定突变型。
<pcr条件>
条件1:由两阶段构成的两步(热变性步骤→退火/延伸步骤)的pcr
条件2:第一阶段的热变性时间为2秒,第二阶段的热变性时间为1秒
条件3:第一阶段的退火/延伸温度为56℃,第二阶段的退火/延伸温度为58℃
条件4:第一阶段的循环数为10次,第二阶段的循环数为50次
如图5所示,通过实施例的方法,能够检测稀有细胞(白色箭头)和白细胞(黑色箭头)。
如图6所示,通过实施例的方法,能够检测egfr的基因突变。
[表1]
如表1所示,通过实施例的方法,处理稀有细胞为10个以下的血液样品,能够得到稀有细胞的丰度比1%以上的样品50μl以下。
(比较例1)
除了不进行第二纯化步骤、第二浓缩步骤、以及基因解析步骤之外,用与实施例1同样的方法进行。其结果如下述表2所示。
[表2]
如表2所示,其结果为,白细胞的残留数、样品量均很多,不能达到稀有细胞的丰度比1%以上、样品50μl以下。
(比较例2)
除了不进行第二浓缩步骤和基因解析步骤之外,用与实施例1同样的方法进行。其结果如下述表3所示。
[表3]
如表3所示,其结果为,样品量很多,不能达到样品50μl以下。
- 还没有人留言评论。精彩留言会获得点赞!