使用浓度相关的自相互作用纳米粒子光谱法确定蛋白质自缔合的可能性的测定的制作方法
本发明大体来说涉及选择用于开发和商业化的治疗性蛋白质;并且更具体来说,涉及选择具有高可能性轻松达到高蛋白质浓度同时具有较低可能性形成聚集体的蛋白质。本发明具体来说涉及评估蛋白质胶体相互作用以及选择蛋白质以在高浓度下配制。
背景技术:
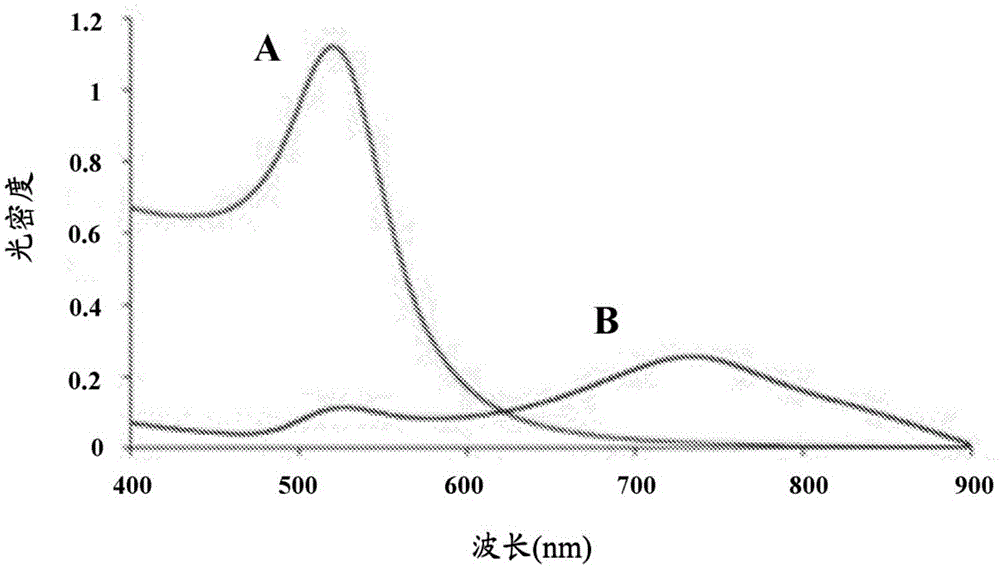
:大生物分子-“生物治疗药物”-是一类重要的药物。例如,单克隆抗体提供精确的治疗特异性、长的生物制剂半衰期和高的安全特征。鉴于尺寸和复杂性,生物治疗药物难以生产和配制。大多数生物治疗药物被配制成冻干固体或液体制剂,并且这些分子的稳定性是一个重要问题。稳定性不仅影响最终产品的保质期,还影响生产过程。根据定义,大分子具有大的分子量。因此,几摩尔药物包括相对大的质量。例如,抗体的分子量约为每摩尔150000克,而像阿托伐他汀这样的小分子药物的分子量约为每摩尔560克。因此,为了获得有效剂量,需要高质量的蛋白质药物。随着更多的药物被配制用于皮下注射,所述高质量必须适应小体积。为了容纳有效治疗剂量,生物治疗药物的皮下制剂必须达到高(约50mg/ml或更高)或非常高(约100-250mg/ml)的浓度,与此同时粘度保持在可控水平。随着大分子被塞入小空间并且蛋白质分子之间的距离减小,胶体相互作用的频率,即,一个分子对另一个分子的通过空间效应增加。蛋白质自身相互作用(胶体相互作用)通常在能量上很弱,通常是可逆的和非特异性的。这些相互作用与蛋白质相关,并且受ph、盐和其他添加剂的影响。在某些情况下,相互作用可能是净相吸的、相斥的或中性的。相互作用的性质和程度可取决于蛋白质的浓度。胶体相互作用跨越广谱的相互作用(势能),所述相互作用用维里系数量化。b22表示成对相互作用,b222表示3体相互作用,b2222表示4体相互作用,等等。正维里系数值表示相斥相互作用,负维里系数表示相吸相互作用,而零维里系数表示理想状态。胶体相互作用通常存在于超过~2mg/ml的蛋白质溶液中,并且在超过~40mg/ml的溶液中变得显著。在较低浓度下,空间和静电力往往占主导地位。随着蛋白质浓度的增加,情况变得更加复杂。随着生产和配制期间蛋白质浓度的增加,胶体相互作用成为问题。胶体相互作用影响蛋白质生产期间的各种下游过程。根据相互作用的性质和程度,这些力可能是有益的或有害的。胶体相互作用影响色谱性能、超滤和渗滤(uf/df)、渗析、粘度和溶液处理,以及蛋白质在溶液中的稳定性。胶体相互作用也影响储存期间的长期稳定性,所述存储期间可形成低聚物和多聚体,以及蛋白质聚集体。因此,在投入资源开发特定蛋白质治疗剂之前,蛋白质的维里系数评估提供重要信息。维里系数分析是一个已经建立且高度活跃的探索领域。目前评估特定蛋白质的维里系数(b22或密切相关的a2)的方法包括膜渗压测定法、沉降平衡分析超离心法、自相互作用色谱法、静态光散射法(sls)、扩散或沉降相互作用参数法,以及自相互作用纳米粒子光谱法(sins)。例如,cohen和benedek(us4080264a,1978年3月3日公开)描述了用以测量抗原或抗体聚集的准弹性光散射光谱法。publicover和vincze(us7514938b2,2009年4月7日公开)描述了使用介电弛豫光谱法(drs)来探测涂覆有蛋白质(包括抗体)的微米和亚微米级粒子的相互作用和聚集。holman等人(us20070291265a1,2007年12月20日公开)描述了一种用于测量光散射和浓度信号以测量大分子聚集的分叉光纤系统。obrezanova等人(mabs,7(2):352-363,2015)描述了使用尺寸排阻高压液相色谱(se-hplc)和低聚物检测测定(光密度微量滴定板抗体捕获测)来系统地测量超过500种抗体的聚集倾向。geoghegan等人(mabs,8(5):941-950,2016)描述了使用疏水相互作用色谱法(hic)停留时间、亲和力捕获sins和动态光散射法来测量单克隆抗体的自相互作用、粘度和稳定性。geng等人(jpharmsci.,103(11):3356-3363,2014)提供了用于评估胶体蛋白质相互作用的现有方法的概述。sule等人(biophys.j.,101:1749-1757,2011)描述了用于评估单克隆抗体自缔合的自相互作用纳米粒子光谱法(sins)。简言之,将抗体吸附到金纳米粒子上,然后将金纳米粒子与缓冲液在96孔微量滴定板中混合。随着纳米粒子由于粘附抗体的自缔合而聚集,纳米粒子的吸收光谱发生变化。表面等离子共振的这种变化与粒子缔合相关。所述测定基于吸收峰转移或幅度变化而提供“自缔合”或“无自缔合”的二元读出。sule等人(mol.pharmaceutics,10:1322-1331,2013)描述了称为亲和力捕获自相互作用纳米粒子光谱法(ac-sins)的sins的改进方法。其中,首先将多克隆人源抗体固定到纳米粒子上,然后使经涂覆粒子与低浓度/低纯度抗体样品接触,然后通过抗人源涂覆捕获。ac-sins可快速筛选细胞上清液,而无需大量抗体纯化。与sins一样,ac-sins提供受测抗体的正自缔合或无自缔合的二元评估。蛋白质是复杂的分子,并且在不同的条件下往往表现出不可预测的行为。现有技术提供了一些观察蛋白质自缔合的方法,但没有提供快速和准确的方法来确定蛋白质在无数不同条件下发生自缔合的倾向。一些蛋白质在某些条件下是稳定的,但在其他条件下不稳定。本领域仍然需要一种测定法来确定蛋白质在变化的条件下相吸性和相斥性的动态范围。技术实现要素:本发明人开发了一种用于确定蛋白质在动态条件范围内自组装的可能性(即,蛋白质的固有相斥性或相吸性)的方法。因此,所述方法可以被理解为一种用于确定自缔合蛋白质的稳定性的方法或一种用于确定聚集蛋白质的稳定性的方法。如本文进一步详述,蛋白质可以是单一类型的蛋白质或不同来源的任何蛋白质的组合。称为浓度相关的自相互作用纳米粒子光谱法(cd-sins)的所述方法测量蛋白质在变化的浓度和各种离子强度和ph条件下自组装的倾向。所述方法能够预测在高浓度或极高浓度条件下的蛋白质,并且通知蛋白质的选择以供商业开发。所述方法还提供了关于如何配制包括一种或多种高浓度生物医药药物的医药组合物同时维持长保质期而不与一种或多种生物医药药物缔合的信息。所述方法还能够获得关于如何配制组合物的信息,所述组合物满足关于物理性质(例如合适的流变学/粘度)的所需规格,以允许特定的所需给药途径。本发明还允许使用较少量的材料来更快速地筛选生物医药以得到合适的制剂或选择合适的候选药物以供进一步的药物开发。在第一方面,本发明提供包括多种纳米粒子、蛋白质和缓冲盐的生物分析混合物。蛋白质在混合物中以至少两相存在:粘附相和可溶相。粘附相包括粘附到(即,涂覆有)纳米粒子的蛋白质。可溶相包括溶解在缓冲盐溶液中的蛋白质。在一些实施方案中,蛋白质以第三相存在,其中蛋白质自缔合为二聚体、三聚体、四聚体或更高级的多聚体,包括聚集的经涂覆纳米粒子。在一个实施方案中,纳米粒子为金纳米粒子。在一些实施方案中,纳米粒子具有约20nm至约100nm的直径。在特定实施方案中,纳米粒子是直径为约20nm的金纳米粒子。在一个实施方案中,每种纳米粒子涂覆有蛋白质。在一些实施方案中,大部分或全部纳米粒子表面上被蛋白质饱和,这意味着表面完全被蛋白质占据并且没有留下裸露的表面供蛋白质粘附。在一些实施方案中,在向混合物中添加其他组分之前,大部分或全部纳米粒子表面被蛋白质饱和,例如合适的盐或缓冲盐。在一个实施方案中,混合物含有每毫升混合物约6×1011至约7×1011个纳米粒子。在特定实施方案中,混合物含有每毫升约6.3×1011个纳米粒子。虽然不希望受理论束缚并且假设平均蛋白质可以被建模为10nm球体,但是涂覆20nm球体所需的10nm球体的理论数量上限是约30。可以估计近似15至20个抗体分子结合单个20nm纳米粒子。因此,估计约2.5μg/ml抗体是完全覆盖6.3×1011个纳米粒子(20nm)/ml所需的最小浓度。在一些实施方案中,混合物包括约2μg/ml至约512μg/ml的蛋白质。在一些实施方案中,包括在混合物中的蛋白质为治疗性抗体。在一些实施方案中,蛋白质包括免疫球蛋白fc结构域。在一些实施方案中,蛋白质为抗原结合蛋白。抗原结合蛋白包括抗体、抗体片段、抗体衍生物、fc融合蛋白和受体-fc-融合蛋白。在一个实施方案中,蛋白质为单克隆抗体。在更具体的实施方案中,单克隆抗体为人源或人源化抗体。在一些实施方案中,单克隆抗体可以是单特异性抗体或双特异性抗体。在一些实施方案中,缓冲盐包括缓冲液和盐。在一些实施方案中,缓冲液提供离子强度。在一些实施方案中,盐缓冲混合物。原则上,盐可以是本领域已知的任何合适的盐,并且可以是例如任何氯化物、溴化物、磷酸盐、硫酸盐或铵盐,或其任何组合。非限制性实例是例如氯化钠、氯化钾、磷酸钾、氯化铵等。在一个实施方案中,盐包括氯化钠。盐(例如,氯化钠)可以约2mm至约300mm的浓度存在。在特定实施方案中,盐以约2mm、约20mm或约200mm的浓度存在于混合物中。在一个实施方案中,缓冲液包括2-(n-吗啉代)乙磺酸(mes)。在具体的实施方案中,mes以约10mm的浓度和约6的ph的混合物存在。在第二方面,本发明提供一种用于确定蛋白质自缔合的可能性的方法。在一个实施方案中,所述方法包括以下步骤:将蛋白质、多种纳米粒子和缓冲盐组合以形成样品;用光激发样品;测量透过样品的光;以及计算样品的第一吸收强度比。所述过程至少再重复一次,每次改变一个或多个参数,并且获得第二吸收比、第三吸收比等。可以绘制从给定蛋白质获得的多个吸收强度比以供分析。这些参数包括盐类型(即,中性盐、离液盐、亲液盐)、盐浓度、ph、蛋白质浓度、包括或排除其他成分。当吸收强度比超过阈值时,蛋白质被认为有利于以高浓度分配。预期被认为有利于以高浓度分配的蛋白质在高浓度下保持稳定并且不易于聚集。在一些实施方案中,蛋白质为治疗性抗体。在一些实施方案中,蛋白质包括免疫球蛋白fc结构域。在一些实施方案中,蛋白质包括抗原结合蛋白。抗原结合蛋白包括抗体、抗体片段、抗体衍生物、fc融合蛋白和受体-fc-融合蛋白。在一个实施方案中,蛋白质为单克隆抗体。在更具体的实施方案中,单克隆抗体为人源或人源化抗体。在一些实施方案中,单克隆抗体可以为单特异性抗体或双特异性抗体。在一些实施方案中,蛋白质被添加到样品中,达到约2μg/ml至约512μg/ml的最终浓度。在一些实施方案中,纳米粒子为金纳米粒子。在一些实施方案中,金纳米粒子具有约20nm至约100nm的直径。在一个实施方案中,金纳米粒子的直径为约20nm。在一些实施方案中,纳米粒子被添加到样品中,达到每ml约5×1011至约8×1011个纳米粒子、每ml约6×1011至约6.5×1011个纳米粒子,或每ml约6.3×1011个纳米粒子的最终浓度。缓冲盐可含有缓冲液、赋予离子强度的缓冲液、盐、具有缓冲能力的盐,或盐和缓冲液。在一个实施方案中,盐包括氯化钠。盐(例如,氯化钠)可以约2mm至约300mm的浓度存在。在一些具体的实施方案中,盐以约2mm、约5mm、约10mm、约20mm、约50mm、约75mm、约100mm、约110mm、约120mm、约150mm、约175mm、约200mm或约300mm的浓度存在于混合物中。在一个实施方案中,缓冲液包括2-(n-吗啉代)乙磺酸(mes)。在具体的实施方案中,mes以约10mm的浓度和约6的ph的混合物存在。在一些实施方案中,激发光为包括波长跨越可见光谱的白光。在一些实施方案中,透射光是在约450nm至约750nm的范围内的多个波长处测量的。吸收强度比为光吸收相对于标准或对照的相对强度的量度。对照可按外部或内部。在一个实施方案中,通过将样品的峰值吸收波长的最大强度(光密度或吸收)除以观察到的初始吸收强度来计算吸收强度比。在一个实施方案中,观察到的初始吸收强度是在450nm处观察到的吸收强度。在所述实施方案中,吸收强度比是峰值吸收(a峰值)/在450nm处的吸收(a450或ainit)。在所述实施方案中,吸收强度比的阈值为约1.5至约2。在具体实施方案中,吸收强度比的阈值为约1.7。在一个实施方案中,被认为有利于以高浓度分配的蛋白质与赋形剂结合以形成配制的药物物质(fds)或药物产品(dp)。在一个实施方案中,蛋白质被配制成约50mg/ml至约250mg/ml的最终浓度。在一个实施方案中,赋形剂包括张力调节剂、缓冲液、表面活性剂、稳定剂,或其中两种或更多种的任意组合。在一个实施方案中,调节剂为盐。在具体实施方案中,盐为氯化钠。在一个实施方案中,缓冲液以约ph6至约ph7缓冲。在具体实施方案中,缓冲液为组氨酸。在另一具体实施方案中,缓冲液为磷酸盐。在一个实施方案中,表面活性剂为聚山梨酸酯,诸如聚山梨酸酯20或聚山梨酸酯80。在一个实施方案中,稳定剂为糖,诸如蔗糖或海藻糖。在另一个实施方案中,稳定剂为氨基酸,例如脯氨酸或精氨酸。在第三方面,本发明提供一种用于生产治疗性蛋白质的方法。在一个实施方案中,方法包括以下步骤:从具有变化的未知胶体稳定性的多种不同蛋白质中选择具有高胶体稳定性的蛋白质;在宿主细胞中生成所选蛋白质;净化蛋白质;将高浓度的蛋白质与赋形剂混合,以形成配制的药物物质或药物产品,其中蛋白质是稳定的。在一个实施方案中,配制的药物物质或药物产品中少于10%的蛋白质聚集。在一个实施方案中,选择具有高胶体稳定性的蛋白质的步骤包括以下步骤:将蛋白质与纳米粒子和缓冲盐组合以形成样品;用光激发样品;测量透过样品的光;以及计算样品的吸收强度比。在改变一个或多个参数的情况下重复所述选择步骤一次或多次。改变的参数包括盐类型、盐浓度、ph、蛋白质浓度,以及包括或排除附加成分。当吸收强度比超过阈值时,选择胶体稳定性高的蛋白质。在一些实施方案中,激发光为包括波长跨越可见光谱的白光。在一些实施方案中,在约450nm至约750nm的范围内的多个波长处测量透射光。吸收强度比为光吸收相对于标准或对照的相对强度的量度。对照可按外部或内部。在一些实施方案中,通过将样品的峰值吸收波长的最大强度(光密度或吸收)除以(1)在所述样品中观察到的初始吸收强度(内部),或除以(2)在不含蛋白质的纳米粒子样品中观察到的初始吸收强度(外部)来计算吸收强度比。在一个实施方案中,初始观察到的吸收强度是在450nm处观察到的吸收强度。在所述实施方案中,吸收强度比是峰值吸收(a峰值)/在450nm处的吸收(a450或ainit)。在所述实施方案中,吸收强度比的阈值为约1.5至约2。在具体实施方案中,吸收强度比的阈值为约1.7。在另一实施方案中,本发明涉及一种包括在高浓度下的生物治疗药物(诸如例如蛋白质或抗体)的组合物。具体地,组合物可以使得总蛋白质种类中不超过约10%存在作为在生物治疗药物浓度下的不可逆聚集体。另选地,组合物使得如本文所讨论的阈值例如在例如约1.5至约2.0(a峰值/a450)的范围内。另一种替代方案为阈值为例如约1.5、约1.6、约1.7、约1.8、约1.9或约2.0(a峰值/a450)。在一些实施方案中,阈值在约0.7至约1.0(a峰值/a对照)的范围内。另一替代方案是阈值为例如约0.7、约0.8、约0.9或约1.0(a峰值/a对照)。在又一个实施方案中,组合物使得总蛋白质种类中不超过约10%存在作为在生物治疗药物浓度下的不可逆聚集体,并且使得组合物具有如本文所讨论的阈值,例如在例如约1.5至约2.0(a峰值/a450)的范围内,或阈值为例如约1.5、约1.6、约1.7、约1.8、约1.9或约2.0(a峰值/a450),和/或阈值在约0.7至约1.0(a峰值/a对照)的范围内,或阈值为例如约0.7、约0.8、约0.9或约1.0(a峰值/a对照)。生物医药药物的浓度可为约50mg/ml或更高。另选地,生物医药的药物浓度可以在例如约50mg/ml至约500mg/ml,例如约50mg/ml至约250mg/ml,诸如例如约100mg/ml至约250mg/ml的范围内。在一个实施方案中,本发明涉及由如本文所公开的用于确定蛋白质自组装的可能性的方法可获得的组合物。在又一方面,本发明涉及一种包括在高浓度下的生物治疗药物(诸如例如蛋白质或抗体)的用于医药的组合物。根据药物,本领域技术人员将知道通过将组合物施用于有需要的受试者可以治疗哪种或哪些临床病症。组合物可以使得总蛋白质种类中不超过约10%存在作为在生物治疗药物浓度下的不可逆聚集体。另选地,组合物使得如本文所讨论的阈值例如在例如约1.5至约2.0(a峰值/a450)的范围内。另一种替代方案为阈值为例如约1.5、约1.6、约1.7、约1.8、约1.9或约2.0(a峰值/a450)。在一些实施方案中,阈值在约0.7至约1.0(a峰值/a对照)的范围内。另一替代方案为,阈值为例如约0.7、约0.8、约0.9,或约1.0(a峰值/a对照)。在又一实施方案中,组合物使得总蛋白质种类中不超过约10%存在作为在生物治疗药物浓度下的不可逆聚集体,并且使得组合物具有如本文所讨论的阈值,例如在例如约1.5至约2.0(a峰值/a450)的范围内,或阈值为例如约1.5、约1.6、约1.7、约1.8、约1.9,或约2.0(a峰值/a450),和/或阈值在约0.7至约1.0(a峰值/a对照)的范围内,或者阈值为例如约0.7、约0.8、约0.9或约1.0(a峰值/a对照)。生物医药药物的浓度可为约50mg/ml或更高。另选地,生物医药的药物浓度可以在例如约50mg/ml至约500mg/ml,例如约50mg/ml至约250mg/ml,诸如例如约100mg/ml至约250mg/ml的范围内。组合物可以单剂量或多剂量按需给药,以获得所需的治疗结果。另选地,本发明涉及包括一种包括在高浓度下的生物治疗性药物(诸如例如蛋白质或抗体)以用于生产治疗所述生物治疗药物可治疗或可治愈的一种或多种疾病的药物的组合物。在一个实施方案中,本发明提供一种制备生物医药组合物(诸如例如蛋白质或抗体)以使所得组合物具有合适的流变学的方法。具体地,如本文所公开的用于确定蛋白质自组装的可能性的方法允许确定包括高生物医药药物浓度的稳定组合物的一系列规定。这种组合物的一个重要特性是粘度。因此,本发明的方法将允许制备具有所需物理性质的组合物,使得组合物可以经由所需的给药途径或方式给药。一种示例性给药途径可以是通过注射给药。因此,在这种情况下,重要的是使制备的组合物的粘度能够通过例如注射器和套管注射。这种套管可以是具有如下尺寸的套管,例如6g、8g、9g、10g、11g、12g、13g、14g、16g、19g、20g、21g、22g、23g、24g或26g。术语“粘度”是指动态或绝对粘度(在20℃和常压下),所述粘度是通过剪切应力或拉伸应力而变形的流体的阻力的测量。因此,“粘度”描述了流体的内部流动阻力,并且可以被认为是流体摩擦的测量。因此,粘性越小,越容易移动(流动性越大)。在本文中,相关的粘度范围从约10-10000mpa·s,例如约20-9000mpa·s,例如约30-8000mpa·s,例如约40-7000mpa·s,例如约50-6000mpa·s,例如约70-5000mpa·s,例如约90-4000mpa·s,例如约100-3000mpa·s或约10mpa·s,或约20mpa·s,或约30mpa·s,或约40mpa·s,或约50mpa·s,或者从约1mpa·s至约20mpa·s,例如约2mpa·s,例如约3mpa·s,例如约4mpa·s,例如约5mpa·s,例如约6mpa·s,例如约7mpa·s,例如约10mpa·s,约13mpa·s,约15mpa·s,例如约20mpa·s。粘度测量的其它单位为人们所熟知,例如,1厘泊相当于1mpa·s。不受任何特定理论的束缚,低浓度(即小于或等于10mg/ml)的典型蛋白质表现出约10cp的粘度。因此,表现出低于约10厘泊(低于约10mpa·s)的粘度的高度浓缩的蛋白质组合物,例如抗体组合物,非常适合用作生物医药组合物。具有约10至约15厘泊(约10mpa·s至约15mpa·s)粘度的蛋白质组合物(高浓度)在生产和药物开发过程中安全进行。具有约15至约20厘泊(约15mpa·s至约20mpa·s)粘度的蛋白质组合物(高浓度)在生产和药物开发过程中通知谨慎进行。粘度大于约20厘泊(大于约20mpa·s)的蛋白质组合物(高浓度)通知生产和药物开发处理有问题。粘度可以通过本文公开的各种组分和成分来控制。“可溶的”和“高度可溶的”还指对于本文公开的任何用途具有合适粘度的蛋白质,例如用于制备和使用生物医药组合物。在一个实施方案中,蛋白质为抗原结合蛋白,例如抗体、抗体片段或受体-fc融合蛋白。在一个实施方案中,含有蛋白质的宿主细胞是中国仓鼠卵巢(cho)细胞或cho细胞的衍生物,诸如cho-k1细胞或细胞(参见chen等人,us771997b2,2010年8月10日公开)。在一个实施方案中,纯化蛋白质的步骤包括将蛋白质经受(1)亲和力色谱法、离子交换色谱法、疏水相互作用色谱法、混合模式色谱法和羟基磷灰石色谱法中的一个或多个步骤;(2)超滤和渗滤中的一者或两者。在一个实施方案中,蛋白质被配制成至少50mg/ml的最终浓度。在一个实施方案中,蛋白质的浓度为约50mg/ml至约250mg/ml。在一个实施方案中,与蛋白质组合以形成配制的药物物质或药物产品的赋形剂包括张力调节剂、缓冲液、表面活性剂和稳定剂中的一种或多种。在一个实施方案中,张力调节剂为盐。在具体实施方案中,盐为氯化钠。在一个实施方案中,缓冲液以约ph6至约ph7缓冲。在具体实施方案中,缓冲液为组氨酸。在另一具体实施方案中,缓冲液为磷酸盐。在一个实施方案中,表面活性剂为聚山梨酸酯,诸如聚山梨酸酯20或聚山梨酸酯80。在一个实施方案中,稳定剂为糖,诸如蔗糖或海藻糖。在另一个实施方案中,稳定剂为氨基酸,例如脯氨酸或精氨酸。附图说明图1描绘分散的20nm金纳米粒子(a线)和聚结的20nm金纳米粒子(线b)的吸收曲线。y轴描绘光密度,单位为任意吸收单位。x轴描绘透射光波长,单位为纳米(nm)。图2描绘浓度不同的单克隆抗体2(mab2)和20nm金纳米粒子在2mm的盐(圆形)、20mm的盐(正方形)和200mm盐(三角形)中的吸收强度比的散点图。y轴描绘每个样品条件的峰值吸收强度与初始吸收强度的比。x轴描绘mab2的浓度,单位为μg/ml。图3描绘浓度不同的单克隆抗体(mab)1(空心符号)和mab5(实心符号)在存在20nm金纳米粒子的情况下在2mm的盐(正方形)、20mm的盐(三角形)和200mm的盐(圆形)中的吸收强度比的散点图。y轴描绘每个样品条件的峰值吸收强度与初始吸收强度的比。x轴描绘mab1的浓度,单位为μg/ml。左侧的框状区域(a)表示具有高选择值的较高胶体相斥条件的条件,中间的框状区域(b)表示具有谨慎或混合选择值的混合相斥和相吸条件的条件,并且右侧的框状区域(c)表示具有问题或低选择值的相吸的条件。图4描绘分散的20nm金纳米粒子与各种浓度的人血清白蛋白(hsa)结合后的多个吸收曲线的叠加(从在曲线的最右侧[750nm]部分处从上往下依次是3.125μg/ml、6.25μg/ml、12.5μg/ml、25μg/ml、50μg/ml、100μg/ml、200μg/ml和400μg/ml)。y轴描绘任意吸收,单位为任意单位。x轴描绘透射光波长,单位为纳米(nm)。图5描绘浓度不同的从图4中所描绘的原始吸收光谱导出的hsa和20nm金纳米粒子在2mm的盐(圆形)、20mm的盐(正方形)和200mm的盐(三角形)中的吸收强度比的散点图。y轴描绘每个样品条件的峰值吸收强度与初始吸收强度的比。x轴描绘hsa的浓度,单位为μg/ml。图6示出了浓度不同的单克隆抗体1(mab1)和20nm金纳米粒子在2mm的盐(圆形)、20mm的盐(正方形)和200mm盐(三角形)中的吸收强度比的散点图。y轴描绘每个样品条件的峰值吸收强度与初始吸收强度的比。x轴描绘mab1的浓度,单位为μg/ml。图7描绘在浓度和离子盐浓度不同的mab1的溶液的散射光强度的散点图:2mmnacl(圆形)、20mmnacl(正方形)和200mmnacl(三角形)。y轴表示光散射强度,单位为任意吸收单位。x轴表示mab1的浓度,单位为g/l。实线表示直径相当的理想硬球。图8描绘浓度不同的单克隆抗体6(mab6)和20nm金纳米粒子在2mm的盐(圆形)、20mm的盐(正方形)和200mm盐(三角形)中的吸收强度比的散点图。y轴描绘每个样品条件的峰值吸收强度与初始吸收强度的比。x轴描绘mab6的浓度,单位为μg/ml。图9描绘在浓度和离子盐浓度不同的mab6的溶液的散射光强度的散点图:2mmnacl(圆形)、20mmnacl(正方形)和200mmnacl(三角形)。y轴表示光散射强度,单位为任意吸收单位。x轴表示mab6的浓度,单位为g/l。实线表示直径相当的理想硬球。图10描绘浓度不同的单克隆抗体3(mab3)和20nm金纳米粒子在2mm的盐(圆形)、20mm的盐(正方形)和200mm盐(三角形)中的吸收强度比的散点图。y轴描绘每个样品条件的峰值吸收强度与初始吸收强度的比。x轴描绘mab3的浓度,单位为μg/ml。图11描绘浓度不同的单克隆抗体4(mab4)和20nm金纳米粒子在2mm的盐(圆形)、20mm的盐(正方形)和200mm盐(三角形)中的吸收强度比的散点图。y轴描绘每个样品条件的峰值吸收强度与初始吸收强度的比。x轴描绘mab4的浓度,单位为μg/ml。图12描绘浓度不同的单克隆抗体5(mab5)和20nm金纳米粒子在2mm的盐(圆形)、20mm的盐(正方形)和200mm盐(三角形)中的吸收强度比的散点图。y轴描绘每个样品条件的峰值吸收强度与初始吸收强度的比。x轴描绘mab5的浓度,单位为μg/ml。图13描绘以不同的缓冲液、ph值和离子强度配制的单克隆抗体7(mab7)在不同浓度下的吸收强度比的cd-sins散布图。每个符号表示不同的缓冲液、ph和离子强度配方,并且mab7浓度为可变的(x轴)。图14描绘在存在不同的糖、糖浓度和/或氨基酸的情况下配制的单克隆抗体7(mab7)在不同浓度下的吸收强度比的cd-sins散布图。每个符号表示不同的糖/氨基酸制剂,并且mab7浓度为可变的(x轴)。图15描绘与不同的苯甲酸盐化合物组合的单克隆抗体7(mab7)在不同浓度下(8μg/ml、32μg/ml、128μg/ml和512μg/mlmab7)的吸收强度比的cd-sins散布图。当与ρ-氨基苯甲酸[paba(-○-),空心圆]组合时,mab7表现出有利的动态胶体相互作用分布,其中吸收强度比(y轴)超过1.6。图16描绘在存在浓度变化的ρ-氨基苯甲酸(paba)的情况下单克隆抗体7(mab7)在不同浓度下的吸收强度比的cd-sins散布图。x轴描绘mab7的浓度的log2(以2为底的对数),单位为μg/ml。y轴描绘吸收强度比。空心圆形(-○-)表示不含paba,空心正方形(-□-)表示12mmpaba,空心三角形(-δ-)表示18mmpaba,实心圆形(--)表示24mmpaba,实心正方形(-■-)表示30mmpaba,而实心三角形(-▲-)表示36mmpaba。图17描绘不含paba(实心圆形[-●-])或含20mmpaba(实心三角形[-▲-])的mab7溶液的稳态剪切粘度作为mab7浓度(单位为g/l)的函数的点图(单位为mpa*s)。空心符号表示预期含有100g/lmab7的溶液的外推粘度。实施方式在描述本发明之前,应当理解,本发明并不限于所述的特定方法和实验条件,因为此类方法和条件可变化。还应理解,本文所用的术语仅出于描述具体实施方案的目的,并且不意图具有限制性,因为本发明的范围将仅受所附权利要求限制。除非另有定义,否则本文所用的全部技术和科学术语与本发明所属领域的普通技术人员所通常理解的意义具有相同的意义。如本文所用,引用特定的列举数值时使用的术语“约”意味所述值可相对于所述列举数值变化不超过15%。例如,如本文所用,表达式“约100”包括85和115以及其间的全部整数和非整数值(例如,86、86.001、87、88、88.3、89,等等)。赋形剂、成分和其它材料的绝对量和相对量可以通过质量或摩尔描述。质量单位可以表示为克、毫克、微克等。如“重量/体积”或“w/v”中的术语“重量”表示“质量”。相对量可以表达为重量百分比(即,质量百分比),其中百分之一(1%)重量/体积(w/v)表示每100毫升体积1克材料。另外,例如,每一(1)份成分“b”的一(1)份成分“a”(按重量计)意味着,例如,对于每一(1)克成分“a”,存在一(1)克成分“b”。另外,例如,百分之一(1%)的成分“a”(按重量计)意味着,例如,对于每100克的总粒子质量,存在一(1)克成分“a”。成分的相对量也可以表达为每给定体积的摩尔数或分子数,例如,每升(毫摩尔(mm))或每个其他成分的毫摩尔,例如,每y份成分“b”的x份成分“a”(按摩尔计)意味着,对于每x摩尔的“a”,存在y摩尔的“b”。尽管类似或等效于本文所述方法和材料的任何方法和材料可用于本发明的实践或测试中,现在描述示例性方法和材料。本文中提到的全部出版物以全文引用方式并入本文。确定动态胶体稳定性的测定:浓度相关的自相互作用纳米粒子光谱法(cd-sins)提供了用于确定蛋白质的动态维里范围的基于sins的简易测定法。蛋白质表现出复杂的行为,所述行为对蛋白质的化学物理环境非常敏感。因此,在一组特定的环境情况下评估蛋白质的维里系数不足以确定所述蛋白质在其他环境中的维里系数。获得给定蛋白质在大量条件下的多个维里系数费力且耗时。本发明人在本文公开了一种用于确定蛋白质的动态胶体稳定性的高产量测定法,所述方法通知选择可以配制或以其他方式保持高浓度而不出现与聚集相关的问题或者至少最小化可能聚集问题的蛋白质。所述测定以一种新颖的方式采用sins,即在变化的蛋白质浓度、变化的离子强度、变化的ph值的条件和其它条件下评估纳米粒子聚集。如上所述和在sule(2011)中,金纳米粒子涂覆有蛋白质并且置于缓冲溶液中。随着纳米粒子由于蛋白质自缔合而聚集,粒子的表面等离子体共振发生变化:最大吸收向较高波长转移(红移);并且吸收具有较低强度,即,吸收分布展开并且向左移动(图1)。这里,未涂覆的20nm金纳米粒子在约520至530nm处具有峰值吸收。常规sins与确定b22或a2的成熟静态光散射(sls)法的比较表明,受测的大多数抗体基本一致。表1比较了在sins测定法下用具体的不同单克隆抗体和人血清白蛋白(hsa)涂覆的珠子的峰值吸收与由sls确定的相同蛋白质的a2维里系数。如表1所示,sins分析容易区分相吸性(负a2)和相斥性(正a2)系统。然而,常规sins和sls测定法表明,相斥性条件没有动态范围。此外,常规sins与sls之间的少数差异指出某些蛋白质的复杂行为。表1本发明人观察到某些蛋白质能够在高浓度下稳定,但表现出负a2或红移的最大吸收光谱(λmax)。例如,mab5可以容易地达到约200g/l的浓度并保持稳定,但它的a2为负,并且其λmax在较低的离子强度下红移。类似地,mab2可以容易地达到约~175g/l的浓度并保持稳定,但其a2是在较低的盐浓度下为负,并且其λmax是在较低的离子强度下红移。本文公开了sins的改进方法。所述方法提供蛋白质的动态胶体稳定性数据,以便在开发时间线的早期评估蛋白质特异性现象,同时避免对大量蛋白质的需求。所述方法在溶液中存在变化量的蛋白质的情况下采用经涂覆纳米粒子表面等离子体共振,所述变化量超过涂覆纳米粒子所需的量。观察吸收曲线,计算每种变体样品的吸收强度比,并且绘图以确定所确定的动态胶体稳定性。在一个实施方案中,对于用于确定给定受测蛋白质的多个单独吸收强度比值的多个样品中的每个样品,纳米粒子与变化量的蛋白质相结合,所述变化量超出完全涂覆粒子所必要的最小蛋白质量。所用的最小蛋白质量取决于蛋白质的分子量(即,流体动力学半径)、纳米粒子的尺寸(表面积)和纳米粒子的浓度。例如,当以每ml约6至6.5×1011个粒子使用20nm金纳米粒子时,约2.5μg/ml约50至150kda的蛋白质足以完全涂覆纳米粒子。因此,在这些条件下,对于多个样品中的每个样品,使用超过2.5μg/ml的蛋白质。在本文中,例如,样品中包括的蛋白质为约2.6μg/ml至约512μg/ml或更高、约3±1μg/ml、约4±1μg/ml、约5±1μg/ml、约6±1μg/ml、约7±1μg/ml、约8±1μg/ml、约9±1μg/ml、约10±1μg/ml、约15±5μg/ml、约20±5μg/ml、约25±5μg/ml、约30±5μg/ml、约40±5μg/ml、约50±10μg/ml、约60±10μg/ml、约70±10μg/ml、约80±10μg/ml、约90±10μg/ml、约100±10μg/ml、约125±15μg/ml、约150±25μg/ml、175±25μg/ml、200±25μg/ml、225±25μg/ml、250±25μg/ml、300±50μg/ml、350±50μg/ml、400±50μg/ml、450±50μg/ml、500±50μg/ml或512±50μg/ml。在一些实施方案中,多个样品包括含有不同蛋白质浓度的两个样品、三个样品、四个样品、五个样品、六个样品、七个样品、八个样品、九个样品、10个样品或更多。例如,在一个实施方案中,多个样品包括6.3×1011粒子/毫升的20nm金纳米粒子和以约3.125μg/ml的第一浓度、6.25μg/ml的第二浓度、约12.5μg/ml的第三浓度、约25μg/ml的第四浓度、约50μg/ml的第五浓度、约100μg/ml的第六浓度、约200μg/m的第七浓度,和约400μg/ml的第八浓度的抗体。在一个实施方案中,对于用于确定给定主题蛋白质的多个单独吸收强度比值的多个样品中的每个样品,每个纳米粒子/蛋白质组合与可变的盐浓度相组合。例如,样品可含有中性盐蛋白质,如浓度为约1μm、约10μm、约100μm、约1mm、约2mm、约4mm、约6mm、约8mm、约10mm、约20mm、约30mm、约40mm、约50mm、约60mm、约70mm、约80mm、约90mm、约100mm、约150mm、约175mm、约200mm、约250mm或约300mm或更高的氯化钠。在另一个实施方案中,盐可以是离液盐,例如氯化胍、高氯酸锂、乙酸锂、氯化镁等。除了或代替离液盐,样品还可含有另一离液剂,例如丁醇、乙醇、苯酚、丙醇、十二烷基硫酸钠、硫脲或尿素。在另一个实施方案中,样品可含有亲液盐,例如碳酸盐、硫酸盐或磷酸盐,例如硫酸铵。多个样品可含有盐浓度不同的两个、三个、四个、五个、六个、七个、八个、九个或10个或更多个样品子集。因此,例如,多个样品可针对总共30个样品包括在三种不同的盐浓度下的10种不同的蛋白质浓度。在具体实施方案中,多个样品中的一个子集含有约2mm氯化钠,多个样品的另一子集含有约20mm氯化钠,而多个样品的另一子集含有约200mm氯化钠。2mm盐被认为低离子强度,而200mm被认为高离子强度。在经历经由疏水相互作用色谱法(hic)柱的纯化的蛋白质制备的情境下,使用高达并包括300mm盐的高张力,尽管这与大多数蛋白质治疗制剂无关。因此,本发明可用于确定在高浓度盐条件下的高浓度蛋白质是否适合于hic纯化等。向每个样品施加白光,并且获得其吸收光谱。计算多个样品中的每个样品的吸收强度比并且绘图。在纳米粒子不聚集或其中聚集低的那些样品中,即,当蛋白质表现出相斥性或低聚集可能性时,吸收峰值波长和吸收强度类似于对照未涂覆纳米粒子。在纳米粒子聚集的那些样品中,即,蛋白质表现出相吸性或高聚集可能性的那些样品中,吸收峰值波长向红色移动,并且吸收分布随着峰值吸收强度相对于对照未涂覆纳米粒子降低而变平。用于给定蛋白质的多个样品中的每个样品可以表现出不同的吸收曲线(即,不同的吸收强度比),在一些情况下展示出相吸性而在其他情况下展示出相斥性。这些蛋白质具有动态范围的胶体稳定性,并且在具体条件下可以是胶体稳定的。对于某些蛋白质,蛋白质可能在全部参数(样品)中展示出相斥性。这种蛋白质被认为是稳健的或具有强大的动态胶体稳定性。对于其他蛋白质,蛋白质可能在全部测试参数条件下展示出相吸性。这种蛋白质被认为是胶体不稳定的。可以选择那些在至少一种测试条件下(在至少一个样品中)表现出相斥性的蛋白质用于大规模生产和配制成稳定的药物物质。这些蛋白质在生产和储存过程中不太可能形成聚集体。此外,蛋白质表现出相斥性的那些条件可以通知蛋白质的生产步骤和制剂赋形剂作为药物物质。例如,如本文所述利用浓度相关的sins(cd-sins)可以确定蛋白质例如在下游超滤和渗滤步骤中的可生产性。选择用于大规模生产的低粘度蛋白质溶液可以提高生物加工的效率并降低成本(shiresj,2009,“formulationandmanufacturabilityofbiologies(生物制剂的配方和可生产性)”,curropinbiotechnol.20(6):708-14)。cd-sins通常也适用于广泛范围内的赋形剂(传统和非传统)。cd-sins可用于推导用于配制蛋白质药物物质的不同化学系列之间的结构-活性关系,并可用于针对逆转自缔合的赋形剂加以选择(参见实例11以及图13和14)。图3中描绘用于选择胶体稳定性动力学可接受的分子和条件的综合标准,其中绘出两种蛋白质mab1和mab5在三种离子强度条件下的吸收强度比。提供三种区域:(a)安全进行,包括预期在高浓度下稳定的稳健分子;(b)谨慎进行,包括在一些条件下表现高于阈值水平的吸收强度比的分子(例如,a峰值/a450≥1.7);以及(c)可能有问题,包括无法在任何条件下获得阈值吸收强度比的分子。例如,mab1(空心符号)就胶体稳定性而言稳健,在较低盐条件下(2mmnacl(空心正方形),20mmnacl(空心三角形))落入“安全进行”区域,而在较高盐条件下(200mmnacl(空心圆形))落入“谨慎进行”区域。相反地,mab5(实心符号)较不稳健,在较低盐条件下落入“可能有问题”区域,而在较高盐条件下落入“谨慎进行”区域。浓度相关的sins(cd-sins)展示蛋白质/溶剂体系随着蛋白质浓度增加如何“演变”。sins(cd-sins)捕获了不同蛋白质表现出高蛋白质浓度的大量胶体相互作用:相斥到理想(中性);相吸到理想;理想到相吸;以及敏感性。sins(cd-sins)捕获了胶体相互作用的许多不同方面,诸如电荷介导的相斥或相吸,束静电筛选,并且定性地提供相当广泛的动态范围。cd-sins揭露可能的疏水介导问题,并且标记通常有问题的分子。方法提供一种用于评估高蛋白质浓度可开发性但对蛋白质要求显著最低的分析工具,并且所述方法能够实现自动化。相吸或混合的胶体蛋白质的粘度降低动态胶体相互作用特征不利(例如,易于自缔合)的蛋白质通常在较高浓度下具有高粘度。在高浓度下的这种高粘度可使得蛋白质不可用于肠胃外注射。本文所述cd-sins测定法用于筛选粘度降低赋形剂。在一个方面,提供一种生产粘度降低蛋白质制剂的方法。在一个实施方案中,可能的粘度降低赋形剂在一些实施方案中,相对于不含粘度降低赋形剂的蛋白质溶液的粘度,粘度降低赋形剂将蛋白质溶液的粘度降低了至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍或>5倍。在一些实施方案中,粘度降低赋形剂是氨基酸或氨基酸的盐。在一些实施方案中,粘度降低赋形剂是烃、烷烃、烯烃、和炔烃、脂肪酸、脂肪酸尾部、含苯结构、苯甲酸、取代的烃、取代的烷烃、取代的烯烃、取代的炔烃,取代的脂肪酸、取代的脂肪酸尾部、取代的含苯结构、取代的苯甲酸、磺酸、氨基苯甲酸、烷基化的苯甲酸、羟基苯甲酸或铵苯甲酸盐。在一个实施方案中,粘度降低赋形剂是对氨基苯甲酸(paba)。在一个实施方案中,paba以5mm、6mm、7mm、8mm、9mm、10mm、11mm、12mm、13mm、14mm、15mm、16mm、17mm、18mm、19mm、20mm、21mm、22mm、23mm、24mm或25mm的浓度包括在蛋白质制剂中。在一个实施方案中,粘度降低赋形剂是在蛋白质溶液中以>12mm的浓度或以20mm的浓度组合的paba。定义如本文所用,可与“自缔合倾向”或“聚集倾向”互换使用的术语“胶体稳定性”是指通过空间分子力的净(总)效果,例如静电、范德华力等,可以导致蛋白质的相吸性、中性或相斥性相互作用可能性。如本文所用,术语“吸收强度比”是指样品的峰值吸收强度与基线吸收强度之比。基线强度可以从相比预期吸收波长足够短或长的任意波长处的样品的吸收获得。在一些实施方案中,20nm金纳米粒子的预期吸收波长为约500至600nm,并且在约530nm处达到峰值。因此,基线吸收强度可以是波长低于500或高于600的样品的吸收强度。例如,基线吸收强度可以是样品在450nm处的吸收强度。本文中,吸收强度比是样品的峰值吸收波长处的吸收强度(a峰值)除以在450nm处的吸收强度(a450或a初始)。在其它实施方案中,基线吸收强度可以是未涂覆纳米粒子(对照纳米粒子)的峰值吸收强度。本文中,对不含蛋白质但在从其取样实验性涂覆纳米粒子的相同缓冲盐中的纳米粒子进行吸收分析。未涂覆对照纳米粒子的峰值吸收强度(a对照)用作基线吸收强度。本文中,吸收强度比计算为a峰值/a对照。吸收通常以任意单位表达,所述单位在计算比时抵消。通过使白光源通过样品来测量吸收。根据样品的光学性质,样品以一定的强度吸收某些波长的光。在多个波长处测量穿过样品的光强度,即“透射光”,并且计算“吸收光”的强度。金纳米粒子的吸收光谱是通过粒子表面等离子体共振测定。入射光的电场与金粒子表面上的自由电子相互作用,并且在可见光区域产生强烈的吸收。所述光学性质取决于纳米粒子的尺寸、形状和附聚状态。例如,较小的粒子(直径为20nm)在较低波长(~522nm)处吸收,并且具有比较大粒子更窄且更强烈的峰(a=~0.6)(例如,250nm粒子在570-660nm处吸收最强,强度为20nm粒子强度的约40%)。不规则形状的粒子展示出相对于球体粒子红移的较低强度的较宽峰。同样,附聚粒子展示出相对于离散的分散球体粒子红移(图1)的较低强度的较宽峰。如本文所用,术语“阈值”表示如果蛋白质的吸收强度比高于所述“阈值”,那么就被认为可在溶液中实现稳定的高浓度。吸收比低于阈值的蛋白质样品指出至少在ph、离子强度和蛋白质密度的实验条件下,蛋白质可能无法在溶液中实现稳定的高浓度。蛋白质在溶液中达到高浓度的可行性与蛋白质的“相吸性”或自缔合的可能性成反比,并且与蛋白质的“相斥性”正相关。在一些实施方案中,阈值为约1.5、1.6、1.7、1.8、1.9或2(a峰值/a450)。在一些实施方案中,阈值为约0.7、0.8、0.9或1(a峰值/a对照)。如本文中所用,术语“动态范围”是指蛋白质在一定条件范围内自缔合的可能性。使用自相互作用纳米粒子光谱法(sins)的现有技术自缔合测定仅测量蛋白质在单组条件下的自缔合可能性。在单点测定可被拒绝的情况下,蛋白质被认为是“相吸性的”,而在所述测定中被认为是“相斥性的”的蛋白质可以保留用于高浓度制剂和生产。本文中,在不同的实验条件下获得一系列吸收强度比并且绘图,从而产生特定蛋白质的“动态范围”曲线。在一些条件下,蛋白质可具有低于阈值的吸收强度比,而在其他条件下,蛋白质可具有高于阈值的吸收强度比。在这些条件下,这种蛋白质具有可接受的相斥程度,这可以为蛋白质生产过程和制剂赋形剂和浓度的选择提供信息。例如,单克隆抗体2(mab2)在高浓度/高离子强度(例如,200mmnacl)条件下展示出可接受的相斥程度,但在低离子强度条件下展示出不可接受的相吸性(图2)。用于确定蛋白质的动态范围的实验条件包括蛋白质的浓度;纳米粒子的大小、形状数;制备纳米粒子的材料;用蛋白质涂覆纳米粒子的方法;缓冲液或溶剂中成分的性质和数量;ph值;以及溶液的离子强度。例如,缓冲液的ph值可能会取决于蛋白质的等电点(pi)而影响蛋白质的总电荷,而电荷反过来可能会影响蛋白质的二级维里系数(负b22是相吸性的,而正b22是相斥性的)。通常已知离子强度(即,盐含量)影响蛋白质自相吸,其中增加的离子强度保护蛋白质免于基于电荷的相斥并促进相吸。在一些实施方案中,数据点(即,吸收强度比)取自不同的盐浓度或完全无盐的情况。例如,盐,例如氯化钠,可以以痕量至过饱和的任何浓度包括在内。在一些实施方案中,氯化钠以约0.1mm至约1m、1mm至500mm,或2mm至300mm的浓度包括在“缓冲盐”中。在一些实施方案中,数据点取自两种、三种、四种、五种、六种、七种、八种、九种、10种或更多种不同的盐浓度条件。在一个实施方案中,使用至少三种盐浓度条件,例如2mm、20mm和200mm氯化钠。在另一个实施方案中,使用至少五种盐浓度条件。五种盐浓度条件的非限制性实例可包括:1mm、2mm、20mm、200nm和300mm氯化钠,或1mm、5mm、20mm、100mm和300mm氯化钠。本领域技术人员可以通过使用基于感兴趣蛋白质的实验或治疗用途的性质的不同盐和/或盐条件来容易地调整测定。如本文所用,术语“缓冲盐”表示含有缓冲液和盐的水溶液。盐可以在任何浓度下,并且缓冲液可以在任何ph范围内具有缓冲能力。在一些实施方案中,盐和缓冲液可以是同一种,例如碳酸钙。已知盐影响蛋白质相互作用并且通常用于沉淀蛋白质,以影响蛋白质折叠、稳定药物制剂、提供张力,以及在色谱法期间调节蛋白质行为。盐可以是亲液(氢键的正自由能)或离液(氢键的负自由能)剂。亲液剂促进水之间的相互作用,并且通常用于盐析蛋白质。亲液离子的实例包括碳酸根、硫酸根、磷酸根、镁根、锂、锌和铝。离液剂破坏氢键并削弱疏水效应,从而促进蛋白质变性。离液盐的实例包括氯化胍、高氯酸锂、乙酸锂和氯化镁。像氯化钠这样的盐类位于霍夫梅斯特序列的中间附近,这意味着它们既没有有效的盐溶也没有盐析。取决于蛋白质自缔合测定的目的,可以针对盐溶、盐析或在生理浓度下保持有效中性的能力来选择缓冲盐的盐。包括“缓冲液”以控制ph值,这反过来又影响蛋白质的电荷性质,以及随后的结构和功能。取决于蛋白质自缔合测定的目的,可以例如针对增强蛋白质纯化、促进长期蛋白质稳定性或在给药治疗性蛋白质期间使患者舒适的能力来选择缓冲液。有用的缓冲液是本领域公知的,包括mes、tris、pipes、mops、磷酸盐、柠檬酸盐-磷酸盐、柠檬酸盐、乙酸盐、碳酸盐-碳酸氢盐、组氨酸、咪唑等。在一个特定的实施方案中,蛋白质自缔合测定中使用的缓冲液是mes(2-(n-吗啉代)乙磺酸),其具有约ph5.5至6.7的有用缓冲液范围。在具体实施方案中,mes以约10mm、ph6包括在缓冲盐中。缓冲液用于测定系统和试剂的缓冲盐组分。缓冲液也用于控制含有超出测定的蛋白质的溶液的ph。缓冲液用于用于生产蛋白质的细胞培养物生产培养基中。缓冲液还用于蛋白质纯化期间使用的溶液和其中部署的各种单元操作。缓冲液用于配制的药物物质和最终的药物产品制剂。可用于蛋白质制剂的缓冲液是本领域已知的,包括组氨酸、琥珀酸盐、柠檬酸盐、乙酸盐、磷酸盐等。缓冲液可以以1mm至100mm的浓度包括在配制的药物物质(fds)或药物产品(dp)中。在一些特定的实施方案中,缓冲液以约10mm包括在产品中。在某些实施方案中,缓冲液以5mm±0.75mm至15mm±2.25mm;6mm±0.9mm至14mm±2.1mm;7mm±1.05mm至13mm±1.95mm;8mm±1.2mm至12mm±1.8mm;9mm±1.35mm至11mm±1.65mm;10mm±1.5mm;或约10mm的浓度存在。在一些具体实施方案中,fds或dp的缓冲液系统包括10mm±1.5mm的组氨酸、磷酸盐和/或乙酸盐。在一些实施方案中,缓冲液是选自能够缓冲约3至约9的ph范围内,或约3.7内至约8.0的ph范围内某处的化学品。例如,预冻干溶液可具有约3.4、约3.6、约3.8、约4.0、约4.2、约4.4、约4.6、约4.8、约5.0、约5.2、约5.4、约5.6、约5.8、约6.0、约6.2、约6.4、约6.6、约6.8、约7.0、约7.2、约7.4、约7.6、约7.8或约8.0的ph。缓冲液可以是单独的缓冲液,诸如,例如,组氨酸和乙酸盐(其乙酸盐缓冲液)的组合。在一个实施方案中,缓冲液具有约3.5至约6、或约3.7至约5.6的缓冲范围,例如由乙酸盐缓冲的范围。在一个实施方案中,缓冲液具有约5.5至约8.5、或约5.8至约8.0的缓冲范围,例如由磷酸盐缓冲的范围。在一个实施方案中,缓冲液具有约5.0至约8.0、或约5.5至约7.4的缓冲范围,例如由组氨酸缓冲的范围。如本文所用,术语“纳米粒子”指的是球体、近球体或类球体粒子,直径在10-9m(0.001微米)至10-6m(1微米)的标度。纳米粒子可包括任何材料,包括有机聚合物、金属、半导体材料、磁性材料和材料的组合。金属纳米粒子特别适用于基于表面等离子共振的测定,因为金属球在其表面上具有自由电子,所述电子可以与来自入射光的电场相互作用,从而产生强吸收光谱。金纳米粒子和银纳米粒子是用于测量等离子体共振变化的金属纳米粒子的实例。纳米粒子的尺寸、形状和材料影响最大吸收的强度和波长。直径为20nm至400nm的金纳米粒子是有用的。在一些实施方案中,在自缔合动态范围测定中使用的纳米粒子是直径为约20nm、30nm、40nm、50nm、60nm、80nm或100nm的金纳米粒子(aunp)。如本文所用,术语“光”意味着电磁辐射(emr)。光可以具有单个波长、窄波长范围、宽波长范围(例如“白光”)、波长集合。光可以呈激光束的形式或者是漫射光。自聚集测定是分光光度测定,其中测量样品对光的影响。因此,向样品施加光(即,“入射光”),样品与光相互作用,例如产生等离子体并吸收特定波长的光(即,吸收光),并且光的一部分透射通过样品到达检测器(即,“透射光”)。在一些实施方案中,入射光是包括具有400nm至800nm波长的emr的白光。在一些实施方案中,透射光是在跨越400nm至800nm的波长处检测和测量的,由此确定吸收强度。如本文所用,术语“自缔合”是指特异性蛋白质到相同物种的另一蛋白质的非特异性结合。非特异性的意思是通过在非生物学上被认为的弱力的联系。为了区分非特异性和特异性相互作用,两个相同的抗体半部形成完整抗体的缔合被认为是特异性相互作用。相反,通过范德华力或疏水相互作用形成两个或更多个相同的完整抗体以形成可逆或不可逆的二聚体、三聚体或更高级多聚体的“非特异性”。如本文所用,术语“稳定的”或“稳定性”是指蛋白质或其他生物大分子的物理结构(热力学稳定性)、化学结构(动力学稳定性)或生物学功能(功能稳定性)随着时间推移的可接受保留程度。即使蛋白质在储存一段时间后仍未维持100%的物理结构、化学结构或生物学功能,蛋白质也可能是稳定的。在某些情况下,在储存特定时间后维持蛋白质结构或功能的约90%、约95%、约96%、约97%、约98%或约99%可被视为“稳定的”。稳定性可通过确定样品中保持的天然蛋白质的百分比来测量。保留其天然形式的蛋白质的百分比可以通过尺寸排阻色谱法测定,所述尺寸排阻色谱法将低分子量天然蛋白质与蛋白质的高分子量聚集体分离。随着时间的推移,稳定的蛋白质将保留其天然结构的90%或更多。稳定的蛋白质含有不超过总蛋白质种类的10%作为不可逆聚集体。稳定的蛋白质具有聚集体形成的低速率。稳定的蛋白质经历的高分子量物质形成(即,聚集)的增加在约5℃至约25℃下长达7个月、长达8个月、长达9个月、长达10个月、长达11个月、长达12个月、长达13个月、长达14个月、长达15个月、长达16个月、长达17个月、长达18个月、长达19个月、长达20个月、长达21个月、长达22个月、长达23个月、或长达24个月的储存期间小于15%、小于14%、小于13%、小于12%、小于11%、小于10%、小于9%、小于8%、小于7%、小于6%、小于5%、小于4%、小于3%、小于2%、小于1%、或小于0.5。可以使用其他方法,诸如例如,差示扫描量热法(dsc)来评估蛋白质的稳定性以确定热稳定性,评估受控的搅拌以确定机械稳定性,以及评估在约350nm或约405nm处的吸收以确定溶液浊度。在一个实施方案中,如果在约5℃至约25℃下储存6个月或更长时间后,蛋白质可被认为是稳定的,那么相比时间零时蛋白质的od405,制剂的od405变化小于约0.05(例如,0.04、0.03、0.02、0.01或更小)。如本文所用,术语“蛋白质”是指具有小于约50个氨基酸通过酰胺键共价连接的多个任意的氨基酸聚合物。蛋白质含有一个或多个本领域称为“多肽”的氨基酸聚合物链。蛋白质可含有一种或多种多肽以形成单一功能的生物分子。“多肽”通常含有超过50个氨基酸,而“肽”通常含有50个氨基酸或更少。蛋白质可含有一种或多种共价和非共价修饰。二硫键(即,在半胱氨酸残基之间形成胱氨酸)可存在于一些蛋白质中。这些共价连接可以在单个多肽链内,或在两个单独的多肽链之间。例如,二硫键对于胰岛素、免疫球蛋白、鱼精蛋白等的适当结构和功能是必需的。关于二硫键形成的最新综述,参见oka和bulleid,“formingdisulfidesintheendoplasmicreticulum(在内质网中形成二硫化物)”,1833(11)biochimbiophysacta2425-9(2013)。除了二硫键形成,蛋白质可能会经受其他的翻译后修饰。这些修饰包括脂化(例如,豆蔻酰化、棕榈酰化、法尼基化、香叶基香叶基化和糖基磷脂酰肌醇(gpi)锚定形成)、烷基化(例如甲基化)、酰化、酰胺化、糖基化(例如,向精氨酸、天冬酰胺、半胱氨酸、羟基赖氨酸、丝氨酸、苏氨酸、酪氨酸和/或色氨酸添加糖基)和磷酸化(即,向丝氨酸、苏氨酸、酪氨酸和/或组氨酸添加磷酸基团)。关于真核生物中生成的蛋白质的翻译后修饰的最新综述,参见mowen和david,“unconventionalpost-translationalmodificationsinimmunologicalsignaling(免疫学信号传导中的非常规翻译后修饰)”,15(6)natimmunol512-20(2014);以及blixt和westerlind,“arrayingthetranslation-translationalglycoproteome(ptg),”18curropinchembiol.62-9(2014)。蛋白质的实例包括治疗性蛋白质、用于研究或治疗的重组蛋白质、捕获蛋白质和其他受体fc-融合蛋白、嵌合蛋白、抗体、单克隆抗体、人源抗体、双特异性抗体、抗体片段、纳米抗体、重组抗体嵌合体、细胞因子、趋化因子、肽激素等。蛋白质可以使用基于重组细胞的生产系统产生,例如昆虫杆状病毒系统、酵母系统(例如,毕赤酵母属sp.)、哺乳动物系统(例如,cho细胞和cho衍生物,例如cho-k1细胞)。关于讨论治疗性蛋白质及其生产的最新综述,参见ghaderi等人,“productionplatformsforbiotherapeuticglycoproteins.occurrence,impact,andchallengesofnon-humansialylation”,28biotechnolgenetengrev.147-75(2012)。如本文所用,“抗原结合蛋白”一词是指能结合另一分子实体的任何蛋白质。分子实体可以是肽、多肽、蛋白质、表位、半抗原、抗原或生物分子。例如,抗原结合蛋白包括结合配体的受体分子,其中配体是抗原。抗原结合蛋白包括抗体、抗体片段(例如,fab)、单链抗体、scfv分子、包括受体和受体部分的重组蛋白、配体分子、包括配体或配体部分的重组蛋白、包括多个受体的重组分子或受体片段(例如,受体-fc-融合蛋白)等。“抗体”或“免疫球蛋白分子”是抗原结合蛋白的子集或子类型。典型的免疫球蛋白蛋白质(例如,igg)包括由二硫键互连的四个多肽链、两个重(h)链和两个轻(l)链。各重链包括重链可变区(文中缩写为hcvr或vh)和重链恒定区。重链恒定区包括三个结构域,即ch1、ch2和ch3。各轻链包括轻链可变区(文中缩写为lcvr或vl)和轻链恒定区。轻链恒定区包括一个结构域,cl。vh和vl区可进一步细分为高变区(称为互补决定区(cdr)),其间散布着较保守的区(称为框架区(fr))。各vh和vl由三个cdr和四个fr构成,从从氨基末端到羧基末端依次布置为:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4(重链cdr可以缩写为hcdr1、hcdr2和hcdr3;轻链cdr可以缩写为lcdr1、lcdr2和lcdr3。如本文所用,“单克隆抗体”仅指单分子实体的抗体,通常由产生单一抗体的亲本细胞的克隆产生。单克隆抗体与多克隆抗体的区别在于多克隆抗体表示由不同细胞产生的抗体集合。单克隆抗体可以具有单价亲和力,这意味着两个抗体半部是相同的并且与“双特异性抗体”中的相同表位或二价亲和力结合,这意味着一个抗体与另一个抗体一半结合不同的表位。“双特异性抗体”包括能够选择性地结合两个或更多个表位的任何抗体。双特异性抗体通常包括两条不同的重链,每条重链在两个不同的分子(例如抗原)上或在同一分子上(例如,在相同的抗原上)特异性地结合不同的表位。如果双特异性抗体能够选择性地结合两个不同的表位(第一表位和第二表位),那么第一重链对第一表位的亲和力通常比第一重链对第二表位的亲和力至少低一到两个或三个或四个数量级,并且反之亦然。由双特异性抗体识别的表位可以在相同或不同的靶上(例如,在相同或不同的蛋白质上)。例如,可以通过将识别相同抗原的不同表位的重链组合来制备双特异性抗体。例如,对识别相同抗原的不同表位的重链可变序列编码的核酸序列可与对不同重链恒定区编码的核酸序列融合,并且这种序列可以在表达免疫球蛋白轻链的细胞中表达。典型的双特异性抗体具有两条重链,每条重链具有三个重链cdr,然后是(从n末端到c末端)chi结构域、铰链、ch2结构域和ch3结构域,以及免疫球蛋白轻链,所述轻链不赋予抗原结合特异性,但可与每条重链缔合,或者可与每条重链缔合并且可结合由重链抗原结合区所结合的一个或多个表位,或者可与每个重链缔合并且能够使重链中的一个或两个与一个或两个表位结合。短语“重链”或“免疫球蛋白重链”包括来自任何生物体的免疫球蛋白重链恒定区序列,并且,除非另有指明,否则包括重链可变结构域。除非另有指明,否则重链可变结构域包括三个重链cdr以及四个fr区。重链的片段包括cdr、cdr和fr,及其组合。典型重链具有以下可变结构域(从n末端到c末端):ch1结构域、铰链、ch2结构域和ch3结构域。重链的功能片段包括能够明确识别抗原(例如,识别kd在微摩尔每升、纳米摩尔每升或皮摩尔每升范围内的抗原)的片段、能够由细胞表达并分泌的片段,以及包括至少一个cdr的片段。短语“轻链”包括来自任何生物体的免疫球蛋白轻链恒定区序列,并且,除非另有指明,否则包括人源κ(kappa)和λ(lambda)轻链。除非另有指明,否则轻链可变(vl)结构域通常包括三个轻链cdr和四个框架(fr)区。通常,全长轻链从氨基末端到羧基末端包括,包括fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4的vl结构域,和轻链恒定结构域。可与本发明一起使用的轻链包括例如不选择性地结合被抗原结合蛋白选择性地结合的第一或第二抗原的轻链。合适的轻链包括可以通过筛选现有抗体库(真实库或电子库)中最常用的轻链来识别的那些轻链,其中所述轻链基本上不干扰抗原结合蛋白的抗原结合结构域的亲和力和/或选择性。合适的轻链包括可以结合由抗原结合蛋白的抗原结合区结合的一个或两个表位的轻链。短语“可变结构域”包括免疫球蛋白轻链或重链(视需要修饰)的氨基酸序列,所述序列从n末端到c末端依序包括以下氨基酸区(除非另有指明):fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。“可变结构域”包括能够折叠到具有双β板结构的典型结构域(vh或vl)中的氨基酸序列,其中所述β板由第一β板与第二β板之间的残基的二硫键连接。术语“互补决定区”或术语“cdr”包括由生物体的免疫球蛋白基因的核酸序列编码的氨基酸序列,通常在(即,在野生型动物)免疫球蛋白分子(例如,抗体或t细胞受体)的轻链或重链可变区中的两个框架区之间出现。cdr可由例如生殖系序列或重排或未重排序列,以及例如由天然或成熟b细胞或t细胞所编码。在一些情况(例如,cdr3)下,cdr可由两个或更多个序列(例如,生殖系序列)编码,所述两个或更多个序列为不连续的(例如,未重排核酸序列),但在b细胞核酸序列中为连续的,例如,由于序列的剪接或连接(例如,v-d-j重组而形成重链cdr3)。含fc蛋白包括抗体、抗体、双特异性抗体、免疫粘附素、“受体-fc-融合蛋白”和包括至少免疫球蛋白ch2和ch3区的功能部分的其他结合蛋白质。“功能部分”是指可以结合fc受体(例如,fcγr;或fcrn,即新生儿fc受体)和/或可以参与互补序列活化的ch2和ch3区。如果ch2和ch3区含有缺失、置换和/或插入或导致无法结合任何fc受体并且还无法活化互补序列的其他修饰,那么ch2和ch3区是没有功能的。含fc的蛋白可包括在免疫球蛋白结构域的修饰,包括修饰影响结合蛋白的一种或多种效应子功能(例如,影响fcγr结合、fcrn结合和由此半衰期,和/或cdc活性的修饰)的情况。这些修饰包括但不限于以下修饰及其组合,参考免疫球蛋白恒定区的eu编号:238,239,248,249,250,252,254,255,256,258,265,267,268,269,270,272,276,278,280,283,285,286,289,290,292,293,294,295,296,297,298,301,303,305,307,308,309,311,340,342,344,356,358,359,360,361,362,373,375,376,378,380,382,383,384,386,388,389,398,414,416,419,428,430,433,434,435,437,438和439。作为实例而并不作为限制,结合蛋白质为含fc蛋白并且表现出增强的血清半衰期(与不具有所述修饰的相同含fc蛋白相比),并且具有在位置250(例如,e或q);250和428(例如,l或f);252(例如,l/y/fav或t)、254(例如,s或t),以及256(例如,s/r/q/e/d或t)处的修饰;或在428和/或433(例如,l/r/si/p/q或k)和/或434(例如,h/f或y)处的修饰;或在250和/或428处的修饰;在307或308(例如,308f、v308f)和434处的修饰。在另一实例中,修饰可包括428l(例如,m428l)和434s(例如,n434s)修饰;428l、2591(例如,v259i),和308f(例如,v308f)修饰;433k(例如,h433k)和434(例如,434y)修饰;252、254和256(例如,252y、254t和256e)修饰;250q和428l修饰(例如,t250q和m428l);307和/或308修饰(例如,308f或308p)。某些重组含fc蛋白包括具有在生物系统中的同源结合配偶体的受体或受体片段、配体或配体片段。“受体fc-融合蛋白”是指含有与免疫球蛋白fc结构域融合的可溶性受体的重组分子。一些受体fc融合蛋白可含有多种不同受体的配体结合结构域。那些受体fc融合蛋白被称为“陷阱”或“陷阱分子”。利纳西普(rilonocept)和阿柏西普(aflibercept)是分别拮抗il1r(参见美国专利号7,927,583)和vegf(参见美国专利号7,087,411)的市售诱捕器的实例。其他重组含fc蛋白包括那些含有与fc结构域融合的肽的重组蛋白,例如centocor的mimetibodytm技术。c.huang在“receptor-fcfusiontherapeutics,traps,andmimetibodytechnology,”20(6)curr.opin.biotechnol.692-9(2009)描述了重组含fc蛋白。如本文所用,术语“张力调节剂”或“张力剂”是向制剂或溶液提供张力或渗摩度的物质或物质的组合。制剂可能需要每千克溶剂近似0.29渗摩溶质的生理渗摩度(290mosm)。具有生理渗摩度的制剂通常称为生理学等渗的。制剂可具有低于290mosm(生理学低渗)或高于290mosm(生理学高渗)的渗透度。将张力调节剂添加到制剂中以将制剂调节至适当的张力。术语“张力”可与渗透度或渗摩度互换使用。张力调节剂包括被添加以调节离子强度或电导的盐,和非盐张力调节剂。常用的盐包括氯化钠、氯化钾、氯化镁和氯化钙。非盐张力调节剂包括糖、糖醇、单糖和二糖,所述实例包括山梨糖醇、甘露糖醇、蔗糖、海藻糖、甘油、麦芽糖和乳糖。如本文所用,术语“表面活性剂”是指降低界面的表面张紧力的添加剂或赋形剂。一些表面活性剂具有亲脂部分和亲水部分。据信,表面活性剂通过减少蛋白质-蛋白质疏水相互作用和由此形成的高分子量物质(即,聚集体)而提供附加的稳定性。一种或多种表面活性剂可包括在含蛋白质的溶液中,包括fds、dp、蛋白质处理和生产溶液,以及蛋白质自缔合测定溶液。表面活性剂可为离子的或非离子的。非离子表面活性剂包括例如烷基聚(环氧乙烷)、烷基多葡糖苷(例如辛基葡糖苷和癸基麦芽糖苷)、脂肪醇,例如鲸蜡醇和油醇、椰油酰胺mea、椰油酰胺dea和椰油酰胺tea。具体的非离子表面活性剂包括例如,聚氧乙烯脱水山梨糖醇酯(又名聚山梨醇酯),例如聚山梨醇酯20、聚山梨醇酯28、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯65、聚山梨醇酯80、聚山梨醇酯81和聚山梨醇酯85;泊洛沙姆,例如泊洛沙姆188、泊洛沙姆407;聚乙二醇-聚丙二醇;或聚乙二醇(peg)。聚山梨醇酯20也称为tween20、脱水山梨糖醇单月桂酸酯和聚氧乙烯山梨糖醇酐单月桂酸酯。聚山梨醇酯80也称为tween80、脱水山梨糖醇单油酸酯和聚氧乙烯山梨糖醇酐单油酸酯。含蛋白质的溶液内所含表面活性剂的量可取决于溶液的所期望的特定性质和用途而变化。在某些实施方案中,溶液可含有约0.001%(w/v)至约0.5%(w/v)的表面活性剂(例如聚山梨醇酯20或聚山梨醇酯80)。例如,溶液可含有约0.001%;约0.0015%;约0.002%;约0.0025%;约0.003%;约0.0035%;约0.004%;约0.0045%;约0.005%;约0.0055%;约0.006%;约0.0065%;约0.007%;约0.0075%;约0.008%;约0.0085%;约0.009%;约0.0095%;约0.01%;约0.015%;约0.016%;约0.017%;约0.018%;约0.019%;约0.02%;约0.021%;约0.022%;约0.023%;约0.024%;约0.025%;约0.026%;约0.027%;约0.028%;约0.029%;约0.03%;约0.031%;约0.032%;约0.033%;约0.034%;约0.035%;约0.036%;约0.037%;约0.038%;约0.039%;约0.04%;约0.041%;约0.042%;约0.043%;约0.044%;约0.045%;约0.046%;约0.047%;约0.048%;约0.049%;约0.05%;约0.051%;约0.052%;约0.053%;约0.054%;约0.055%;约0.056%;约0.057%;约0.058%;约0.059%;约0.06%;约0.061%;约0.062%;约0.063%;约0.064%;约0.065%;约0.066%;约0.067%;约0.068%;约0.069%;约0.07%;约0.071%;约0.072%;约0.073%;约0.074%;约0.075%;约0.076%;约0.077%;约0.078%;约0.079%;约0.08%;约0.081%;约0.082%;约0.083%;约0.084%;约0.085%;约0.086%;约0.087%;约0.088%;约0.089%;约0.09%;约0.091%;约0.092%;约0.093%;约0.094%;约0.095%;约0.096%;约0.097%;约0.098%;约0.099%;约0.10%;约0.15%;约0.20%;约0.25%;约0.30%;约0.35%;约0.40%;约0.45%;或约0.50%的表面活性剂(例如聚山梨醇酯20或聚山梨醇酯80)。如本文所用,术语“稳定剂”是指用于稳定蛋白质的天然构象的分子或化合物或化学实体的组合(即,多于一个的化学实体)。稳定剂通过以下一种或多种机制稳定溶液中的蛋白质:(1)增加水的表面张力,(2)蛋白质-赋形剂排除,在蛋白质周围形成一层水,(3)负肽键相互作用,以及(4)与蛋白质表面的相斥性相互作用。无论具体机制如何,优先将稳定剂排除在蛋白质表面之外,从而使蛋白质表面的水富集。此外,不利的蛋白质-赋形剂相互作用导致在热力学上不利的蛋白质伸展,因为蛋白质的表面积在变性期间增加。稳定剂包括例如多元醇、糖、氨基酸、盐析盐或其任何组合。有用的稳定剂的实例包括聚乙二醇、山梨糖醇、甘油、甘露醇、海藻糖、蔗糖、精氨酸、丙氨酸、脯氨酸、甘氨酸、氯化钠或其任何组合。蔗糖和海藻糖是最常用的糖。本发明由以下非限制性项描述。项1.一种用于确定蛋白质自缔合的可能性的方法,所述方法包括:a.将蛋白质、纳米粒子和缓冲盐组合以形成样品;b.用光激发所述样品;c.测量透过所述样品的光;d.计算所述样品的吸收强度比,其中,当所述吸收强度比超过阈值时,所述蛋白质在高浓度下为稳定的。项2.如项1所述的方法,其中,所述蛋白质为抗原结合蛋白。项3.如项2所述的方法,其中,所述抗原结合蛋白为抗体、抗体片段或受体-fc融合蛋白。项4.如项3所述的方法,其中,所述抗原结合蛋白为人源单克隆抗体。项5.根据前述项中任一项所述的方法,其中,所述蛋白质以约2μg/ml至约512μg/ml的浓度存在于所述样品中。项6.根据前述项中任一项所述的方法,其中,所述纳米粒子为金纳米粒子。项7.如项6所述的方法,其中,所述金纳米粒子具有约20nm至约100nm的直径。项8.如项7所述的方法,其中,所述金纳米粒子的所述直径为约20nm。项9.根据前述项中任一项所述的方法,其中,所述样品包括每ml约5x1011至约8x1011个纳米粒子。项10.根据前述项中任一项所述的方法,其中,所述样品包括每ml约6-6.5×1011个纳米粒子。项11.根据前述项中任一项所述的方法,其中,所述盐以约2mm至约250mm的浓度存在于所述样品中。项12.根据前述项中任一项所述的方法,其中,所述盐为氯化钠。项13.根据前述项中任一项所述的方法,其中,所述盐浓度为约2mm、约20mm或约200mm。项14.根据前述项中任一项所述的方法,其中,所述透射光是在约450nm至约750nm范围内的多个波长处测量的。项15.根据前述项中任一项所述的方法,其中,所述吸收强度比是所述吸收最大值与所述初始吸收的比。项16.根据前述项中任一项所述的方法,其中,所述吸收强度比的所述阈值为约1.7。项17.根据前述项中任一项所述的方法,其还包括使用蛋白质在所述样品中的不同浓度重复步骤(a)-(d)。项18.根据前述项中任一项所述的方法,其还包括使用盐在所述样品中的不同浓度重复步骤(a)-(d)。项19.根据前述项中任一项所述的方法,其还包括使用所述样品的不同ph重复步骤(a)-(d)。项20.根据前述项中任一项所述的方法,其还包括以下步骤:e.将高浓度下的所述高度可溶的蛋白质与赋形剂组合以形成配制的药物物质。项21.根据前述项中任一项所述的方法,其中,所述蛋白质的所述浓度为约50mg/ml至约500mg/ml。项22.根据项20或21中任一项所述的方法,其中,所述赋形剂是选自由以下各项组成的组:张力调节剂、缓冲液、表面活性剂、稳定剂,及其组合。项23.如项22所述的方法,其中,所述张力调节剂为盐。项24.根据前述项中任一项所述的方法,其中,所述盐为nacl。项25.一种包括可通过根据前述项中任一项所述的方法获得的生物治疗药物的组合物。项26.根据项25所述的组合物,其中,总生物治疗药物种类中不超过约10%存在作为在所述生物治疗药物的浓度下的不可逆聚集体。项27.根据项25-26中任一项所述的组合物,其中,所述组合物使得所述阈值在例如约1.5至约2.0(a峰值/a450)的范围内。项28.根据项25-27中任一项所述的组合物,其中,所述阈值在约0.7至约1.0(a峰值/a对照)的范围内。项29.根据项25-28中任一项所述的组合物,其中,所述生物医药药物的所述浓度范围为例如约50mg/ml至约500mg/ml、约50mg/ml至约250mg/ml、或约100mg/ml至l至约250mg/ml。项30.一种根据项25-29中任一项可获得的用于医学的组合物。项31.根据项1-24中任一项所述的方法,其用于制备包括生物医药药物的组合物,其中,所述组合物的粘度为约10-10000mpas、约20-9000mpas、约30-8000mpas、约40-7000mpas、约50-6000mpas、约70-5000mpas、约90-4000mpas、约100-3000mpas或约10mpas、或约20mpas、或约30mpas、或约40mpas、或约50mpas、或者约1mpas至约20mpas、约2mpas、约3mpas、约4mpas、约5mpas、约6mpas、约7mpas、约10mpas、13mpas、15mpas或约20mpas。项32.根据第31项所述的方法,其中,所述生物医药药物是一种或多种蛋白质或一种或多种抗体或其任何混合物。项33.根据项31-32中任一项所述的方法,其中,所述抗体为单克隆抗体、多克隆抗体或其组合。项34.一种生物分析混合物,其包括:a.至少两种纳米粒子;b.处于至少两相的蛋白质;以及c.盐或缓冲液。项35.如项34所述的生物分析混合物,其中,所述蛋白质的所述至少两相中的第一相是可溶相。项36.如项34或35所述的生物分析混合物,其中,所述蛋白质的所述至少两相中的第二相是粘附相,其中所述蛋白质粘附于所述至少两种纳米粒子中的每一种的表面上。项37.根据前述项34至36中任一项所述的生物分析混合物,其中,所述蛋白质的所述至少两相中的第三相是聚集相,其中所述蛋白质经自缔合以形成聚集体。项38.根据前述项34至37中任一项所述的生物分析混合物,其中,所述聚集蛋白质中的一种或多种也粘附于纳米粒子的所述表面。项39.根据前述项34至38中任一项所述的生物分析混合物,其中,所述至少两种纳米粒子中的每一种包括金。项40.根据前述项34至39中任一项所述的生物分析混合物,其中,所述至少两种纳米粒子中的每一种包括约20nm至约100nm的直径。项41.根据前述项34至40中任一项所述的生物分析混合物,其中,所述直径为约20nm。项42.根据前述项34至41中任一项所述的生物分析混合物,其中,所述至少两种纳米粒子中的每一种被所述蛋白质饱和。项43.根据前述项34至42中任一项所述的生物分析混合物,其中,所述纳米粒子以每毫升混合物约6×1011至约7×1011个纳米粒子的密度存在。项44.根据前述项34至43中任一项所述的生物分析混合物,其中,所述蛋白质以约2μg/ml至约512μg/ml的浓度存在。项45.根据前述项34至44中任一项所述的生物分析混合物,其中,所述蛋白质是抗原结合蛋白。项46.根据前述项34至45中任一项所述的生物分析混合物,其中,所述抗原结合蛋白选自由以下各项组成的组:抗体、抗体片段、核酸配体和受体-fc-融合蛋白。项47.根据前述项34至46中任一项所述的生物分析混合物,其中,所述抗原结合蛋白为抗体。项48.根据前述项34至47中任一项所述的生物分析混合物,其中,所述抗体为人源单克隆抗体。项49.根据前述项34至48中任一项所述的生物分析混合物,其中,所述盐以约2mm至约300mm的浓度存在。项50.根据前述项34至49中任一项所述的生物分析混合物,其中,所述盐以约2mm、约20mm或约200mm的浓度存在。项51.根据前述项34至50中任一项所述的生物分析混合物,其中,所述盐包括nacl。实例提供以下实例以进一步说明本发明的方法。所述实例仅为说明性的,并且并非意在以任何方式限制本发明的范围。实例1:材料单克隆抗体(mab)由细胞生成,并且通过蛋白a色谱法纯化和阴离子交换或疏水相互作用色谱法的抛光步骤。缓冲液组分是从sigma-aldrich、vwr或jt-baker获得,并且是可获得的最高等级。illustranap柱(cat.#17-0853-02)和xk26/100superdex200pg柱(cat.#90-1002-73)购自gehealthcarelifesciences。amicon离心过滤装置(cat.#ufc905024)购自emdmillipore。slide-a-lyzertmg2透析盒(cat.#87732)购自thermofisherscientific。20nm金纳米粒子(cat.#hd.gc20)购自bbisolutions。thermoscientifictmnunctmmicrowelltm96孔微孔板(cat.#12-565-66)用作反应容器以获得吸收光谱。实例2:高浓度静态光散射法(hc-sls)。在10mmmes、ph6.0、50mm氯化钠中,通过xk26/100superdex200pg柱在avant(gehealthcarelifesciences)上纯化每种浓缩(100g/l)的单克隆抗体(mab1、mab2、mab3、mab4、mab5和mab6)。收集单体mab部分,并且使用串联的easy-loadmasterflexl/s(coleparmer)泵和vivaflow20030,000mwcohy膜进行浓缩。将150ml的每种浓缩抗体分成3个部分,并且装入10,000mwco透析盒中,并且按照2l的10mmmes、ph6.0、250mm氯化钠;10mmmes、ph6.0、50mm氯化钠;和10mmmes、ph6.0、10mm氯化钠溶液交换。使用具有50,000mwco的离心过滤器单元将溶液浓缩至相应缓冲液中约15ml的最终体积。使用solovpe(ctechnologies,inc.)测量浓度。在10mmmes、ph6.0、10mm氯化钠中,抗体浓度不能超过标称60g/l。将另外两种盐浓度(250mm和50mm氯化钠)调节至标称80g/l。取三种条件的等分试样并稀释至10g/l。将80g/l、10g/l的样品和缓冲液附接到cg-mals装置(wyatttechnology)上,并且测量光散射信号作为mab浓度的函数。实例3:标准自相互作用纳米粒子光谱法(sins)。将在不同盐条件下的每种抗体(mab1、mab2、mab3、mab4、mab5和mab6)的亚等分试样添加到单独的15ml离心管中。将5ml的1光密度(1o.d)的20nm金纳米粒子溶液添加到溶液中,使所得最终蛋白质浓度为50μg/ml。在等待30分钟后,将吸收光谱和λmax记录在spectramax340pc(moleculardevices)中。浓度相关的自相互作用纳米粒子光谱法(cd-sins)。在合适的ph下制备100mm缓冲溶液。用2.4ml的100mm缓冲溶液(例如,mes或磷酸钠,这取决于目标ph调节illustranap柱。使用经调节的脱盐柱缓冲交换浓缩的(50-75g/l)mab储备溶液。使用solovpe测量所得浓度。随后将每种抗体在100mm缓冲液中稀释至5.12mg/ml。然后将mab添加到微孔板的第1柱,并且在100mm缓冲液中连续稀释至0.04mg/ml。将80μl的金纳米粒子添加到96微孔板的第2、3和4柱中。使用多通道移液管将40μl连续稀释后的mab添加到每个柱中,所述多通道移液管含有维持来自第1柱的连续稀释的金纳米粒子。随后使用多通道移液管将280ml的357mm、71mm和14mm氯化钠盐原液分别添加至第2、3和4柱。使所得溶液平衡30分钟,然后在spectramax340pc上记录吸收光谱。将最大吸收强度相对于450nm处的吸收归一化。将所述比绘制为抗体的最终浓度的函数。实例4:人血清白蛋白(hsa)的动态胶体稳定性将每毫升约6.3×1011个粒子的20nm金纳米粒子与在2mmnacl、20mmnacl或200mmnacl、ph6下的10mmmes缓冲液中各种浓度的人血清白蛋白(has)组合。将含有3.125μg/ml、6.25μg/ml、12.5μg/ml、25μg/ml、50μg/ml、100μg/ml、200μg/ml和400μg/ml的单个样品进行吸光光谱分析。绘制光谱图(图4描绘200mmnacl样品的光谱),并且针对每种蛋白质浓度计算最大吸收(λmax)处的吸收强度与450nm处的初始吸收之比并且绘图(图5)。hsa展示了针对全部离子强度和在较高蛋白质浓度下吸收强度比大于1.7(a峰值/a450),这指出了良好的动态胶体相互作用特征。静态光散射实验表明正维里系数(a2)与cd-sins曲线总体一致(表2)。表2naclmmsls(a2)21.17e-4209.68e-51207.85e-5实例5:1号单克隆抗体(mab1)将每毫升约6.3×1011个粒子的20nm金纳米粒子与在2mmnacl、20mmnacl或200mmnacl、ph6下的10mmmes缓冲液中各种浓度的人源mab1组合。将含有3.125μg/ml、6.25μg/ml、12.5μg/ml、25μg/ml、50μg/ml、100μg/ml、200μg/ml和400μg/ml的单个样品进行吸光光谱分析。绘制光谱图,并且针对每种蛋白质浓度计算最大吸收(λmax)处的吸收强度与450nm处的初始吸收之比并且绘图(图6)。mab1展示了针对全部离子强度和在较高蛋白质浓度下吸收强度比大于1.7(a峰值/a450),这指出了良好的动态胶体相互作用特征。高浓度静态光散射实验表明正维里系数(a2)与cd-sins曲线总体一致(表3,图7)。表3naclmmsls(a2)21.72e-4206.70e-52001.34e-5实例6:6号单克隆抗体(mab6)将每毫升约6.3×1011个粒子的20nm金纳米粒子与在2mmnacl、20mmnacl或200mmnacl、ph6下的10mmmes缓冲液中各种浓度的人源mab6组合。将含有3.125μg/ml、6.25μg/ml、12.5μg/ml、25μg/ml、50μg/ml、100μg/ml、200μg/ml和400μg/ml的单个样品进行吸光光谱分析。绘制光谱图,并且针对每种蛋白质浓度计算最大吸收(λmax)处的吸收强度与450nm处的初始吸收之比并且绘图(图8)。mab6展示了在较低离子强度下和在较高蛋白质浓度下吸收强度比大于1.7(a峰值/a450),这指出了良好的动态胶体相互作用特征。随着离子强度增加,mab6表现出的相吸相互作用增加。高浓度静态光散射实验表明可变维里系数(a2)与cd-sins曲线总体一致(图9)。实例7:2号单克隆抗体(mab2)将每毫升约6.3×1011个粒子的20nm金纳米粒子与在2mmnacl、20mmnacl或200mmnacl、ph6下的10mmmes缓冲液中各种浓度的人源mab2组合。将含有3.125μg/ml、6.25μg/ml、12.5μg/ml、25μg/ml、50μg/ml、100μg/ml、200μg/ml和400μg/ml的单个样品进行吸光光谱分析。绘制光谱图,并且针对每种蛋白质浓度计算最大吸收(λmax)处的吸收强度与450nm处的初始吸收之比并且绘图(图2)。mab2展示了在不同条件下净蛋白质相互作用的显著变化。在低离子强度下,mab2表现出的相吸相互作用增加。随着离子强度增加,分子变得总体相斥。在200mmnacl下,抗体具有有利的胶体稳定性。高浓度静态光散射实验表明可变维里系数(a2)与最大吸收的常规sins波长总体一致(表1)。实例8:3号单克隆抗体(mab3)将每毫升约6.3×1011个粒子的20nm金纳米粒子与在2mmnacl、20mmnacl或200mmnacl、ph6下的10mmmes缓冲液中各种浓度的人源mab3组合。将含有3.125μg/ml、6.25μg/ml、12.5μg/ml、25μg/ml、50μg/ml、100μg/ml、200μg/ml和400μg/ml的单个样品进行吸光光谱分析。绘制光谱图,并且针对每种蛋白质浓度计算最大吸收(λmax)处的吸收强度与450nm处的初始吸收之比并且绘图(图10)。mab3是胶体不稳定蛋白质的一个实例,这预示着高浓度配制和生产会有问题。在全部离子强度和蛋白质浓度下,mab3表现出相吸相互作用。高浓度静态光散射实验表明负维里系数(a2)与最大吸收的常规sins波长总体一致(表1)。实例9:4号单克隆抗体(mab4)将每毫升约6.3×1011个粒子的20nm金纳米粒子与在2mmnacl、20mmnacl或200mmnacl、ph6下的10mmmes缓冲液中各种浓度的人源mab4组合。将含有3.125μg/ml、6.25μg/ml、12.5μg/ml、25μg/ml、50μg/ml、100μg/ml、200μg/ml和400μg/ml的单个样品进行吸光光谱分析。绘制光谱图,并且针对每种蛋白质浓度计算最大吸收(λmax)处的吸收强度与450nm处的初始吸收之比并且绘图(图11)。mab4是展示了在低离子强度下在较高的蛋白质浓度下较低溶解度、在较低离子强度下胶体稳定蛋白质的实例。描绘混合维里系数(低离子强度为负,高离子强度为正)的静态光散射实验展示了与cd-sins生成的数据存在差异,后者展示mab4的相斥特征(表1)。实例10:5号单克隆抗体(mab5)将每毫升约6.3×1011个粒子的20nm金纳米粒子与在2mmnacl、20mmnacl或200mmnacl、ph6下的10mmmes缓冲液中各种浓度的人源mab5组合。将含有3.125μg/ml、6.25μg/ml、12.5μg/ml、25μg/ml、50μg/ml、100μg/ml、200μg/ml和400μg/ml的单个样品进行吸光光谱分析。绘制光谱图,并且针对每种蛋白质浓度计算最大吸收(λmax)处的吸收强度与450nm处的初始吸收之比并且绘图(图12)。mab5是在低离子强度下相吸并且随着离子强度增加表现出高蛋白浓度行为的改进的胶体混合蛋白的实例。仅描绘负维里系数的静态光散射实验展示了与cd-sins生成的数据的差异,后者展示出mab4的混合特征(表1)。实例11:赋形剂筛选和选择使用在某些制剂条件下具有不利的动态胶体相互作用特征的高粘度配制抗体(mab7)来针对改善抗体的cg-sins特征的能力筛选另外的赋形剂。在含有不同缓冲液和离子强度(图13)以及糖和/或氨基酸赋形剂(图14)的各种溶液中配制的单克隆抗体7(mab7)的cg-sins特征保持低于有利于在高浓度下分配的吸收/吸收阈值(例如,低于1.7)。在~100cp下观察到以约100mg/ml配制的mab7的粘度。使用cd-sins测定来筛选各种取代的苯甲酸酯化合物对mab7的胶体稳定影响。取代的苯甲酸包括间羟基苯甲酸、对羟基苯甲酸、间甲基苯甲酸、对甲基苯甲酸、间乙基苯甲酸、对乙基苯甲酸、间氨基苯甲酸、对氨基苯甲酸、磺酸,和苯甲酸铵。图15描绘用每种取代的苯甲酸配制的mab7的cd-sins吸收比散点图。当对氨基苯甲酸(paba,图15中的空心圆形)与配制的mab7组合时,mab7表现出有利的胶体稳定性,如通过吸收比超过有利于在高浓度下分配的阈值所证明,即,>1.6或1.7,如图15所示。paba以剂量相关的方式与mab7组合并且经受cd-sins分析。>12mmpaba(例如,18mm、24mm、30mm和36mmpaba)与mab7的组合产生有利的(即,相斥性)胶体相互作用特征(图16)。paba对mab7的胶体相互作用特征的影响似乎在约20mmpaba处饱和。将20mmpaba与5g/l、10g/l、30g/l、50g/l、70g/l和80g/l的mab7混合,并且经受使用锥体的粘度分析和使用扭转流变仪的板方法(pathak等人,biophys.j.104(4):913-993,2013年2月19日)。图17中描述所述结果。使用krieger-dougherty算法将这些结果外推至100g/lmab7(参见,例如,lukham和ukeje,j.colloidinterfacesci.,220(2):347-356,1999年12月15日)展示出在含有20mmpaba的mab7制剂中稳态剪切粘度的近似3倍降低。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1