巴氏染色试剂盒及其染色方法与流程
本发明涉及体外诊断领域,具体涉及巴氏染色试剂盒及其染色方法。
背景技术:
巴氏染色法是脱落细胞染色中最好的染色方法,该染色法不但具有显示细胞核结构清晰,分色明显,透明度好,胞浆受色鲜艳等特点,而且所染标本不易脱色,可长久保存。
目前,子宫颈炎、肺结核、胸膜炎、尿路感染等疾病成为我国临床上的常见疾病、多发病,这些疾病的发病率高,治愈时间长,如何诊断这些疾病成为一个研究的热点。液基薄层细胞学技术可辅助临床医生对上述疾病提早发现并制定正确的治疗方案,使患者尽快康复,减少痛苦,因而受到研究人员和临床医生的关注。
液基薄层细胞学技术的重要步骤之一就是对细胞进行染色,而巴氏染色液是最常用的染色方法之一。利用巴氏染色液染色的标本细胞透明度好,结构清晰,制片色彩丰富而鲜艳。
传统的巴氏染色手续繁杂,染色时间较长且难以掌握,并且需要单独透明更是增加了时长和操作步骤。因此,为了提高诊断的效率,亟需研发快速的巴氏染色。
技术实现要素:
为解决上述现有技术问题,本发明提供了一种巴氏染色试剂盒及其染色方法。该巴氏染色试剂盒染色快速,并且染色后颜色区别分明,有效地提高了诊断的效率。
一种巴氏染色试剂盒,该试剂盒包括苏木素染液、返蓝液、伊红染液和清洗液;其中,
所述伊红染液是由以下浓度的物质配制而成:600-900ml/l的乙醇、100-400ml/l的甲醇、1-4g/l的曙红y、1-4g/l的磷钨酸、0.01-2g/l的固绿、1-10ml/l的弱酸;
所述清洗液是由溶剂油、无水乙醇和丙二醇甲醚醋酸酯按体积比10-350:600-950:10-200混合而得。
在一个优选实施方式中,所述伊红染液是由以下浓度的物质配制而成:700-880ml/l的乙醇、120-300ml/l的甲醇、1.1-2g/l的曙红y、1.5-3g/l的磷钨酸、0.05-1g/l的固绿、2-8ml/l的弱酸;
所述清洗液是由溶剂油、无水乙醇和丙二醇甲醚醋酸酯按体积比50-250:650-900:50-150混合而得。
在另一个优选实施方式中,伊红染液中,所述弱酸优选无水乙酸、无水碳酸、无水柠檬酸或无水磷酸中的任意一种,更优选地,所述弱酸为无水乙酸。
在另一个优选实施方式中,所述苏木素染液是由以下浓度的物质配制而成:1-4g/l的苏木素、150-400ml/l的醇、10-40g/l的硫酸铝、0.1-4g/l的氧化剂、15-50ml/l的弱酸、余量为水;
更优选地,所述苏木素染液是由以下浓度的物质配制而成:1.5-3g/l的苏木素、200-350ml/l的醇、12-25g/l的硫酸铝、0.12-2g/l的氧化剂、20-40ml/l的弱酸、余量为水。
在另一个优选实施方式中,苏木素染液中,所述醇优选甲醇、乙醇、异丙醇和丙三醇中的一种或多种;所述氧化剂优选氧化汞或碘酸钠;所述弱酸优选乙酸、碳酸、柠檬酸或磷酸中的任意一种,更优选地,所述弱酸为乙酸。
在另一个优选实施方式中,所述返蓝液为碱性溶液。所述碱性溶液包括饱和碳酸锂溶液、scott促蓝液、氢氧化铵水溶液、tris溶液。
在另一个优选实施方式中,所述返蓝液是质量浓度为0.1-1g/l的tris溶液;优选地,所述返蓝液是质量浓度为0.2-0.8g/l的tris溶液。
在另一个优选实施方式中,所述返蓝液中加入0.05-0.5g/l的柠檬酸;更优选地,所述返蓝液中加入0.08-0.2g/l的柠檬酸。
一种巴氏染色试剂盒,该试剂盒包括苏木素染液、返蓝液、伊红染液和清洗液;所述苏木素染液是由以下浓度的物质配制而成:1-4g/l的苏木素、150-400ml/l的乙醇、10-40g/l的硫酸铝、0.1-4g/l的碘酸钠、15-50ml/l的乙酸、余量为水;所述返蓝液是由以下浓度的物质配制而成:0.1-1g/l的tris、0.05-0.5g/l的柠檬酸、0.1-5ml/l的防腐剂、余量为水;
所述伊红染液是由以下浓度的物质配制而成:600-900ml/l的乙醇、100-400ml/l的甲醇、1-4g/l的曙红y、1-4g/l的磷钨酸、0.01-2g/l的固绿、1-10ml/l的无水乙酸;
所述清洗液是由溶剂油、无水乙醇和丙二醇甲醚醋酸酯按体积比10-350:600-950:10-200混合而得。
在一个优选实施方式中,巴氏染色试剂盒中,所述苏木素染液是由以下浓度的物质配制而成:1.5-3g/l的苏木素、200-350ml/l的乙醇、12-25g/l的硫酸铝、0.12-2g/l的碘酸钠、20-40ml/l的乙酸、余量为水;
所述返蓝液是由以下浓度的物质配制而成:0.2-0.8g/l的tris、0.08-0.2g/l的柠檬酸、0.2-3ml/l的防腐剂、余量为水;
所述伊红染液是由以下浓度的物质配制而成:700-880ml/l的乙醇、120-300ml/l的甲醇、1.1-2g/l的曙红y、1.5-3g/l的磷钨酸、0.05-1g/l的固绿、2-8ml/l的无水乙酸;
所述清洗液是由溶剂油、无水乙醇和丙二醇甲醚醋酸酯按体积比50-250:650-900:50-150混合而得。
更优选地,巴氏染色试剂盒中所述苏木素染液是由以下浓度的物质配制而成:2g/l的苏木素、300ml/l的乙醇、17g/l的硫酸铝、0.2g/l的碘酸钠、30ml/l的乙酸、余量为水;
所述返蓝液是由以下浓度的物质配制而成:0.25g/l的tris、0.09g/l的柠檬酸、0.5ml/l的防腐剂、余量为水;
所述伊红染液是由以下浓度的物质配制而成:850ml/l的乙醇、150ml/l的甲醇、1.5g/l的曙红y、2g/l的磷钨酸、0.1g/l的固绿、5ml/l的无水乙酸;
所述清洗液是由溶剂油、无水乙醇和丙二醇甲醚醋酸酯按体积比50-250:650-900:50-150混合而得。
一种用上述巴氏染色试剂盒染色的方法,该方法包括以下步骤:
(1)固定
向制成薄片的样品中加入固定剂固定60s后,吸净固定剂后干燥;
(2)细胞核染色
向步骤(1)干燥的样品中加入苏木素染液染色65-75s后;加入返蓝液蓝化25-35s;
(3)细胞质染色
向步骤(2)蓝化的样品中加入伊红染液染色65-75s后,吸净液体;
(4)清洗并透明
向步骤(3)伊红染色的样品中加入清洗液,清洗25-35s后封片。
在一个实施方式中,所述固定剂优选为乙醇。
在另一个优选实施方式中,所述苏木素染液染色是加入苏木素染液后,抽吸混匀并吸净液体,然后再加入苏木素染液静置60s后,吸净液体;所述伊红染液染色是加入伊红染液后,抽吸混匀并吸净液体,然后再加入伊红染液静置60s后,吸净液体。
下面将详细地解释本发明。
本发明中,苏木素染液是对细胞核染色,细胞核内的染色质主要是脱氧核糖核酸(dna),dna的双螺旋结构中,两条链上的磷酸基向外,带负电荷,呈酸性,很容易与带正电荷的苏木素碱性染料以离子或氢键结合而被染色。为了保证细胞核与细胞质染色分明,需用弱酸调节苏木素染色过程,但是由于酸能破坏苏木素的醌型结构,使色素与组织解离,因此合适量的弱酸既能苏木素染色成功又能保证细胞核与细胞质的染色分明。
由于苏木素在酸性条件下处于红色离子状态,在碱性溶液中呈蓝色离子状态,所以经过苏木素染液染色后蓝化可以使细胞核呈蓝色。因此返蓝液为碱性溶液即可。本发明的返蓝液优选tris溶液,在该溶液中加入柠檬酸可有效调节返蓝液ph值。以使该返蓝液快速有效地将细胞核染成蓝色。
伊红染液是对细胞质染色,伊红染液中的伊红、固绿属于酸性染料,在溶解酶中其发色团是负离子部分,发色团可与蛋白质带正电的氨基结合,从而使胞浆显红色或绿色。但是蛋白质带正负电荷的多少是随溶液的ph值而改变的,在偏酸环境中蛋白质氨基游离增多,带正电,因此伊红染液中需使用弱酸进行染色。伊红染液中的磷钨酸不但作为媒染剂可增加染料着色力,同时磷钨酸也是弱酸,可配合弱酸乙酸调节伊红染液的ph值。本发明中,曙红y即为伊红。
本发明中伊红染液为全醇染液,不含水。当进行完伊红染液染色后,可不经过脱水过程,直接进行透明,因此不需要单独透明过程。但是,直接使用常用的透明液和清洗液获得的样本各种颜色混杂在一起,且结构极不清晰。本发明为了清洗伊红染液,使用了丙二醇甲醚醋酸酯,其能有效地溶解未结合蛋白质的伊红染液;同时,本发明还通过在清洗液中加入透明剂——溶剂油,意外地发现在通过丙二醇甲醚醋酸酯、溶剂油和无水乙醇合适量的配合下,可使清洗液实现清洗和透明同步进行,并且清洗后获得的样品染色分明,结构清晰。本发明的清洗液中,所述溶剂油为环保型溶剂油,优选d80溶剂油。本发明返蓝液中,所述防腐剂选自pc-300、叠氮钠、奥麦丁钠中的一种或多种。
本发明的巴氏染色试剂盒从固定到染色到封片只需6min左右即可完成,且无需单独透明;染色时间快并简化了染色步骤。此外,本发明的巴氏染色试剂盒染色分明,能清楚区分细胞结构。
附图说明
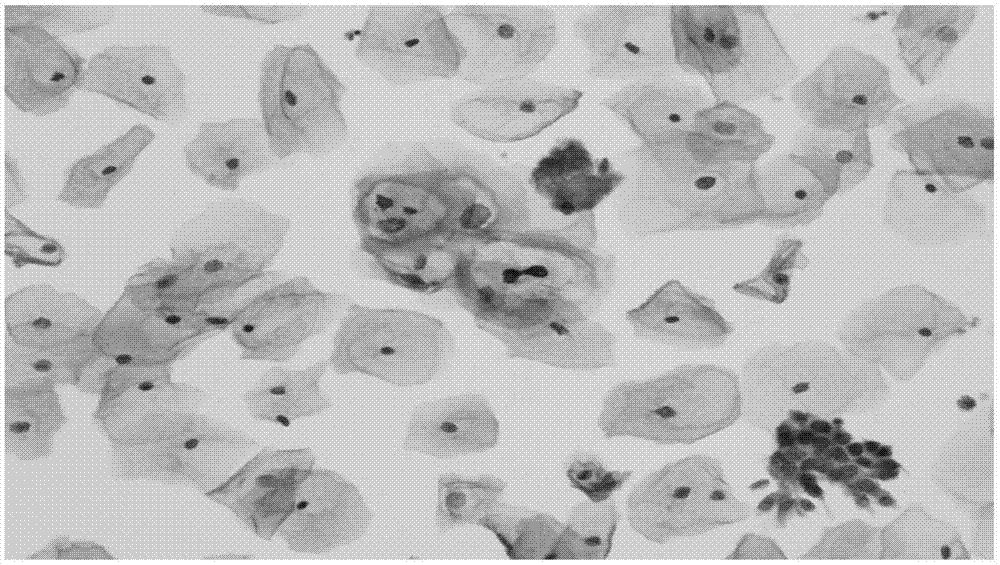
图1为实施例1的巴氏染色试剂盒对宫颈液基样本染色的镜检图;
图2为实施例2的巴氏染色试剂盒对宫颈液基样本染色的镜检图;
图3为实施例3的巴氏染色试剂盒对宫颈液基样本染色的镜检图;
图4为对比实施例1的巴氏染色试剂盒对宫颈液基样本染色的镜检图;
图5为对比实施例2的巴氏染色试剂盒对宫颈液基样本a染色的镜检图;
图6为对比实施例2的巴氏染色试剂盒对宫颈液基样本b染色的镜检图;
图7为实施例1的巴氏染色试剂盒对宫颈液基样本c染色的镜检图;
图8为实施例1的巴氏染色试剂盒对宫颈液基样本d染色的镜检图;
图9为实施例1的巴氏染色试剂盒对尿液液基样本a染色的镜检图;
图10为实施例1的巴氏染色试剂盒对尿液液基样本b染色的镜检图;
图11为实施例1的巴氏染色试剂盒对胸水液基样本染色的镜检图。
具体实施方式
为了使本领域技术领域人员更好地理解本申请中的技术方案,下面将结合下面结合实施例对本发明作进一步说明,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都应当属于本申请保护的范围。
本发明中,
弱酸,是和强酸相对的酸,酸性较弱。弱酸通常是指其电离常数(ka)小于0.0001(酸度系数pka大于4)的酸,即在溶液中不完全电离的酸。常见的弱酸有偏硅酸、氢氰酸、碳酸、氢氟酸、醋酸、氢硫酸、次氯酸、亚硝酸、有机酸等。
碱性溶液是指常温下ph大于7的或者氢氧根离子浓度大于氢离子的溶液。也可说是含有某种能在溶剂中向其它物质提供未共用电子对的能力的液态混合物。本发明的碱性溶液优选使用弱碱性溶液。弱碱溶液,是指水中的氢氧根是由溶质在水中不完全电离,一般是碱性化合物的水溶液。常见的弱碱性溶液有碳酸钠(苏打水)、碳酸氢钠(小苏打水)、一水合氨(氨水)、tris溶液等。
防腐剂是能抑制微生物活动,防止试剂腐败变质的一类添加剂。防腐剂的防腐原理是干扰微生物的酶系,破坏其正常的新陈代谢,抑制酶的活性,是使微生物的蛋白质凝固和变性,干扰其生存和繁殖。因此本发明中使用防腐剂的返蓝液可保证返蓝液保存时间长,ph值波动较小。
实施例1
一种巴氏染色试剂盒,该试剂盒包括苏木素染液、返蓝液、伊红染液和清洗液。具体配方如表1所示。
表1为实施例1的巴氏染色试剂盒配方
实施例2
一种巴氏染色试剂盒,该试剂盒包括苏木素染液、返蓝液、伊红染液和清洗液。具体配方如表2所示。
表2为实施例2的巴氏染色试剂盒配方
实施例3
一种巴氏染色试剂盒,该试剂盒包括苏木素染液、返蓝液、伊红染液和清洗液。具体配方如表3所示。
表3为实施例3的巴氏染色试剂盒配方
对比实施例1
一种巴氏染色试剂盒,该试剂盒包括苏木素染液、返蓝液、伊红染液和清洗液。具体配方如表4所示。
表4为对比实施例1的巴氏染色试剂盒配方
实施例5
使用实施例1-3和对比实施例1的巴氏染色试剂盒对宫颈液基样本进行染色,染色的步骤如下:
(a)将样本制成薄片;
(b)加固定剂固定60秒,吸净液体后空气中自然干燥60秒;
(c)加苏木素染液淌洗1次,再加苏木素染液静置60秒,吸净液体(共约70秒);
(d)加返蓝液淌洗3次(约30秒);
(e)加伊红染液淌洗1次,再加伊红染液静置60秒,吸净液体(共约70秒);
(f)加清洗液淌洗3次(约30秒),此步骤为清洗加透明的效果。
(g)封片镜检(约30秒)
这里所述的淌洗就是将苏木素染液加入玻片上,抽吸混匀,吸净液体;淌洗的动作类似润洗。
上述染色时间耗时约6min。实施例1的巴氏染色试剂盒染色结果如图1所示;实施例2的巴氏染色试剂盒染色结果如图2所示;实施例3的巴氏染色试剂盒染色结果如图3所示。
从图1~3可以看出,使用本发明的巴氏染色试剂盒仅需在6min左右就能将样品着色成功,并且细胞结构清晰分明。
而使用对比实施例1的巴氏染色试剂盒染色结果如图4所示,对比图1-3中可以看出,只有在本发明苏木素染液、返蓝液、伊红染液和清洗液给出的各成分使用量范围内才能在6min左右达到较好的染色效果,保证染色出来的样品结构清晰分明;此外,申请人对清洗液中溶剂油、无水乙醇和丙二醇甲醚醋酸酯的成分含量进行各种含量如370:600:10、10:400:8、20:700:230等非本发明公开的比值范围外的配比,均不能获得结构清晰分明的染色样品因此,仅有清洗液中溶剂油、无水乙醇和丙二醇甲醚醋酸酯按体积比10-350:600-950:10-200范围内,才能保证该染色液染色得到的样品结构清洗分明。
对比实施例2
利用市售的巴氏染色试剂盒对宫颈液基样本a、b进行染色,染色步骤如下:
(a)将样本制成薄片;
(b)加95%乙醇固定2-5min,清水冲洗多次;
(c)加苏木素染液染色3-5min,清水冲洗3次;
(d)加返蓝液蓝化1-3min,乙醇漂洗脱水3min;
(e)加伊红染液润洗1次,再加伊红染液静置2min,吸净液体;
(f)加脱水剂脱水清洗3min;
(g)将制片转移至异丙醇中浸泡5min,取出,马上转移至二甲苯中浸泡8min透明;
(h)封片镜检
对比实施例2的染色结果如图5和图6所示。利用实施例1的巴氏染色试剂盒再次对宫颈液基样本c、d染色,按实施例5的染色方法进行染色,结果如图7和图8所示。
通过对图5-8对比可以看出,利用本发明的巴氏染色试剂盒仅需要6min左右就能将宫颈液基样本染色并且细胞结构清晰着色分明,与该染色效果与现有染色试剂盒经15-30min染色的效果基本一致。综上,本发明的巴氏染色试剂盒整体染色快速,操作简便。
实施例6
利用本发明实施例1的巴氏染色试剂盒对尿液液基样本a、b按实施例5的染色步骤进行染色,染色结果如图9和10所示。
利用本发明实施例1的巴氏染色试剂盒对胸水液基样本按实施例5的染色步骤进行染色,染色结果如图11所示。
从图9-11可以看出,利用本发明的巴氏染色试剂盒对尿液、胸水等液基样本染色,其结构比较清晰并且着色分明,可明显区分出尿液中的结晶、上皮细胞和管型。由此可见,本发明巴氏染色试剂盒可针对不同液基样本进行染色,着色分明,并且染色快速,操作简单。
综上,本发明的巴氏染色试剂盒从固定到染色到封片染色时间快,无需单独透明,简化了染色步骤。此外,本发明的巴氏染色试剂盒染色分明,能清楚区分细胞结构。利用本发明的巴氏染色试剂盒可有效提高诊断的效率。
应该理解到披露的本发明不仅仅限于描述的特定的方法、方案和物质,因为这些均可变化。还应理解这里所用的术语仅仅是为了描述特定的实施方式方案的目的,而不是意欲限制本发明的范围,本发明的范围仅受限于所附的权利要求。
本领域的技术人员还将认识到,或者能够确认使用不超过常规实验,在本文中所述的本发明的具体的实施方案的许多等价物。这些等价物也包含在所附的权利要求中。
- 还没有人留言评论。精彩留言会获得点赞!