对血细胞成像的方法与流程
优先权要求
本申请要求于2017年8月17日提交的美国临时申请no.62/546,713和2018年3月23日提交的美国临时申请no.62/647,421的优先权,其全部内容通过引用并入本文。
本发明一般而言涉及用于在微观尺度上执行生物成像的设备、系统和方法,并且更具体地涉及包括被配置为在微观尺度上执行生物成像的一次性测试设备的设备和系统,以及使用一次性测试设备执行生物成像的方法。
背景技术:
护理点(poc)样本分析系统通常基于一个或多个可重用的手持式分析器(即,仪器或读取装置),这些分析器使用单次使用的一次性测试设备(例如,含有分析元件的盒或条带,分析元件例如是用于感测分析物(诸如ph、氧气和葡萄糖以及各种类型的蛋白质、酶和血细胞)的电极或光学器件)执行样本测试。一次性测试设备可以包括流体元件(例如,用于接纳并输送样本到感测电极或光学器件的导管)、校准元件(例如,用于用已知浓度的分析物标准化电极和光学器件的水性流体)以及用于标准化光学器件的具有已知消光系数的染料。仪器或读取装置可以包含用于操作电极或光学器件、进行测量并执行计算的电路系统和其它部件。仪器或读取装置还可以具有显示结果并例如经由计算机工作站或其它数据管理系统将那些结果传送给实验室和医院信息系统(分别为lis和his)的能力。仪器或读取装置与工作站之间以及工作站与lis或his之间的通信可以经由例如红外链路、有线连接、无线通信或能够传输和接收电子信息的任何其它数据通信形式,或其任意组合。在美国专利no.5,096,669中公开了一种著名的护理点系统(
护理点样本测试系统的好处之一是消除了将样本发送到中央实验室以进行测试需要耗费的时间。护理点样本测试系统允许护士或医生(用户或操作者)在患者床边获得可靠的定量分析结果,该结果在质量上与在实验室中获得的结果相当。在操作中,护士选择具有所需测试面板的测试设备、从患者身上提取生物样本、将生物样本分配(dispenses)到测试设备中、可选地密封测试设备以及将测试设备插入仪器或读取装置中。虽然步骤发生的特定次序可以在不同的护理点系统和提供者之间变化,但在患者位置附近提供快速样本测试结果的意图保持相同。然后,仪器或读取装置执行测试周期,即,执行测试所需的所有其它分析步骤。这种简单性使医生可以更快地了解患者的生理状况,并且,通过减少诊断或监视的周转时间,使医生能够更快地做出适当治疗的决定,从而提高患者成功结果的可能性。
如本文所讨论的,护理点样本测试系统通常包括仪器或分析器,该仪器或分析器被配置为使用单性使用的一次性测试设备来执行样本测试,以确定生物样本中的分析物。所执行的样本测试的类型可以变化,并且可以使用一个或多个一次性测试设备来实现,这些一次性测试设备包括例如定性或半定量测试设备(例如,侧向流动或微阵列测定)、定量测试设备(例如,电化学测定),或定性或半定量测试设备与定量测试设备的组合(例如,既具有侧向流动或微阵列测定又具有电化学测定的测试设备)。为了执行样本测试,仪器或分析器包括被配置为处理来自定性或半定量测试设备的信号的光学传感器和/或被配置为处理来自定量测试设备的信号的电连接器(参见例如美国专利no.9,194,859,该专利通过引用整体并入本文)。特别地,光学传感器包括光学成像器,该光学成像器被配置为对光学测试盒的测定进行成像。测定是定性或半定量的侧向流动测试或微阵列测试(例如,部署在光学测试盒的导管中的一个或多个侧向流动测试条或微阵列)。光学传感器还包括处理器,该处理器被配置为处理由光学成像器生成的信号以显示定性或半定量的测试结果。
但是,与这些常规的仪器或分析器相关联的问题是它们无法在微观尺度上执行生物成像,而在微观尺度上执行生物成像对于血液学测定(例如,细胞计数)是重要的。而且,光学成像器是硬连线到非一次性仪器或分析器的设定类型,因此在不改变硬件的情况下,在测试设备内执行多种类型的测定(例如,血液学和免疫测定)的灵活性有限。将光学传感器置于非一次性仪器或分析器中并与硬连线设计相结合所强加的限制不利地影响仪器或分析器在微观尺度上执行生物成像以及在不改变硬件的情况下进行多次测试或测量的能力。
常规地,已经使用透镜(诸如用利用物镜放大血细胞的光学显微镜)在微观尺度上执行生物成像(例如,执行血液学测定,诸如细胞计数和分类(differential))。但是,近来,无透镜的成像已经成熟,成为与常规的基于透镜的显微镜相比具有竞争力的一种模态。在无透镜显微镜中,由物体(基于例如散射或荧光)产生的衍射图案被直接记录在数字图像传感器阵列上,而没有被任何透镜元件光学成像或放大。然后,所记录的衍射图案被计算重建,以形成(一个或多个)物体的“图像”。无透镜显微镜的最新成熟很大程度上是由于以下因素实现的:具有小像素尺寸和高像素计数的廉价的数字图像传感器的大量生产,连同用于处理捕获的衍射图案的计算能力和重建算法的改善。与常规的基于透镜的显微镜相比,无透镜方法具有几个关键优点,包括:大空间带宽积(同时的大视场和高分辨率)、高分辨率、成本效益和便携性。
为了利用无透镜显微镜,已经使用数字图像传感器和特殊设计的室开发出替代类型的测定系统,该特殊设计的室允许样本中的颗粒物(例如,血细胞)的枚举。例如,通过引用整体并入本文的美国专利no.7,850,916描述了一种用于枚举颗粒物(例如,血细胞)的室,该室包括柔性的第一平面构件、第二平面构件和至少三个分隔器。可以通过使用或者传统的图像处理方法或者在美国专利no.5,321,975、no.6,235,536、no.6,350,613、no.8,797,527和no.9,041,790、美国专利公开no.20130169948和no.20120034647以及aydoganozcan和euanmcleod的lenslessimagingandsensing,annu.rev.biomed.eng.,2016.18:77-102,doi:10.1146/annurev-bioeng-092515-010849(所有这些均通过引用整体并入本文)中描述的技术对遇到的每个单个血细胞进行分类来执行室内的血细胞的表征(例如,白细胞分类计数)。
但是,与这些无透镜显微镜测定系统相关联的问题是通常系统的一个或多个部件(诸如数字图像传感器阵列、光源、成像室和图像处理软件/硬件)未被适当地设计为有助于护理点使用。具体而言,这些常规的无透镜显微镜测试系统缺乏便携性和可处置性(disposability),而便携性和可处置性是通常与护理点测试设备相关联的方面。因此,在微观尺度的生物成像领域内,特别是对于要在生物样本(诸如血液)中确定细胞和分析物的应用,需要如下设备:能够在患者的护理点处快速且简单地确定细胞和分析物的存在、计数、识别和/或浓度,并且能够由比可以进行常规的基于实验室的测试的人员受过较少培训的人员执行。例如,能够毫不拖延地在患者的床边获得光学测定结果(诸如细胞计数和分类)对于主治医师或护士的紧急医疗条件的诊断和治疗将是有益的。
技术实现要素:
一个或多个计算机的系统可以被配置为通过在系统上安装软件、固件、硬件或其组合来执行特定的操作或动作,这些软件、固件、硬件或其组合在操作中引起系统执行动作。一个或多个计算机程序可以被配置为通过包括指令来执行特定的操作或动作,这些指令在由数据处理装置执行时使该装置执行动作。在各种实施例中,提供了一种用于执行分类血细胞计数的方法,包括:提供测试盒,测试盒包括样本进入端口、流体连接到样本进入端口的样本测试导管以及包括像素阵列的成像器芯片。该方法还包括提供分析器,分析器包括处理器和显示器;使测试盒与分析器配合。该方法还包括在将测试盒与分析器配合之前或之后,将血液样本引入到样本进入端口中。该方法还包括将干燥试剂溶解到血液样本中以生成修正的血液样本。该方法还包括将修正的血液样本移动到样本测试导管中,其中样本测试导管包括由成像器芯片的至少一部分形成的第一壁、由透明材料层形成的第二壁以及具有平均间隔物高度并部署在第一壁和第二壁之间的多个间隔物元件,并且其中平均间隔物高度定义在成像器芯片的该部分和透明材料层之间的室的平均室高度。该方法还包括驱动光发射器以投射光通过室和修正的血液样本。该方法还包括基于从室和修正的血液样本接收到的光,在像素阵列处记录吸光度和荧光中的至少一个的输出信号。该方法还包括使用处理器将输出信号转换成血液样本中每种类型的细胞的数量计数或百分比。该方法还包括在显示器上显示血液样本中每种类型的细胞的数量计数或百分比。该方面的其他实施例包括各自被配置为执行该方法的一个或多个动作的对应的计算机系统、装置和记录在一个或多个计算机存储设备上的计算机程序。
该方法的实施方式可以包括以下特征中的一个或多个。该方法还包括将测试盒与分析器解除配合。该方法还包括处置测试盒。该方法,其中,干燥试剂包括吖啶橙或抗凝剂。该方法,其中,干燥试剂与血细胞中的核酸dna键合。该方法,其中,配合包括将测试盒插入到分析器的端口中。该方法,其中,分析器还包括多端子连接器,测试盒还包括多个分立的连接器触点,成像器芯片电连接到该多个分立的连接器触点中的至少一个,以及将测试盒插入到分析器的端口中使多端子连接器与该多个分立的连接器触点电接触。该方法,其中,处理器电连接到光发射器,处理器经由该多个分立的连接器触点中的至少一个和多端子连接器电连接到成像器芯片,经由处理器来驱动光发射器以投射光,并且经由处理器来控制成像器芯片以记录输出信号。该方法,分析器还包括泵致动器,测试盒还包括泵,将测试盒插入到分析器的端口中使泵致动器与泵对准,以及将修正的血液样本移动到样本测试导管中包括驱动泵致动器以致动泵并将修正的血液样本移动到样本测试导管中。所描述的技术的实施方式可以包括硬件,方法或处理或者计算机可访问介质上的计算机软件。
在各种实施例中,提供了一种系统,包括:一个或多个处理器。该系统还包括耦合到该一个或多个处理器的存储器,该存储器被编码有被配置为执行处理的指令集,该处理包括:。该系统还包括从测试盒接收指示插入到分析器中的盒的类型的操作状态信号。该系统还包括确定盒的类型是具有连接到被配置为对血液样本中的血细胞成像的成像器芯片的触点的测试盒。该系统还包括驱动泵致动器以致动测试盒上的泵,并将血液样本从样本接纳室移动到样本测试导管中,其中样本测试导管包括由成像器芯片的至少一部分形成的第一壁、由透明材料层形成的第二壁以及部署在第一壁和第二壁之间的多个间隔物元件。该系统还包括驱动光发射器以投射光通过样本测试导管和血液样本。该系统还包括基于从样本测试导管和血液样本接收的光,在成像器芯片的像素阵列处记录吸光度和荧光中的至少一个的输出信号。该系统还包括将输出信号转换成血液样本中每种类型的细胞的数量计数或百分比。
该系统的实施方式可以包括以下特征中的一个或多个。该系统,其中,该方法还包括驱动泵致动器,以致动测试盒上的泵,并移动血液样本与干燥试剂接触。该系统,其中,干燥试剂包括吖啶橙或抗凝剂。该系统,其中,干燥试剂与血细胞中的核酸dna键合。该系统,其中,干燥试剂被部署在样本接纳室中。该系统,其中,干燥试剂被部署在样本测试导管中。该系统,还包括在显示器上显示血液样本中每种类型的细胞的数量计数或百分比。该系统,其中,光发射器将光投射通过透明材料层、样本测试导管和血液样本。该系统,其中,光发射器部署在测试盒中,并且确定盒的类型是具有连接到成像器芯片的触点和连接到光发射器的另一个触点的测试盒。该系统,其中,该多个间隔物元件具有预定的平均间隔物高度,该预定的平均间隔物高度定义在成像器芯片的该部分与透明材料层之间的室的预定的平均室高度。该系统,其中,该多个间隔物元件和第二壁中的至少一个是可变形的,使得第二壁和该多个间隔物元件通过来自正被移动到样本测试导管中的血液样本的毛细管作用力而被拉向彼此。
在各种实施例中,提供了一种非暂态机器可读存储介质,其存储指令,当该指令由计算系统的一个或多个处理器执行时,使该计算系统执行操作,该操作包括:驱动泵致动器以致动测试盒上的泵,并将血液样本从样本接纳室移动到样本测试导管中,其中样本测试导管包括由成像器芯片的至少一部分形成的第一壁、由透明材料层形成的第二壁以及部署在第一壁和第二壁之间的多个间隔物元件。该非暂态机器可读存储介质还包括驱动光发射器以投射光通过样本测试导管和血液样本。该非暂态机器可读存储介质还包括基于从样本测试导管和血液样本接收的光,在成像器芯片的像素阵列处记录吸光度和荧光中的至少一个的输出信号。该非暂态机器可读存储介质还包括将输出信号转换成血液样本中每种类型的细胞的数量计数或百分比。
该非暂态机器可读存储介质的实施方式可以包括以下特征中的一个或多个。该非暂态机器可读存储介质,其中,操作还包括驱动泵致动器以致动测试盒上的泵,以将血液样本分成第一部分和第二部分,其中血液样本的第一部分被移动到样本测试导管中。该非暂态机器可读存储介质,其中,操作还包括驱动泵致动器以致动测试盒上的泵,以将血液样本的第二部分移动到包括用于检测血液样本中的分析物的电化学传感器的辅助导管中。该非暂态机器可读存储介质,其中,操作还包括基于辅助导管中的电化学分析测试的性能来记录来自电化学传感器的分析物信号,以及基于分析物信号,确定与血液样本中的分析物的量成比例的定性、半定量或定量值。该非暂态机器可读存储介质,其中,执行电化学分析测试包括:相对于参考电极向电化学传感器施加电位,以及测量与血液样本内的分析物的量成比例的跨血液样本的电流变化,并且其中分析物信号被记录为指示跨血液样本的测量电流变化。该非暂态机器可读存储介质,其中,操作还包括:从测试盒接收指示插入到分析器中的盒的类型的操作状态信号,以及确定盒的类型是具有连接到成像器芯片的第一触点和连接到电化学传感器的第二触点的测试盒。该非暂态机器可读存储介质,其中,该多个间隔物元件具有预定的平均间隔物高度,该预定的平均间隔物高度定义在成像器芯片的该部分与透明材料层之间的室的预定的平均室高度。该非暂态机器可读存储介质,其中,该多个间隔物元件和第二壁中的至少一个是可变形的,使得第二壁和该多个间隔物元件通过来自正被移动到样本测试导管中的血液样本的毛细管作用力而被拉向彼此。
附图说明
鉴于以下非限制性附图,将更好地理解本发明。
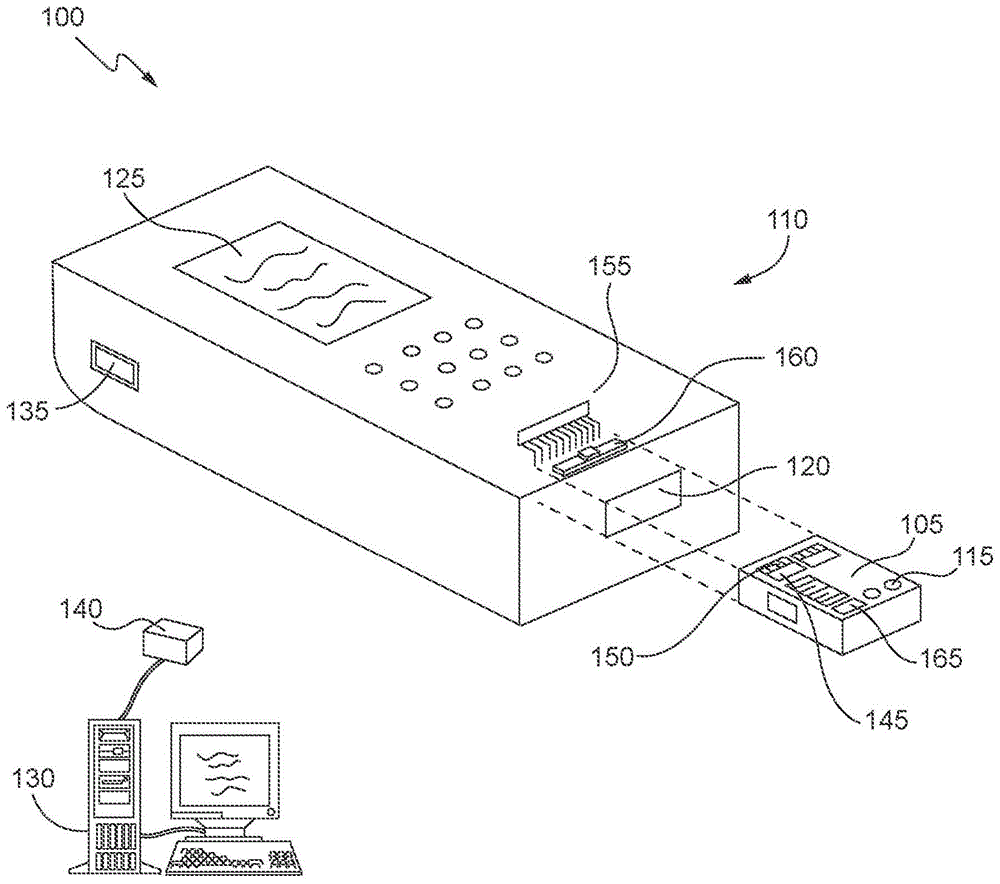
图1示出了根据各种实施例的一次性测试设备和仪器;
图2示出了根据各种实施例实现的计算系统的例示性体系架构;
图3和图4a-图4r示出了根据各种实施例的测试设备或盒;
图5示出了根据各种实施例的成像设备;
图6示出了根据各种实施例的成像室的截面;
图7示出了根据各种实施例的成像室的顶部平面图;
图8示出了根据各种实施例的成像室,该成像室包括第一平面构件、第二平面构件以及部署在第一平面构件和第二平面构件之间的多个间隔物元件;
图9例示了根据各种实施例的成像室的多个间隔物元件,该多个间隔物元件可以由比第一平面构件和第二平面构件具有更大的柔性的材料形成;
图10例示了根据各种实施例的成像室的第二平面构件,该第二平面构件可以由比多个间隔物元件和第一平面构件具有更大的柔性的材料形成;
图11a-图11i示出了根据各种实施例的成像室,该成像室包括第一平面构件、第二平面构件以及部署在第一平面构件和第二平面构件之间的多个阱(well);
图12示出了根据各种实施例的成像器芯片的晶片级微制造;
图13示出了根据各种实施例的电化学芯片的晶片级微制造;
图14示出了根据各种实施例的传感器芯片配置;
图15示出了根据各种实施例的替代传感器芯片配置;以及
图16-图22示出了根据各种实施例的用于执行处理步骤的示例性流程图。
具体实施方式
介绍
本发明的各种实施例针对用于执行光学和可选地电化学测定的设备、系统和方法。例如,图1示出了示例性系统100,该系统可以包括自给式(self-contained)一次性测试设备或盒105以及便携式的或固定的并且由电池供电或由线路供电的仪器或读取装置110(例如,分析器)。在一些实施例中,测试设备105是被配置为在单次使用之后可丢弃的单次使用设备。待测量的流体样本(例如,全血)经由测试设备105中的样本入口孔115被吸入样本接纳室,并且测试设备105可以通过端口120插入到分析器110中。分析器110可以包括处理器,该处理器被配置为执行包括但不限于以下处理的处理:驱动光发射器、光学传感器、泵和/或电化学传感器;获得以下至少之一的输出信号:吸光度和荧光(光学的)、电流(安培的(amperometric))、电位或电荷累积(电位的(potentiometric))、电极之间的介质的导电特性(导电的(conductometric))和阻抗(电阻和电抗二者);并将输出信号转换成:(i)血液样本中每种类型细胞的数量计数或百分比,或(ii)指示生物样本与至少一个测定珠(bead)的反应的值。可以将由分析器110执行的测量和确定(例如,(i)血液样本中每种类型细胞的数量计数或百分比,或(ii)指示反应的值)输出到显示器125或经由分析器110上的端口135到计算机端口140输出到其它输出设备(诸如打印机或数据管理系统130)。传输可以经由有线或无线通信,诸如电话网络、互联网连接、wi-fi、蓝牙链接、红外等。测试设备105中的(一个或多个)传感器145(例如,光学传感器)包括多个分立的连接器触点150,当将测试设备105插入到端口140中时,这些触点经由多端子连接器155与分析器110电接触。例如,多端子连接器155可以具有在美国专利no.4,954,087中公开的设计,该专利通过引用整体并入本文。分析器110还可以包括泵致动器160,并且测试设备105还可以包括泵165。在一些实施例中,将测试设备105插入到分析器105的端口120中将泵致动器160与泵165对准,并且通过驱动泵致动器160以致动泵165并将流体样本移位到样本测试导管中,可以将流体样本移动到测试设备105的样本测试导管中。在某些实施例中,分析器110还被配置为执行用于测试设备105中的自动流体流量补偿的方法,如美国专利no.5,821,399中所公开的,该专利也通过引用整体并入本文。
为了具体地解决与常规仪器或读取装置相关联的问题,本文描述的一些实施例针对包括被配置为以微观尺度执行生物成像的一次性测试设备的设备和系统,以及使用一次性测试设备执行生物成像的方法。在一个实施例中,提供了一种用于对血液样本中的血细胞进行成像的测试设备,包括:用于接收血液样本的样本进入端口;流体连接到样本进入端口的样本接纳室;流体连接到样本接纳室的样本测试导管,该样本测试导管包括:(i)平面构件、(ii)透明平面构件,以及(iii)多个间隔物元件,该多个间隔物元件具有平均间隔物高度并部署在平面构件和透明平面构件之间以形成在平面构件和透明平面构件之间延伸的具有平均室高度的室;以及成像器芯片,其形成平面构件的至少一部分。
在另一个实施例中,提供了一种用于对血液样本中的血细胞进行成像的系统,包括:分析器,包括:端口、多端子连接器、连接到多端子连接器的处理器以及耦合到处理器的存储器;以及测试盒,包括:多个连接器触点、被配置为接纳血液样本的样本接纳室、流体连接到样本接纳室的样本测试导管,样本测试导管包括:(i)第一壁、(ii)第二壁和(iii)具有预定平均间隔物高度并且部署在第一壁和第二壁之间以形成在第一壁和第二壁之间延伸的具有预定平均室高度的室的多个间隔物元件;以及分析物测定区域,包括:成像器芯片和室的一部分,其中成像器芯片电连接到多个连接器触点中的至少一个,并且成像器芯片的至少一部分形成样本接纳室的第一壁的一部分。测试盒可插入到端口中,使得多端子连接器与多个连接器触点电接触。
在另一个实施例中,提供了一种用于执行分类血细胞计数的方法,包括:提供测试盒,测试盒包括样本进入端口、流体连接到样本进入端口的样本测试导管以及包括像素阵列的成像器芯片;提供分析器,分析器包括处理器和显示器;将测试盒与分析器配合;在将测试盒与分析器配合之前或之后将血液样本引入到样本进入端口中;将干燥试剂溶解在血液样本中以生成修正的血液样本;将修正的血液样本移动到样本测试导管中,其中样本测试导管包括由成像器芯片的至少一部分形成的第一壁、由透明材料层形成的第二壁以及具有平均间隔物高度并部署在第一壁和第二壁之间的多个间隔物元件,并且其中平均间隔物高度定义在成像器芯片的该部分和透明材料层之间的室的平均室高度;驱动光发射器以投射光通过室和修正的血液样本;基于从室和修正的血液样本接收到的光,在像素阵列处记录吸光度和荧光中的至少一个的输出信号;使用处理器将输出信号转换成血液样本中每种类型细胞的数量计数或百分比;以及在显示器上显示血液样本中每种类型细胞的数量计数或百分比。
在另一个实施例中,提供了一种用于对测定珠成像的测试设备,包括:用于接收生物样本的样本进入端口;流体连接到样本进入端口的样本接纳室;以及流体连接到样本接纳室的样本测试导管,该样本测试导管包括:(i)第一平面构件、(ii)第二平面构件,以及(iii)具有预定平均阱高度并部署在第一平面构件和第二平面构件之间的多个阱。第二平面构件包括成像器芯片,该成像器芯片包括像素阵列;并且多个阱中的每一个与像素阵列中的一个或多个像素垂直对准。
在另一个实施例中,提供了一种用于对测定珠成像的系统,包括:分析器,包括:端口、多端子连接器、连接到多端子连接器的处理器以及耦合到处理器的存储器;以及测试盒,包括:多个分立的连接器触点;被配置为接纳生物样本的样本接纳室;流体连接到样本接纳室的样本测试导管,该样本测试导管包括:(i)第一壁、(ii)第二壁以及(iii)具有平均阱高度并部署在第一壁和第二壁之间的多个阱;以及分析物测定区域,包括:样本测试导管的一部分和成像器芯片,其中成像器芯片被电连接到多个分立的连接器触点中的至少一个,并且成像器芯片的至少一部分形成样本接纳室的第一壁的一部分。多个阱中的每一个与成像器芯片的一个或多个像素垂直对准,并且多个阱中的每一个包括至少一个测定珠。测试盒可插入到端口中,使得多端子连接器与多个分立的连接器电接触。存储器编码有被配置为对生物样本执行分析测试的指令集并执行该分析测试,(i)处理器电连接到光发射器,(ii)处理器经由多个分立的连接器触点中的至少一个和多端子连接器电连接到成像器芯片,(iii)处理器被配置为驱动光发射器以生成投射到样本测试导管的该部分中的光,(iv)成像器芯片被配置为将从样本测试导管的该部分接收的光转换成输出信号,以及(v)处理器被配置为将成像器芯片的输出信号转换成指示生物样本与多个阱中的每一个中的至少一个测定珠的反应的值。
在另一个实施例中,提供了一种用于对测定珠成像的方法,包括:使测试盒与分析器配合,其中测试盒包括样本进入端口、流体连接到样本进入端口的样本测试导管以及成像器芯片,并且分析器包括处理器和显示器;在将测试盒与分析器配合之前或之后,将生物样本引入样本进入端口;将生物样本移动到样本测试导管中,其中样本测试导管包括由成像器芯片的至少一部分形成的第一壁、由透明材料层形成的第二壁,以及具有平均阱高度并部署在第一壁和第二壁之间的多个阱,并且其中多个阱中的每一个均与成像器芯片的一个或多个像素垂直对准,并且多个阱中的至少一部分包括至少一个测定珠;驱动光发射器以投射光通过多个阱;基于从多个阱接收的光在成像器芯片的像素处记录吸光度和荧光中的至少一个的输出信号;使用处理器将输出信号转换成指示生物样本与在多个阱中的每一个中的至少一个测定珠的反应的值;并在显示器上显示该值。
有利地,这些方法为设备、系统和方法提供了在测试设备设计方面的更大的灵活性,包括:(i)任何给定测试设备中的测试的组合,(ii)任何给定传感器芯片上的测试的组合,(iii)传感器在测试设备中的位置,(iv)扩展分析器的用途,以执行各种类型的测定而无需硬件改变,以及(v)增加护理点测试机会。此外,这些方法还可以减少用于制造用于各种测试的所有不同测试设备的不同测试设备底座(容纳传感器芯片)的数量。此外,这些方法允许微观尺度的生物成像,并且特别是对于其中患者护理点处细胞的计数和/或识别以及可选地分析物的浓度能够由比可以进行常规的基于实验室的测试的人员受过较少培训的人员执行的应用。
系统环境
图2是在各种实施例中实现的计算系统200的例示性体系架构。计算系统200仅是合适的计算系统的一个示例,并且不旨在暗示对各种实施例的使用范围或功能的任何限制。而且,计算系统200不应当被解释为具有与计算系统200中例示的部件中的任何一个或部件的组合相关的任何依赖性或要求。
如图2中所示,计算系统200包括计算设备205。计算设备205可以驻留在网络基础设施上(诸如云环境内),或者可以是分离的独立计算设备(例如,如关于图1所描述的,在诸如分析器110之类的分析器的环境内实现的计算设备)。计算设备205可以包括一个或多个输入设备210、一个或多个输出设备212、总线215、处理器220、存储设备225、系统存储器(硬件设备)230以及通信接口235。
一个或多个输入设备210可以包括允许操作者向计算设备205输入信息的一个或多个机构,诸如但不限于触摸板、拨盘、点击轮、滚轮、触摸屏、一个或多个按钮(例如,键盘)、鼠标、游戏控制器、轨迹球、麦克风、相机、接近传感器、光检测器、运动传感器、生物特征传感器及其组合。一个或多个输出设备212可以包括向操作者输出信息的一个或多个机构,诸如但不限于音频扬声器、耳机、音频输出、视觉显示器、天线、红外端口、触觉反馈、打印机或其组合。总线215允许计算设备205的部件之间的通信。例如,总线215可以是若干种类型的总线结构中的任何一种,包括存储器总线或存储器控制器、外围总线,以及使用各种总线体系架构中的任何一种来提供一个或多个有线或无线通信链路或路径用于向计算设备205的各种其它部件、从计算设备205的各种其它部件或在计算设备205的各种其它部件之间传送数据和/或电力的本地总线。
处理器220可以是一个或多个集成电路、印刷电路、控制器、微处理器或专门的专用处理器,其包括可操作以解释和执行计算机可读程序指令(诸如用于控制计算设备205的各种其它部件中的一个或多个的操作和性能以实现本文讨论的实施例的功能、步骤和/或性能的程序指令)的处理电路系统。在某些实施例中,处理器220解释并执行可以由计算机可读程序指令可操作地实现的处理、步骤、功能和/或性能。例如,处理器220可以从测试盒接收指示插入到分析器中的盒的类型的操作状态信号;确定盒的类型是具有连接到传感器芯片的触点的测试盒,该传感器芯片被配置为对血液样本中的血细胞进行成像;驱动泵致动器以致动测试盒上的泵并将血液样本从样本接纳室移动到样本测试导管中,驱动光发射器以投射光通过样本测试导管和血液样本,基于从样本测试导管和血液样本中接收的光在传感器芯片的像素阵列处记录吸光度和荧光中的至少一个的输出信号,并将输出信号转换成血液样本中每种类型的细胞的数量计数或百分比。在一些实施例中,由处理器220获得或生成的信息(例如,测试盒的类型、每种类型的细胞的数量计数或百分比、信道的电路配置、各种操作的计数(tally)、输出电流、查找表、要施加的电位等)可以存储在存储设备225中。在某些实施例中,处理器220包括用于控制导管的一部分中的生物样本或样品的温度的热控制器。
在各种实施例中,处理器220包括专用集成电路240,该专用集成电路240包括通用信道电路系统245和模数信号转换器247。在其它实施例中,处理器220与包括通用信道电路系统245的专用集成电路240通信。专用集成电路240是被定制为执行多种功能的集成电路(ic),这些功能包括模数信号接口、电流到电压转换、多路复用、电阻器选择、信号放大、电位和电导生成和/或测量,以及多种类型的测定的执行。通用信道电路系统245包括可以结合计算机可读程序指令、数据结构、程序模块和其它数据来实现的电路系统,以在各种模式或配置(例如,电位模式、安培模式、电导模式、光学模式等)之间切换并且有助于多种类型的测定的执行。
存储设备225可以包括可移除/不可移除、易失性/非易失性计算机可读介质,诸如但不限于非暂态机器可读存储介质(诸如磁和/或光记录介质及其对应的驱动器)。驱动器及其相关联的计算机可读介质提供了用于操作计算设备205的计算机可读程序指令、数据结构、程序模块和其它数据的存储。在各种实施例中,存储设备225存储操作系统250、应用程序255和/或程序数据260。在一些实施例中,应用程序255和/或程序数据260可以包括数据库、索引或表以及算法,例如,用于图像分析、数据存储、照明控制、数据显示、样本分析和样本移动的固件或软件。在一些实施例中,计算系统200实现算法,该算法提供用于执行处理器220以增强、检测、分析、表征和测量细胞和其它感兴趣的样品的图像的指令,并将这些算法的结果显示或传输到人类操作员和/或第二基于计算机的系统,诸如个人计算设备(例如,智能电话)或包括医院病历存储系统的存储系统。在某些实施例中,计算系统200实现定性、半定量或定量值算法,其包括用于确定生物样品和/或样本中目标分析物的存在和/或量的部件,用于基于检测到的电导、细胞计数和分类算法确定生物样本在测试设备中的位置的位置确定算法,以及用于基于跨生物样本检测到的电导确定生物样本的血细胞比容(hematocrit)的血细胞比容确定算法,它们提供了用于执行处理器220的指令。
系统存储器230可以包括一种或多种存储介质,包括例如非暂态机器可读存储介质(诸如闪存)、永久存储器(诸如只读存储器(“rom”))、半永久存储器(诸如随机存取存储器(“ram”))、任何其它合适类型的非暂态存储部件或它们的任意组合。在一些实施例中,包括诸如在启动期间帮助在计算设备205的各种其它部件之间传送信息的基本例程的输入/输出系统265(bios)可以存储在rom中。此外,可被处理器220访问和/或当前被处理器220操作的数据和/或程序模块270(诸如操作系统250、应用程序255和/或程序数据260的至少一部分)可以包含在系统存储器230中。
通信接口235可以包括使计算设备205能够与远程设备或系统(诸如其它分析器、医院信息系统、移动设备或其它计算设备(诸如例如联网环境(例如,云环境)中的服务器))通信的任何类似收发器的机构(例如,网络接口、网络适配器、调制解调器或其组合)。例如,计算设备205可以使用通信接口235经由一个或多个局域网(lan)和/或一个或多个广域网(wan)连接到远程设备或系统。
如本文所论述的,计算系统200可以被配置为执行一个或多个分析测试(例如,血液学测定)。特别地,响应于处理器220执行包含在非暂态机器可读存储介质(诸如系统存储器230)中的程序指令,计算设备205可以执行任务(例如,处理、步骤、方法和/或功能)。程序指令可以从诸如数据存储设备225之类的另一个计算机可读介质(例如,非暂态机器可读存储介质)或者经由通信接口235从另一个设备或者从位于云环境之内或之外的服务器被读取到系统存储器230中。在一些实施例中,使用计算系统200的硬连线的电路系统来代替程序指令或与程序指令结合来实现与本文讨论的不同方面一致的任务(例如步骤、方法和/或功能)。因此,能够以硬件电路系统和软件的任意组合来实现本文公开的步骤、方法和/或功能。
测试设备或盒
在一个实施例中,如图3中所示,测试设备或盒300(例如,如关于图1描述的测试设备105)包括顶部305(例如,盖)和底部310(例如,底座),其中安装有至少一个部署在具有电触点325的成像器芯片载体320(例如,基板)上的微制造的传感器芯片315和可选地含有流体(例如,校准流体、稀释流体、试剂和/或清洗流体)的袋子(pouch)330。在一些实施例中,袋子330中的流体的组成选自水、校准流体、试剂流体、控制流体、清洗流体及其组合所组成的组。传感器芯片315和成像器芯片载体320可以位于凹进区域335中,并且被配置为基于例如透射通过传感器芯片315的成像室340和生物样品(例如,来自患者的血液样本)的光生成电信号。垫圈(gasket)345可以位于顶部305和底部310之间,以将它们结合在一起,并在盒300内定义和密封若干腔体和导管。如图3所示,垫圈345可以基本上覆盖盒300的顶部305和底部310之间的整个区域,或者可以仅位于预定结构特征件(例如,盒300的传感器芯片315)之上和之间(未示出)。垫圈345可以包括孔口350,以使得顶部305和底部310的结构特征件之间能够物理、流体和/或气体连通。垫圈345可以具有或可以不具有粘合表面,并且可以在其两侧都具有粘合表面,即,形成双面粘合层。在一些实施例中(其中光发射器由诸如分析器(例如,如关于图1讨论的读取装置110)之类的外部元件提供),顶部305和垫圈345(或可选地底部310)分别包括透明窗口或切口355、360(为了例示的目的,在顶部305和垫圈345中示出)。在其它实施例中(其中光发射器365在测试设备或盒300内提供),光发射器365在传感器芯片315或成像器芯片载体320上提供,并且顶部305和垫圈345(或可选地底部310)中不包括透明窗口或切口355、360。
如图4a-图4j中所示,在一些实施例中,测试设备或盒400(例如,如关于图3描述的盒300)具有壳体,该壳体包括由材料的刚性区和柔性区形成的顶部405(例如,盖)和底部410(例如,底座)。如图4a-图4j中所示,盖405和底座410的刚性区(非阴影部分)分别优选地各自是单个连续区;但是,模制工艺可以提供多个不连续的基本刚性的区。盖405和底座410的柔性区(阴影部分)分别优选地是若干不连续的区的集合。例如,围绕可移位膜(membrane)的柔性区可以与在可封闭的密封构件处的柔性区分开并且不同。可替代地,柔性区可以包括单个连续区。
测试设备或盒400还包括可密封的样本进入端口415和用于闭合样本进入端口415的可闭合的密封构件417、位于样本进入端口415下游的样本接纳室420、可选的毛细管止动件(capillarystop)422、在样本接纳室420和传感器区域430(即,测定区域)之间的可选的过滤器425以及位于传感器区域430下游的废物室433。在某些实施例中,过滤器425被配置为保留来自生物样本的血细胞并允许血浆通过进入传感器区域430。优选地,样本接纳室420的一部分的横截面积相对于样本进入端口415朝远侧减小。在一些实施例中,袋子(例如,关于图3描述的袋子320)部署在凹进区域435中并且与通向传感器区域430的导管437流体连通,可选地经由导管440。袋子可以具有美国专利no.5,096,669或更优选地美国专利no.8,216,529中描述的设计,这两个专利都通过引用整体并入本文。凹进区域435优选地包括尖刺(spike)442,该尖刺442被配置为在例如通过读取器或分析器(例如,如关于图1描述的分析器110)将力施加到袋子上时使袋子破裂。一旦袋子破裂,该系统就被配置为将流体物质从袋子输送到导管437中。流体进入导管437和到传感器区域430和/或在导管440内的移动可以由泵(例如,连接到(一个或多个)导管437或440的气动泵)实现。优选地,气动泵包括由壳体的柔性区447的一部分形成的可移位膜445,该柔性区447的一部分在凹进区域或气囊450之上形成。在图4a-图4j所示的实施例中,在反复压下可移位膜445后,设备经由导管455和460泵送,从而使得来自破裂的袋子的流体流经导管437,可选地流入导管440,并经由导管465流过传感器区域430。
在一些实施例中,可闭合的密封构件417包括形成密封构件470的刚性区的一部分和形成密封件475的柔性区的一部分。当处于闭合位置时,密封构件417可以绕铰链480旋转并使密封件475与样本进入端口415接合,从而提供气密性密封。可替代地,可以通过在热塑性弹性体(tpe)上接触两种柔性材料(例如tpe)来形成气密性密封。可选地,可密封的样本进入端口415还包括排气孔(未示出)。在替代实施例中,刚性区的一部分形成密封构件,而柔性区的一部分形成围绕样本进入端口的周边密封件,由此当处于闭合位置时,密封构件可以绕铰链旋转并接合周边密封件,从而提供气密性密封。可替代地,周边密封件可以通过两种柔性材料的接触来形成。在又一个实施例中,密封构件可以包括如在待审的美国专利no.7,682,833中描述的可滑动的闭合元件,该专利的全部内容通过引用并入本文。
在一些实施例中,传感器区域430包含传感器阵列,该传感器阵列包括用于分析(诸如细胞计数)或确定一种或多种目标分析物的一个或多个传感器。例如,传感器阵列可以包括用于细胞计数的光学传感器和可选地用于确定一种或多种目标分析物的电化学传感器。光学传感器可以包括位于导管465附近的一个或多个光检测器,用于接收通过生物样品(例如,导管465中的血液样本)的光。在某些实施例中,基于在互补金属氧化物半导体(cmos)或电荷耦合器件(ccd)图像传感器中发现的类似技术(例如,包括像素阵列的光敏表面)来构造一个或多个光检测器。在一些实施例中,电化学传感器包括在基本平面的芯片上的基座传感器或感测电极,其中感测电极位于辅助导管(未示出)中,用于接收与试剂混合的样本。
在一些实施例中,导管465的一部分形成成像室485。例如,导管465的一部分可以包括(i)平面构件、(ii)透明平面构件,以及(iii)具有平均间隔物高度并且部署在平面构件和透明平面构件之间以形成在平面构件和透明平面构件之间延伸的具有平均室高度的成像室485的多个间隔物元件。在某些实施例中,一个或多个光检测器形成平面构件的至少一部分。优选地,导管465的该部分包括在大约0.5mm至大约2cm范围内的均匀宽度尺寸、在大约0.5mm至大约2cm范围内的均匀长度尺寸和在大约1.5μm至大约35μm范围内(例如,大约2μm至大约20μm)的均匀高度尺寸。如本文所使用的,术语“基本上”、“近似”和“大约”被定义为在很大程度上但不一定完全是所指定的(并且包括完全是所指定的),如本领域的普通技术人员所理解的那样。在任何公开的实施例中,术语“基本上”、“近似”或“大约”可以被替换为在所指定的“[百分比]内”,其中百分比包括百分之0.1、1、5和10。
传感器响应的分析物/特性可以选自颗粒(例如,血细胞或微粒)、人绒毛膜促性腺激素、ph、分压co2、分压o2、葡萄糖、乳酸、肌酐、尿素、钠、钾、氯、钙、镁、磷酸盐、血细胞比容、凝血酶原时间(pt)、活化部分凝血酶原时间(aptt)、活化凝血时间(act)、d-二聚体、前列腺特异性抗原(psa)、肌酸激酶-mb(ckmb)、脑钠肽(bnp)、肌钙蛋白i(tni)、心肌肌钙蛋白(ctni)、人绒毛膜促性腺激素、肌钙蛋白t、肌钙蛋白c、肌红蛋白、中性粒细胞明胶酶相关脂质运载蛋白(ngal)、半乳糖凝集素3、前列腺特异性抗原(psa)、甲状旁腺激素(pth)、半乳糖凝集素-3、天冬氨酸转氨酶(ast)、丙氨酸转氨酶(alt)、白蛋白、总蛋白、胆红素、碱性磷酸酶(alp)等及其组合。在各种实施例中,光学传感器被配置为将从成像室的一部分内的细胞接收的光转换成输出信号,并且连接到光学传感器的处理器被配置为将输出信号转换成血液样本中每种类型的细胞的数量计数或百分比。在一些实施例中,分类血细胞计数是全血样本中每种类型的细胞(例如,白细胞(wbc))的数量或百分比的测度。细胞类型包括红细胞、白细胞和血小板。成像可以区分各种类型的白细胞,包括嗜中性粒细胞、淋巴细胞、粒细胞、嗜酸性粒细胞、嗜碱性粒细胞和单核细胞。分类血细胞计数还可以揭示是否存在任何异常或未成熟的细胞。优选地,在作为全血的液体样本中测试分析物/特性,但是可以使用其它样本,包括血液、血清、血浆、尿液、脑脊髓液、唾液及其修改形式。修正可以包括稀释、浓缩、添加诸如抗凝剂之类的试剂等。无论样本类型如何,均可以通过盒400的样本进入端口415容纳。
在一些实施例中,盒400还包括柔性区447的位于凹进区域435上方的一部分490,该部分490被配置为像泵一样被致动以在凹进区域435内施加压力。在某些实施例中,柔性区447包括通用符号描述,以向用户指示用户不应当将压力施加到柔性区447。例如,符号可以包括带有横杆的压花圆(embossedcircle)。柔性区447的部分490提供了可以容纳分析器(例如,如关于图1描述的分析器110)的致动器特征的表面,以施加力并使在凹进区域435中的下面的袋子破裂。柔性区447的部分490中的塑料的厚度可以优选地从大约200μm至大约800μm,例如大约400μm。本质上,柔性区436的部分490应当足够薄以易于弯曲,但又应当足够厚以保持物理完整性而不会撕裂。
在各种实施例中,传感器区域430的一部分(例如,传感器的基板的顶表面)、导管465的壁和/或样本接纳室420的壁涂覆有一种或多种用于修正生物样本的干燥试剂。该一种或多种干燥试剂可以包括一种或多种非荧光或荧光染料(诸如曙红、亚甲蓝(methyleneblue)、吖啶橙(也称为“碱性橙15”或“aco”)或阿斯特拉宗橙(也称为“ao”或碱性橙21))、与细胞(例如,血细胞,诸如wbc)中的核酸dna结合的成分、抗凝剂、抗体、抗体片段、离子载体、酶、酶的集合、具有可裂解的可检测部分的肽、基质、识别测定珠的类型的光学标记染料和/或其组合。在一些实施例中,该一种或多种干燥试剂在样本接纳室420中并且在样本到达传感器区域430之前溶解到样本中。在其它实施例中,传感器区域430的一部分(例如,传感器的基板的顶表面)包括涂覆有用于感兴趣的分析物或细胞的反应物和/或基质的试剂区域。试剂区域可以由容纳环结构定义。在一些实施例中,容纳环结构是聚酰亚胺或另一种光刻产生的层的疏水环。可以将含有某种形式的该一种或多种干燥试剂的微滴或数个微滴(尺寸大致为5-40nl)或一系列大约100纳米滴(尺寸大致为50至1000pl)分配或印刷到传感器的表面上或传感器附近。光定义的环结构包含该水性液滴,其允许试剂区域定位到几微米的精度。可以使试剂区域的尺寸从0.03mm2至近似2mm2。在本实施例中,这个尺寸的上端受到导管和传感器芯片400的尺寸的限制,而不是本发明的限制。
生物样本或流体可以在干燥试剂(例如,试剂区域)上方通过至少一次以将试剂溶解在生物样本或流体中。在生物样本或流体的区段内,试剂可以优先溶解和集中在该区段的预定区域内。这是通过控制该区段的位置和移动来实现的。因此,例如,如果该区段的仅一部分(诸如前缘)在试剂上方往复运动,那么可以在靠近前缘处实现试剂的高局部浓度。可替代地,如果期望试剂的均匀分布,例如,如果定量分析要求已知浓度的试剂,那么样本或流体的进一步往复运动将实现混合和均匀分布。
如图4k-图4r中所示,在替代实施例中,测试设备或盒400(例如,如关于图3描述的盒300)具有壳体,该壳体包括由刚性材料形成的顶部405(例如,盖)和底部410(例如,底座)。如图4a-图4j中所示,盖405和底座410的刚性材料分别优选地各自是单个连续的区;但是,模制工艺可以提供多个不连续的基本刚性的区。测试设备或盒400还包括样本进入端口415、位于样本进入端口415下游的样本接纳室420,以及将样本接纳室420流体连接到传感器区域430(即,测定区域)的导管465。样本接纳室420、导管465和传感器区域430中的样本运动可以通过毛细管作用(capillaryaction)来控制,其中流体路径和导管的尺寸被确定为促进毛细管作用。流体路径和/或导管的表面也可以使用本领域中已知的技术进行处理,以使它们或多或少具有亲水性和疏水性,以进一步促进毛细管作用。
在一些实施例中,传感器区域430包括至少一个微制造的传感器芯片492,其部署在具有电触点495的成像器芯片载体493(例如,基板)上。传感器芯片492和成像器芯片载体493可以位于传感器区域430中并且被配置为基于例如透射通过传感器芯片492的成像室485和生物样品(例如,来自患者的血液样本)的光来生成电信号。在其中光发射器是由诸如分析器(例如,如关于图1讨论的读取装置110)之类的外部元件提供的一些实施例中,顶部405或底部410包括透明窗口或切口497(出于例示目的,在底部410中示出)。在其中在测试设备或盒400内提供光发射器498的其它实施例中,在传感器芯片492或成像器芯片载体493上提供光发射器498,并且顶部405或底部410中不包括透明窗口或切口497。在一些实施例中,导管465的一部分形成成像室485。例如,导管465的一部分可以包括(i)平面构件、(ii)透明平面构件,以及(iii)具有平均间隔物高度并且部署在平面构件和透明平面构件之间以形成在平面构件和透明平面构件之间延伸的具有平均室高度的成像室485的多个间隔物元件。在某些实施例中,一个或多个光检测器形成平面构件的至少一部分。优选地,导管465的该部分包括在大约0.5mm至大约2cm范围内的均匀宽度尺寸、在大约0.5mm至大约2cm范围内的均匀长度尺寸和在大约1.5μm至大约35μm范围内(例如,大约2μm至大约20μm)的均匀高度尺寸。
传感器响应的分析物/特性可以选自颗粒(例如,血细胞或微粒)、人绒毛膜促性腺激素、ph、分压co2、分压o2、葡萄糖、乳酸、肌酐、尿素、钠、钾、氯、钙、镁、磷酸盐、血细胞比容、凝血酶原时间(pt)、活化部分凝血酶原时间(aptt)、活化凝血时间(act)、d-二聚体、前列腺特异性抗原(psa)、肌酸激酶-mb(ckmb)、脑钠肽(bnp)、肌钙蛋白i(tni)、心肌肌钙蛋白(ctni)、人绒毛膜促性腺激素、肌钙蛋白t、肌钙蛋白c、肌红蛋白、中性粒细胞明胶酶相关脂质运载蛋白(ngal)、半乳糖凝集素3、前列腺特异性抗原(psa)、甲状旁腺激素(pth)、半乳糖凝集素-3、天冬氨酸转氨酶(ast)、丙氨酸转氨酶(alt)、白蛋白、总蛋白、胆红素、碱性磷酸酶(alp)等及其组合。在各种实施例中,光学传感器被配置为将从成像室的一部分内的细胞接收的光转换成输出信号,并且连接到光学传感器的处理器被配置为将输出信号转换成血液样本中每种类型的细胞的数量计数或百分比。在一些实施例中,分类血细胞计数是全血样本中每种类型的细胞(例如,白细胞(wbc))的数量或百分比的测度。细胞类型包括红细胞、白细胞和血小板。成像可以区分各种类型的白细胞,包括嗜中性粒细胞、淋巴细胞、粒细胞、嗜酸性粒细胞、嗜碱性粒细胞和单核细胞。分类血细胞计数还可以揭示是否存在任何异常或未成熟的细胞。优选地,在作为全血的液体样本中测试分析物/特性,但是可以使用其它样本,包括血液、血清、血浆、尿液、脑脊髓液、唾液及其修改形式。修正可以包括稀释、浓缩、添加诸如抗凝剂之类的试剂等。无论样本类型如何,均可以通过盒400的样本进入端口415容纳。
在各种实施例中,传感器区域430的一部分(例如,传感器的基板的顶表面)、导管465的壁和/或样本接纳室420的壁涂覆有一种或多种用于修正生物样本的干燥试剂。该一种或多种干燥试剂可以包括吖啶橙(也称为“碱性橙15”或“aco”)、阿斯特拉宗橙(也称为“ao”或碱性橙21)、与细胞(例如,血细胞,诸如wbc)中的核酸dna结合的成分、抗凝剂、抗体、抗体片段、离子载体、酶、酶的集合、具有可裂解的可检测部分的肽、基质、识别测定珠的类型的光学标记染料和/或其组合。在一些实施例中,该一种或多种干燥试剂在样本接纳室420中并且在样本到达传感器区域430之前溶解到样本中。在其它实施例中,传感器区域430的一部分(例如,传感器的基板的顶表面)包括涂覆有用于感兴趣的分析物或细胞的反应物和/或基质的试剂区域。试剂区域可以由容纳环结构定义。在一些实施例中,容纳环结构是聚酰亚胺或另一种光刻产生的层的疏水环。可以将含有某种形式的该一种或多种干燥试剂的微滴或数个微滴(尺寸大致为5-40nl)或一系列大约100纳米滴(尺寸大致为50至1000pl)分配或印刷到传感器的表面上或传感器附近。光定义的环结构包含该水性液滴,其允许试剂区域定位到几微米的精度。可以使试剂区域的尺寸从0.03mm2至近似2mm2。在本实施例中,这个尺寸的上端受到导管和传感器芯片400的尺寸的限制,而不是本发明的限制。生物样本或流体可以通过毛细管作用在干燥试剂(例如,试剂区域)上方通过,以将试剂溶解在生物样本或流体中。
成像设备
为了在护理点应用(例如,如关于图1、图2、图3和图4a-4r描述的分析器和盒系统)中实现无透镜显微镜,本发明的几个方面针对一种成像设备,其包括:(i)一个或多个光检测器、(ii)成像室,以及(iii)一个或多个光发射器。成像设备的各种实施例通过图5-图10和图11a-图11i中所示的示例来例示。在一些实施例中,成像设备500包括光检测器,诸如成像器芯片505,具有由在基板上形成的成像集成电路515呈现的内表面或光敏表面510。成像集成电路515(例如,超大规模集成(vlsi)电路)可以具有高分辨率光敏阵列,该高分辨率光敏阵列包括在其表面510处呈现的多维的像素阵列以及用于处理和读出的非光敏支持电路系统。成像集成电路515可以电气地和机械地附接到传感器芯片520,该传感器芯片520是印刷电路板,其部件连接到能够将光敏表面510连接到一个或多个导电引脚(诸如分析器(例如,如关于图1描述的分析器110)的临时电连接器)的一个或多个电连接件(例如,包括多个分立触点的电连接件)。
多维的像素阵列可以是由在超大规模或更大的集成电路中使用的半导体材料形成的光传感器或光检测器。半导体材料的定义特性是它可以掺杂有以可控方式更改其电子特性的杂质;在一些实施例中,该阵列基本上由诸如硅之类的结晶无机固体形成;并且在其它实施例中,阵列基本上由化合物半导体形成,该化合物半导体包括至少两种不同物质的元素。化合物半导体可以包括13-15族(旧的iii-v族)中的元素,例如来自13族(旧的iii族,硼、铝、镓、铟)和来自15族(旧的v族,氮、磷、砷、锑、铋)的元素。化合物半导体的可能化学式的范围可以包括二元(两个元素,例如砷化镓(iii))、三元(三个元素,例如铟镓砷(ingaas))和四元(四个元素,例如,铝铟镓磷(alingap))合金。在一些实施例中,像素阵列是光传感器或诸如(一个或多个)pd之类的光电检测器,例如,具有夹在p型半导体区域和n型半导体区域之间的未掺杂本征半导体区域的(一个或多个)硅光电pin二极管。可替代地,在不脱离本发明的精神和范围的情况下,可以使用具有或不具有滤波器来控制波长的其它光传感器或检测器。多维的像素阵列的频谱响应可以在300nm至1000nm的范围内。这提供了覆盖led波长的宽频谱的能力。可以选择光敏表面510的尺寸,以适合测试设备的其它部件(例如,导管或传感器区域),例如,可用作表面安装二极管(smd)的光敏表面510和芯片级封装(csp)可以被用于适合各种测试设备。在一些实施例中,传感器芯片520可以具有大约1mm至大约20mm的宽度和大约1mm至大约20mm的长度(例如,大约5mm的宽度和大约6mm的长度),以便容纳具有工业标准2.0mm×1.25mm占位面积(footprint)的低剖面(lowprofile)光敏表面510,其提供了高效的光检测和低功耗。根据各个方面,光敏表面510的灵敏度在0.5ua/cm2-4ua/cm2的范围内,例如基本上为1ua/cm2。
如本文所述,多维的像素阵列形成高分辨率光敏阵列的一部分。如本文中所使用的,术语“高分辨率”是指等于或超过标准的基于透镜的光学显微镜的分辨率。标准的基于透镜的光学显微镜的分辨率被定义为样品上观察者或相机系统仍能够区分为分开的实体的两个点之间的最短距离。例如,取决于应用的上下文,高分辨率是指小于5μm,小于2μm,小于1μm,小于大约0.5μm或甚至更小。光学传感器中的分辨率主要由光敏阵列的像素尺寸来确定。一些光敏阵列在一侧具有数百万个正方形像素,每个像素略大于1μm,从而导致分辨率大约为1μm;可实现的分辨率将随着像素尺寸的减小而提高,随着集成电路或其它设备的设计和制造技术的改进,理论上超过例如10亿像素,每个像素在一侧小至200nm或更小。每英寸像素(ppi)或每厘米像素(ppcm)是光学传感器的像素密度的测度。光学传感器的分辨率是对最终图像有贡献的像素计数,并且通常以百万像素(意味着数百万像素)为单位进行测量。例如,包括1280×720像素的光敏阵列具有921600个像素或小于1兆像素分辨率,而包括1920×1080像素的光敏阵列具有2073600个像素或大约2.1兆像素分辨率。在一些实施例中,光敏表面510包括具有至少5兆像素分辨率和至少150ppi像素密度的像素阵列。在一些实施例中,阵列的每个像素的长度和宽度等于或小于10μm、等于或小于5μm。等于或小于1μm、等于或小于500nm、等于或小于250nm。在某些实施例中,阵列的每个像素具有大约0.9μm2、1.1μm2、1.4μm2或1.8μm2的面积。就范围而言,阵列的每个像素的面积可以小于大约10.0μm2、小于大约5.0μm2、小于大约2.0μm2,例如从大约0.5μm2至大约1.5μm2。
微制造技术(例如,光刻和等离子体沉积)可以被用于在受约束的空间中构造多层传感器结构。在一些实施例中,成像集成电路515被制造为包括ccd。在其它实施例中,成像集成电路515是使用cmos技术制造的。ccd对于接触式光学显微镜应用具有优点,包括检测在芯片的整个暴露表面上的光(100%填充因子)的能力,尽管由于需要从光感测(并行寄存器)到读出(串行寄存器)元件顺序转移电荷而导致它们与cmos相比具有较慢的读取速度。可以使用ccd的各种配置:全帧体系架构可以被用于最大化可用于成像的芯片的比例,但是要求外部快门来防止在读出期间的图像拖尾(smearing);而帧传输体系架构避免了图像拖尾,但是在该处理中,要求并行寄存器的被屏蔽的非光敏区域的尺寸与并行寄存器的光敏区域的尺寸大致相同,因此成像集成电路具有全帧体系架构的光敏区域的大约一半。由于根据本文讨论的各个方面使用的阵列中的各个像素的面积较小,因此在许多成像条件下,在每个像素中收集的电荷将较小;但是,由于样品与像素接触或几乎接触,因此像素对从样品发出的光子的有效接受角大于常规显微镜中的透镜所实现的接受角。在一些ccd实施例中,为了进一步提高灵敏度,任何体系架构的ccd都附加地采用电子倍增增益,其中施加到(一个或多个)串行寄存器的扩展区域的高时钟电压放大随着每个像素的电荷向(一个或多个)输出节点移位而对其进行放大。
cmos器件对这些应用具有替代优点,包括制造成本较低、通过嵌入在单个像素中的电子元件进行信号处理以及无需顺序转移即可单独读出独立寻址的像素值的能力。在一些cmos实施例中,使用了减薄的背面照明阵列;虽然以前要求昂贵且复杂的制造方法,但它们可以使用结合晶片处理便宜地制造,结合晶片处理诸如使用具有掩埋氧化物层作为蚀刻停止层的绝缘体上硅基板以产生均匀最佳减薄的光吸收背层的处理(参见例如美国专利no.7,425,460,该专利通过引用并入本文)。进入普通(正面照明)成像集成电路的光通常穿过上面的层,这些层散射光并且其金属电路元件阻挡了下面的光敏层;在背面照明成像集成电路中,光敏层靠近表面,在金属电路承载层上方,通常导致较少的光阻挡(较大的“填充因子”),因此导致较高的有效量子效率。
在各种实施例中,成像设备500还包括流体连接到样本接纳室(例如,图4a-图4r的样本接纳室420)的样本测试导管525。样本测试导管525的一部分可以包括:(i)具有内表面535的平面构件530(例如,具有光敏表面510的成像器芯片505)和(ii)具有内表面545的透明平面构件540,以形成在平面构件和透明平面构件之间延伸的具有平均室高度的成像室550。成像室550被结构化以获得驻留在成像室550中的样本的至少一部分的图像。在一些实施例中,成像室被结构化以获得样本内的细胞(例如,单层红细胞和/或白细胞)的图像。在其它实施例中,成像室被结构化以获得用于执行分析测试(例如,针对样本内的目标分析物的定性或半定量分析测试)的一个或多个测定珠的图像。图6示出了具有在z轴上测得的预定高度(h1)的成像室600的横截面。在一些实施例中,室高度(h1)被选择以适应细胞的分析(例如,单层细胞的形成),并且将是从大约2μm至大约20μm、从大约2μm至大约6μm或从大约3μm至大约5μm,例如大约4μm、大约2μm或大约6μm。在其它实施例中,室高度(h1)被选择以适应测定珠的分析,并且将是从大约0.5μm至大约40μm、从大约0.5μm至大约20μm或从大约2μm至大约10μm,例如大约4μm、大约8μm或大约10μm。图7示出了成像室700的顶部平面图,该成像室具有在x-y平面上测得的面积(a1)和在x、y和z轴上测得的体积((v1)=(h1)x(a1))。成像室700的侧向边界705可以例如由分别在平面构件和透明平面构件的内表面之间延伸的结构化特征件710(例如,部署在平面构件表面上的抑制侧向行进的导管的侧面、胶合线或吸水材料)定义。
成像室500、600、700的尺寸通常被确定为保持大约0.2μl至大约2.0μl样本,但是成像室500、600、700不限于任何特定的体积容量,并且容量可以变化以适合分析应用。例如,其尺寸被确定为产生单层的红细胞或白细胞以用于细胞识别和计数。在一些实施例中,成像室500、600、700可操作以静态地(quiescent)保持液体样本。本文中使用术语“静态地”来描述样本沉积在成像室500、600、700内以进行分析,并且在分析期间没有被有目的地移动。就血液样本中存在运动的程度而言,主要是由于血液样本中的形成成分的布朗运动引起的,该运动不会禁用本发明的使用。但是,在其它实施例中,成像室500、600、700可操作以主动地保持液体样本。在本文中使用术语“主动地”来描述样本被沉积在成像室500、600、700内以进行分析,并且在分析期间被有目的地移动(例如,经由诸如由柔性区427的一部分形成的可移位膜426之类的泵,如关于图4a-图4r所描述的)。
如图5中所示,在各种实施例中,成像设备500还包括位于样本测试导管525附近(例如,在导管的一侧或在导管上方)的光发射器555。在一些实施例中,光发射器555由诸如分析器(例如,如关于图1讨论的读取装置110)之类的外部元件提供。在其它实施例中,光发射器555在测试设备或盒(例如,如关于图1所讨论的测试设备或盒110)内的成像器芯片或成像器芯片载体上提供。在一些实施例中,光发射器555被定位成使得从光发射器555到传感器芯片520的光敏表面510的光路与光敏表面510成45度或更大的角度。在一些实施例中,光发射器555被定位成使得从光发射器555到光敏表面510的光路与光敏表面510成至多45度的角度。在一些实施例中,光发射器555被定位成使得从光发射器555到光敏表面510的光路大致垂直于或平行于光敏表面510。
在光发射器555存在的情况下,可以获得样品的图像。光发射器555可以产生成像集成电路515对其响应的至少一个波长的光。在一些实施例中,光发射器555包括激光器,并且预定波长是激光器的基本上单色的波长。在一些实施例中,光发射器555包括黑体,并且预定波长带是在产生时黑体适当地高效的电磁频谱的一段,而无论使用或不使用插入在光发射器555和样品之间的带通频谱滤波器。在一些实施例中,光发射器555包括一个或多个发光二极管,例如,被定向为产生在一个或多个预定波长带中的光的有机发光二极管阵列。在一些实施例中,光发射器555是连续的。在一些实施例中,光发射器555是脉冲的。在一些实施例中,光发射器555是偏振的。在一些实施例中,光发射器555包括任何环境光源、白炽光源或荧光光源。在其中荧光染料被用作试剂的某些实施例中,光发射器555包括荧光照明器。在一些实施例中,光发射器555被结构化为诸如亮条(brightbars)的周期性光栅。结合适当的倾斜、脉冲、偏振、结构化或照明的其它形式,一些实施例可以生成与显微镜技术领域已知的方法对应的附加有用信息,包括但绝不限于暗场、荧光、荧光寿命、光学层析成像和偏振显微镜。在一些实施例中,样品本身就是光发射器555;例如,通过化学发光,或者在处理光敏阵列以使像素对放射性样品发射的辐射敏感的情况下。在一些实施例中,可以存在能够作为上面提到的任何光发射器操作的附加光发射器。
(一个或多个)光源的频谱可以位于使用光敏阵列可检测到的电磁频谱的任何预定区域中,无论经过或不经过专门处理以扩展这种阵列可检测到的波长的有效范围。在一些实施例中,预定波长或波长带在红外频谱中。在一些实施例中,预定波长或波长带在紫外频谱中。在一些实施例中,预定波长或波长带在可见频谱中。在某些实施例中,光发射器555被配置为以大约300nm至大约1000μm的波长将光透射通过成像室550到达传感器芯片520。在其它实施例中,光发射器555被配置为以大约300nm至大约1000μm的多个波长将光透射通过成像室550到达传感器芯片520。
在各种实施例中,光发射器555位于与成像室530相邻处(即,在透明平面构件附近,例如在大约1mm、大约2mm或大约3mm之内)。在某些实施例中,测试盒或测试设备包括壳体,并且传感器芯片520、样本测试导管525和光发射器555被容纳在壳体内。例如,测试盒可以包括光发射器555,并且光发射器555可以电连接到多个连接器触点中的至少一个,并且光发射器555可以被配置为以大约300nm至大约1000μm的一个或多个波长使光透射通过成像室550的一部分到达传感器芯片520。在其它实施例中,分析器包括光发射器555,并且测试盒还包括壳体,该壳体包括与样本测试导管525相邻的窗口,用于照亮成像室550的一部分,并且测试盒可插入到分析器的端口中,以使光发射器555在窗口和成像室550的该部分上方对准,从而以大约300nm至大约1000μm的一个或多个波长将光透射通过成像室550的一部分到达传感器芯片520。
在一些实施例中,光发射器555包括针对其频谱发射特性和所发射的光的均匀性而选择的单独控制的发光二极管(led),并且被定位成便于进行预期的分析。在一些实施例中,光发射器555被定位成均匀地照亮成像室550。可以例如通过结合在盒或分析器内的嵌入式控制器来控制led。可以例如单个地或者成组地控制led,以便于进行预期的分析,包括但不限于其中照明器、样品和成像系统基本上对准的常规的显微镜,以及其中从像素的接受角之外的角度照亮样品的暗场显微镜。此外,通过适当选择光发射器555中的led,预期的成像设备可以被用于但不限于例如彩色成像、荧光显微镜、偏振显微镜、红外和紫外线显微镜。一些实施例将结合多个光发射器555,每个光发射器555可以具有不同的特点,以便于进行更广泛的分析。在一些实施例中,光发射器555将易于互换。在一些实施例中,光发射器555包括具有选择性寻址的有机led(oled)或有源矩阵有机led(amoled)面板。一些实施例既促进了均匀的样品照明又促进了快速的照明变化,以便促进还预期进行的对静止和移动样品二者的分析。在一些实施例中,amoled面板被用于通过面板光发射器的适当控制来照亮样品。在一些示例中,光发射器555可以包括led、有机led面板、荧光面板、紫外线源、诸如日光或室内光之类的环境照明、白炽光源或任何其它光源,包括没有任何光源(例如对于化学发光样品),以及这些示例的组合。光发射器555的配置包括但不限于平板、光源的矩形或其它网格布局、可移动光源、多色光源以及固定到内部或安装在成像室550上方的半球形外壳的光源(其中室的中心作为外壳的中心)或它们的组合。光发射器555的控制可以包括但不限于稳定的照明、同时或依次选择性地激发一个或多个光发射器555、控制任何一个或多个光发射器555的强度、控制每个或多个光发射器555以便具有特定时间照明图案或者使用它们中的任何一个或任何组合以及其它(包括未来的技术)。用于光发射器555的控制器可以包括但不限于诸如开关或旋钮之类的手动控制器、自动嵌入式计算系统、诸如在分析器板上的外部计算系统、诸如台式或膝上型计算机之类的外部计算系统或前述的组合。
对细胞进行成像
如图8中所示,成像室800包括第一平面构件805、第二平面构件810以及部署在第一平面构件805和第二平面构件810之间的多个间隔物元件815。预先确定成像室800的高度(h1),使得驻留在成像室800内的样本将经由毛细管作用力在成像室800内横向行进。在各种实施例中,第一平面构件805和第二平面构件810中的至少一个是透明的(例如,透明平面构件)。包含丙烯酸或聚苯乙烯的透明塑料膜是用于第一平面构件805和第二平面构件810的可接受材料的示例。在一些实施例中,第一平面构件805或第二平面构件810(例如,平面构件)的至少一部分由成像器芯片820形成。例如,通常光学传感器在光敏表面825上方具有保护窗。但是,在某些实施例中,光学传感器不包括保护窗,代替地,成像器芯片820是无窗的,以使样本足够接近光敏表面825以实现如本文所定义的高分辨率,而无需计算图像处理。对于在光敏表面825的像素宽度的一半内的样本部分,图像的分辨率受到构成光敏表面825的像素的尺寸的限制。例如,当样本(例如,细胞)上的点距最近的像素的中心小于像素宽度的一半时,从该点朝阵列发射或散射的几乎所有光都将主要入射在最近的像素上,并且因此仅激发该像素;在这些条件下,分辨率可以由像素尺寸或更精确地由等效区域的圆的尺寸确定(例如,对于400nm×400nm像素,分辨率约为450nm),但是分辨率可以通过计算、样本流或其它手段进一步增强。例如,当光敏表面和样本之间的距离小于感兴趣的波长时,可以认为已达到近场准则。不要求透镜或任何其它光学部件实现这些条件,从而实现这种像素受限的分辨率。
在其它实施例中,光敏表面825用一个或多个薄层处理。当施加到光敏表面825上的这些层的总厚度仍允许满足或基本满足本文所述的近场准则时,这些层可以被认为是薄的。在若干实施例中,这些层足够薄,以使样本进入光敏表面825的像素宽度的一半以内。在一些实施例中,这些层在光路的方向上足够薄,使得光路穿过这些层的总距离不大于大约感兴趣的波长。在一些实施例中,透明的化学耐受性材料的薄层涂覆光敏表面825。这样的薄膜基板可以是任何足够透明且绝缘的材料,包括但不限于氧化硅、氧化钛、氧化铝、氧化钽、氟化镁、氟化镧、氟化铝、氮化硅和氮氧化硅;并且其可以通过多种方式沉积,包括但不限于磁控溅射、化学气相沉积、热或真空电弧等离子体蒸发。在一些实施例中,基板是充当干涉滤光器的介电薄膜,由此将底层像素的频谱灵敏度限制为适合于给定应用。在一些实施例中,基板被用于实现某些形式的彩色成像。在某些实施例中,基板基本上能透射预定波长带的一部分,诸如带通滤波器。在其它实施例中(诸如针对荧光或发射显微镜),基板基本上能透射与由样本的荧光、发射或以其它方式产生的波长带对应的其它预定波长带。在一些实施例中,基板包括充当抗反射涂层的介电薄膜。在一些实施例中,存在彼此紧密接触的多个基板。在一些实施例中,光敏表面825被硅烷化(silanized)以减少表面与样本之间的粘附。在一些实施例中,化学耐受性材料包括例如通过化学气相沉积而沉积在适当的薄层中的金刚石。在一些实施例中,化学耐受性材料包括例如通过化学气相沉积而沉积在适当的薄层中的al2o3或si3n4。这种材料能给予光敏表面825更坚固的特点,从而允许易于清洁以及保护表面不受磨蚀性样本的影响。在一些实施例中,通常为si3n4的钝化层涂敷成像集成电路,导致当与金属或其它导电样本(诸如盐溶液)一起使用时导电率降低。在一些实施例中,偏振材料的薄层涂覆光敏表面825。在一些实施例中,吸收材料的薄层涂覆光敏表面825。在一些实施例中,干涉材料的薄层涂覆光敏表面825。在一些实施例中,表面等离子体激元生成材料的薄层涂覆光敏表面825。技术可用于将这种层沉积为薄膜,并以任意的逐像素图案进行沉积。
在各种实施例中,多个间隔物元件815是可设置在第一平面构件805和第二平面构件810之间并且可操作以将第一平面构件805和第二平面构件810彼此间隔开并维持室高度(h1)的任何结构。多个间隔物元件815中的每一个的高度通常不是彼此完全相等,但是基本相等,并且在类似分析装置中使用的间隔单元的商业可接受的公差内。照此,多个间隔物元件815的高度被表征为平均间隔物高度(h2)。在一些实施例中,平均间隔物高度(h2)被选择以适应细胞的分析(例如,细胞单层的形成)并且将为从大约2μm至大约20μm、从大约2μm至大约6μm或从大约3μm至大约5μm,例如大约4μm、大约2μm或大约6μm。在其它实施例中,平均间隔物高度(h2)被选择以适应测定珠的分析,并且将为从大约0.5μm至大约40μm、从大约0.5μm至大约20μm或从大约2μm至大约10μm,例如大约4μm、大约8μm或大约10μm。间隔物元件的高度可以通过通常用于测量物体的高度或尺寸的任何已知的分析技术(诸如流式细胞仪、激光设备、sem成像、粒度分析器等)来确定。如本文所使用的,“平均间隔物高度”是指用于构造室的间隔物元件中的至少90%的平均高度。“平均值”应理解为数字集合的计算“中心”值(数字集合的总和除以计数),其中数字集合是构造室的间隔物中的至少90%的高度值的集合。
在一些实施例中,多个间隔物元件815是球形珠(例如,可从例如bangs实验室有限公司商购的用于诊断、研究和流式细胞仪应用的均匀聚合物、二氧化硅或磁性微球产品)。在一些实施例中,多个间隔件元件815是在以下结构上制造的柱状结构:(i)第一平面构件805的表面(例如,传感器芯片820的光敏表面825)的至少一部分,和/或(ii)第二平面构件810的表面的至少一部分。在一些实施例中,多个间隔物元件815是在以下结构上浮雕的结构:(i)第一平面构件805的表面(例如,传感器芯片820的光敏表面825)的至少一部分,和/或(ii)第二平面构件810的表面的至少一部分。在一些实施例中,多个间隔物元件815直接地(物体之间有物理接触)在以下结构上形成:(i)第一平面构件805的表面(例如,传感器芯片820的光敏表面825)的至少一部分,和/或(ii)第二平面构件810的表面的至少一部分。在一些实施例中,多个间隔物元件815间接地(物体之间没有物理接触)在以下结构上形成:(i)第一平面构件805的表面(例如,传感器芯片820的光敏表面825)的至少一部分,和/或(ii)第二平面构件810的表面的至少一部分。
在若干实施例中,多个间隔物元件815包括比第一平面构件805和第二平面构件810中的一个或两者具有更大柔性的材料;即,相对而言,第一平面构件805和第二平面构件810中的一个或两者可以被认为相对于多个间隔物元件815是刚性的,并且多个间隔物元件815可以被认为相对于第一平面构件805和第二平面构件810中的一个或两者是柔性的。在其它实施例中,多个间隔物元件815包括比第一平面构件805和第二平面构件810中的一个或两者具有更小柔性的材料;即,相对而言,第一平面构件805和第二平面构件810中的一个或两者可以被认为相对于多个间隔物元件815是柔性的,并且多个间隔物元件815可以被认为相对于第一平面构件805和第二平面构件810中的一个或两者是刚性的。
特别地,已经发现,如果使用部署在平面构件之间的间隔物形成成像室800,并且如果第一平面构件805和第二平面构件810中的至少一个和/或多个间隔物元件815是柔性的,那么成像室800表现地不同于常规血细胞计数器(hemocytometer)室,并且这种差异是非常有利的。当成像室800充满液体(例如,血液样本)时,毛细管作用力趋向于将第一平面构件805和第二平面构件810拉在一起,从而在保持的多个间隔物元件815上施加轻微的压力。这个压力将造成柔性元件以使得室高度(h1)平均地近似在第一平面构件805和第二平面构件810之间部署的多个间隔物元件815的平均尺寸(平均间隔物高度(h2))的方式变形。例如,如果第一平面构件805和第二平面构件810均是刚性的并且多个间隔物元件815是柔性的,那么大于平均直径的间隔物将被压缩,并且第一平面构件805和第二平面构件810将接近,直到越来越多的间隔物与第一平面构件805和第二平面构件810接触,从而防止进一步的接近。在这个时候,室的高度(h1)将具有平均高度,该平均高度基本上近似于多个间隔物元件815的平均高度(h2),并且可以容易地确定,只要多个间隔物元件815的高度的标准偏差是可接受的并且多个间隔物元件815具有足够的柔性即可。如本文所使用的,术语“柔性”是在去除施加的力或应力时材料弹性变形并返回其原始形状的能力(定义为由单位力造成的位移)。如本文所使用的,术语“柔性的”和“足够柔性的”被定义为具有小于0.4mn/m的taber硬度的物体。如本文所使用的,术语“刚性”和“硬度”是柔性的对立项,并且是在施加力或应力时材料能够抵抗变形的程度(定义为产生单位位移所需的力)。如本文所使用的,术语“刚性的”、“硬的”、“足够刚性的”和“足够硬的”被定义为具有大于0.4mn/m的taber硬度的物体。在另一个示例中,如果多个间隔物元件815是刚性的并且第一平面构件805和/或第二平面构件810是柔性的,那么第一平面构件805和/或第二平面构件810将变形并且在每个较大的间隔物周围的小区域内“隆起(tented-up)”,并在较小的间隔物上方则较低。假定第一平面构件805和/或第二平面构件810足够柔性,那么室的高度(h1)将具有基本近似于多个间隔物元件815的平均高度(h2)的平均高度。
间隔物元件的高度可以通过通常用于测量结构的高度或尺寸的任何已知的分析技术来确定,已知的分析技术诸如是激光设备、sem成像、内标准品(internalstandard)手段等。内标准品的示例包括不与样本混溶并包含已知、稳定和均匀浓度的可感测光学染料的柔性或可流动材料。该材料可以是染色的柔性珠、染色的油等,并且可以存在于室的一个或多个区域中。由于光密度与校准材料的厚度成正比,因此测量完全充满室高度的校准材料部分的光密度将允许在设定的位置处的确切的室高度的计算在光学系统的精密能力以内。如本文所使用的,“平均室高度”意指室的至少90%的平均高度。“平均值”应理解为数字集合的计算出的“中心”值(数字集合的总和除以计数),其中数字集合是室的至少90%的高度值的集合。
如图9中所示,在一些实施例中,成像设备900包括第一平面构件905和第二平面构件910,它们由多个间隔物元件915隔开,该多个间隔物元件915定义了在第一平面构件905和第二平面构件910之间的成像室920。该多个间隔物元件915由比第一平面构件905和第二平面构件910具有更大柔性的材料形成;即,可以认为第一平面构件905和第二平面构件910相对于多个间隔物元件915是刚性的,并且可以认为多个间隔物元件915相对于第一平面构件905和第二平面构件910是柔性的。在这个示例中,较大的间隔物元件925可以被压缩到以下程度:第一平面构件905和第二平面构件910已经接近到多个间隔物元件915中的大多数都分别接触第一平面构件905和第二平面构件910的内表面930、935的程度,由此使得当血液样本被接纳在样本测试导管中时,平均间隔物高度(h2)基本上等于室高度(h1)。测试表明,在室高度小于四微米的情况下,期望的室高度(h1)可以被控制为1%或更好。
如图10中所示,在其它实施例中,成像设备1000包括第一平面构件1005和第二平面构件1010,它们由多个间隔物元件1015隔开,该多个间隔物元件1015定义了在第一平面构件1005和第二平面构件1010之间的成像室1020。第二平面构件1010由比多个间隔物元件1015和第一平面构件1005更柔性的材料形成,并且将以账篷状(tent-like)方式覆盖该多个间隔物元件1015,即,相对而言,第二平面构件1010可以被认为相对于多个间隔物1015是柔性的,并且多个间隔物1015可以被认为相对于第二平面构件1010是刚性的。在这个示例中,显而易见的是,虽然成像室1020的小的局部区域将偏离期望的室高度(h1),但是所有账篷状区域的平均高度将接近平均间隔物高度(h2),从而使得当血液样本被接纳到样本测试导管中时,平均间隔物高度(h2)基本上等于室高度(h1)。测试表明,在室高度小于四微米的情况下,期望的室高度(h1)可以被控制为1%或更好。
成像测定珠
如图11a中所示,成像室1100可以包括第一平面构件1105、第二平面构件1110以及部署在第一平面构件1105和第二平面构件1110之间的多个阱1115。可以预先确定成像室1100的高度(h1),使得驻留在成像室1100内的样本将经由毛细管作用力在成像室1100内横向行进。在各种实施例中,第一平面构件1105和第二平面构件1110中的至少一个是透明的(例如,透明平面构件)。包括丙烯酸或聚苯乙烯的透明塑料膜是用于第一平面构件1105和第二平面构件1110的可接受材料的示例。在一些实施例中,第一平面构件1105或第二平面构件1110(例如,平面构件)的至少一部分由成像器芯片1120形成,如关于图8中例示的成像室800所描述的。
如图11b、图11c和图11d中所示,多个阱1115可以按照图案布置在光敏表面1125上,使得这些阱与像素阵列中的一个或多个像素1130垂直地对准。在一些实施例中,多个阱1115被布置在光敏表面1125上,使得至少50%的阱与像素阵列中的一个或多个像素1130垂直地对准(参见例如图11b)。在若干实施例中,多个阱1115被布置在光敏表面1125上,使得每个阱与像素阵列中的一个或多个像素1130垂直地对准(参见例如图11c)。在某些实施例中,多个阱1115被布置在光敏表面1125上,使得每个阱与像素阵列中的像素中的恰好一个垂直地对准(参见例如图11d)。因此,阱和像素之间的对准有助于满足近场准则和要在阱内捕获的测定珠的分辨率。
在各种实施例中,多个阱1115是可部署在第一平面构件1105和第二平面构件1110之间并且可操作以保持一个或多个测定珠1135的任何结构。在某些实施例中,确定每个阱1115的尺寸并且确定每个测定珠1135的尺寸,使得每个阱1115被结构化为恰好保持一个测定珠1135(参见例如图11b)。在其它实施例中,确定每个阱1115的尺寸并且确定每个测定珠1135的尺寸,使得每个阱1115被结构化为保持至少一个测定珠1135(参见例如图11c)。在其它实施例中,确定每个阱1115的尺寸并且确定每个测定珠1135的尺寸,使得每个阱1115被结构化为保持多个测定珠1135(参见例如图11d)。多个阱1115中的每一个的高度通常不是彼此完全相等,但是可以基本相等。照此,多个阱1115的高度可以被表征为平均阱高度(h3)。在一些实施例中,平均阱高度(h3)被选择以适应测定珠1135的分析,并且将为从大约0.5μm至大约40μm、从大约0.5μm至大约20μm或从大约2μm至大约10μm,例如大约4μm、大约8μm或大约10μm。多个阱1115中的每一个的宽度通常不是彼此完全相等,但是可以基本相等。照此,多个阱1115的宽度可以被表征为平均阱宽度(w1)。在一些实施例中,平均阱宽度(w1)被选择以适应分析珠1135的分析,并且将为从大约0.5μm至大约40μm、从大约2.0μm至大约20μm、或从大约2μm至大约10μm,例如大约4μm、大约10μm或大约15μm。
在一些实施例中,多个阱1115是柱(例如,圆形或正方形均匀聚合物,二氧化硅或聚苯乙烯柱)。在一些实施例中,多个阱1115是在以下结构上制造的中空柱状结构:(i)第一平面构件1105的表面的至少一部分(例如,传感器芯片1120的光敏表面1125),和/或(ii)第二平面构件1110的表面的至少一部分。在一些实施例中,多个阱1115是浮雕在以下结构上的中空结构:(i)第一平面构件1105的表面的至少一部分(例如,传感器芯片1120的光敏表面1125),和/或(ii)第二平面构件1110的表面的至少一部分。在一些实施例中,多个阱1115直接地(物体之间有物理接触)在以下结构上形成:(i)第一平面构件1105的表面的至少一部分(例如,传感器芯片1120的光敏表面1125),和/或(ii)第二平面构件1110的表面的至少一部分。在一些实施例中,多个间隔物1115间接地(物体之间没有物理接触)在以下结构上形成:(i)第一平面构件1105的表面的至少一部分(例如,传感器芯片1120的光敏表面1125),和/或(ii)第二平面构件1110的表面的至少一部分。
在各种实施例中,测定珠1135是具有以下形状的微粒:一般形状,诸如球形、圆柱体、立方体、十二面体、椭圆形或其它规则或不规则形状。在一些实施例中,测定珠1135由诸如乳胶、玻璃、二氧化硅或聚苯乙烯之类的聚合物形成。在其它实施例中,测定珠1135由磁性材料形成,使得它们在置于磁场中时表现出磁性,并且一旦从磁场中移除就没有残留磁性。测定珠1135的直径、宽度和/或长度可以为从大约0.1μm至大约35μm、从大约0.1μm至大约20μm或从大约0.1μm至大约10μm。测定珠1135可以用能够结合样本中的靶抗原的试剂涂覆。试剂可以包括抗体、抗体片段、离子载体、酶、酶的集合、具有可裂解的可检测部分的肽、识别测定珠的类型的光学标记染料和/或其组合。
在一些实施例中,测定珠1135在成像室1100内是移动的,这可以加速结合反应,使得测定的捕获步骤更快。例如,成像室1100可以包含能够与分析物交互并且位于光敏表面1125上方的移动测定珠1135,由此样品经由毛细管作用力、主动力(例如,经由泵)和/或重力在成像室1100中的运动被用于在多个阱1115中捕获移动测定珠1135。可替代地,成像室1100可以包含能够与分析物交互并且位于光敏表面1125上方的移动磁性测定珠1135,由此,磁力被用于在多个阱1115中捕获移动测定珠1135。在一些实施例中,恰好一个测定珠1135能够(通过毛细管作用、主动作用、重力或磁力)被捕获在多个阱1115中的每一个中;但是,并非所有阱1115都必须捕获珠1135(参见例如图11b)。例如,布置多个阱1115,使得至少50%的阱1115捕获测定珠1135、至少65%的阱1115捕获测定珠1135或至少85%的阱1115捕获测定珠1135。在其它实施例中,至少一个测定珠1135能够(通过毛细管作用、主动作用、重力或磁力)被捕获在多个阱1115中的每一个中;但是,并非所有阱1115都必须捕获至少一个测定珠1135(参见例如图11c)。例如,布置多个阱1115,使得至少60%的阱1115捕获至少一个测定珠1135、至少75%的阱1115捕获至少一个测定珠1135或至少85%的阱1115捕获至少一个测定珠1135。在其它实施例中,在多个阱1115中的每一个中(通过毛细管作用、主动作用、重力或磁力)捕获多个测定珠1135;但是,并非所有阱1115都必须捕获多个珠1135(参见例如图11d)。例如,布置多个阱1115,使得至少65%的阱1115捕获多个测定珠1135、至少75%的阱1115捕获多个测定珠1135或至少85%的阱1115捕获多个测定珠1135。
在其它实施例中,测定珠1135被固定在成像室1100内。例如,测定珠1135可以分配到多个阱1115中,形成粘附的多孔生物活性层。生物活性层具有特别是对于感兴趣的分析物的结合特性或当分析物存在时表现出可检测到的改变的特性,并且最优选的是针对目标分析物的固定抗体。在一些实施例中,来自多个测定珠1135的恰好一个测定珠1135被固定在多个阱1115的每一个中。在一些实施例中,来自多个测定珠1135的恰好一个测定珠1135被固定在多个阱1115的至少50%中(参见例如图11b)。在其它实施例中,来自多个测定珠1135的至少一个测定珠1135被固定在多个阱1115的每一个中。在其它实施例中,来自多个测定珠1135的至少一个测定珠1135被固定在多个阱1115的至少50%中(参见例如图11c)。在其它实施例中,来自多个测定珠1135的多个测定珠1135被固定在多个阱的每一个的一部分中。在其它实施例中,来自多个测定珠1135的多个测定珠1135被固定在多个阱的至少50%的一部分中(参见例如图11d)。
如图11e、图11f、图11g和图11h所示,在各种实施例中,成像室1100还包括多个间隔物元件1140。多个间隔物元件1140可以是可部署在第一平面构件1105和第二平面构件1110之间并且可操作以将第一平面构件1105和第二平面构件1110彼此间隔开并保持室高度(h1)的任何结构,如关于图8中例示的多个间隔物元件815所描述的。在一些实施例中,多个间隔物元件1140具有预定的平均间隔物高度(h2)并且部署在第一平面构件1105和第二平面构件1115之间,以形成在第一平面构件1105和第二平面构件1115之间延伸的具有预定的平均室高度(h1)的室1145。图11e和图11f示出了多个间隔物元件1140可以是球形珠。图11g示出了多个间隔物元件1140可以是在以下结构上制造的柱状结构:(i)第一平面构件1105的表面的至少一部分(例如,光敏表面1125),和/或(ii)第二平面构件1110的表面的至少一部分。在若干实施例中,多个间隔物元件1140包括比第一平面构件1105和第二平面构件1110中的一个或两者具有更大柔性的材料。在其它实施例中,多个间隔物元件1140包括比第一平面构件1105和第二平面构件1110中的一个或两者具有更小柔性的材料。例如,(i)第二平面构件1110和(ii)多个间隔物元件1135中的至少一个可以是可变形的,使得预定的平均间隔物高度(h2)基本上等于预定的平均室高度(h1)(例如,(h2)=(h1))。可替代地,(i)第二平面构件1110和(ii)多个间隔物元件1135中的至少一个可以是刚性的,使得预定的平均间隔物高度(h2)基本上等于预定的平均室高度(h1)(例如,(h2)=(h1))。
在其它实施例中,多个间隔物元件1140可部署在第一平面构件1105和第二平面构件1110之间并且可部署在阱1115的上方或下方,使得间隔物元件1140和阱1115可以一起操作以将第一平面构件1105和第二平面构件1110彼此间隔开并维持室高度(h1)。图11h和图11i示出了多个间隔物元件1140可以是在以下结构上制造的柱状结构:(i)一个或多个阱1115的表面的至少一部分,和/或(ii)第二平面构件1110的表面的至少一部分。例如:(i)第二平面构件1110和(ii)多个间隔物元件1135中的至少一个是可变形的,使得当血液样本被接纳在样本测试导管中时,预定的平均阱高度(h3)加上预定的平均间隔物高度(h2)基本等于预定的平均室高度(h1)(例如,(h3)+(h2)=(h1))。可替代地,(i)第二平面构件1110和(ii)多个间隔物元件1135中的至少一个是刚性的,使得当血液样本被接纳在样本测试导管中时,预定的平均阱高度(h3)加上预定的平均间隔物高度(h2)基本等于预定的平均室高度(h1)(例如,(h3)+(h2)=(h1))。
传感器和芯片设计
在一个实施例中,微制造的传感器芯片(例如,如关于图3描述的至少一个传感器芯片315)包括传感器或换能器(例如,光学传感器)。在其它实施例中,微制造的传感器芯片包括传感器阵列,该传感器阵列包括至少第一传感器(例如,电化学传感器)和第二传感器(例如,光学传感器)。在一些实施例中,传感器被单个地制造,作为单个芯片的传感器阵列内的相邻结构。在其它实施例中,传感器被单个地制造,在多个芯片的传感器阵列内彼此分离,或其任意组合。在某些实施例中,(一个或多个)微制造的传感器芯片包括塑料、聚酯、聚酰亚胺或硅平面基板,塑料、聚酯、聚酰亚胺或硅非平面基板,透明的塑料、聚酯、聚酰亚胺或硅基板,印刷电路板(pcb)等。
在各种实施例中,微制造的传感器芯片是包括一个或多个光学传感器(例如,光检测器)的成像器芯片。例如,可以实现成像器芯片1200的优选实施例的晶片级微制造,如图12中所示。具有平坦的顶表面和底表面的非导电基板1205可以被用作成像器芯片1200的基底。可以通过常规手段(例如,本领域技术人员已知的微制造技术)在基板1205上提供或形成成像集成电路1210,以形成在其表面1220(即,光敏表面)处呈现的多维像素阵列1215以及用于处理和读出的非光敏支持电路系统1225。在使用诸如吖啶橙之类的荧光染料作为试剂的某些实施例中,成像器芯片1200还包括在样本和多维像素阵列1215之间的滤光层1227(例如,吸收性或二向色性滤光层)。例如,滤光层1227可以部署在多维像素阵列1215的顶表面上。滤光层1227是在特定波长或一个或多个波长带(例如,红色、蓝色、绿色等)处吸收的滤光层。滤光层1227可以作为涂层被制造在成像器芯片1200上,例如被分配并干燥以形成该层。可替代地,滤光层1227可以作为如在例如美国专利no.5,200,051中描述的图案化的光致抗蚀剂材料被制造在成像器芯片1200上,该专利通过引用整体并入本文。可替代地,滤光层1227可以作为固定到成像器芯片1200的表面(例如,多维像素阵列1215的顶表面)的单独的膜层被制造在成像器芯片1200上。
微制造的成像器芯片1200还可以包括电连接件1230(例如,包括多个分立触点的电连接件),该电连接件将成像集成电路1210连接到一个或多个导电引脚1235,诸如临时电连接器。可以选择多维像素阵列1215的尺寸以适合测试设备的其它部件(例如,导管或传感器区域),例如,多维像素阵列1215可以被提供为表面安装二极管(smd)并且芯片级封装(csp)可以被用于适合各种测试设备。在一些实施例中,成像器芯片1200可以具有大约1mm至大约20mm的宽度和大约1mm至大约20mm的长度(例如,大约5mm的宽度和大约6mm的长度),以便容纳具有工业标准2.0mm×1.25mm占位面积的低剖面多维像素阵列1215,这提供了高效的光检测和低功耗。根据本发明的各个方面,多维像素阵列1215的灵敏度可以在0.5ua/cm2-4ua/cm2的范围内,例如基本上为1ua/cm2。
在各种实施例中,微制造的传感器芯片是包括一个或多个电化学传感器(诸如安培电极)的电化学传感器芯片。例如,如图13中所示,可以实现电化学传感器芯片1300的优选实施例的晶片级微制造。具有平坦的顶表面和底表面的非导电基板1305可以用作电化学传感器芯片1300的基底。可以通过常规手段(例如,丝网印刷或本领域技术人员已知的微制造技术)将导电层1310沉积在基板1305上,以形成至少一个部件1315(例如,安培电极)。导电层1310可以包括诸如金、铂、银、钯、铱之类的贵金属或其合金,但是也可以使用诸如钛和钨之类的其它非反应性金属或其合金,也可以使用石墨、导电聚合物或其它材料的非金属电极。在某些实施例中,电化学传感器中的一个或多个可以被形成为具有金表面的电极,该金表面涂覆有光定义的聚酰亚胺层1330,该光定义的聚酰亚胺层1330包括开口以定义小金电极(例如,金微阵列电极)的网格,电活性物质可以在该网格处被氧化。电化学传感器芯片1300还可以包括电连接件1320,该电连接件1320将导电层1310的每个部件连接到一个或多个导电引脚1325,诸如临时(接通和断开)电连接器。
在一些实施例中,电化学传感器芯片1300在15μm的中心上包括5μm-10μm的贵金属盘(例如7μm的贵金属盘)的阵列。贵金属盘或电极的阵列可以覆盖一个区域,例如圆形区域,直径为近似300μm至900μm,可选地为400μm至800μm或大约600μm,并且可以通过在由包括si、sio2、tiw和/或au或其组合的一系列层制成的基板上对厚度达1.5μm的聚酰亚胺或光致抗蚀剂的薄层进行光图案化来形成。在一些实施例中,电极具有大约130000至300000平方微米的工作面积(即,微电极),在电极正上方的样本的体积可以为大约0.1μl-0.3μl,并且在传感器芯片上方的样本的体积可以为1μl-3μl。根据本发明的这些方面,在电极的区域(例如,关于图4g和图4h描述的一个或多个传感器凹部430)中的导管(例如,关于图4a和图4d描述的导管465)具有小于大约6μl至大约1mm2的体积与传感器面积比。
如图14中所示,在一些实施例中,微制造的传感器芯片1400包括光学传感器1405。光学传感器1405可以由非导电基板1410形成,并且可以在基板1410上提供或形成成像集成电路1415。成像集成电路1415可以包括用于光检测的多维像素阵列1420和用于处理和读出的非光敏支持电路系统1425。多维像素阵列1420创建光学传感器1405的光敏表面1430。在某些实施例中,像素阵列1420的每个像素包括光电检测器(例如,一个或多个光检测器)并可选地包括放大器,以便测量光的特性,诸如来自与光学传感器1405相邻部署的成像室1435的吸光度和荧光。如关于图5-图10和图11a-图11i所描述的,光敏表面1430的至少一部分形成导管1445(例如,如关于图4a和图4d描述的导管465)的壁或平面构件1440的一部分。
在各种实施例中,一个或多个光发射器1450定位在导管1445附近(例如,在导管的侧面或在导管上方),并且被配置为将光透射通过另一个壁或透明平面构件1452的一部分和成像室1435到达传感器芯片1400。在一些实施例中,一个或多个光发射器1450定位成与导管1445的透明平面构件1452相邻,并且被配置为将光透射通过透明平面构件1452和成像室1435到达传感器芯片1400。照此,传感器芯片1400、导管1445和一个或多个光发射器1450包含在测试设备的相同壳体内(如关于图4a-图4r所描述的)。在其它实施例中,一个或多个光发射器1450位于导管1445的透明平面构件1452附近,但是不在测试设备的相同壳体内,而是设置在仪器或分析器内。照此,传感器芯片1400和导管1445被容纳在相同壳体内(如关于图4a-图4r所描述的),并且壳体还包括与透明平面构件1452相邻的窗口,用于从外部环境照亮成像室1435。在某些实施例中,一个或多个光发射器1450被配置为将光透射通过窗口、透明平面构件1452和成像室1435到达传感器芯片1400。
在若干实施例中,光学传感器1405被配置为测量由于辐射与导管1445中的生物样本的相互作用引起的随频率或波长变化的辐射(即,光)的吸收。根据这些方面,一个或多个光发射器1450被布置为使得具有一个或多个波长的入射光1455透射通过具有生物样本的导管1445。在入射光1455撞击样本后,与细胞、目标分析物或与生物样品中存在的细胞、目标分析物的存在相关的有色物质的能隙匹配的光子被吸收。其它的光的光子1457透射通过导管1445并且生物样品不受影响。光学传感器1405被布置为收集透射通过导管1445以及生物样本的光的光子1457,并将透射的光的光子1457转换成电流。通过比较光的光子1457相对于入射光1455的衰减,可以获得吸收频谱,以识别生物样品中细胞或目标分析物的存在、身份、计数和/或浓度。
在各种实施例中,光学传感器1405分别经由布线1460、1462连接到导电触点1465、1467(例如,临时电连接器)。在一个或多个光发射器1450与光学传感器1405设置在相同壳体内的实施例中,一个或多个光发射器1450分别经由布线1470、1472连接到另一个导电触点1475、1477(例如,临时电连接器)。布线1460、1462、1470、1472可以形成有金表面,该表面可选地涂覆有光定义的聚酰亚胺或光致抗蚀剂层,使得布线1460、1462、1470、1472避免暴露于传感器区域环境(例如,部署在导管1445内的生物样本)。布线1460、1462、1470、1472分别终止于导电触点1465、1467、1475、1477(例如,如关于图1描述的分立的连接器触点150),这些导电触点用于与分析器(例如,如美国专利no.4,954,087中描述的
在一些实施例中,分析器的通用信道电路系统可选地经由导电触点1475将驱动电流(例如,大于2v的电压和小于1ma的电流)施加到一个或多个光发射器1450,并且经由可选的导电触点1477测量来自一个或多个光发射器1450的输出电流。输出电流从导电触点1477引导到通用信道电路系统中,并且通用信道电路系统的(一个或多个)反馈电阻器可以使用输出电流来设置0.5ma至4ma的标称范围(nominalrange),例如基本上为2ma,其可以在高达4v处提供超过1ma。(一个或多个)反馈电阻器能够建立恒定电流,以在预定的时间段内连续驱动一个或多个光发射器1450。分析器的通用信道电路系统可以经由导电触点1467控制光学传感器1405。光学传感器1405将输出电流(即,从自一个或多个光发射器1450接收的光的光子1457转换的电流)引导到导电触点1465中。输出电流从导电触点1465被引导到通用信道电路系统中,并被转换成与光学传感器1405检测到的光量成比例的可测量电压。处理器(例如,如关于图2描述的处理器220)将可测量的电压转换成与以下各项成比例的定性、半定量或定量值:(i)血液样本中每种类型的细胞的数量计数或百分比,(ii)或生物样品中目标分析物的量。
如图15中所示,在替代实施例中,微制造的传感器芯片1500包括第一传感器1505(例如,光学传感器),并且可选地,不同的传感器芯片1510或相同的传感器芯片1500包括第二传感器1515(例如,电化学传感器)。第一传感器1505可以是如关于图14类似地描述而构造的光学传感器。第二传感器1515可以是由覆盖传感器芯片1500/1510的区域的金属盘或电极的阵列构成的电化学传感器。在一些实施例中,电化学传感器可以被形成为具有金表面的电极1520,金表面暴露(例如,没有聚酰亚胺或光致抗蚀剂覆盖)于辅助导管1525的内部环境并且被配置为直接接触被部署在导管1525内的生物样本。第二传感器1515可以经由布线1530连接到导电触点1535(例如,临时电连接器)。布线1535可以形成有金表面,该金表面可选地涂覆有光定义的聚酰亚胺或光致抗蚀剂层,使得布线1530避免暴露于传感器区域环境(例如,部署在导管1445内的生物样本)。布线1530终止于导电触点1535(例如,如关于图1描述的分立的连接器触点150),该导电触点被用于与分析器(例如,如美国专利no,4,954,087中描述的
在一些实施例中,传感器芯片1500/1510的一部分(例如,基板的顶表面),辅助导管1525的壁和/或样本接纳室(例如,如关于图4a-图4r描述的样本接纳室420)的壁可以涂覆一种或多种干燥试剂,以修正生物样本来进行电化学测定。例如,传感器芯片1500/1510可以包括涂覆有针对感兴趣的分析物的抗体-酶偶联物(antibody-enzymeconjugate)的试剂区域1540。试剂区域1540可以由容纳环结构1545定义。在一些实施例中,容纳环结构1545是聚酰亚胺或另一种光刻产生的层的疏水环。可以将含有某种形式的抗体-酶偶联物的微滴或若干微滴(尺寸大致为5-40nl)或一系列大约100纳米滴(尺寸大致为50至1000pl)分配或印刷在传感器芯片1500/1510的表面上。光定义的环结构1545包含这种水性液滴,从而允许试剂区域1540定位到几微米的精度。可以使试剂区域1545的尺寸从0.03mm2至近似2mm2。在本实施例中,这个尺寸的上端受到传感器芯片1500/1510和导管的尺寸的限制,而不是本发明的限制。
生物样本或流体可以通过干燥试剂(例如,试剂区域1540)至少一次,以将试剂溶解在生物样本或流体内。用于修正盒内生物样本或流体的试剂可以包括抗体-酶偶联物,涂覆有捕获抗体的磁珠或阻止测定化合物之间发生或者特异性或者非特异性结合反应的阻断剂。在生物样本或流体的区段内,试剂可以优先溶解和集中在该区段的预定区域内。这是通过控制该区段的位置和移动来实现的。因此,例如,如果该区段的仅一部分(诸如前缘)在试剂上方往复运动,那么可以在靠近前缘处实现试剂的高局部浓度。可替代地,如果期望试剂的均匀分布,例如,如果定量分析要求已知浓度的试剂,那么样本或流体的进一步往复运动将实现混合和均匀分布。
在某些实施例中,第二传感器1515是位于辅助导管1525中的免疫传感器,用于接收与抗体-酶偶联物混合的生物样本,该抗体-酶偶联物被配置为结合生物样本中的目标分析物。例如,第二传感器1515可以被配置为从基质(例如,4-氨基苯基磷酸酯)与抗体-酶偶联物(例如,结合到碱性磷酸酶(alp)的一种或多种抗体)的反应中检测酶促产生的电活性物质(例如,4-氨基苯酚)。根据这些方面,第二传感器1515包含涂覆有捕获抗体的一个或多个捕获区域1550,捕获抗体被配置为与结合到抗体-酶偶联物的目标分析物结合。捕获区域1550可以由容纳环结构1555定义。在一些实施例中,容纳环结构1535是聚酰亚胺或另一种光刻产生的层的疏水环。包含某种形式(例如与珠或微球结合)的捕获抗体的微液滴或若干微液滴(尺寸近似为5nl-40nl)可以分配在第二传感器1515的表面上。光定义的环结构1555包含这种水性液滴,从而允许捕获区域1550定位到几微米的精度。可以使捕获区域1550的尺寸从0.03mm2至近似2mm2。在本实施例中,这个尺寸的上端受到辅助导管1525和传感器芯片1500/1510的尺寸的限制,而不是本发明的限制。
在各种实施例中,微制造的传感器阵列(例如,微制造的传感器芯片1500、不同的传感器芯片1510或完全不同的传感器芯片(诸如接地芯片)上的传感器阵列)还包括参考传感器或电极1560。根据某些方面,其中第二传感器1515是安培传感器,参考电极1560被配置为反电极(counterelectrode)以完成电路系统。在优选实施例中,参考电极1560可以包括沉积在固体基板上的银金属(ag)及其银盐(agcl)(即,ag/agcl参考电极)。参考电极1560可以经由布线1565连接到参考触点1570(例如,临时电连接器)。可以将微制造的传感器阵列设计为使得接地芯片位于半导体芯片1500/1510的上游。但是,应当理解的是,在不脱离本发明的精神和范围的情况下,传感器和接地芯片的其它布置也是可能的。例如,传感器阵列还可以包括一个或多个附加的传感器芯片(未示出),这些传感器芯片被配置为检测潜在感兴趣的各种分析物,诸如肌钙蛋白i、肌钙蛋白t、ckmb、降钙素、bhcg、hcg、ntprobnp、probnp、bnp、肌红蛋白、甲状旁腺激素、d-二聚体、ngal、半乳凝素-3和/或psa等分析物。
在某些实施例中,分析器的通用信道电路系统经由导电触点1535将电位施加到第二传感器1515和参考电极1560,并测量由来自基质的氧化电流生成的电流改变作为电化学信号。电化学信号与生物样本中分析物的浓度成比例。第二传感器1515可以相对于参考电极1560具有近似+0mv至90mv(例如60mv)的施加电位,并且在另一个实施例中,第二传感器1515相对于参考电极1560具有近似+40mv的施加电位。在近似+10mv处由酶反应产物产生的信号与在近似+200mv处由未反应的基质产生的信号是可区分的。应当注意的是,用于安培检测基质和分析物的确切电压将取决于基质的化学结构而变化。重要的是,用于检测基质的电压差足够大,以防止读数之间的干扰。
在各种实施例中,传感器芯片1500/1510还包括一个或多个电导传感器1577(例如,血细胞比容传感器)。一个或多个电导传感器1577被配置为确定生物样本到达和/或离开试剂区域1540以及生物样本到达和/或离开第一传感器1505和第二传感器1515。更具体而言,一个或多个电导传感器1577垂直于导管1525或传感器导管的长度,并且用于传感器1577的电极对之间的电阻可以被用于监视生物样本的流体前沿的相对位置。例如,在极端情况下,开路读数可以指示生物样本已经被从试剂区域1540中推出,而闭路读数可以指示试剂区域1540被生物样本覆盖。
在一些实施例中,一个或多个电导传感器1577包括至少两个电极1580和1585(即,电极对)。电极1580可以位于试剂区域1540的上游,并且电极1585可以位于试剂区域1540的下游和第二传感器1515的上游。如图15中所示,电极1580和1585可以分别经由布线1590和1592连接到用作电导低引脚的导电触点1595和用作交流电源或电导高引脚的导电触点1597。布线1590和1592可以形成有金表面,该金表面涂覆有光定义的聚酰亚胺或光致抗蚀剂层,使得布线1590和1592避免暴露于部署在导管内的生物样本。照此,在一些实施例中,生物样本或流体在离开样本接纳室并通过电极1580之后到达试剂区域1540,然后在离开试剂区域1540并通过电极1585之后,生物样本随后到达第二传感器1515。
虽然本文针对电连接到某些引脚的某些类型的传感器(例如,光学、电化学和电导传感器)公开了一些实施例,但这并不意图是限制性的。相反,本领域普通技术人员应当理解的是,在不脱离本发明的精神和范围的情况下,可以想到用于传感器和引脚的任何设计或布置。例如,通用信道电路系统被配置为使得任何引脚和连接器连接件都可以用作用于光学、安培、电导和/或电位测量的信道。
测定方法
图16-图22示出了用于执行本发明的处理步骤的示例性流程图。可以使用上面关于图1-图15描述的计算设备和系统来实现图16-图22的步骤。具体而言,图16-图22中的流程图例示了根据本发明的若干实施例的系统、方法和计算机程序产品的可能实施方式的体系架构、功能和操作。就这方面,流程图中的每个方框可以表示代码的模块、区段或部分,其包括存储在非暂态机器可读存储介质上的一个或多个可执行指令,这些指令在由一个或多个处理器(例如,分析器的处理器)执行时使该一个或多个处理器执行该一个或多个可执行指令中特定的(一个或多个)逻辑功能。还应当注意的是,在一些替代实施方式中,方框中指出的功能可以不按图中指出的次序发生。例如,取决于所涉及的功能,实际上可以基本上同时执行连续示出的两个方框,或者有时会以相反的次序执行这些方框。还应当注意的是,流程图例示的每个方框以及流程图例示中的方框的组合可以由执行特定功能或动作的基于专用硬件的系统或专用硬件和计算机指令的组合来实现。
图16例示了根据本发明一个实施例的使用测试设备来执行光学测定的方法1600(参考图4a-图4j中所示的测试设备400)。在步骤1605处,可以通过样本进入端口(例如,关于图4b和图4c描述的可密封的样本进入端口415)将未计量的生物样本引入测试设备的样本接纳室(例如,关于图4g和图4h描述的样本接纳室420)。可选地,在步骤1610处,可以过滤生物样本以移除细胞,使得仅样本的血浆部分到达传感器(例如,在一些实施例(例如,使用测定珠执行的测定)中,如果没有基本上移除细胞,那么它们会散射来自led的光并影响测定性能)。在一些实施例中,样本接纳室包括过滤材料,使得仅血浆部分到达设备的样本计量部分。在其它实施例中,第一导管(例如,关于图4a描述的导管465)包括过滤材料,使得样本的被计量的部分被过滤以移除细胞。在步骤1615处,毛细管止动件(例如,关于图4g和图4h描述的毛细管止动件422)可以在这个阶段防止样本通过进入第一导管(例如,关于图4a描述的导管465),并且样本室中充满了样本。样本室末端处的毛细管止动件限制了生物样本的被计量的部分。在步骤1620处,可以闭合盖子(例如,关于图4a和图4b描述的可闭合的密封构件417),以防止生物样本从感测设备泄漏。当生物样本位于样本室或第一导管内时,可以可选地在步骤1625处用最初作为干燥涂层存在于样本室或第一导管的内表面上的一种或多种化合物(例如,试剂,诸如染料、酶、酶基质、活化剂、稳定剂、结合剂、抗凝剂、缓冲剂、酶标记的抗体偶联物等)来修正生物样本。
在步骤1630处,根据本发明的一些方面,可以将测试设备插入到分析器(例如,关于图1描述的分析器105)中。可选地,在步骤1635处,将感测设备插入分析器中可以激活第一泵(例如,如关于图4a和图4b描述的柔性区的部分490)或在将封装按压在尖刺(例如,如关于图4g和图4h描述的尖刺442)上时刺穿含流体的封装的机构。流体(例如,基质)由此可以被排出到与第一导管流体连通的第二导管(例如,如关于图4g和图4h描述的导管437)中。第二导管中的收缩件阻止流体的进一步移动。在步骤1640处,分析器对第二泵(例如,如关于图4a、图4b、图4g和图4h描述的可移位膜445)的操作向感测设备的气囊施加压力,从而迫使空气通过第三导管(例如,如关于图4g和图4h描述的导管455)并进入样本室中的预定位置。
在步骤1645,通过在步骤1640处在气囊内产生的气压将生物样本的被计量的部分通过毛细管止动件排出到第一导管中。可选地,在步骤1650处,通过在气囊内产生的气压,将生物样本在第一导管内向前移动到第一导管(例如,如关于图4a描述的导管465)的暴露于传感器芯片(例如,如关于图14描述的传感器芯片1400)的一部分,使得生物样品可以用最初作为干燥涂层存在于传感器芯片的一部分(例如,一个或多个试剂区域)上的一种或多种化合物(例如,试剂,诸如酶、酶基质、活化剂、稳定剂、缓冲剂、酶标记的抗体偶联物等)进行修正。附加地或可替代地,第二导管中的流体可移动通过收缩件进入第一导管并通过由第一泵产生的气压与生物样品接触。流体可以包括可以被生物样品和/或修正的化合物作用以产生有色物质的基质。为了便于基质、一种或多种化合物在生物样本中的溶解和/或促进高效的反应,可以通过气囊内产生的气压来振荡生物样本。在一个实施例中,使用大约0.2hz至大约5hz之间的振荡频率,最优选地为大约0.7hz。
在步骤1655处,通过在气囊内产生的气压,将生物样本在第一导管内向前移动到第一导管的形成暴露于传感器芯片(例如,如关于图5和图14描述的传感器505或1400)的成像室(例如,如关于图5描述的成像室530)的一部分,使得可以对生物样品执行分析(例如,光学分析)。一旦生物样本向前移动到成像室,生物样品就通过毛细管作用分散在整个成像室中。在各种实施例中,生物样本在整个成像室中分散在光敏表面上方,使得一个或多个光发射器可以将一个或多个波长的入射光透射到成像室的该部分和生物样品中。在入射光撞击生物样本后,与细胞、目标分析物或与生物样品中存在的细胞或目标分析物的存在相关的有色物质的能隙相匹配的光子被吸收。其它光子透射通过成像室而生物样品不受影响。光敏表面收集透射通过成像室和生物样本的光的光子,并将透射的光的光子转换成电流。在步骤1660处,电流经由导电触点作为输出信号被传输到分析器,并且分析器比较透射的光相对于入射光的衰减以获得吸收频谱,并将输出信号转换成:(i)血液样本中每种类型的细胞的数量计数或百分比,或者(ii)与从成像室接收并由光敏表面收集的光成比例的分析物信号。
图17例示了根据本发明一个实施例的使用测试设备执行光学测定和电化学测定的方法1700(参考图4a-图4j所示的测试设备400)。在步骤1705处,可以通过样本进入端口(例如,关于图4b和图4c描述的可密封的样本进入端口415)将未计量的生物样本引入到测试设备的样本室(例如,关于图4g和图4h描述的样本接纳室420)内中。可选地,在步骤1710处,可以过滤生物样本以移除细胞,使得仅样本的血浆部分到达传感器(例如,在一些实施例中,如果没有基本上移除细胞,那么它们会散射来自led的光并影响测定性能)。在一些实施例中,样本接纳室包括过滤材料,使得仅血浆部分到达设备的样本计量部分。在其它实施例中,第一导管(例如,关于图4a描述的导管465)包括过滤材料,使得样本的被计量的部分被过滤以移除细胞。在步骤1715处,毛细管止动件(例如,关于图4g和图4h描述的毛细管止动件422)可以在这个阶段阻止样本通过进入第一导管(例如,关于图4a描述的导管465),并且样本室中充满了样本。样本室末端处的毛细管止动件限制了生物样本的被计量的部分。在步骤1720处,可以关闭盖子(例如,关于图4a和图4b描述的可闭合的密封构件417)以防止生物样本从感测设备泄漏。当生物样本位于样本室或第一导管内时,可以可选地在步骤1725处用最初作为干燥涂层存在于样本室或第一导管的内表面上的一种或多种化合物(例如,试剂,诸如染料、酶、酶基质、活化剂、稳定剂、结合剂、抗凝剂、缓冲剂、酶标记的抗体偶联物等)来修正生物样本。
在步骤1730处,根据本发明的一些方面,可以将测试设备插入到分析器(例如,关于图1描述的分析器105)中。可选地,在步骤1735处,将感测设备插入到分析器中可以激活第一泵(例如,如关于图4a和图4b描述的柔性区的部分490)或在将封装按压在尖刺(例如,如关于图4g和图4h描述的尖刺442)上时刺穿含流体的封装的机构。流体(例如,基质)由此可以被排出到与第一导管和/或辅助导管流体连通的第二导管(例如,如关于图4g和图4h描述的导管437)中。第二导管中的收缩阻止流体的进一步移动。在步骤1740处,分析器对第二泵(例如,如关于图4a、图4b、图4g和图4h描述的可移位膜445)的操作向感测设备的气囊施加压力,从而迫使空气通过第三导管(例如,如关于图4g和图4h描述的导管455)并进入样本室中的预定位置。
在步骤1745处,通过在步骤1740处在气囊内产生的气压将生物样本的被计量的部分通过毛细管止动件排出到第一导管中。可选地,在步骤1750处,通过在气囊内产生的气压,将生物样本在第一导管内向前移动到第一导管(例如,如关于图4a描述的导管465)的暴露于传感器芯片(例如,如关于图14描述的传感器芯片1400)的一部分,使得生物样品可以用最初作为干燥涂层存在于传感器芯片的一部分(例如,一个或多个试剂区域)上的一种或多种化合物(例如,试剂,诸如酶、酶基质、活化剂、稳定剂、缓冲剂、酶标记的抗体偶联物等)进行修正。附加地或可替代地,第二导管中的流体可移动通过收缩件进入第一导管并通过由第一泵产生的气压与生物样品接触。流体可以包括可以被生物样品和/或修正的化合物作用以产生有色物质的基质。为了便于基质、一种或多种化合物在生物样本中的溶解和/或促进高效的反应,可以通过气囊内产生的气压来振荡生物样本。在一个实施例中,使用大约0.2hz至大约5hz之间的振荡频率,最优选地为大约0.7hz。
在步骤1755处,通过在气囊内产生的气压,将生物样本在第一导管内向前移动到第一导管的形成暴露于传感器芯片(例如,如关于图5和图14描述的传感器505或1400)的成像室(例如,如关于图5描述的成像室530)的一部分,使得可以对生物样品执行分析(例如,光学分析)。一旦生物样本向前移动到成像室,生物样品就通过毛细管作用分散在整个成像室中。在各种实施例中,生物样本在整个成像室中分散在光敏表面上方,使得一个或多个光发射器可以将一个或多个波长的入射光透射到成像室的该部分和生物样品中。在入射光撞击生物样本后,与细胞、目标分析物或与生物样品中存在的细胞或目标分析物的存在相关的有色物质的能隙相匹配的光子被吸收。其它光子透射通过成像室而生物样品不受影响。光敏表面收集透射通过成像室和生物样本的光的光子,并将透射的光的光子转换成电流。在步骤1760处,电流经由导电触点作为输出信号被传输到分析器,并且分析器比较透射的光相对于入射光的衰减以获得吸收频谱,并将输出信号转换成:(i)血液样本中每种类型的细胞的数量计数或百分比,或者(ii)与从成像室接收并由光敏表面收集的光成比例的分析物信号。
在步骤1765处,通过在气囊内产生的气压,将生物样本在第一导管内向前移动到暴露于传感器芯片(例如,如关于图15描述的传感器芯片1500/1510)的辅助导管(例如,如关于图15描述的辅助导管1525),使得可以对生物样品执行分析(例如,电化学分析)。可选地,在步骤1770处,将生物样本向前移动,使得生物样品可以用最初作为干燥涂层存在于传感器芯片的一部分(例如,一个或多个试剂区域)上的一种或多种化合物(例如,试剂,诸如酶和酶基质标记的抗体偶联物)进行修正。为了便于一种或多种化合物在生物样本中的溶解和/或促进高效的反应,可以通过气囊内产生的气压在一个或多个试剂区域上方振荡生物样本。在一个实施例中,使用大约0.2hz和大约5hz之间的振荡频率,最优选地为大约0.7hz。在步骤1775处,通过空气囊内产生的气压,将生物样本在辅助导管内向前移动到第二传感器(例如,安培传感器)上方的位置。可选地,在步骤1780处,为了促进在包括生物层的第二传感器的表面上或附近的高效的反应产物形成夹心结构的形成,可以通过气囊内产生的气压在第二传感器上方振荡生物样本。在一个实施例中,使用大约0.2hz和大约5hz之间的振荡频率,最优选地为大约0.7hz。
在步骤1785处,通过施加到气囊的进一步压力,从辅助导管移出生物样本,并且生物样本传递到废物室(例如,关于图4a和4g描述的废物室433)。在可选步骤1790处,可以通过任何合适的手段在第一导管内产生一个或多个空气段(弯月面),合适的手段包括被动手段或主动手段,被动手段的实施例在通过引用整体并入本文的美国专利no.7,682,833中详细描述,主动手段包括使用第二泵瞬时降低第一导管内的压力,从而通过阀瓣或阀将空气吸入第一导管。该一个或多个空气段对于从第一导管清除或冲洗受生物样本污染的流体非常有效。例如,该一个或多个空气段的前缘和/或后缘可以在第一传感器和第二传感器上方经过多次,以冲洗并重新悬浮可能已经从生物样本中沉积的异物(extraneousmaterial)。异物包括除特异性结合的分析物或分析物/抗体-酶偶联复合物以外的任何物质。但是,根据各种实施例,使用一个或多个空气段的清除或冲洗步骤1790不足够持久或剧烈,以至于不会促进特异性结合的分析物或分析物/抗体-酶偶联复合物从生物层的基本解离(dissociation)。
可选地,在步骤1795处,通过由第一泵产生的气压,移动第二导管中的流体通过收缩件进入辅助导管并与第二传感器接触。流体可以包括基质或信号剂,并且残留在辅助导管内并固定在第二传感器上或附近的酶或者从电非活性基质产生电活性物质或者破坏电活性基质。在一些实施例中,可以将流体施加到第二传感器以从第二传感器清洗生物样本。在步骤1797处,将第二传感器处由于电活性物质的产生或破坏而生成的电流或电位的变化以及该变化作为时间的函数经由导电触点传输到分析器,并且分析器执行该电流或电位的变化的分析以识别生物样品中的目标分析物的存在和/或浓度。
应当理解的是,根据本发明的替代实施例,可以将先前的步骤拆分为两个或更多个处理,以使用两个或更多个测试设备来执行光学测定和电化学测定。例如,与光学测定有关的步骤可以经由光学测试设备执行,随后与电化学测定有关的步骤可以经由电化学测试设备执行,反之亦然。
图18例示了根据本发明一个实施例的使用测试设备来执行光学测定的方法1800(参考如图4k-图4r中所示的测试设备400)。在步骤1805处,可以通过样本进入端口(例如,关于图4k和图4p中描述的样本进入端口415)将未计量的生物样本引入到测试设备的样本接纳室(例如,关于图4r描述的样本接纳室420)中。当生物样本位于样本室中时,生物样本可以可选地用最初作为干燥涂层存在于样本室的内表面上的一种或多种化合物(例如,试剂,诸如染料、酶、酶基质、活化剂、稳定剂、结合剂、抗凝剂、缓冲剂、酶标记的抗体偶联物等)被动地修正。
在步骤1810处,根据本发明的一些方面,可以将测试设备插入到分析器(例如,关于图1描述的分析器105)中。在步骤1815处,生物样本从样本室被动地移动到导管(例如,关于图4r描述的导管465)中。例如,毛细管作用可以促进生物样本从样本室到导管的被动移动。在一些实施例中,可以使用本领域中已知的技术来处理流体路径和/或导管的表面以使其或多或少具有亲水性和疏水性,以进一步促进毛细管作用。当生物样本在导管内时,生物样本可以可选地用最初作为干燥涂层存在于导管的内表面上的一种或多种化合物(例如,试剂,诸如染料、酶、酶基质、活化剂、稳定剂、结合剂、抗凝剂、缓冲剂、酶标记的抗体偶联物等)被动地修正(例如,溶解)。
在步骤1820处,生物样本被动地移动通过导管到导管的形成暴露于传感器芯片(例如,如关于图5和图14描述的传感器芯片505或1400)的成像室(例如,如关于图4p和图5描述的成像室485、530)的一部分。例如,毛细管作用可以促进生物样本通过导管并进入成像室的被动移动。当生物样本位于成像室内时,生物样本可以可选地用最初作为干燥涂层存在于成像室的内表面上的一种或多种化合物(例如,试剂,诸如染料、酶、酶基质、活化剂、稳定剂、结合剂、抗凝剂、缓冲剂、酶标记的抗体偶联物等)被动地修正。
一旦生物样本向前移动到成像室,生物样品就通过毛细管作用分散在整个成像室中。在各种实施例中,生物样本在整个成像室中分散在光敏表面上方,使得一个或多个光发射器可以将一个或多个波长的入射光透射到成像室的该部分和生物样品中。在入射光撞击生物样本后,与细胞、目标分析物或与生物样品中存在的细胞或目标分析物的存在相关的有色物质的能隙相匹配的光子被吸收。其它光子透射通过成像室而生物样品不受影响。光敏表面收集透射通过成像室和生物样本的光的光子,并将透射的光的光子转换成电流。在步骤1825处,电流经由导电触点作为输出信号被传输到分析器,并且分析器比较透射的光相对于入射光的衰减以获得吸收频谱,并将输出信号转换成:(i)血液样本中每种类型的细胞的数量计数或百分比,或者(ii)与从成像室接收并由光敏表面收集的光成比例的分析物信号。
图19例示了根据本发明各种实施例的在生物样本(例如,全血)中执行分类血细胞计数的方法1900。在步骤1905处,提供一种测试盒,其包括样本进入端口、流体连接到样本进入端口的样本测试导管、可选地泵以及包括像素阵列的成像器芯片。在一些实施例中,测试盒还包括多个分立的连接器触点,并且成像器芯片电连接到多个分立的连接器触点中的至少一个。在步骤1910处,提供了包括处理器和显示器的分析器。在一些实施例中,分析器还包括多端子连接器和可选的泵致动器。在步骤1915处,测试盒与分析器配合。配合可以包括将测试设备插入到分析器的端口中。将测试盒配合或插入到分析器的端口中可以使多端子连接器与多个分立的连接器触点电接触。将测试盒配合或插入到分析器的端口中也可以将泵致动器与测试盒中的泵对准。在步骤1920处,在将测试盒与分析器配合之前或之后,将血液样本(例如,全血)引入到样本进入端口中。
在步骤1925处,接收指示插入到分析器中的测试盒的类型的操作状态信号。在一些实施例中,操作状态信号包括测试盒的触点与短路条之间的测得的电阻值。例如,为了将盒识别功能赋予测试盒,可以在传感器芯片布置中包括用于盒识别的附加机构或手段。在某些实施例中,可以在触点之间实现电阻器。通过在将盒插入到分析器中之后(例如之后立即)在触点之间施加较小的电压(例如,1mv),可以通过检测器(例如,处理器)测量电阻器的电阻。然后可以将测得的电阻的值用于盒识别。例如,每个盒类型(例如,
在替代实施例中,操作状态信号包括从位于测试盒或测试盒的封装上的条形码获得的值。例如,如关于图1所描述的,测试盒的成像区域可以被用于使用仪器110的条形码读取器135来扫描条形码以获得值。然后,条形码的值可以被用于盒识别。例如,每个盒类型(例如,
在步骤1930处,基于识别出的盒的类型来确定关于测试盒的传感器的信息。在某些实施例中,确定信息包括:基于操作状态信号的值,使用查找表来识别测试盒的类型;以及基于测试盒的类型,从数据库获得关于传感器的信息,其中该数据库具有针对每种类型的测试盒的信息。在各种实施例中,该信息指示测试盒的传感器的类型(例如,一个或多个光学传感器、一个或多个参考电极、一个或多个电化学传感器等)以及连接到测试盒的传感器的导电触点的位置。除了经由识别出的测试盒的类型从数据库获得关于传感器的类型和导电触点的位置的信息以外,或作为其替代,可以使用关于与测试盒的各种导电触点接触的连接器引脚获得的信息来识别传感器的类型和导电触点的位置。例如,分析器连接器可以是连接器引脚(例如,引脚一至二十)的线性阵列。传感器的类型和导电触点的位置可以经由各个引脚相对于触点的位置来识别。例如,光发射器可以经由触点连接到引脚“x”(例如,引脚11)并且光学传感器的光检测器可以经由另一个触点连接到引脚“y”(例如,12),因此,由于使用了引脚11和12二者,因此可以经由数据库识别连接到触点的传感器的类型(光学)和部件(例如,光发射器和光检测器)。因此,如本文所述,分析器然后可以将通用电路系统的信道指派给针对被确定为在识别出的测试盒中的传感器类型的适当引脚。如应当理解的,一旦运行测试周期并将测试盒从仪器或分析器中移除,当将新的测试盒插入到分析器中时,通用电路系统的信道可以被重新指派给相同或不同的连接器引脚。
在步骤1935处,经由:(i)第一触点和对应的第一引脚,以及可选地,(ii)第二触点和对应的第二引脚,将第一信道指派给光发射器。在步骤1940处,经由第三触点和对应的第三引脚,将第二信道指派给光检测器。在步骤1945处,将第一信道的电路系统切换到电流驱动模式。在一些实施例中,切换第一信道的电路系统包括修改电路系统的开关元件,使得第一信道被配置为经由第一触点和对应的第一引脚向光发射器施加驱动电流。在步骤1950处,将第二信道的电路系统切换到电流测量模式。在一些实施例中,切换第二信道的电路系统包括修改电路系统的开关元件,使得第二信道被配置为将从光检测器接收的输出电流转换成与由光检测器检测到的光量成比例的可测量的电压。
在步骤1955处,将干燥试剂溶解到血液样本中以生成修正的血液样本。在一些实施例中,溶解干燥试剂可以包括驱动泵致动器以致动测试盒上的泵并移动血液样本以使其与干燥试剂接触(例如,使血液样本在干燥试剂上方振荡),这最终将干燥试剂溶解在血液样本中。在其它实施例中,溶解干燥试剂可以包括血液样本被动地移动以与干燥试剂接触,这最终将干燥试剂溶解在血液样本中。在步骤1960处,将修正后的血液样本移动到样本测试导管中。样本测试导管可以包括:第一壁,由成像器芯片的至少一部分形成;第二壁,由透明材料层形成;以及多个间隔物元件,其具有平均间隔物高度并且被部署在第一壁和第二壁之间。在某些实施例中,平均间隔物高度定义成像器芯片的该部分与透明材料层之间的室的平均室高度。在一些实施例中,将血液样本移动到样本测试导管中包括驱动泵致动器以致动测试盒上的泵并将血液样本从样本接纳室移动到样本测试导管中。在其它实施例中,将血液样本移动到样本测试导管中包括血液样本从样本接纳室被动地移动到样本测试导管中。
在步骤1965处,使用第一信道将驱动电流施加到光发射器。将驱动电流施加到光发射器使光发射器生成输出电流和包括预定波长的光,该光被投射通过室和修正的血液样本。可选地在步骤1970处,在第一信道处从第二触点和对应的第二引脚接收由光发射器生成的输出电流,并且将输出电流施加到反馈电阻器以为驱动电流建立恒定电流。
在步骤1975处,光检测器将从光发射器接收的光的光子转换成输出电流,并将输出电流作为输出信号发送到第三触点。在一些实施例中,输出信号是吸光度和荧光中的至少一个,并且基于从光发射器接收的光被记录在像素阵列处。在步骤1980处,来自光检测器的输出信号经由第三触点和对应的第三引脚在第二信道处被接收。可以使用第二信道将输出信号转换成血液样本中每种类型的细胞的数量计数或百分比。在步骤1885处,可以在显示器上显示血液样本中每种类型的细胞的数量计数或百分比。可选地,在步骤1990处,将测试盒与分析器解除配合,并且将测试盒丢弃在垃圾箱中。
图20例示了根据本发明各种实施例的在生物样本(例如,全血)中执行分类血细胞计数的方法2000。医学诊断常常包括对来自患者的全血样本的分析。更流行的诊断方法之一是全血细胞计数(称为“cbc”),这是一套测试,除了细胞成分的枚举外,还可以包括红细胞度量、网织红细胞计数和白细胞分类计数(“ldc”;有时也称为“白细胞分类”),它是对血液样本中存在的白细胞(wbc)的类型的识别和枚举。在步骤2005处,提供一种测试盒,其包括样本进入端口、流体连接到样本进入端口的样本测试导管、可选地泵以及包括像素阵列的成像器芯片。在一些实施例中,测试盒还包括多个分立的连接器触点,并且成像器芯片电连接到该多个分立的连接器触点中的至少一个。在步骤2010处,提供了包括处理器和显示器的分析器。在一些实施例中,分析器还包括多端子连接器和可选地泵致动器。在步骤2015处,将测试盒与分析器配合。配合可以包括将测试设备插入到分析器的端口中。将测试盒配合或插入到分析器的端口中可以使多端子连接器与多个分立的连接器触点电接触。将测试盒配合或插入到分析器的端口中也可以将泵致动器与测试盒中的泵对准。在步骤2020处,在将测试盒与分析器配合之前或之后,将血液样本(例如,全血)引入到样本进入端口中。
在步骤2025处,将干燥试剂溶解到血液样本中以生成修正的血液样本。在一些实施例中,溶解干燥试剂可以包括驱动泵致动器以致动测试盒上的泵并移动血液样本以使其与干燥试剂接触(例如,使血液样本在干燥试剂上方振荡),这最终将干燥试剂溶解在血液样本中。在其它实施例中,溶解干燥试剂可以包括血液样本被动地移动以与干燥试剂接触,这最终将干燥试剂溶解在血液样本中。可以将试剂添加到样本中以促进区分样本内的一种成分与另一种成分。例如,试剂可以是染料或着色剂,诸如吖啶橙(也称为“碱性橙15”或“aco”)和阿斯特拉宗橙(也称为“ao”或碱性橙21),当与全血混合并经受来自光发射器的激发波长时,它发射特定波长处的光。光发射器能够可操作以产生与红色、绿色和蓝色光中的一种或多种相关联的波长处的光。通常在大约600-700nm范围内产生红光,红光优选地在大约660nm处。通常在大约515-570nm范围内产生绿光,绿光优选地在大约540nm处。蓝光通常在大约405-425nm的范围内,蓝光优选地在大约413nm处。透射通过样本或从样本荧光发出的光被使用成像器芯片捕获,并且代表捕获的光的信号被发送到分析器,在那里被处理成图像。以允许以每个单元为基础确定图像内捕获的光透射率或荧光强度的方式产生图像。例如,“每个单元为基础”是可以剖析样本的图像的增量单位,诸如像素。
在步骤2030处,将修正的血液样本移动到样本测试导管中。在某些实施例中,样本静态地驻留在室内。样本测试导管可以包括由成像器芯片的至少一部分形成的第一壁、由透明材料层形成的第二壁以及具有平均间隔物高度并部署在第一壁和第二壁之间的多个间隔物元件。在某些实施例中,平均间隔物高度定义成像器芯片的该部分与透明材料层之间的室的平均室高度。在一些实施例中,将血液样本移动到样本测试导管中包括驱动泵致动器以致动测试盒上的泵并将血液样本从样本接纳室移动到样本测试导管中。在其它实施例中,将血液样本移动到样本测试导管中包括血液样本从样本接纳室被动地移动到样本测试导管中。
在步骤2035处,使用成像器芯片产生驻留在室内的样本的至少一个图像。在一些实施例中,成像器芯片包括ccd型图像传感器,该ccd型图像传感器将通过(或来自)样本的光转换成电子数据格式图像。在其它实施例中,成像器芯片包括cmos型图像传感器,其将通过(或来自)样本的光转换成电子数据格式图像。来自成像器芯片的信号提供了针对图像的每个像素的信息,该信息包括或可以被推导以包括强度、波长和光密度。可以为强度值指派任意标度(scale),例如0单位到4095单位(“ivu”)。光密度(od)是被吸收的光的量相对于透射通过介质的光的量的测度;例如,“od”值越高,在透射期间被吸收的光的量越大。od可以以光密度单位(“od”)或其分数来定量地描述;例如,milliod是od的1/1000。一个“od”单位将光强度降低90%。作为定量值的“od”或“milliod”可以被用于通过透射光(例如,透射蓝光)获取或导出的图像。
在一些实施例中,来自成像器芯片的信息被分隔到多个信道(例如三个信道)中,这为确定四部分ldc提供了特定的效用。但是,本发明不限于三信道实施例。三个信道中的第一信道可以指向与以第一波长(例如,540nm,显示为绿色)从样本发射的光相关的信息。第二信道可以指向与以第二波长(例如,660nm,显示为红色)从样本发射的光相关的信息。第三信道可以指向与以第三波长(例如,413nm,其被用于确定蓝色光密度(“od”))通过样本的光相关的信息。当对全血样本执行ldc时,这些波长值和信道数具有特定的效用。但是,本发明不限于这些特定的波长或信道数。可以实现其它信道来收集不同波长和/或透射值的信息。该信息进而可以被用于评估样本中的附加成分和/或提高分析的准确性。例如,在期望进一步区分样本中嗜碱性粒细胞的应用中,可以添加第四信道和第五信道。第四信道可以指向与以第四波长(例如,540nm)通过样本的光相关的信息,第四波长被用于确定绿色od,而第五信道可以指向与以第五波长(例如,660nm)通过样本的光相关的信息,第五波长被用于确定红色od。这些od值进而可以被用于识别嗜碱性粒细胞。
在步骤2040处,成像器芯片将从光发射器接收的光的光子转换成输出电流,并将输出电流发送到分析器。在步骤2045处,来自成像器芯片的输出信号在分析器处被接收。例如,分析器与测试盒、光发射器和成像器芯片通信,并且可以适于(例如,被编程为)发送信号和从盒、光发射器和成像器芯片中的一个或多个接收信号。例如,分析器适于:(i)将信号发送到光发射器以产生定义波长(或可替代地多个波长)处的光;以及(ii)发送信号和从成像器芯片接收信号,以捕获光达定义的时间段。分析器还适于根据一种或多种预定算法来处理从成像器芯片接收到的信号(例如,输出信号)。特定算法的细节将取决于当前的分析。如上面所指示的,本发明在应用于对全血样本执行ldc时具有特定的效用,并且为了例示该效用,本文将本发明描述为执行ldc。但是,本发明不限于这种特定分析。
在步骤2050处,使用从成像器芯片接收的输出信号执行分类血细胞计数。在一些实施例中,分类血细胞计数包括:(i)识别驻留在室内的样本内的细胞(例如白细胞);(ii)相对于一个或多个预定的可定量确定的特征,定量分析图像内识别出的细胞中的至少一些;以及(iii)使用可定量确定的特征,从识别出的细胞中识别至少一种类型的细胞。例如,为了执行分类血细胞计数(诸如ldc),该算法利用识别特征的集合,这些特征中的每个可与其它特征区分开,并且这些特征中的每个可从样本的图像中定量确定。每种wbc可以通过某些识别特征的存在或不存在和/或通过与某些特征相关联的定量信息来表征。为了提供使能性公开,本文关于能够用于选择性地识别和区分wbc的识别特征的示例性集合来描述本发明。这个集合没有包括所有可能的特征,因此本发明不限于这个特定的集合。
对于wbc分析,如果例如使用吖啶橙,那么识别特征的示例性集合包括标题为:细胞、细胞核、叶数、细胞面积、大颗粒的细胞核面积比、细胞核比、红-绿比、细胞核形状、细胞形状、细胞核亮度、细胞质亮度、给定波长处的平均细胞吸收、细胞核纹理、细胞质纹理、给定波长处的细胞吸收纹理、细胞核凹陷度(hollowness)和细胞质凹陷度;每个都在美国专利公开no.20120034647中描述,该专利通过引用并入本文。在一些情况下,某些特征直接提供关于特定细胞的信息(例如,细胞核形状)。在其它情况下,特征(例如,细胞面积)可以被用于间接提供有关特定细胞的信息(例如,细胞核面积与细胞面积之比-上文中称为“细胞核比”等)。识别特征基于可量化的特点,诸如光强度、光颜色、od、面积和相对位置(例如,形状)。如上面所指示的,颜色可以通过将一种或多种荧光着色剂与样本混合来产生,荧光着色剂在被激发后在与特定颜色相关联的特定波长处产生荧光发射。如应当理解的,这个原理也适用于基于与特定颜色相关联的特定波长的吸光度的非荧光染料检测。
可以在对全血样本执行ldc时使用的可接受的着色剂的示例是吖啶橙(“aco”)。aco是一种荧光染料,当与全血样本混合时,其选择性地对样本内的成分(例如,白细胞、血小板、网织红细胞和有核红细胞)进行染色。关于wbc,aco穿过相应的wbc并染色其dna和rna。wbc内由染料发射的(一种或多种)颜色是多种因素的函数,多种因素包括:染料内rna和dna的数量、成分中染料的浓度以及成分的ph。本发明不限于使用aco,并且可以使用其它染料(例如,阿斯特拉宗橙)代替aco或与aco结合使用。使用aco和白细胞作为示例,如果样本经受波长处于470nm或大约470nm的激发光,那么与白细胞的细胞核内的物质(例如,dna)结合的aco将在大约540nm处发射光(显示为绿色),并且与白细胞的细胞质内的物质(例如,rna)结合的aco将在大约660nm处发射光(显示为红色)。
如上面所指示的,样本内的od值是细胞内天然存在的物质(例如,血红蛋白)在预定波长处对光的吸光度的函数,和/或可以是由样本内的成分吸收(或不吸收)的着色剂的函数。可以使用多种不同的技术对一个或多个定义波长处的特定像素组进行识别。例如,分割(segmentation)技术可以用于产生仅描绘图像内满足准则(例如,强度和颜色)的那些像素的被掩蔽图像。对于仅从图像的绿光部分(例如,细胞核)或红光部分(例如,细胞质)或这两者获取信息的那些分析,可以对样本图像进行掩蔽以产生仅描绘示出绿色、红色或两者的那些像素的部分图像,并且也可以通过预定强度阈值来区分。本发明不限于任何特定的分割技术,并且可以根据当前的应用来选择具体的技术。例如,可以使用硬分割技术,其中像素被指派为或者属于或者不属于物体。可以使用阈值化、区域增长或分水岭型例程来实现“硬”分割技术。可替代地,可以利用软分割技术。例如,“模糊”分割,其中为每个像素指派0到1范围内的值,该值描述特定像素属于物体的可能性。以下每个识别特征的描述将提供定量数据(诸如与波长和强度相关联的数据)如何可以为区分一种wbc与另一种wbc提供基础的清晰示例。本发明也不限于使用分割技术,并且可以使用选择(即,“挑选”)像素或以其它方式区分具有特定属性的像素的其它技术。
如上面所指示的,ldc是一种分析,其中识别并枚举不同类型的wbc。可以关于识别出的wbc类型的相对百分比来表述结果。因此,在步骤2050处,可以使用分析器将输出信号转换成血液样本中每种类型的细胞的数量计数或百分比。在步骤2050处,可以在显示器上显示血液样本中每种类型的细胞的数量计数或百分比。可选地,在步骤2055处,将测试盒与分析器解除配合,并且将测试盒丢弃在垃圾箱中。
图21例示了根据本发明各种实施例的对生物样本(例如,血浆)中的测定珠成像的方法2100。在步骤2105处,提供测试盒,其包括样本进入端口、流体连接到样本进入端口的样本测试导管、可选地泵以及包括像素阵列的成像器芯片。在一些实施例中,测试盒还包括多个分立的连接器触点,并且成像器芯片电连接到该多个分立的连接器触点中的至少一个。在步骤2110处,提供了包括处理器和显示器的分析器。在一些实施例中,分析器还包括多端子连接器和可选地泵致动器。在步骤2115处,测试盒与分析器配合。配合可以包括将测试设备插入到分析器的端口中。将测试盒配合或插入到分析器的端口中可以使多端子连接器与多个分立的连接器触点电接触。将测试盒配合或插入到分析器的端口中也可以将泵致动器与测试盒中的泵对准。在步骤2020处,在将测试盒与分析器配合之前或之后,将血液样本引入到样本进入端口中。
在步骤2125,接收指示插入到分析器中的测试盒的类型的操作状态信号。在一些实施例中,操作状态信号包括测试盒的触点与短路条之间的测得的电阻值。例如,为了将盒识别功能赋予测试盒,可以在传感器芯片布置中包括用于盒识别出的附加机构或手段。在某些实施例中,可以在触点之间实现电阻器。通过在将盒插入到分析器之后(例如,之后立即)在触点之间施加较小的电压(例如,1mv),可以由检测器(例如,处理器)测量电阻器的电阻。然后可以将测得的电阻值用于盒识别。例如,每个盒类型(例如,
在替代实施例中,操作状态信号包括从位于测试盒或测试盒的封装上的条形码获得的值。例如,如关于图1所描述的,测试盒的成像区域可以被用于使用仪器110的条形码读取器135来扫描条形码以获得值。然后,条形码的值可以被用于盒识别。例如,每个盒类型(例如,
在步骤2130处,基于识别出的盒的类型来确定关于测试盒的传感器的信息。在某些实施例中,确定信息包括:基于操作状态信号的值,使用查找表来识别测试盒的类型;以及基于测试盒的类型,从数据库获得关于传感器的信息,其中该数据库具有针对每种类型的测试盒的信息。在各种实施例中,该信息指示测试盒的传感器的类型(例如,一个或多个光学传感器、一个或多个参考电极、一个或多个电化学传感器等)以及连接到测试盒的传感器的导电触点的位置。除了经由识别出的测试盒的类型从数据库获得关于传感器的类型和导电触点的位置的信息以外,或作为其替代,可以使用关于与测试盒的各种导电触点接触的连接器引脚获得的信息来识别传感器的类型和导电触点的位置。例如,分析器连接器可以是连接器引脚(例如,引脚一至二十)的线性阵列。传感器的类型和导电触点的位置可以经由各个引脚相对于触点的位置来识别。例如,光发射器可以经由触点连接到引脚“x”(例如,引脚11)并且光学传感器的光检测器可以经由另一个触点连接到引脚“y”(例如,12),因此,由于使用了引脚11和12二者,因此可以经由数据库识别连接到触点的传感器的类型(光学)和部件(例如,光发射器和光检测器)。因此,如本文所述,分析器然后可以将通用电路系统的信道指派给针对被确定为在识别出的测试盒中的传感器类型的适当引脚。如应当理解的,一旦运行测试周期并将测试盒从仪器或分析器中移除,当将新的测试盒插入到分析器中时,通用电路系统的信道可以被重新指派给相同或不同的连接器引脚。
在步骤2135处,经由:(i)第一触点和对应的第一引脚,以及可选地,(ii)第二触点和对应的第二引脚,将第一信道指派给光发射器。在步骤2140处,经由第三触点和对应的第三引脚,将第二信道指派给光检测器。在步骤2145处,将第一信道的电路系统切换到电流驱动模式。在一些实施例中,切换第一信道的电路系统包括修改电路系统的开关元件,使得第一信道被配置为经由第一触点和对应的第一引脚向光发射器施加驱动电流。在步骤2150处,将第二信道的电路系统切换到电流测量模式。在一些实施例中,切换第二信道的电路系统包括修改电路系统的开关元件,使得第二信道被配置为将从光检测器接收的输出电流转换成与由光检测器检测到的光量成比例的可测量的电压。
可选地,在步骤2155处,将干燥试剂溶解在血液样本中以生成修正的血液样本。在一些实施例中,溶解干燥试剂可以包括驱动泵致动器以致动测试盒上的泵并使血液样本与干燥试剂接触(例如,使血液样本在干燥试剂上方振荡),这最终将干燥试剂溶解在血液样本中。在其它实施例中,溶解干燥试剂可以包括血液样本被动地移动以与干燥试剂接触,这最终将干燥试剂溶解在血液样本中。在步骤2160处,将修正后的血液样本移动到样本测试导管中。样本测试导管可以包括:第一壁,由成像器芯片的至少一部分形成;第二壁,由透明材料层形成;以及具有平均阱高度并部署在第一壁和第二壁之间的多个阱。在一些实施例中,多个阱中的每一个与成像器芯片的一个或多个像素垂直对准,并且多个阱中的至少一部分包括至少一个测定珠。在一些实施例中,将血液样本移动到样本测试导管中包括驱动泵致动器以致动测试盒上的泵并将血液样本从样本接纳室移动到样本测试导管中。在其它实施例中,将血液样本移动到样本测试导管中包括血液样本从样本接纳室被动地移动到样本测试导管中。
在步骤2165处,使用第一信道将驱动电流施加到光发射器。将驱动电流施加到光发射器使光发射器生成输出电流和包括预定波长的光,该光被投射通过样本测试导管和修正的血液样本。可选地,在步骤2170处,在第一信道处从第二触点和对应的第二引脚接收由光发射器生成的输出电流,并且将输出电流施加到反馈电阻器以为驱动电流建立恒定电流。
在步骤2175处,光检测器将从光发射器接收的光的光子转换成输出电流,并将输出电流作为输出信号发送到第三触点。在一些实施例中,输出信号是吸光度和荧光中的至少一个,并且基于从光发射器接收的光被记录在像素阵列处。在步骤2180处,来自光检测器的输出信号经由第三触点和对应的第三引脚在第二信道处被接收。可以使用第二信道将输出信号转换成指示生物样本与多个阱中的每一个中的至少一个测定珠的反应的值。在步骤2185处,可以在显示器上显示指示生物样本的反应的值。可选地,在步骤2190处,将测试盒与分析器解除配合,并将测试盒丢弃到垃圾箱中。
图22例示了使用相同的测试设备执行光学测定和电化学测定的方法2200。在步骤2205处,根据方法1900的步骤1905-步骤1985或方法2100的步骤2105-步骤2185,基于与生物样本中的细胞类型或目标分析物的量成比例的可测量的电压来确定定性、半定量或定量值。在步骤2210处,基于测试盒的类型和/或正使用的引脚来确定关于测试盒的传感器的附加/替代信息。在各种实施例中,该信息指示第四触点连接到反电极,第五触点连接到参考电极,并且第三触点或第六触点连接到工作电极(例如,安培电极)。
在步骤2215处,经由第四触点和对应的第四引脚将第三信道指派给反电极。在步骤2220处,经由第五触点和对应的第五引脚将第四信道指派给参考电极。在步骤2225处,经由第三触点和对应的第三引脚或第六触点和对应的第六引脚将第二信道指派给工作电极。在步骤2230处,第三信道的电路系统被切换到反测量模式。在一些实施例中,切换第三信道的电路系统包括修改电路系统的开关元件,使得第三信道被配置为施加可选地不被测量并且被调整以平衡在工作电极处发生的反应的电位。该配置允许相对于已知电极(即,反电极)测量工作电极的电位,而不会通过使电流流过参考电极而损害参考电极的稳定性。在步骤2235处,第四信道的电路系统被切换到参考测量模式。在一些实施例中,切换第四信道的电路系统包括修改电路系统的开关元件,使得第四信道被配置为向参考电极施加稳定的电位,其可以用作由工作电极进行的测量的参考。
在步骤2240处,驱动泵致动器以致动测试盒上的泵,从而将血液样本分为第一部分和第二部分。在一些实施例中,血液样本的第一部分被移动到样本测试导管中。在步骤2245处,驱动泵致动器以致动测试盒上的泵,以将血液样本的第二部分移动到包括用于检测血液样本中的分析物的电化学传感器的辅助导管中。在步骤2250处,基于辅助导管中的电化学分析测试的性能来记录来自电化学传感器的分析物信号,并基于分析物信号来确定与血液样本中分析物的量成比例的定性、半定量或定量值。在各种实施例中,执行电化学分析测试包括:(i)使用第三信道向反电极施加电位;(ii)使用第四信道向参考电极施加电位;(iii)使用第二信道向工作电极施加电位;(iv)使用第二信道测量跨生物样品的电流变化,该变化与生物样品内目标分析物的浓度成比例;以及(v)基于跨生物样品的电流变化来确定生物样品内目标分析物的浓度。在各种实施例中,反电极和参考电极与工作电极结合使用,以测量跨生物样品的电流变化。在步骤2255处,可以在显示器上显示生物样品内目标分析物的浓度。可选地,在步骤2260处,将测试盒与分析器解除配合,并将测试盒丢弃到垃圾箱中。
虽然已经详细描述了本发明,但是在本发明的精神和范围内进行修改对本领域技术人员而言将是清楚的。应当理解的是,上面和/或所附权利要求书中列举的本发明的各方面以及各种实施例和各种特征的部分可以或者全部或者部分地组合或互换。在各种实施例的前述描述中,如本领域技术人员将认识到的,可以将参考另一个实施例的那些实施例与其它实施例适当地组合。此外,本领域技术人员将认识到的是,前述描述仅仅是示例性的,并且无意于限制本发明。
- 还没有人留言评论。精彩留言会获得点赞!