一种细胞粘附力测量方法与流程
本发明涉及生物科学研究领域,尤其是一种能够在液体环境中测量细胞与衬底之间的粘附力的一种细胞粘附力测量方法。
背景技术:
细胞与材料之间的粘附力是细胞重要的特性,对细胞的培养及分化有重要的意义,通常通过测量处于液体环境中的细胞与某种材料的衬底之间的粘附力来定性地研究,现有技术一般采用原子力显微镜,通过原子力显微镜的探针尖端吸附细胞,然后通过操纵原子力显微镜的悬臂来控制探针移动,使得细胞与衬底表面之间产生摩擦,并通过测量原子力显微镜的悬臂的位移来计算探针所受到的力,以此估算细胞与衬底表面之间的粘附力,其缺点是,通常情况下原子力显微镜的探针尖端每次只能吸附一个细胞,因此每次实验只能对一个细胞进行测试,而更换新的探针既耗时又容易引入污染,所述一种细胞粘附力测量方法能够解决问题。
技术实现要素:
为了解决上述问题,本发明方法在现有的原子力显微镜技术的基础上进行改进,采用特殊的悬臂结合胶体小球的方法来吸附细胞并进行单细胞粘附力测量实验。
本发明所采用的技术方案是:
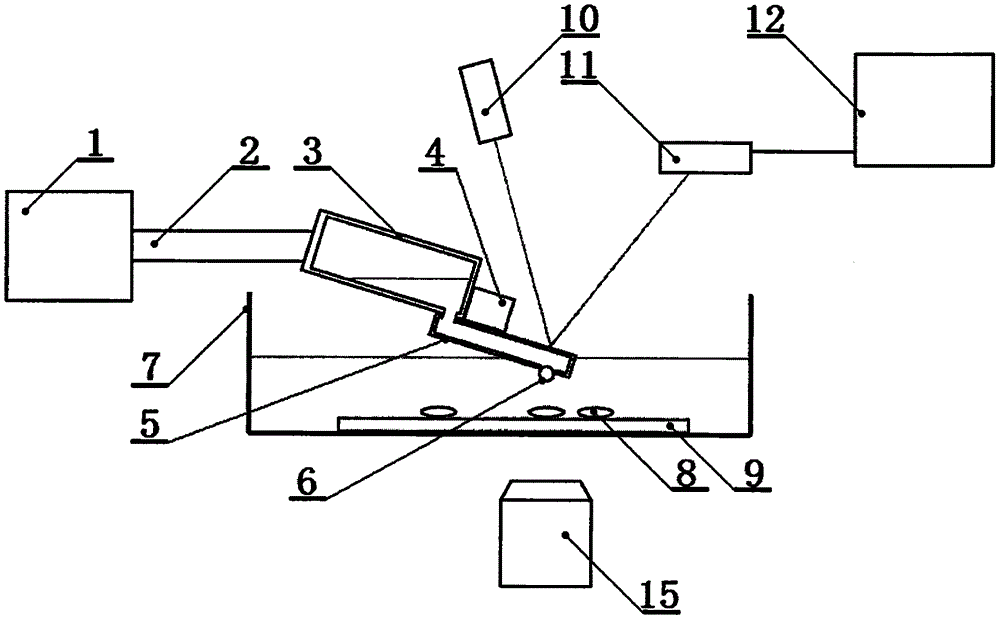
细胞粘附力测量装置包括压力控制单元、气管、储液腔、致动器、悬臂、胶体小球、样品池、待测样品、衬底、激光器、光探测器、计算机、制备池、基底、光学显微镜和电缆,储液腔是具有进气口和出液口的圆柱形容器,储液腔处于斜躺位置,进气口位于储液腔的上底面,出液口位于靠近储液腔下底面的侧面,出液口朝下且低于进气口,压力控制单元、气管和进气口依次连接,压力控制单元能够对储液腔进行抽气或充气,悬臂为金属片状,悬臂的内部具有微通道,微通道的两端分别是进液口和抽吸口,进液口位于悬臂一端的上表面,抽吸口位于悬臂另一端的下表面,进液口连接储液腔的出液口,抽吸口能够吸附一个胶体小球,胶体小球为胶体制成的球状物,致动器连接于悬臂的上表面并紧贴储液腔的下底面,致动器电缆连接计算机,通过计算机对致动器施加不同的电压以控制致动器的伸缩形变,从而能够控制悬臂的位移,样品池位于悬臂的下方,样品池内具有保护液、待测样品和衬底,待测样品位于衬底的上面并均置于保护液中,光学显微镜位于样品池下方的10厘米处,激光器和光探测器均位于悬臂的上方,光探测器通过电缆连接计算机,激光器发生的激光在悬臂的上表面反射后,能够进入光探测器;储液腔的内径为2毫米、长度为10毫米,致动器由压电陶瓷制成,悬臂的长度为300微米、宽度为50微米、厚度为5微米,悬臂的微通道的直径为2.5微米,悬臂的抽吸口的直径为2微米,胶体小球的直径为3微米,待测样品为细胞样品。
悬臂的抽吸口吸附胶体小球的两种方法:第一种方法是将包含胶体小球的液体置于制备池内,液体中胶体小球的浓度为0.01摩尔/升,并将悬臂置于制备池内,压力控制单元通过气管对储液腔进行抽气,以使得储液腔及悬臂的微通道内气压为负,气压值为负800毫巴,30秒后将悬臂取出制备池,采用光学显微镜观察悬臂,重复以上操作,直到制备池液体中的一个胶体小球被吸附并完全覆盖于抽吸口。第二种方法是将胶体小球均布于基底表面,压力控制单元通过气管对储液腔进行抽气,以使得储液腔及悬臂的微通道内气压为负,并通过计算机控制致动器以调节悬臂的位移,使得悬臂的抽吸口位于基底上方的0.5微米位置,然后通过计算机控制致动器以使得悬臂在竖直方向产生频率为30赫兹的振动,并使得悬臂的抽吸口位置处在竖直方向的振幅为1微米,30秒后停止悬臂振动,采用光学显微镜观察悬臂,重复以上操作,直到基底表面的一个胶体小球被吸附并完全覆盖于抽吸口。
所述一种细胞粘附力测量方法的步骤为:
步骤一,悬臂的抽吸口吸附一个胶体小球:包含胶体小球的液体置于制备池内,液体中胶体小球的浓度为0.01摩尔/升,并将悬臂置于制备池内,压力控制单元通过气管对储液腔进行抽气,以使得储液腔及悬臂的微通道内的气压值为负800毫巴,30秒后将悬臂取出制备池,采用光学显微镜观察悬臂,重复以上操作,直到一个胶体小球被吸附并完全覆盖于抽吸口;
步骤二,将悬臂移至样品池内,调节激光器及光探测器的位置,使得激光器发射的激光在悬臂的上表面反射后进入光探测器,通过计算机控制致动器使悬臂带动胶体小球在竖直方向产生振动并同时在衬底表面移动,当胶体小球位于待测样品中的一个细胞上方时,通过计算机控制致动器使悬臂停止振动并带动胶体小球向下移动,移动距离范围为20纳米到50纳米,直到计算机根据悬臂反射光的信息算出悬臂的受力产生变化,说明胶体小球与一个待测细胞直接接触,且待测细胞与衬底之间产生压力;
步骤三,通过计算机控制致动器使悬臂带动胶体小球沿竖直方向向上移动,计算机同时记录悬臂的受力信息,直到记录的悬臂的受力不再变化,即表明待测细胞与衬底表面分离;
步骤四,根据计算机记录的悬臂的受力信息,计算得到待测细胞在衬底表面的粘附力特征;
步骤五,更换胶体小球:将悬臂置于制备池内,压力控制单元通过气管对储液腔进行充气,以使得储液腔及悬臂的微通道内气压值为正1000毫巴,2秒后将悬臂取出制备池,采用光学显微镜观察悬臂,重复以上操作,直到悬臂的抽吸口位置无胶体小球吸附;
步骤六,重复步骤一到步骤四,以对下一个待测细胞进行测量。
所述步骤一还可以采用另一种方法:悬臂的抽吸口吸附一个胶体小球:将胶体小球均布于基底表面,压力控制单元通过气管对储液腔进行抽气,以使得储液腔及悬臂的微通道内气压为负,并通过计算机控制致动器以调节悬臂的位移,使得悬臂的抽吸口位于基底上方的0.5微米位置,然后通过计算机控制致动器以使得悬臂在竖直方向产生频率为30赫兹的振动,并使得悬臂的抽吸口位置处在竖直方向的振幅为1微米,30秒后停止悬臂振动,采用光学显微镜观察悬臂,重复以上操作,直到一个胶体小球被吸附并完全覆盖于抽吸口。
本发明的有益效果是:
本发明的进行单细胞粘附力测量实验的方法,每次实验中无需更换悬臂就能够对不同的细胞进行测量,实验步骤简单,不会引入污染。
附图说明
下面结合本发明的图形进一步说明:
图1是本发明示意图;
图2是悬臂与制备池的示意图;
图3是胶体小球与基底的示意图。
图中,1.压力控制单元,2.气管,3.储液腔,4.致动器,5.悬臂,6.胶体小球,7.样品池,8.待测样品,9.衬底,10.激光器,11.光探测器,12.计算机,13.制备池,14.基底,15.光学显微镜。
具体实施方式
如图1是本发明示意图,如图2是悬臂与制备池的示意图,如图3是胶体小球与基底的示意图,包括压力控制单元(1)、气管(2)、储液腔(3)、致动器(4)、悬臂(5)、胶体小球(6)、样品池(7)、待测样品(8)、衬底(9)、激光器(10)、光探测器(11)、计算机(12)、制备池(13)、基底(14)、光学显微镜(15)和电缆,储液腔(3)是具有进气口和出液口的圆柱形容器,储液腔(3)处于斜躺位置,进气口位于储液腔(3)的上底面,出液口位于靠近储液腔(3)下底面的侧面,出液口朝下且低于进气口,压力控制单元(1)、气管(2)和进气口依次连接,压力控制单元(1)能够对储液腔(3)进行抽气或充气,悬臂(5)为金属片状,悬臂(5)的内部具有微通道,微通道的两端分别是进液口和抽吸口,进液口位于悬臂(5)一端的上表面,抽吸口位于悬臂(5)另一端的下表面,进液口连接储液腔(3)的出液口,抽吸口能够吸附一个胶体小球(6),胶体小球(6)为胶体制成的球状物,致动器(4)连接于悬臂(5)的上表面并紧贴储液腔(3)的下底面,致动器(4)电缆连接计算机(12),通过计算机(12)对致动器(4)施加不同的电压以控制致动器(4)的伸缩形变,从而能够控制悬臂(5)的位移,样品池(7)位于悬臂(5)的下方,样品池(7)内具有保护液、待测样品(8)和衬底(9),待测样品(8)位于衬底(9)的上面并均置于保护液中,光学显微镜(15)位于样品池(7)下方的10厘米处,激光器(10)和光探测器(11)均位于悬臂(5)的上方,光探测器(11)通过电缆连接计算机(12),激光器(10)发生的激光在悬臂(5)的上表面反射后,能够进入光探测器(11);储液腔(3)的内径为2毫米、长度为10毫米,致动器(4)由压电陶瓷制成,悬臂(5)的长度为300微米、宽度为50微米、厚度为5微米,悬臂(5)的微通道的直径为2.5微米,悬臂(5)的抽吸口的直径为2微米,胶体小球(6)的直径为3微米,待测样品(8)为细胞样品。
如图2中,包括悬臂(5)、胶体小球(6)、制备池(13)和光学显微镜(15),反映悬臂(5)的抽吸口吸附胶体小球(6)的一种方法,包含胶体小球(6)的液体置于制备池(13)内,液体中胶体小球(6)的浓度为0.01摩尔/升,并将悬臂(5)置于制备池(13)内,压力控制单元(1)通过气管(2)对储液腔(3)进行抽气,以使得储液腔(3)及悬臂(5)的微通道内气压为负,气压值为负800毫巴,30秒后将悬臂(5)取出制备池(13),采用光学显微镜(15)观察悬臂(5),重复以上操作,直到制备池(13)液体中的一个胶体小球(6)被吸附并完全覆盖于抽吸口。
如图3中,包括悬臂(5)、胶体小球(6)、基底(14)和光学显微镜(15),反映悬臂(5)的抽吸口吸附胶体小球(6)的另一种方法,将胶体小球(6)均布于基底(14)表面,压力控制单元(1)通过气管(2)对储液腔(3)进行抽气,以使得储液腔(3)及悬臂(5)的微通道内气压为负,并通过计算机(12)控制致动器(4)以调节悬臂(5)的位移,使得悬臂(5)的抽吸口位于基底(14)上方的0.5微米位置,然后通过计算机(12)控制致动器(4)以使得悬臂(5)在竖直方向产生频率为30赫兹的振动,并使得悬臂(5)的抽吸口位置处在竖直方向的振幅为1微米,30秒后停止悬臂(5)振动,采用光学显微镜(15)观察悬臂(5),重复以上操作,直到基底(14)表面的一个胶体小球(6)被吸附并完全覆盖于抽吸口。
悬臂(5)的抽吸口吸附胶体小球(6)的原理:压力控制单元(1)能够通过气管(2)对储液腔(3)进行抽气或充气,即能够调节储液腔(3)及悬臂(5)的微通道内的气压,当储液腔(3)及悬臂(5)的微通道内气压为负时,能够在悬臂(5)的抽吸口产生向微通道内的抽吸力,因此能够对胶体小球(6)产生吸附力,使胶体小球(6)结合于抽吸口,当储液腔(3)及悬臂(5)的微通道内气压为正时,能够在悬臂(5)的抽吸口产生向外的推力,能够将原本吸附于抽吸口的胶体小球(6)脱离抽吸口。
细胞粘附力测量装置进行单细胞粘附力测量的原理:悬臂(5)的抽吸口吸附了胶体小球(6)后,以胶体小球(6)作为悬臂(5)的“探针”,通过胶体小球(6)与待测样品(8)及衬底(9)直接接触,悬臂(5)带动胶体小球(6)在衬底(9)扫描的原理与原子力显微镜的工作原理相同:通过计算机(12)对致动器(4)施加不同的电压以控制致动器(4)的伸缩形变,从而能够控制悬臂(5)的位移及振动,使得胶体小球(6)在竖直方向产生振动并同时在衬底(9)表面移动,激光器(10)发生的激光在悬臂(5)的上表面反射后,进入光探测器(11),计算机(12)根据光探测器(11)获得的悬臂(5)反射光的信息来计算出悬臂(5)的受力特征,估算出胶体小球(6)在衬底(9)表面受到的作用力,并能够判断胶体小球(6)是否位于待测样品(8)中的一个细胞上方。
所述一种细胞粘附力测量方法的步骤为:
步骤一,悬臂(5)的抽吸口吸附一个胶体小球(6):包含胶体小球(6)的液体置于制备池(13)内,液体中胶体小球(6)的浓度为0.01摩尔/升,并将悬臂(5)置于制备池(13)内,压力控制单元(1)通过气管(2)对储液腔(3)进行抽气,以使得储液腔(3)及悬臂(5)的微通道内的气压值为负800毫巴,30秒后将悬臂(5)取出制备池(13),采用光学显微镜(15)观察悬臂(5),重复以上操作,直到一个胶体小球(6)被吸附并完全覆盖于抽吸口;
步骤二,将悬臂(5)移至样品池(7)内,调节激光器(10)及光探测器(11)的位置,使得激光器(10)发射的激光在悬臂(5)的上表面反射后进入光探测器(11),通过计算机(12)控制致动器(4)使悬臂(5)带动胶体小球(6)在竖直方向产生振动并同时在衬底(9)表面移动,当胶体小球(6)位于待测样品(8)中的一个细胞上方时,通过计算机(12)控制致动器(4)使悬臂(5)停止振动并带动胶体小球(6)向下移动,移动距离范围为20纳米到50纳米,直到计算机(12)根据悬臂(5)反射光的信息算出悬臂(5)的受力产生变化,说明胶体小球(6)与一个待测细胞直接接触,且待测细胞与衬底(9)之间产生压力;
步骤三,通过计算机(12)控制致动器(4)使悬臂(5)带动胶体小球(6)沿竖直方向向上移动,计算机(12)同时记录悬臂(5)的受力信息,直到记录的悬臂(5)的受力不再变化,即表明待测细胞与衬底(9)表面分离;
步骤四,根据计算机(12)记录的悬臂(5)的受力信息,计算得到待测细胞在衬底(9)表面的粘附力特征;
步骤五,更换胶体小球(6):将悬臂(5)置于制备池(13)内,压力控制单元(1)通过气管(2)对储液腔(3)进行充气,以使得储液腔(3)及悬臂(5)的微通道内气压值为正1000毫巴,2秒后将悬臂(5)取出制备池(13),采用光学显微镜(15)观察悬臂(5),重复以上操作,直到悬臂(5)的抽吸口位置无胶体小球(6)吸附;
步骤六,重复步骤一到步骤四,以对下一个待测细胞进行测量。
所述一种细胞粘附力测量方法的步骤一的另一种方法,悬臂(5)的抽吸口吸附一个胶体小球(6):将胶体小球(6)均布于基底(14)表面,压力控制单元(1)通过气管(2)对储液腔(3)进行抽气,以使得储液腔(3)及悬臂(5)的微通道内气压为负,并通过计算机(12)控制致动器(4)以调节悬臂(5)的位移,使得悬臂(5)的抽吸口位于基底(14)上方的0.5微米位置,然后通过计算机(12)控制致动器(4)以使得悬臂(5)在竖直方向产生频率为30赫兹的振动,并使得悬臂(5)的抽吸口位置处在竖直方向的振幅为1微米,30秒后停止悬臂(5)振动,采用光学显微镜(15)观察悬臂(5),重复以上操作,直到一个胶体小球(6)被吸附并完全覆盖于抽吸口。
本发明方法基于现有的原子力显微镜技术,并采用具有微通道的悬臂结合胶体小球的方法来进行单细胞粘附力测量实验,每次实验中能够对不同的细胞进行测量,节省时间,且降低引入污染的几率。
- 还没有人留言评论。精彩留言会获得点赞!