一种对弓形虫速殖子直接计数的方法与流程
本发明属于病原体检测领域,具体涉及一种对弓形虫速殖子直接计数的方法。
背景技术:
弓形虫(toxoplasmagondii)属于真球虫目,弓形虫科。该病呈世界性分布,广泛存在于温血动物中,其中猫科动物为其中宿主和重要传染源。弓形虫寄生于细胞内,随血液流动,到达全身各部位,破坏大脑、心脏、致使家畜免疫力下降,引起各种疾病。弓形虫速殖子是引起弓形虫病的主要原因,其专性寄生于有核细胞内,香蕉形,长4-7μm,宽2-4μm,在有核细胞内二分裂增殖,大量增殖后连同细胞被称为假包囊,穿透细胞后释放到血液中,随血液分布到全身各部位。弓形虫速殖子其表膜蛋白抗原(sag)由sag基因家族编码,sag1位于弓形虫速殖子表面,可诱导宿主的免疫应答,sag2是速殖子表膜的另一个主要抗原,可诱导弓形虫速殖子入侵,这两种抗原均具有较强的免疫原性。
目前对弓形虫检测常用的方法有①显微镜镜检法:该方法操作简单,结果直观,但以为无法将病原与样品中杂质区分开,导致假阳性较高。②血清学检测:有免疫荧光法、免疫层析技术、酶联免疫吸附试验(elisa)。免疫荧光法具有较高的敏感性、特异性和重现性等优点,被广泛应用于动物弓形虫血清igg或igm抗体的检测,单因其需要专业荧光显微镜观察而限制了该方法的推广使用。免疫层析技术作为一种简单、便捷的血清学检测方法,适于养殖场及野外现场动物弓形虫的检测,且该方法具有快速、操作简便、结果易判和不需特定仪器等优点,但是当前市场上试纸条存在检测灵敏度低、特异性不高等现象导致检测结果可靠性低。酶联免疫吸附试验利用酶的高效催化作用及底物放大反应效果,使检测灵敏度大大提高,但该方法实验耗时长,且重复性差,无法用于临床上快速准确的检测。③聚合酶链式反应(pcr):pcr法是临床上对弓形虫大量检测常用的一种方法,pcr法准确度高,且适合大量样品同时操作,但其操作耗时费力,且无法对虫体数目定量。
技术实现要素:
发明目的:本发明所要解决的技术问题是提供了一种磁探针。
本发明还要解决的技术问题是提供了该磁探针的制备方法及其应用。
本发明最后要解决的技术问题是提供了一种对弓形虫速殖子直接计数的方法,且对弓形虫速殖子检测灵敏度达到10个/μl。
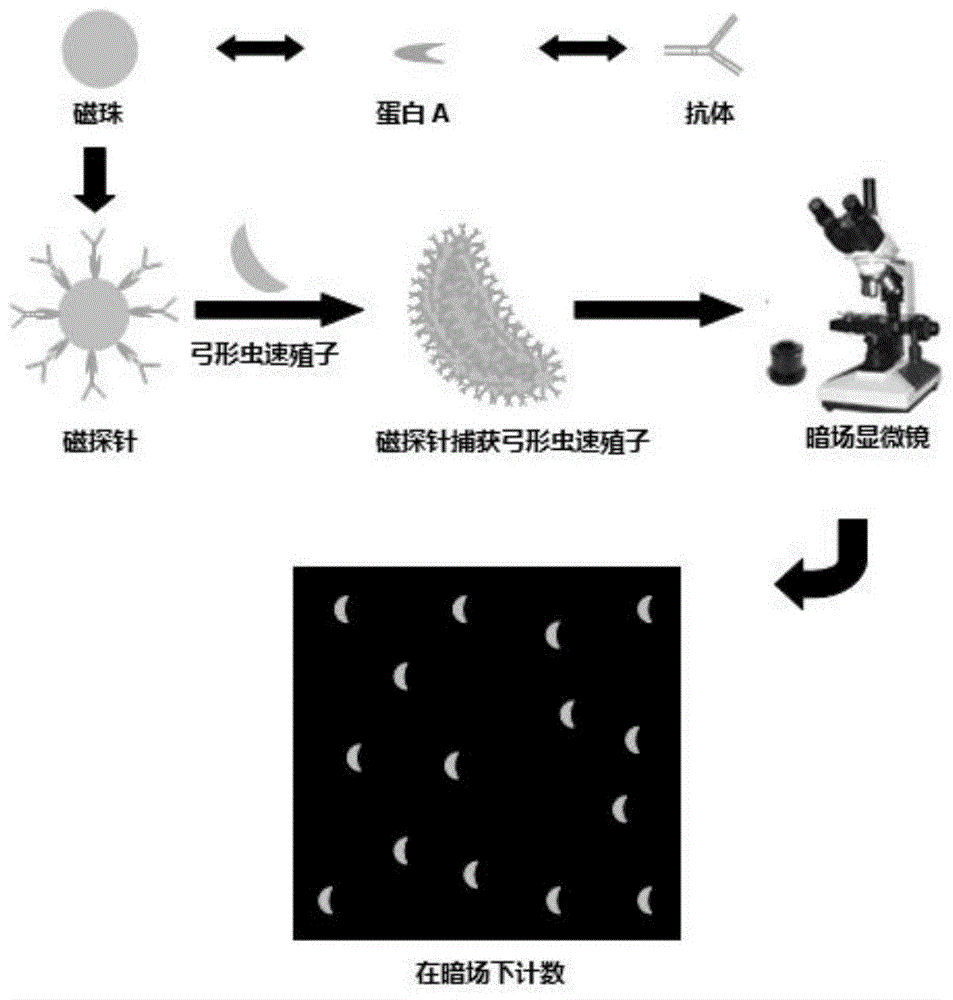
技术方案:为了解决上述技术问题,本发明所采用的技术方案为:一种磁探针,所述磁探针为将弓形虫速殖子单克隆抗体和包被有蛋白a的磁珠进行偶联即得。
其中,所述弓形虫速殖子单克隆抗体和包被有蛋白a的磁珠的质量比为1∶5。
其中,所述磁珠粒径为50nm。
本发明内容还包括所述的磁探针的制备方法,包括以下步骤:
1)磁珠的清洗:将包被有蛋白a的磁珠进行清洗获得分散性均一的磁珠;
2)抗体的偶联:将弓形虫速殖子单克隆抗体和步骤1)清洗后的磁珠混合,进行亲和偶联,获得具有特异性捕获弓形虫速殖子的磁探针。
其中,所述磁珠的粒径为50nm。
其中,所述弓形虫速殖子单克隆抗体和清洗后的磁珠的质量比为1∶5。
本发明内容还包括所述的磁探针在弓形虫速殖子计数方面的应用。
本发明内容还包括一种对弓形虫速殖子直接计数的方法,包括以下步骤:
1)磁珠的清洗:将包被有蛋白a的磁珠进行清洗获得分散性均一的磁珠;
2)抗体的偶联:将弓形虫速殖子单克隆抗体和步骤1)清洗后的磁珠混合,进行亲和偶联,获得具有特异性捕获弓形虫速殖子的磁探针;
3)将步骤2)中获得的磁探针磁分离去上清,用含有bsa的pbst重悬,并室温封闭,得到封闭完好的特异性捕获弓形虫速殖子的磁探针;
4)将步骤3)构建好的磁探针对待测样品中的弓形虫速殖子进行捕获得到混合液;
5)取步骤4)中的混合液滴加到载玻片上,暗场显微镜下观察计数。
其中,优选地,所述磁珠的清洗步骤为:将包被有蛋白a的磁珠与0.05%pbst溶液进行混合,磁分离后静置,弃上清,重悬于0.05%pbst溶液中,弃上清,洗涤后再重悬于0.05%pbst溶液中,移液枪吹打数次,获得分散性较均一的磁珠;
其中,优选地,本发明中磁珠清洗所用的0.05%pbst为加入0.05%吐温-20的ph7.4的磷酸盐缓冲液,每次清洗的时间为5min,清洗次数为3次;
其中,所述弓形虫速殖子单克隆抗体和步骤1)清洗后的磁珠的质量比为1∶5。
其中,所述待测样品为血液。
其中,所述磁探针添加量为每100μl样本溶液加入50μl磁探针;
其中,所述磁探针捕获弓形虫的时间为30min。
有益效果:与现有技术相比,本发明的优点是:本发明提供的利用暗场显微镜肉眼直接检测血液中样品中弓形虫速殖子的方法,核心技术为磁探针分离技术。利用磁探针检测弓形虫速殖子,不需要特殊的实验仪器,只需要磁力分离器和暗场显微镜就可完成实验;在检测过程中,只需要将磁珠偶联上弓形虫速殖子的特异性抗体,利用抗原抗体间特异性结合就能完成实验,室温下就可以操作,不要特殊的实验条件;在短时间内就可完成检测,且具有较高的灵敏度,适用于实地现场作业。该方法具有简便、快速,特异性强,灵敏度高,且无需特殊设备等特点,可直接用于检测人或动物血液中有无弓形虫速殖子。
附图说明
图1、免疫磁珠检测弓形虫速殖子原理示意图;
图2验证磁珠与鼠抗弓形虫速殖子单克隆抗体结合的sds-page图;其中marker为预染蛋白标记,1为20ug50nm磁珠;2为50ug磁珠与10ug抗体结合后的上样量;3为1ug抗体上样量;4为2ug抗体上样量;5为3ug抗体上样量;
图3磁探针捕获小鼠血液中弓形虫速殖子后,虫体在暗场显微镜下视野图,放大倍数为400倍;
图4磁探针捕获小鼠血液中弓形虫速殖子后,在扫描电镜20000倍,可看到虫体表面被探针包裹;
图5磁探针与大肠杆菌混合后扫描电镜20000倍;
图6虫体溶液梯度稀释为10000个/μl、1000个/μl、100个/μl、10个/μl后磁探针捕获后暗场显微镜下视野图,放大倍数为400倍;
图7pcr检测弓形虫速殖子,核酸电泳结果:m、dnamarker;1、10000个/μl;2、1000个/μl;3、100个/μl;4、10个/μl;5、1个/μl。
具体实施方式
下面通过具体的实施例对本发明进一步说明,应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干变型和改进,这些也应视为属于本发明的保护范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的实验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
包被有蛋白a的磁珠货号为:jqm146购自美国creativediagnostics公司;鼠抗弓形虫速殖子单克隆抗体货号为:gr3221591-5购自美国abcam公司;弓形虫速殖子为实验室保存rh株;磁力分离器购自美国promega公司;hulamixer购自lifetechnology公司(挪威)。
实施例1具有特异性捕获弓形虫速殖子的磁探针的制备
1.磁珠的清洗
将50μl商品化包被有蛋白a的直径为50nm磁珠加入400μl0.05%pbst的1.5ml离心管中,混匀,放入磁力分离器上,待磁颗粒吸附完全,弃去上清;再向离心管中加入400μl0.05%pbst溶液,移液枪吹打数次,充分混匀,待用;
2.抗体的偶联
将5μl商品化鼠抗弓形虫速殖子单克隆抗体(2μg/ul)和步骤1中清洗后的50μl磁珠(1μg/ul)混合,进行亲和偶联,振荡混匀后,在mixer中室温下旋转振荡孵育1-3h;结合反应完成后,放入磁力分离器中,待吸附完全,弃去上清,然后用0.05%pbst溶液洗涤,重复3次,重悬于0.05%pbst溶液中,获得具有特异捕获能力的磁探针;
3.磁探针封闭
将步骤2中获得的磁探针用1%bsa室温孵育1h,磁分离洗涤,pbst重悬得到封闭良好的具有特异性捕获弓形虫速殖子的磁探针。
实施例2抗体偶联效率的测定
取与包被蛋白a的磁珠偶联前后的抗体溶液,sds-page法检测磁珠与抗体偶联效率:置于100℃左右的沸水中变性5min,离心10s,120vsds-page电泳,结果如图2所示,通过灰度的对比,确定该探针上偶联抗体的量为1μg,磁珠能较高效率捕获弓形虫速殖子抗体。
实施例3磁探针对弓形虫速殖子的捕获
取100μl鼠抗弓形虫速殖子抗体包被的磁探针与100μl感染弓形虫的小鼠血液样品混匀,mixer中室温下旋转振荡孵育30min;结合反应完成后,放入磁力分离器中,待吸附完全,加入400μl的0.05%pbst洗涤探针,重复操作三次,加入100μl0.05%pbst重悬磁探针得到混合液。
将混合液20μl,滴加到载玻片上,在暗场显微镜400倍视野下,结果如图3所示,可清晰看到弓形虫速殖子表面带有金灿灿的衣壳,形状像金灿灿的弯月状,虫体数量为60个。取20μl混合液,滴到硅片上,制样做扫描电镜,扫描电镜放大20000倍视野下,可以看到虫体表面结合了大量磁珠颗粒,结果如图4所示。
实施例4磁探针特异性的鉴定
取100μl鼠抗弓形虫速殖子抗体包被的磁探针与100μllb培养的大肠杆菌混匀,mixer中室温下旋转振荡孵育30min;取10μl混合液点样,做扫描电镜。放大20000倍视野下,可以看到大肠杆菌不与探针磁珠发生任何结合,证明探针不结合大肠杆菌,其特异性良好,结果如图5所示。
实施例5磁探针检测灵敏度的鉴定
将实验室猪肾传代细胞培养的弓形虫速殖子在细胞计数板上进行计数,使虫体浓度为10000个/μl,在进行梯度稀释,使虫体浓度分别为10000个/μl、1000个/μl、100个/μl、10个/μl。将上述4种梯度的虫体稀释液分别取100μl,分别加入事先制好的弓形虫速殖子磁探针100μl,mixer中室温下旋转振荡孵育30min;结合反应完成后,放入磁力分离器中,待吸附完全,加入400μl的0.05%pbst洗涤探针,重复操作三次,加入100μl0.05%pbst重悬磁探针得到混合液。
将上面4个梯度混合液分别取20μl,滴加到载玻片上,在暗场显微镜400倍视野下下,结果如图6所示。a:虫体浓度为10000个/μl时单个视野;b:虫体浓度为1000个/μl时单个视野;c:虫体浓度为100个/μl时单个视野;d:虫体浓度为10个/μl时随机找10个视野可看到一个虫子。结果显示,磁探针对弓形虫速殖子的检测灵敏度可达到10个/μl。
对比例传统pcr对弓形虫速殖子检测灵敏度的鉴定
以弓形虫速殖子529bp重复序列设计引物如下:
f:5’-cgctgcagggaggaagacgaaagttg-3’
r:5’-cgctgcagacacagtgcatctggatt-3’;
虫子浓度梯度稀释为分别为10000个/μl,1000个/μl,100个/μl,10个/μl,1个/μl,分别取1μl稀释液做pcr模版,采用常规pcr扩增体系,退火温度设置为58℃,延伸时间设置为40s,25μl体系30个循环。pcr扩增产物跑琼脂糖凝胶电泳,结果如图7所示。pcr对弓形虫速殖子的检测灵敏度为100个/μl。
上述仅为本发明优选的实施例,并不不限制于本发明。对于所属领域的技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或变动。这里无需也无法对所有的实施例来举例说明。而由此方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之内。
序列表
<110>扬州大学
<120>一种对弓形虫速殖子直接计数的方法
<160>2
<170>siposequencelisting1.0
<210>1
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>1
cgctgcagggaggaagacgaaagttg26
<210>2
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>2
cgctgcagacacagtgcatctggatt26
- 还没有人留言评论。精彩留言会获得点赞!