一种功能化磷脂制备纳米单颗粒的方法及该纳米单颗粒的检测与流程
本发明属于化学领域,具体涉及一种功能化磷脂制备纳米单颗粒的方法及该纳米单颗粒的检测。
背景技术:
脂质体(liposome)最早是由英国的a.d.bangham在1956年正式发现的(banghamad,standishmm,watkinsjc.j.mole.biol.,1965,13:238-252.)。脂质体是由脂质双分子层组成的闭合囊泡,脂质分子是双亲性分子,由极性的亲水头部和非极性的疏水尾部组成。当脂质分子在水中分散形成脂质体时,脂质分子的疏水端指向内部,其亲水端则在双分子层的表面。值得注意的是,脂质和蛋白质是构成生物膜的主要成分,因此脂质体也是一种重要的模型生物膜体系。脂质体被发现以来,由于其独特的结构,在化妆品、食品和医药等领域有着广泛的应用。特别是由于组成脂质体的磷脂分子具有双亲性,其内部可以包裹水溶性和脂溶性药物,而且磷脂与人体细胞膜的组成近似,使得脂质体成为一类非常有效的基因和药物载体,成功用于基因和药物传递。
目前制备脂质体囊泡的方法有若干种,如挤出法、超声法、水合溶胀法、电形成法等。对于小单层囊泡和大单层囊泡,一般先将一定量的磷脂溶解于氯仿或氯仿/甲醇的混合溶液中,使用氮气将溶剂吹干并在真空下除去痕量剩余溶剂,在玻璃表面得到一层干燥的磷脂膜,加入缓冲溶液对磷脂膜进行水合溶胀,经震荡或搅拌即可得到尺寸不一的多室脂质体囊泡。利用挤出法或超声法,可将大小不一的多室脂质体囊泡转变为大单层囊泡或小单层囊泡。对于巨型单层囊泡,可以将在玻璃表面得到的层状磷脂膜置于水溶液中水合,使其自然膨胀得到巨型囊泡,或者在外加交流电场条件下形成巨型囊泡。
生物纳米颗粒,如蛋白、囊泡、脂质体和病毒等的功能和性质都与其形貌、尺寸、电荷密度和表面化学性质等密切相关。因此,发展可用于单颗粒检测和分析的研究方法,对于了解颗粒结构和性能的关系具有重要的意义。目前,可用于颗粒检测的方法和技术主要包括电镜技术和光谱技术两大类。对于前者,比较普遍的有扫描电子显微镜(sem)和透射电子显微镜(tem)。但是,这类方法目前还很难直接用于单颗粒在溶液状态下的实时检测。动态光散射技术(dls)虽然可用于颗粒在溶液中原位实时检测,但其给出的仍是整个体系中颗粒的统计结果,尚无法提供单个颗粒的具体特征,并且体系中存在的已团聚的大颗粒或杂质对检测结果会存在干扰(edwardsma,germansr,dickje,bardaj,whitehs.acsnano,2015,9:12274-12282.)。随着电分析化学技术和微纳加工技术的发展,单颗粒电化学检测技术在最近几年得到了快速发展。由于该方法可以精确地探测单颗粒的性质(如表面电荷、几何尺寸、表面化学),因而在单颗粒分析中展现出了强大的应用前景(zhaolj,qianrc,maw,tianh,longyt.anal.chem.,2016,88:8375-8379;kleijnsef,laiscs,kopermtm,unwinpr.angew.chem.int.ed.,2014,53:3558–3586.)。
技术实现要素:
本发明的目的之一是提供一种功能化磷脂制备纳米单颗粒的方法。
本发明所提供的功能化磷脂制备纳米单颗粒的方法,包括如下步骤:
1)将磷脂dopc与功能化磷脂biotinylpe分别溶解在有机溶剂中得到磷脂dopc溶液和功能化磷脂biotinylpe溶液,将上述两种溶液混合,将混合后体系中的溶剂去除,得到一层薄磷脂膜;
2)向步骤1)所得的薄磷脂膜中加入pbs缓冲溶液,混匀后静置,水合溶胀,超声分散,得到功能化脂质体纳米单颗粒(biotin-liposome)的溶液。
上述方法步骤1)中,所述有机溶剂具体可为氯仿;
所述磷脂dopc溶液中dopc的浓度可为8×10-4mol/l;
所述功能化磷脂biotinylpe溶液中biotinylpe的浓度可为2×10-4mol/l;
混合后体系中,磷脂dopc与功能化磷脂biotinylpe的浓度比可为1:1-6:1,具体可为1:1、2:1、4:1或6:1;
所述将混合后体系中的溶剂去除的操作为:用氮气吹干体系中的溶剂;
上述方法在进行步骤2)之前,还可进一步包括将所述薄磷脂膜干燥以去除残余溶剂的操作,所述干燥可在真空干燥箱中进行;所述干燥的时间可为6-12h,具体可为6h,9h,12h等。
所述薄磷脂膜水合溶胀步骤中,所述静置的时间可为10-60min,具体可为30min;
所述超声分散的操作为:采用超声细胞破碎仪超声至溶液澄清;其中所述超声细胞破碎仪购自宁波新芝生物科技有限公司,型号:scientz-iid;
超声参数设置如下:功率70%,10s开,10s关,超声时长10-40min,具体可为10min、20min。
所述功能化脂质体纳米单颗粒(biotin-liposome)的溶液中,脂质体纳米单颗粒的浓度可为500nm-5mm,具体可为1mm。
上述方法还可进一步包括将功能化脂质体纳米单颗粒从所述功能化磷脂纳米单颗粒(biotin-liposome)的溶液中分离出来的操作。
具体可为:采用膜过滤将所述功能化脂质体纳米单颗粒分离出来。
所用膜的孔径为50-200nm。
由上述方法制备得到的功能化脂质体纳米单颗粒也属于本发明的保护范围。
本发明的另一目的是提供一种检测上述功能化脂质体纳米单颗粒的方法。
本发明所提供的检测上述功能化脂质体纳米单颗粒的方法为:以avidin-sh修饰的金微电极为工作电极构筑三电极体系,通过电化学技术实现功能化脂质体纳米单颗粒的检测。
上述检测的具体操作如下:
以avidin-sh修饰的金微电极au-s-avidin作为工作电极,ag/agcl电极为参比电极,铂电极为对电极构筑三电极体系,甲醇二茂铁为电化学探针,在不同电位下检测加入一定浓度的功能化脂质体纳米单颗粒后的时间-电流曲线,观察并分析实验结果,得到纳米颗粒的粒径、表面电荷、与电极碰撞频率等信息。
其中,所述avidin-sh修饰的金微电极au-s-avidin通过包括下述步骤的方法制备得到:将金微电极清洗,然后在硫酸溶液中进行电化学活化,再用二次水清洗;将清洗后的金微电极浸泡在avidin-sh溶液中,即可得到avidin-sh修饰的金微电极(au-s-avidin)。
所述清洗为依次用乙醇、二次水清洗金微电极;
所述硫酸溶液具体可为0.5m硫酸溶液。
所述浸泡的时间可为6-48h,具体可为12h;温度可为4℃;
所述修饰电极在进行电化学测试之前用二次水清洗3次,去除掉未被固定的分子。
所述avidin-sh修饰的金微电极(au-s-avidin)不使用时放在4℃下保存。
所述不同电位可为-0.5v至0.5v中的任意电位。
所述一定浓度指脂质体纳米单颗粒在检测溶液中的浓度,具体可为500μm-1pm之间的任意值。
本发明提供了一种简单的制备单一尺寸、功能化脂质体纳米颗粒的方法,功能化的磷脂biotinylpe与磷脂dopc可以制备脂质体单纳米颗粒;通过biotin-liposome与avidin-sh修饰的金电极的特异性结合和电化学技术实现对电化学活性较差的脂质体单颗粒的检测。据我们所知,这是首次通过avidin与biotin的特异性识别及biotin功能化的单颗粒与电极的碰撞来检测单颗粒。
附图说明
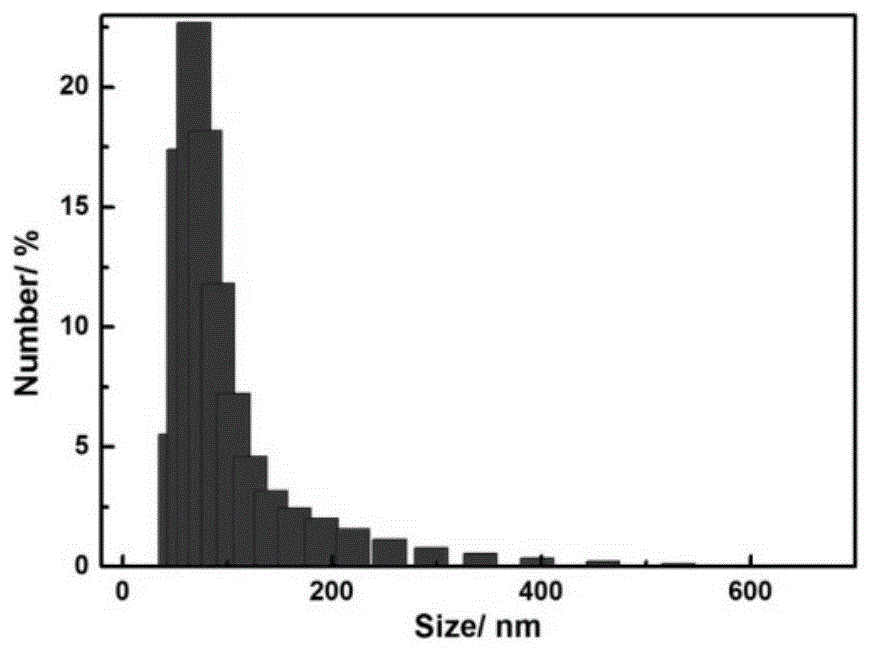
图1为本发明实施例1制备的脂质体单纳米颗粒的动态光散射粒径分布图。
图2为本发明实施例1制备的脂质体单纳米颗粒吸附在电极表面的sem表征图。
图3为修饰的金电极检测实施例1制备的脂质体单纳米颗粒的时间-电流曲线。
图4为金微电极检测脂质体纳米单颗粒原理示意图。
具体实施方式
下面通过具体实施例对本发明进行说明,但本发明并不局限于此。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、材料等,如无特殊说明,均可从商业途径得到。
下述实施例中采用的磷脂dopc购自北京希凯创新科技有限公司,商品名为1,2-dioleoyl-sn-glycero-3-phosphocholine,powder(avanti);
biotinylpe购自西安瑞禧生物科技有限公司,商品名为1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-n-(biotinyl)(sodiumsalt),powder(avanti)。
实施例1、功能化磷脂制备脂质体纳米单颗粒及其检测
1)功能化磷脂制备脂质体纳米单颗粒:
将购买的磷脂溶解在氯仿中,按一定的比例混合,混合后磷脂dopc与biotinylpe的浓度比为4:1;氮气吹干溶剂,在容器底部形成一层均匀的薄磷脂膜;
将所得薄磷脂膜在真空干燥箱里干燥12h,随后再加入2mlpbs缓冲溶液水化,震荡混匀后静置30min,并用细胞破碎仪超声20min使其分散均匀(功率70%,10s开,10s关),即可得到尺寸均一含脂质体纳米单颗粒的溶液(脂质体纳米单颗粒的浓度为1mm);
2)修饰电极的制备:
金微电极的前处理:依次用乙醇、二次水清洗电极,将电极在0.5m硫酸溶液中电化学活化30min,再用二次水清洗电极;
制备修饰电极:将清洗干净的电极浸泡在avidin-sh溶液中、置于冰箱4℃下修饰12h,巯基被修饰在金微电极表面。
所有的修饰电极在进行电化学测试之前都用二次水清洗3次,去除掉未被固定的分子,电极不使用时放在4℃条件下保存。
3)修饰电极用于脂质体纳米单颗粒的检测:
将步骤2)所得au-s-avidin微电极作为工作电极,以ag/agcl电极为参比电极,铂电极为对电极构筑三电极体系,甲醇二茂铁为电化学探针,在0.5v电位下检测加入一定浓度的(40μm,将步骤1)中制备的脂质体纳米单颗粒的溶液加入到空白溶液后的浓度)脂质体纳米单颗粒后的时间-电流曲线,观察分析实验结果得到纳米颗粒的粒径、表面电荷、与电极碰撞频率等信息。
图1所示的是制备得到的脂质体单纳米颗粒的动态光散射粒径分布图,从图中可以看出纳米颗粒的直径大约是100nm。
图2所示为修饰后的金微电极au-s-avidin在与脂质体单纳米颗粒通过特异性识别相互作用一段时间后,单纳米颗粒吸附在电极表面的扫描电子显微镜(sem)图。
图3为修饰后的金微电极au-s-avidin检测脂质体单纳米颗粒的时间-电流曲线。由图3可知:功能化脂质体纳米颗粒与电极碰撞后主要是产生峰型信号和台阶式信号。
图4所示为修饰后的金微电极检测脂质体纳米单颗粒原理示意图。
实施例2、功能化磷脂制备脂质体纳米单颗粒及其检测
1)功能化磷脂制备脂质体单纳米颗粒:
将购买的磷脂溶解在氯仿中,按一定的比例混合,混合后磷脂dopc与biotinylpe的浓度比为2:1;氮气吹干溶剂,在容器底部形成一层均匀的薄磷脂膜;
将所得薄磷脂膜在真空干燥箱里干燥9h,随后再加入2mlpbs缓冲溶液水化,震荡混匀后静置30min,并用细胞破碎仪超声10min使其分散均匀,即可得到尺寸均一含脂质体纳米单颗粒的溶液(脂质体纳米单颗粒的浓度为1mm);
2)修饰电极的制备:
金微电极的前处理:依次用乙醇、二次水清洗电极,将电极在0.5m硫酸溶液中电化学活化,再用二次水清洗电极;
制备修饰电极:将清洗干净的电极浸泡在avidin-sh溶液中、置于冰箱4℃下修饰24h,巯基被修饰在金微电极表面。
所有的修饰电极在进行电化学测试之前都用二次水清洗3次,去除掉未被固定的分子,电极不使用时放在4℃条件下保存。
3)修饰电极用于脂质体纳米单颗粒的检测:
将步骤2)所得au-s-avidin微电极作为工作电极,以ag/agcl电极为参比电极,铂电极为对电极构筑三电极体系,甲醇二茂铁为电化学探针,在0v电位下检测加入一定浓度的脂质体纳米单颗粒后的时间-电流曲线,观察并分析实验结果。
实施例3、功能化磷脂制备脂质体纳米单颗粒及其检测
1)功能化磷脂制备脂质体单纳米颗粒:
将购买的磷脂溶解在氯仿中,按一定的比例混合,混合后磷脂dopc与biotinylpe的浓度比为6:1;氮气吹干溶剂,在容器底部形成一层均匀的薄磷脂膜;
将所得薄磷脂膜在真空干燥箱里干燥6h,随后再加入2mlpbs缓冲溶液水化,震荡混匀后静置30min,并用细胞破碎仪超声40min使其分散均匀,即可得到尺寸均一含脂质体纳米单颗粒的溶液(脂质体纳米单颗粒的浓度为1mm);
2)修饰电极的制备:
金微电极的前处理:依次用乙醇、二次水清洗电极,将电极在0.5m硫酸溶液中电化学活化,再用二次水清洗电极;
制备修饰电极:将清洗干净的电极浸泡在avidin-sh溶液中、置于冰箱4℃下修饰12h,巯基被修饰在金微电极表面。
所有的修饰电极在进行电化学测试之前都用二次水清洗3次,去除掉未被固定的分子,电极不使用时放在4℃条件下保存。
3)修饰电极用于脂质体纳米单颗粒的检测:
将步骤2)所得au-s-avidin微电极作为工作电极,以ag/agcl电极为参比电极,铂电极为对电极构筑三电极体系,甲醇二茂铁为电化学探针,在-0.5v电位下检测加入一定浓度的脂质体纳米单颗粒后的时间-电流曲线,观察分析实验结果。
脂质是构成生物膜的主要成分之一,脂质体的磷脂分子具有双亲性,其内部可以包裹水溶性和脂溶性药物,而且磷脂与细胞膜的组成近似,使得脂质体成为一类非常有效的基因和药物载体,成功用于基因和药物传递。利用脂质体与细胞膜良好的生物相容性,还可以将功能化的脂质体单颗粒(或功能化的脂质体单颗粒包裹药物后)与细胞共孵育,来研究功能化的脂质体单颗粒在细胞内的活动状态以及它的加入对于细胞一些生理状态的影响。利用电化学技术实现脂质体/载药脂质体纳米颗粒在细胞内分布、形态等检测,为疾病观测、诊断和治疗提供帮助。
- 还没有人留言评论。精彩留言会获得点赞!