一种组织学切片染色方法与流程
本发明涉及医学生物形态学研究领域,具体涉及一种组织学染色方法,即苏木素伊红染色方法,简称he染色。
背景技术:
he染色技术目前是医学生物学领域应用最广泛的组织学染色方法,h指苏木精(hemaltoxylm),e指伊红(eosin)。染料的摄取常常是由于染料和组织之间的亲和力不同,而选择性的着色。亲和力受多种因素影响,如库伦引力,范德华力、氢键等,他们在时间和空间上影响着色效果。
一般来说,苏木素将细胞核染成蓝黑色,而伊红将细胞质和大多数结缔组织纤维染成不同程度的红色。
苏木素是由洋苏木(苏木素树的树心)经热水,尿素等工艺流程提炼而得,苏木素本身并不是一种染料,其主要氧化产物苏木红是一种天然染料,是该染料发挥功能的主要成分。
苏木红可由苏木素通过自然氧化和化学氧化两种方法获得。自然氧化获得的苏木素染液染色能力可维持较长时间,但由于其生产周期长,在生物学领域应用较少。苏木素中功能成分苏木红是阴离子,若无媒介染剂,其对核的染色不会很充分,对组织的亲和力也较弱,因此根据苏木素中添加的媒染剂的不同,可分为:明矾苏木素、铁苏木素、钨苏木素、钼苏木素、铅苏木素和无媒染剂的苏木素。常规苏木素染液有ehrlich、mayer、harris、gill、delafield和cole,其中最常使用的是mayer苏木素。
伊红属于夹氧杂蒽类染料,市场上可见的伊红种类较多,但伊红y实用最广泛。作为胞浆染料,最常与苏木素联用来显示常见的组织结构。
he染色的染色步骤分为两步,第一步为苏木素染色,第二部为伊红染色。其中苏木素染色根据苏木素种类的不同,可分为进行性染色和退行性染色。进行性染色是一次性达到核的着色效果,退行性染色是指先将组织切片过度染色,接着用酸性酒精分化,最后再反蓝。伊红的独特之处在于:适当分化后能染成不同程度的深浅不一的粉红至红色,便于区分不同类型的细胞的胞浆以及不同类型的结缔组织和基质。
医学及生物学实验中,获取目的组织后,大都选择在福尔马林或布氏固定液中固定,然后实用酒精保存。对于某种特定的物质而言,其在不同的固定剂中的保存程度通常不同,比如酒精对组织中蛋白质的保存能力较差,而且在保存抗原及酶的活性方面也较差;许多脂类在四氧化锇或重铬酸盐中固定后保存完好,而在福尔马林中固定保存较差,在丙酮或酒精中固定过程中被吸除,因此酒精固定后,脂类无法染色。因此增加了后续染色的难度,对提高he图片的质量有了更高的挑战。
he染色的核心是染液的选择,而染色效果主要取决于染色时间,在组织没有物理损伤的前提下,观察对照组和处理组之间的异同。尽管苏木素和伊红苏染液种类繁多,但是从它们的配方过程不难发现,二者不仅能溶于水,也易溶于醇溶液。he染色过程中样品接触的主要溶液是水和不同梯度的酒精溶液,弱碱性水对某些苏木素染液有“反蓝作用”,如明矾苏木素,carzzzi苏木素。而mayer苏木素既可以用于进行性染色也可用于退行性染色,尤其是当需要核复染以突出特殊染色后的胞浆成分时,不需要水化,以免破坏或褪去胞浆成分的着色,carzzzi苏木素也可用于进行性核复染,但是需要在自来水中蓝化。
尽管伊红染色的着色强度及分化程度因人喜好而异,但通常会出现以下情况:一是由于汞盐固定的原因,伊红染色深而较难分化充分;二是由于逆酒精梯度脱水时,醇溶液过度分化,导致伊红易被洗脱,酒精被污染的同时造成染色质量下降,组织切片中仅有红细胞和嗜曙红颗粒着色,从而使染色出现偏差,影响着色质量,也造成实验耗材浪费;三是伊红作为胞浆染液,经常会出现真菌生长现象;四是是苏木素(胞核)着色较弱的现象。he染色过程中,苏木素染色一次,但是要在水中蓝化一次,醇溶液中分化一次,特别是在醇溶液中分化,酒精分化速度快,无选择性,不易控制,从而导致苏木素染液洗脱,核着色较浅,影响观察。染色过程在脱水环节,绝大多数的伊红会被洗脱,各个梯度的醇溶液均会出现不同程度的污染,若不丢弃,会对后一批的染色造成颜色上的干扰,比如正常情况下肌纤维的着色为红色,红细胞的着色为橘红,而纤维素的着色为深粉色,污染后的醇溶液容易使不同组织间的着色发生混淆,影响观察。若丢弃,则会造成不必要的经济损失。最后,伊红处理过的组织切片,紧接着进行梯度酒精脱水,查阅众多文献发现,按照正常的脱水时间,伊红的着色会被严重洗脱,若减短脱水时间,则会导致脱水不足,后续封片中组织周围会形成水雾,严重影响观察。
he是目前最基础最广泛的组织学染色方法,也是实验探究过程中最直观的实验方法。因此精细化的染色,是制备he切片的前提,也是决定能否在普遍性中找共性,在共性中找差异的基础。
技术实现要素:
为解决上述技术问题,本发明通过调整he染色过程中的步骤,从而使染色效果进一步优化,同样值得一提的是,通过优化染色程序,梯度脱水的醇溶液将不再被污染,可以循环实用,大大降低了科研成本。
本发明具体技术方案如下:
本发明的第一个目的是提供一种用于he染色的天青石蓝溶液,包括天青石蓝b、硫酸铁铵、甘油、蒸馏水;
所述天青石蓝b、硫酸铁铵、甘油、蒸馏水的重量体积比为
重量体积比为2.5g:25g:50ml:450ml。;调整成分比例后在本发明中配套使用,效果显著提高。
所述天青石蓝溶液的配置方法为:将硫酸铁铵溶解于冷蒸馏水中,搅拌均匀后加入天青石蓝b煮沸溶解,冷却过滤,加入甘油,用前过滤。
本发明天青石蓝溶液中添加了高价铁盐,应用于he染色时,可增强苏木素与细胞核的结合力,使胞核染色更深。
在某个特定的实施方案中,天青石蓝溶液的体系如表1所示:
表1
本发明的第二个目的是提供一种用于he染色的苏木素染液,包括苏木素、钾明矾、碘酸钠、柠檬酸、水合氯醛ar、蒸馏水;
所述苏木素、钾明矾、碘酸钠、柠檬酸、水合氯醛ar、蒸馏水质量比为1:50:0.2:1:30:1000的;
所述苏木素染液的配置方法为:将苏木素、钾明矾和碘酸钠在蒸馏水里室温过夜溶解后,加入水合氯醛ar和柠檬酸,混合物煮沸后5分钟,冷却过滤则制备完成,用前过滤。
相对于现有技术,本发明在苏木素染液体系中,加入了新成分:柠檬酸,柠檬酸使该苏木素呈弱酸性体系,应用于he染色时,可有效阻碍胞浆部分着色,使着色更具针对性,与此同时,弱酸环境可使后续蓝化过程在蒸馏水中即可完成,不再需要氨水处理,简化步骤,节省实验试剂。此外,在苏木素染液体系中加入水合氯醛ar,增强胞核金色离子的着色效果。
在某个特定的实施方案中,苏木素染液的体系如表2所示:
表2
本发明的第三个目的是提供一种用于he染色的伊红染液,包括1%伊红y、1%四溴四氯荧光素钠b、100%酒精、乙酸、麝香草芬;
所述伊红染液中,1%伊红y、1%四溴四氯荧光素钠b、100%酒精、乙酸的体积比为5:1:93:1:4,所述1%伊红y、1%四溴四氯荧光素钠b、100%酒精、乙酸的混合液与麝香草芬的比为250ml:1g;
所述伊红染液的配置方法为:将1%伊红y和1%四溴四氯荧光素钠b依次混入100%的酒精后,加入乙酸,最后加入麝香草芬低温避光溶解,he染色实验前4个月制备,密封备用。
相对于现有技术,本发明将四溴四氯荧光素钠b和伊红y1:5配比使用,将适量乙酸加入伊红染液体系,应用于he染色时,可增强着色。将适量麝香草芬加入伊红染液体系,可延长伊红的使用寿命。
在某个特定的实施方案中,伊红染液的体系如表3所示:
表3
本发明的第四个目的是提供前述的天青石蓝溶液或前述的苏木素染液或前述的伊红染液在he染色中的应用。
本发明的第五个目的是提供一种组织学切片he染色方法,所述方法包括以下步骤:
(1)将生物组织切片、烘干、脱蜡,梯度酒精水化至水;
(2)采用天青石蓝溶液浸泡5分钟;
(3)苏木素染液染色;根据进行性或退行性染色方式,确定染色时间。
(4)水流冲洗至蓝化,所述冲洗时间不超过5分钟;
(5)梯度酒精脱水;
(6)伊红染液染色3~15秒,优选的,染色5秒。
(7)采用二甲苯透明两次,每次3分钟;
(8)封片。
进一步的,步骤(1)所述生物组织为动物组织,优选的,为动物睾丸组织、肝脏组织、肾脏组织、肌肉组织或小肠组织。
进一步的,步骤(1)中所述组织切片厚度为3~5μm。
进一步的,步骤(1)中所述脱蜡为采用二甲苯浸泡两次,每次6分钟,后用50%二甲苯与50%酒精混合后浸泡3分钟。
优选的,上述两次浸泡所用的二甲苯分别编号回收,于步骤(7)中逆序重复使用。
具体的,所述逆序重复使用为:步骤(1)脱蜡采用二甲苯ⅰ(第一份)浸泡6分钟、二甲苯ⅱ(第二份)浸泡6分钟、50%二甲苯与50%酒精等体积混合后浸泡3分钟;步骤(7)透明为,先采用步骤(1)回收的二甲苯ⅱ(第二份)浸泡3分钟、再采用步骤(1)回收的二甲苯ⅰ(第二份)浸泡3分钟。
进一步的,步骤(1)中所述水化的为依次采用体积浓度为100%、100%、90%、80%、70%、50%的酒精梯度处理(此处均为vol.%);
优选的,水化所用的梯度酒精分别回收,于后续的步骤(1)的水化或步骤(5)中重复使用;
更优选的,所述两份100%酒精分别编号并回收,于步骤(5)中逆序重复使用。
具体的,所述逆序重复使用为:步骤(1)水化依次采用梯度酒精100%ⅰ(第一份)、100%ⅱ(第二份)、90%、80%、70%、50%(ⅰ)水化至水后,分别回收,可在后续的步骤(1)水化中重复使用,也可在步骤(5)的梯的脱水步骤中,依次采用步骤(1)回收的50%(ⅱ)、70%、80%、90%、100%ⅱ(第二份)、100%ⅰ(第一份)进行脱水。需明确的是,步骤(1)水化所用50%酒精(ⅰ)中不添加6%乙酸,步骤(5)脱水中,向50%酒精(ⅱ)中添加6%乙酸(每100ml体系中乙酸和50%酒精体积比6ml:94ml)。
进一步的,步骤(2)中所述天青石蓝溶液包括天青石蓝b、硫酸铁铵、甘油、蒸馏水,
所述天青石蓝b、硫酸铁铵、甘油、蒸馏水的重量体积比为2.5g:25g:50ml:450ml。
所述天青石蓝溶液的配置方法为:将硫酸铁铵溶解于冷蒸馏水中,搅拌均匀后加入天青石蓝b煮沸溶解,冷却过滤,加入甘油,用前过滤。
进一步的,步骤(3)中所述苏木素染液包括苏木素、钾明矾、碘酸钠、柠檬酸、水合氯醛ar、蒸馏水;
所述苏木素、钾明矾、碘酸钠、柠檬酸、水合氯醛ar、蒸馏水质量比为1:50:0.2:1:30:1000的;
所述苏木素染液的配置方法为:将苏木素、钾明矾和碘酸钠在蒸馏水里室温过夜溶解后,加入水合氯醛ar和柠檬酸,混合物煮沸后5分钟,冷却过滤则制备完成,用前过滤。
进一步的,步骤(5)中所述脱水为依次采用体积浓度为50%、70%、80%、90%、100%、100%的酒精梯度处理,所述50%酒精中加入浓度为6%的乙酸(每100ml体系中有6ml乙酸94ml50%酒精)。进一步的,脱水所用的梯度酒精分别回收,可在后续的步骤(1)水化中重复使用,也可后续的在步骤(5)中的重复使用。需明确的是,步骤(5)中加入了6%的50%的酒精只可在后续的步骤(5)中重复使用,不能在步骤(1)中使用;其他梯度的酒精既可回收重复用于步骤(1)也可用于步骤(5)。
进一步的,步骤(6)中所述伊红染液包括1%伊红y、1%四溴四氯荧光素钠b、100%酒精、乙酸、麝香草芬;
所述1%伊红y、1%四溴四氯荧光素钠b、100%酒精、乙酸的体积比为5:1:93:1:4,所述1%伊红y、1%四溴四氯荧光素钠b、100%酒精、乙酸的混合液与麝香草芬的比为250ml:1g;所述伊红染液的配置方法为:将1%伊红y和1%四溴四氯荧光素钠b依次混入100%的酒精后,加入乙酸,最后加入麝香草芬低温避光溶解,he染色实验前4个月制备,密封备用。
本发明技术方案相对于现有技术的有益效果在于:
1、本发明的he染色方法在步骤(3)苏木素染液染色、步骤(4)反蓝后,直接进行(5)的50%→100%梯度酒精脱水步骤,在50%的醇溶液中滴加适量乙酸,梯度至100%酒精后进行伊红染色,该步骤为he染色最核心的部分:首先,弱酸的醇溶液环境可去除胞浆或核浆中的染料,而使核酸复合物保持完整,其次,弱酸性环境可减缓后续分化过程,使分化过程可控性增强。通过该步骤的优化创新,将伊红染色调整到脱水步骤之后,保证脱水的梯度酒精无污染,使梯度酒精循环使用次数显著增加,大大降低了实验成本。并且调整后伊红染液的染色时间由常规的5~8分钟缩短至3~15秒,缩短染色周期,简化实验步骤,he染色效果显著提升。
2、本发明的天青石蓝溶液中添加了高价铁盐,应用于he染色时,可增强苏木素与细胞核的结合力,使胞核染色更深。
3、本发明的苏木素染液体系中,加入了新成分:柠檬酸,柠檬酸使该苏木素呈弱酸性体系,应用于he染色时,可有效阻碍胞浆部分着色,使着色更具针对性,与此同时,弱酸环境可使后续蓝化过程在蒸馏水中即可完成,不再需要氨水处理,简化步骤,节省实验试剂。此外,在苏木素染液体系中加入水合氯醛ar,增强胞核金色离子的着色效果。
4、本发明的伊红染液中,将四溴四氯荧光素钠b和伊红y1:5配比使用,将适量乙酸加入伊红染液体系,应用于he染色时,可增强着色。将适量麝香草芬加入伊红染液体系,可延长伊红的使用寿命,避免不必要的试剂消耗。
附图说明
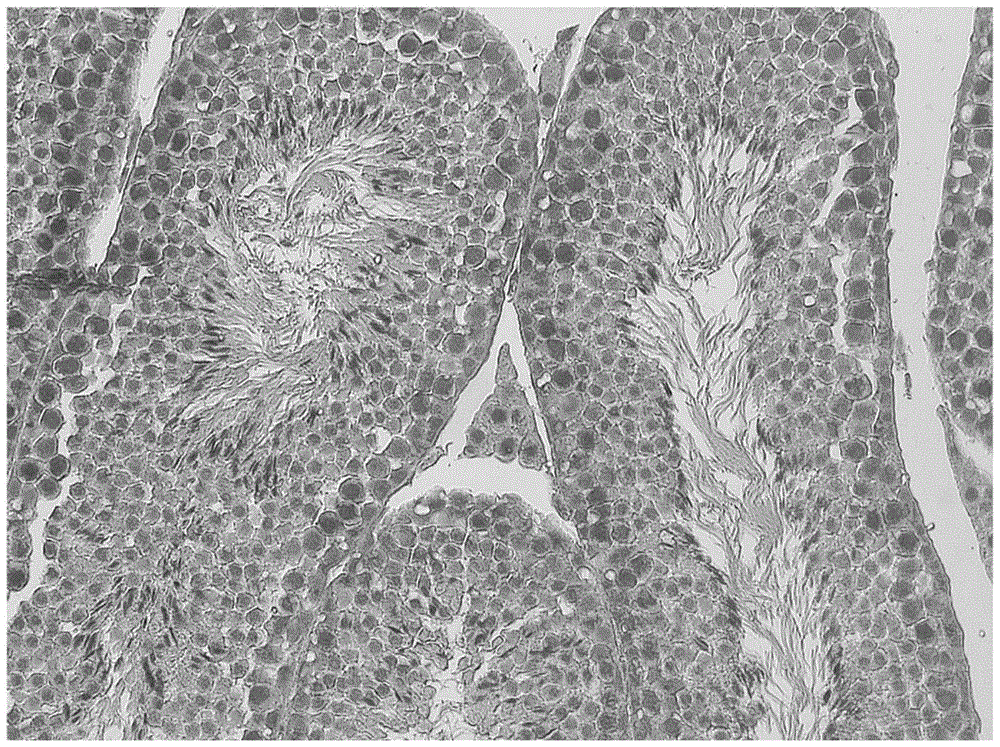
图1为实施例4制备的小鼠睾丸组织组织he染色切片的显微观察图。
具体实施方式
为了使该领域技术人员更好地掌握本发明的技术方案,以下结合具体的实施例对本发明做详细说明。
采用传统he染色方法与本发明的he染色方法对比,同时本发明使用的染液为本发明改进后的天青石蓝溶液、苏木素染液、伊红染液三种染液体系,并且我们使用多种不同的生物组织对两者进行试验对比。
实施例1苏木素染液配制
制备过程:按表4所示配方分别取样,将苏木素、钾明矾和碘酸钠在蒸馏水里室温过夜溶解,然后加入水合氯醛ar和柠檬酸,混合物煮沸后5分钟,冷却过滤则制备完成,用前过滤。
表4
实施例2伊红染液配制
制备过程:按表5所示配方分别取样,将1%伊红y和1%四溴四氯荧光素钠b依次混入100%的酒精,加入乙酸,最后加入麝香草芬低温避光溶解,提前4个月制备,密封备用。
表5
实施例3天青石蓝溶液配制
制备过程:按表6所示配方分别取样,将硫酸铁铵溶解于冷蒸馏水中,搅拌均匀后加入天青石蓝煮沸溶解,冷却过滤,加入甘油,用前过滤。
表6
实施例4采用本发明he染色方法处理以下组织:
摘取实验动物的睾丸组织、肝脏组织、肾脏组织、肌肉组织及小肠组织,进行前处理处理,固定以上组织,包埋,切片,前处理步骤如下:
1、固定:取材后标本及时置于10%中性福尔马林溶液中浸泡,依标本大小决定浸泡时间,大标本可剖开固定,幼龄动物组织固定时间为24小时,成年动物可适当延长1~2天,固定期间,更换固定液2~3次。
2、脱水:室温下①75%酒精浸泡3h;②95%酒精过夜;③无水乙醇ⅰ浸泡45min;④无水乙醇ⅱ浸泡45min;
45℃下①75%酒精浸泡30min;②95%酒精30min;③无水乙醇ⅰ浸泡30min;④无水乙醇ⅱ浸泡30min。根据组织大小、类型适当调整时间。
3、透明:
室温下①二甲苯ⅰ浸泡30min;②二甲苯ⅱ浸泡30min;
45℃下①二甲苯ⅰ浸泡15min;②二甲苯ⅱ浸泡15min。根据组织大小、类型适当调整时间。
4、浸蜡:将温度设置在略高于固体石蜡熔点,①蜡ⅰ浸泡1.5h;②蜡ⅱ浸泡1.5h;
5、包埋:通常以最大切面向下;用镊子轻压平整。
前处理后进行组织学切片he染色:
1、切片:采用石蜡切片机切片,厚度在3um~5um之间,依组织细胞密度、细胞大小决定厚度,睾丸卵巢等生殖器官切片厚度为3μm,小肠切片厚度4μm,肝脏、肾脏、肌肉切片厚度5μm,烘干。
2、脱蜡:分别采用二甲苯(ⅰ)浸泡6分钟、二甲苯(ⅱ)浸泡6分钟、50%二甲苯与50%酒精等体积混合后浸泡3分钟,所述两次浸泡所用的二甲苯分别编号为(ⅰ)、(ⅱ),回收,待步骤(9)中逆序重复使用。
3、依次采用体积浓度为100%酒精(ⅰ)2分钟、100%酒精(ⅱ)2分钟、90%酒精2分钟、80%酒精2分钟、70%酒精2分钟、50%酒精2分钟的梯度酒精水化至水2分钟。水化所用的梯度酒精分别回收,于步骤(5)中重复使用,所用的两份100%酒精分别编号为(ⅰ)、(ⅱ),回收,于步骤(7)中逆序重复使用。
4、采用实施例1制备的天青石蓝溶液浸泡5分钟。
5、采用实施例2制备的苏木素染液染色至合适时间:睾丸卵巢等生殖器官切片:3分钟,小肠切片:4分钟,肝脏、肾脏、肌肉切片:5分钟。
6、水流冲洗至蓝化约4分钟。
7、梯度酒精脱水:依次采用步骤3中回收的体积浓度为50%(ⅱ)、70%、80%、90%、100%(ⅱ)、100%(ⅰ)酒精脱水、其中50%(ⅱ)酒精为向50%酒精(ⅰ)中加入浓度为6%的乙酸(每100ml体系中乙酸和50%酒精体积比6ml:94ml)。
8、采用实施例3制备的伊红染液染色5秒。
9、采用步骤2回收的二甲苯透明两次:二甲苯(ⅱ)3分钟、二甲苯(ⅰ)3分钟。
10、封片:采用中性树胶作为粘合剂,轻轻扣压,均匀且无气泡封片。
实施例5采用用传统he染色方法处理以上组织:
1、切片:根据实验需要将目的组织切至不同厚度3~5μm不等,其中睾丸卵巢等生殖器官切片厚度为3μm,小肠切片厚度4μm,肝脏、肾脏、肌肉切片厚度5μm。
2、脱蜡(二甲苯(ⅰ)15分钟、二甲苯(ⅱ)15分钟、50%二甲苯+50%酒精等体积混合后浸泡2分钟依次更换溶液脱蜡)
3、梯度酒精(依次为100%(ⅰ)5分钟、100%(ⅱ)5分钟、85%酒精5分钟、75%酒精5分钟)至蒸馏水5分钟。
4、本发明苏木素染色5分钟。
5、水流冲洗10分钟。
6、1%盐酸乙醇30秒(盐酸和乙醇体积比1:99)
7、蒸馏水冲洗1分钟。
8、本发明5%伊红染色3分钟左右。
9、水洗30秒。
10、梯度酒精脱水(75%酒精1分钟、85%酒精1分钟、95%酒精(ⅰ)1分钟、95%酒精(ⅱ)1分钟、100%酒精(ⅱ)3分钟、100%酒精(ⅰ)3分钟)。
11、采用步骤2回收的二甲苯透明两次:二甲苯(ⅱ)3分钟、二甲苯(ⅰ)3分钟。
12、采用中性树胶作为粘合剂,轻轻扣压盖玻片,均匀且无气泡封片。
实施例6染色观察
对实施例4和实施例5分别制备的染色切片进行显微观察:实验结果显示该发明的染色方法染色效果显著改善。显微镜下可见细胞核成蓝色,核仁清晰;细胞质呈粉红色,染色质颗粒清晰可见。
本申请人从以下几个方面对传统染色和发明新染色方法的染色结果做如下对比:
表7为对实施例5传统染色和实施例4新发明染色方法的染色结果对比。
表7传统染色和新发明染色结果对比
从上表可见,发明新染色方法的染色效果更能清晰观察到组织的细胞膜和细胞核膜的边缘,核与质更加分明。图1为实施例4制备的小鼠睾丸组织he染色切片的显微观察图。
为增加该发明的染色效果的说服性及可靠性,我们借助图像分析系统中的光度学参数进行定量分析;光度学参数定量分析常用指标为光密度(od)又称吸光度,它指光线通过某溶液或物质前的入射强度(ia)与通过后的光线强度(ib)比值的对数,即:od=lg(ia/ib)。已有文献证明a=od(吸光度等于光密度)。od值越大则光线被吸收程度越大,物质的颜色就越深;反之,物质的吸光度越小,则光线被吸收的程度越少,物质的颜色越浅,可反映所含物质的量越低的状况。细胞内不同化学成分染色后有不同的吸收波长,因此即借助吸光度测量法检测细胞质某种物质的含量,并且我们在此基础上进一步计算细胞核与细胞质着色吸光度比及应用。
首先将实施例5传统he染色和实施例4制备的本发明he染色染出的不同组织的片子各挑出50张,每张片子拍摄5个不同的视野,光镜下统一放大倍数(10x20倍),使用image-proplus图像分析软件对图像进行综合形态测量分析,选择光密度,对选中阳性区域进行测定,获取结果并进行统计,使用spss20.0统计软件进行方差齐性分析及one-wayanova检验,并且p<0.05时认为差异具有统计学意义,统计结果用平均值加减标准误(mean±sem)表示,测定结果如下表8。
表8不同组织核质吸光度
通过统计学分析的结果及比较,进一步表明本发明的染色方法的着色效果较好,由上表可知,与常规染色方法相比,发明的新方法可以有效增强大多数组织的细胞核着色,并且有效减弱细胞质着色,使胞质中胞浆、肌纤维、红细胞、以及纤维素等呈现不同程度的红色,比如肌纤维呈现深粉色,红细胞呈现橘红色等,着色分明达到真正的精细化染色。参考表7可见与光学显微镜下观察的染色效果一致,胞核呈鲜艳的蓝色,核膜核仁清晰可见,分辨良好,胞浆粉红色,胞核胞浆对比鲜明。
实施例7传统方法和发明染色新方法在操作步骤及时间对比:
表9.传统方法和发明染色新方法对比:
将常规he染色方法和本发明所述he染色方法进行对比,结果如上实施例7表9所示,可以看出发明的he染色新方法染色过程的效率显著提高,用时比常规he染色要短。
实施例8传统方法和发明染色新方法主要实验耗材对比:
表10.传统方法和发明染色新方法对比:
注:通常每个梯度酒精体系为200ml体系,工业酒精单价:500ml/20元
将常规he染色方法和本发明所述he染色方法进行对比,结果如上实施例8表所示,常规he染色的梯度酒精被不同程度的污染,其中标红梯度酒精表示在该状态下,需要更换。而发明的he染色新方法染色的脱水环节,多次循环使用梯度酒精仍无颜色干扰,大大减少脱水过程中酒精的消耗,显著降低了实验成本,同时为保证脱水质量本发明中梯度酒精循环使用次数不超过15次。
以上仅是本发明的优选实施方式,该方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也是本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!