一种用于检测I型骨质疏松症的蛋白芯片及其制作方法与应用
本发明属于生物检测领域,具体的属于一种用于检测i型骨质疏松症的蛋白芯片及其制作方法与应用。
背景技术:
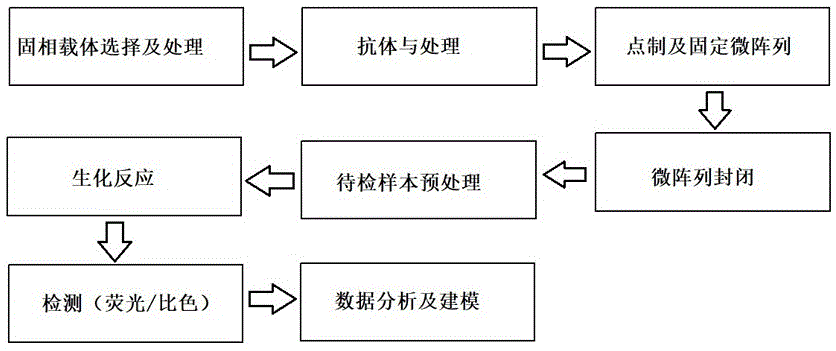
:随着社会经济的发展和生活水平的提高,我国已逐渐进入老龄化社会,骨质疏松的患病率逐年增加。我国老年人骨质疏松的患病率女性为90%,男性为61%,在全世界居常见病第六位。who认为骨质疏松症为心血管疾病之后,第二大致死的健康照顾问题。该疾病所导致的骨痛、骨病甚至骨折严重降低了中老年人的生活质量,且大大增加了患者的医疗费用,因而备受医疗和科研人员的重视。骨质疏松即骨质疏松症,是多种原因引起的一组骨病,骨组织有正常的钙化,钙盐与基质呈正常比例,以单位体积内骨组织量减少为特点的代谢性骨病变。在多数骨质疏松中,骨组织的减少主要由于骨质吸收增多所致。以骨骼疼痛、易于骨折为特征。临床表现为疼痛,原发性骨质疏松症最常见的症状,以腰背痛多见,占疼痛患者中的70%~80%。疼痛沿脊柱向两侧扩散,仰卧或坐位时疼痛减轻,直立时后伸或久立、久坐时疼痛加剧,弯腰、咳嗽、大便用力时加重。一般骨量丢失12%以上时即可出现骨痛。老年骨质疏松症时,椎体压缩变形,脊柱前屈,肌肉疲劳甚至痉挛,产生疼痛。新近胸腰椎压缩性骨折,亦可产生急性疼痛,相应部位的脊柱棘突可有强烈压痛及叩击痛。若压迫相应的脊神经可产生四肢放射痛、双下肢感觉运动障碍、肋间神经痛、胸骨后疼痛类似心绞痛。若压迫脊髓、马尾神经还影响膀胱、直肠功能。退行性骨质疏松症最常见和最严重的并发症。骨质疏松的检查在实验室层面上主要是如下几点:(1)血钙、磷和碱性磷酸酶在原发性骨质疏松症中,血清钙、磷以及碱性磷酸酶水平通常是正常的,骨折后数月碱性磷酸酶水平可增高。(2)血甲状旁腺激素应检查甲状旁腺功能除外继发性骨质疏松症。原发性骨质疏松症者血甲状旁腺激素水平可正常或升高。(3)骨更新的标记物骨质疏松症患者部分血清学生化指标可以反应骨转换(包括骨形成和骨吸收)状态,这些生化测量指标包括:骨特异的碱性磷酸酶(反应骨形成)、抗酒石酸酸性磷酸酶(反应骨吸收)、骨钙素(反应骨形成)、ⅰ型原胶原肽(反应骨形成)、尿吡啶啉和脱氧吡啶啉(反应骨吸收)、ⅰ型胶原的n-c-末端交联肽(反应骨吸收)。(4)晨尿钙/肌酐比值正常比值为0.13±0.01,尿钙排量过多则比值增高,提示有骨吸收率增加可能。其次是辅助检查,又分为以下几个方面,骨影像学检查和骨密度①摄取病变部位的x线片x线可以发现骨折以及其他病变,如骨关节炎、椎间盘疾病以及脊椎前移。骨质减少(低骨密度)摄片时可见骨透亮度增加,骨小梁减少及其间隙增宽,横行骨小梁消失,骨结构模糊,但通常需在骨量下降30%以上才能观察到。大体上可见椎体双凹变形,椎体前缘塌陷呈楔形变,亦称压缩性骨折,常见于第11、12胸椎和第1、2腰椎。②骨密度检测骨密度检测是骨折的预测指标。测量何部位的骨密度,可以用来评估总体的骨折发生危险度;测量特定部位的骨密度可以预测局部的骨折发生的危险性。在现有技术中,cn102534019a公开了一种试剂盒通过检测与骨质疏松症发生密切相关的5个单核苷酸多态性位点的基因型来筛查出容易患骨质疏松症的女性高危人群,并最终根据每一位受检者的基因检测结果从基因层面评估骨质疏松症易感的风险级别,指导更年期女性针对性的有效预防骨质疏松症的发生。近年来,对骨质疏松的诊断和检测的研究已渐深入。目前骨质疏松症检测方法主要只有骨密度包括双能x线,超声骨密度和腰椎定量ct(qct)等,临床上没有直接检测血清方法,只有通过骨生化标志物(骨形成指标和骨破坏指标)来进行综合的判定。蛋白芯片是一种高通量的蛋白功能分析技术,是近年发展起来的一项生物检测技术。利用这项技术,通过将大量抗体或抗原密集地点制在固相载体上,具有可同时检测多种蛋白质且样本需求量小的特点,对于高通量基因表达的研究具有非常重要的意义。但是,目前未见有关i型骨质疏松症的临床血清蛋白芯片检测产品。技术实现要素:本发明的目的在于为了解决目前未见有关i型骨质疏松症的临床血清蛋白芯片检测产品,而提供一种用于检测i型骨质疏松症的蛋白芯片。本发明的第二个目的是提供了该蛋白芯片。本发明的第三个目的是提供了该蛋白芯片的应用。为了实现上述目的,本发明采用以下技术方案:一种用于检测i型骨质疏松症的蛋白芯片,包括固相载体和阵列式分布于固相载体上的差异蛋白抗体,所述差异蛋白抗体包括:显著下调蛋白cystatin-b与leucine-richalpha-2-glycoprotein、显著上调蛋白calmodulin与talin-1、gla、ifn-γ、rab7a、tsp1、gas6、pinp及nmid。差异蛋白筛选:获取正常和绝经后骨质疏松症(i型)患者血清及外周血单核细胞,基于itraq蛋白质组学定量分析技术筛选i型骨质疏松症差异蛋白;层聚类及go富集分析确定i型骨质疏松症差异蛋白表达趋势及其参与的胞内主要生物途径;kegg通路注释确定差异蛋白参与调控的信号通路及蛋白互作网络;结合itraq筛选蛋白差异比率及文献报道,初步确定一些和骨质疏松、骨代谢等相关候选差异蛋白及与关键候选蛋白存在高度互作的蛋白分子;差异蛋白验证:结合elisa实验,在受试样本中验证候选差异蛋白。前期基于itraq发明人已经筛选到1321个差异蛋白,经过两步精准筛查(≥1.5倍以及≤0.8且p<0.01;结合文献调查),确定了四个显著性变化的蛋白:1)下调:cystatin-b和leucine-richalpha-2-glycoprotein(lrg1),它们均与促进骨形成和抑制骨吸收相关;2)上调:calmodulin和talin-1,均与促进破骨细胞的分化形成及骨吸收相关;为了蛋白芯片检测准确性和覆盖面广的特性,发明人扩大检索范围。基于数据库检索及分析结果,选取处于比值≥1.5倍以及≤0.6倍且p<0.05的差异蛋白;结合文献报道,进一步确定骨质疏松、骨代谢等相关的蛋白质,且差异处于≥1.5以及≤0.6范围(p<0.05)的差异蛋白,初步确定候选差异蛋白。同时,检测蛋白芯片中还加入经文献调研确定的一些i型骨质疏松症的血清蛋白标志物,例如:血清基质蛋白gla、ifn-γ、rab7a、tsp1、gas6、、pinp及nmid。作为优选,所述蛋白芯片还包括阳性对照和阴性对照作为优选,所述固相载体为玻璃载片、滴定板或滤膜。作为优选,所述蛋白芯片是分别将差异蛋白抗体、阳性对照和阴性对照利用点制基因微阵列商品化点样仪或喷膜法点制到固相载体上。作为优选,所述差异蛋白抗体、阳性对照和阴性对照点样3-5个重复。一种用于检测i型骨质疏松症的蛋白芯片,所述制作方法包括以下步骤:1)固相载体及其处理:使用琼脂糖膜处理固相载体,所述固相载体上设置有阴性控制孔与阳性控制孔;2)蛋白质预处理:将差异蛋白抗体溶解;3)点制微阵列:将步骤2)得到的差异蛋白抗体、阳性对照和阴性对照利用点制基因微阵列商品化点样仪或喷膜法点制到固相载体上,每个差异蛋白抗体、阳性对照和阴性对照点样3-5个重复;4)固定微阵列:使用链霉亲和素于步骤3)得到的固相载体上;5)封闭微阵列:待差异蛋白抗体微阵列固定后,使用bsa或者甘油进行芯片封闭,静置后得到蛋白芯片。作为优选,所述差异蛋白抗体包括:显著下调蛋白cystatin-b与leucine-richalpha-2-glycoprotein、显著上调蛋白calmodulin与talin-1、gla、ifn-γ、rab7a、tsp1、gas6、pinp及nmid。一种用于检测i型骨质疏松症的蛋白芯片的应用,获取样本后,将样本用生物素标记,与权利要求1所述的蛋白芯片共孵育,经过化学耦合后,再加入目标蛋白的生物素标记抗体;反应结束后,结合荧光和比色扫描,检测hrp-链霉亲和素或荧光素-链霉亲和素芯片信号,结合系统软件,将数据进行图像量化,标准化,并建立一定计算模型,执行数据分析和建模;采用spss22.0统计软件进行统计分析,计量资料采用均数±标准差表示,并采用独立样本t检验进行统计分析,计数资料采用卡方检验。以p<0.05为差异有统计学意义,差异标准:auc>0.7。本发明的有益效果是:本发明基于itraq蛋白定量组学分析i型骨质疏松症患者血清和外周血单核细胞中差异蛋白。itraq蛋白定量技术具有灵敏性高,可同时执行多个样本的检测,避免了多次质谱之间的组间差异。因此,本发明筛选的i型骨质疏松症患者中的候选差异蛋白具有高度可信性。本发明1)所需样本量极少(10-100微升);2)有高的信噪比,高准确性、灵敏性(单克隆抗体);3)快速、微型化和自动化(3小时内);4)可通过标准曲线进行定量检测;因此,本发明研发的产品将大大提高临床诊断i型骨质疏松症患者的准确率及效率,具有很强的应用创新性及十分重要的临床研究意义。附图说明图1是本发明蛋白芯片操作流程图。图2是cystatin-b的roc曲线图。图3是lrg1的roc曲线图。图4是calmodulin的roc曲线图。图5是talin-1的roc曲线图。具体实施方式下面将结合实验数据及附图对本发明的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施方式,而不是全部的实施方式。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施方式,都属于本发明保护的范围。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用。实施例1差异蛋白筛选选择正常和i型骨质疏松症(各10例)患者,正常组是结合who骨量判定标准为骨量正常组,且无其他慢性疾病及骨代谢相关疾病;所有入组群体均获得患者知情同意书,且经伦理委员会批准。入组标准:1)绝经后女性;2)近3个月内均未使用过降钙素、钙剂及维生素d类药物;3)结合who骨质疏松诊断标准定义骨质疏松症;排除标准:1)排除患有糖尿病、甲状腺、肝、肾等代谢性骨病所致的继发性骨质疏松因素;2)骨转移性疾病患者;3)使用皮质醇或镇静剂超过6个月或接受过激素替代疗法患者;4)过去一年内患有消化系统疾病:胃溃疡、吸收不良、局部性肠炎,或者其他会造成营养吸收障碍的慢性疾病。样本获取、处理及分组样本获取及处理:获取正常和i型骨质疏松症患者外周血15ml,留取10ml血液使用ficol淋巴细胞分离液分离人pbmc(注:取血后,2h内分离最好,最长不宜超过6h),并提取pbmc蛋白。留取5ml,37度孵育30min,高速离心后(1500rpm/min,15min),收集上清液,结合白蛋白去除试剂盒(bio-rad),基于亲和树脂特异性去除血清中高丰度的白蛋白,用于后续蛋白组学检测。研究分组:1)正常组血清2)正常组外周血单核细胞3)疾病组血清4)疾病组外周血单核细胞。itraq蛋白质组学定量技术将上述几组蛋白经过还原、封闭及定量后,用胰蛋白酶酶切;各组样本的肽段混合物分别用不同的itraq试剂标记(141-121);等量混合各样本中的标记肽段后,结合ms/ms质谱检测;不同样本中蛋白质的差异表达可通过二级质谱中itraq试剂的峰面积确定,根据该肽段的二级质谱峰图,结合数据库检索,得到蛋白的定性信息。结合数据库检索和火山图构建等初步确定几组样本中存在的差异蛋白,包括上调和下调显著的差异蛋白。候选差异蛋白筛选前期基于itraq已经筛选到1321个差异蛋白,经过两步精准筛查(≥1.5倍以及≤0.8且p<0.01;结合文献调查),确定了四个显著性变化的蛋白:1)下调:cystatin-b和leucine-richalpha-2-glycoprotein(lrg1),它们均与促进骨形成和抑制骨吸收相关;2)上调:calmodulin和talin-1,均与促进破骨细胞的分化形成及骨吸收相关;为了蛋白芯片检测准确性和覆盖面广的特性,扩大检索范围。基于数据库检索及分析结果,选取处于比值≥1.5倍以及≤0.6倍且p<0.05的差异蛋白;结合文献报道,进一步确定骨质疏松、骨代谢等相关的蛋白质,且差异处于≥1.5以及≤0.6范围(p<0.05)的差异蛋白,初步确定一些候选差异蛋白。选择表1的蛋白进行对比。表1、选取结果proteinaccessionproteinnamegenenamemw[kda]scorecoverage[%]#uniquepeptidesa0m8q6iglambda-7chaincregioniglc711.3035.977952.83a6nhl2tubulinalphachain-like3tubal349.9083.11678.51b1ajz9forkhead-associateddomain-containingprotein1fhad1161.92.70182.33o00159unconventionalmyosin-icmyo1c121.687.51514.65p04080cystatin-bcstb11.13918.05945.93p02750leucine-richalpha-2-glycoproteinlrg138.17717.0614.15p62158calmodulincalm116.837323.3161.112q9y490talin-1tln1269.76323.3145.799结果见表2。表2、对比结果genenamea1a2a3b1b2b3c1c2c3a/bratioa/bpvaluea/cratioa/cpvalueb/cratiob/cpvalueiglc70.3441.7860.870tubal31.000fhad11.0421.0590.899myo1c0.9060.9351.159cstb1.4701.5432.1210.4840.2980.5060.6770.9130.9873.9870.0172971.9920.0369750.5000.023983lrg10.6070.5840.6390.8400.8470.8441.7741.3551.5080.7230.0041450.3950.0154470.5460.029033calm10.9290.8560.8371.1881.0631.0410.9760.9961.1150.7960.0205660.8490.0481.0660.339209tln10.7790.8020.7891.1031.0271.0511.1561.1511.1410.7450.0040570.6875.22e-060.9230.053043由表2可见,1)下调:cystatin-b和leucine-richalpha-2-glycoprotein(lrg1),它们均与促进骨形成和抑制骨吸收相关;2)上调:calmodulin和talin-1,均与促进破骨细胞的分化形成及骨吸收相关,特异性较好。层聚类及go富集分析层聚类及go富集分析确定i型骨质疏松症差异蛋白表达趋势及其参与的胞内主要途径;层聚类分析是一种常用的探索性数据分析方法,其目的是在相似性的基础上对数据进行分组、归类。在聚类分析过程中,聚类算法会对样本(sample)和变量(variable,在蛋白质组学研究中通常指蛋白质的定量信息)两个维度进行分类。对四组样本的聚类结果帮助,发明人从蛋白质集合中区分具有不同表达模式的蛋白质子集合,具有相近表达模式的蛋白质可能具有相似的功能或者参与相同的生物学途径,或者在调控骨代谢通路中处于临近的调控位置。go功能注释结果主要鉴定差异蛋白参与的信号转导、细胞通讯和骨蛋白质代谢等胞内途径。进一步帮助精确筛选候选蛋白标志物。kegg通路注释在生物体中,蛋白质并不独立行使其功能,而是不同蛋白质相互协调完成一系列生化反应以行使其生物学功能。因此,通路分析是更系统、全面地了解细胞的生物学过程、性状或疾病的发生机理、药物作用机制等最直接和必要的途径。对差异蛋白集合进行基于kegg数据库通路的注释帮助发明人进一步筛选参与绝经后骨质疏松症患者骨代谢/吸收等途径的差异蛋白;及差异蛋白在骨代谢/吸收通路中存在的互作情况。同时确定关键候选蛋白(比值≥2.5倍以及≤0.8倍且p<0.01)存在高度互作的蛋白分子。统计分析数据采用spss22.0统计软件进行统计分析,计量资料采用均数±标准差表示,并采用独立样本t检验进行统计分析,计数资料采用卡方检验。蛋白峰采用flexanalysis3.3标峰软件及clinprotools统计软件进行统计分析,经anderson-darling检验,数据呈非正态分布,故选用wilcoxon检验,以p<0.05为差异有统计学意义,差异峰标准:差异倍数≥1.5和≤0.8。i型骨质疏松症和差异蛋白标志物关联性分析研究对象选取正常和i型骨质疏松患者各200例,入组及排除原则同前面部分。样本获取、处理及分组获取正常和i型骨质疏松症患者外周血15ml,留取10ml血液使用ficol淋巴细胞分离液分离人pbmc(注:取血后,2h内分离最好,最长不宜超过6h),并提取pbmc蛋白。留取5ml,37度孵育30min,高速离心后(1500rpm/min,15min),收集上清液,结合白蛋白去除试剂盒(bio-rad),基于亲和树脂特异性去除血清中高丰度的白蛋白,用于后续蛋白组学检测。研究分组:1)正常组血清2)正常组外周血单核细胞3)疾病组血清4)疾病组外周血单核细胞。elisa检测获取入组群体(200例正常/200例患者)的血清和单核细胞样本,结合elisa试剂盒说明检入组群体中候选差异蛋白表达模式。临床信息收集结合临床记录数据,获取入组群体的临床资料,主要包括a:一般人口学情况(年龄、性别、身高、体重、职业、文化程度、婚姻状况等);b:骨质疏松症疾病等级;c:行为因素(吸烟、饮酒等),对上述各组群体进行相关资料统计分析。关联性分析使用epidata3.1软件建立数据库,对所有的数据经反复检查、核对后进行双份录入,并逻辑核错。采用sas软件进行统计分析。计量资料间比较进行t检验,分类资料间比较采用χ2检验,对各个临床相关因素和候选差异蛋白表达模式进行单因素logistic回归分析;在此基础上进行临床因素、差异蛋白表达模式及骨质疏松症病理状况等进行多因素非条件logistic回归筛选,结果展示各因素的回归系数(β)、标准误、p值、or值及其95%可信区间(ci)利用在线及spss等软件进行相关性分析。roc曲线分析roc曲线绘制:依据专业知识,对疾病组和正常组候选差异蛋白测定结果进行分析,确定测定值的上下限、组距以及截断点(cut-offpoint),按选择的组距间隔列出累积频数分布表,分别计算出所有截断点的敏感性、特异性和假阳性率(1-特异性)。以敏感性为纵坐标代表真阳性率,(1-特异性)为横坐标代表假阳性率,作图绘成roc曲线。roc曲线除了针对单个候选蛋白的敏感性和特异性进行分析;还针对多个候选蛋白联合作为诊断i型骨质疏松症的灵敏性和特异性。roc曲线评价统计量计算。roc曲线下的面积值在1.0和0.5之间。在auc>0.5的情况下,auc越接近于1,说明诊断效果越好。auc在0.5~0.7时有较低准确性,auc在0.7~0.9时有一定准确性,auc在0.9以上时有较高准确性。auc=0.5时,说明诊断方法完全不起作用,无诊断价值。auc<0.5不符合真实情况,在实际中极少出现。参照图2、图3、图4与图5,可见:cystatin-b:auc=0.918(0.884to0.952),auc=0.759(0.691to0.827);lrg1:auc=0.759(0.691to0.827);calmodulin:auc=0.752(0.690to0.814)talin-1:auc=0.838(0.788to0.888)。统计分析数据采用spss22.0统计软件进行统计分析,计量资料采用均数±标准差表示,并采用独立样本t检验进行统计分析,计数资料采用卡方检验。以p<0.05为差异有统计学意义。差异标准:auc>0.7。实施例2蛋白芯片制作:固相载体及其处理载体选择必须符合1)表面有可以进行化学反应的活性基团;2)使单位载体上结合的蛋白质分子达到最佳容量;有足够的稳定性;具有良好的生物兼容性。一般载体包括滴定板、滤膜、凝胶及载玻片,常用的则是载玻片。固相载体首先用琼脂糖膜处理。蛋白质预处理选择具有高纯度和完好生物活性的候选差异蛋白抗体进行溶解。点制微阵列将预处理好的候选差异蛋白抗体利用点制基因微阵列商品化点样仪或喷膜法,按照既定顺序点制到固相载体上。每个目的蛋白抗体点样3-5个重复。且需设置阴性和阳性控制孔。点间距为4.5mm,点的直径250μm阴性对照(normaligg),阳性对照(anti-rnapolymeraseii)。差异蛋白抗体包括:显著下调蛋白cystatin-b与leucine-richalpha-2-glycoprotein、显著上调蛋白calmodulin与talin-1、gla、ifn-γ、rab7a、tsp1、gas6、pinp及nmid。固定微阵列载玻片等固相载体需要基于化学修饰产生醛基固定蛋白,常用为:链霉亲和素。封闭微阵列差异蛋白抗体微阵列固定后,用bsa或者甘油进行芯片封闭,静置后待用。实施例3参照图1,蛋白芯片的应用验证:随机获取正常和i型骨质疏松症患者的血清,经生物素标记后和蛋白芯片共孵育,再加入目标蛋白的生物素标记抗体,最后,基于hrp-链霉亲和素或荧光素-链霉亲和素检测芯片信号,用于判定候选标志物表达水平样本获取、处理及分组获取正常和i型骨质疏松症患者外周血15ml,留取10ml血液使用ficol淋巴细胞分离液分离人pbmc(注:取血后,2h内分离最好,最长不宜超过6h),并提取pbmc蛋白。留取5ml,37℃孵育30min,高速离心后(1500rpm/min,15min),收集上清液,结合白蛋白去除试剂盒(bio-rad),基于亲和树脂特异性去除血清中高丰度的白蛋白,用于后续蛋白组学检测。研究分组:1)正常组血清2)正常组外周血单核细胞3)疾病组血清4)疾病组外周血单核细胞。蛋白芯片孵育获取入组群体(200例正常/200例患者)的血清和单核细胞样本,将样品用生物素标记后,与蛋白芯片共孵育;经过化学耦合后,再加入目标蛋白的生物素标记抗体,严格控制反应温度和时间;最后,终止反应并清洗蛋白芯片;荧光检测设置参数,结合荧光和比色扫描,检测hrp-链霉亲和素或荧光素-链霉亲和素芯片信号。结合系统软件,将数据进行图像量化,标准化,并建立一定计算模型,执行数据分析和建模。确定蛋白芯片准确性结合蛋白芯片及前面两部分elisa检测结果,评估该蛋白芯片的准确性及作为诊断i型骨质疏松症的灵敏性和特异性。统计分析数据采用spss22.0统计软件进行统计分析,计量资料采用均数±标准差表示,并采用独立样本t检验进行统计分析,计数资料采用卡方检验。以p<0.05为差异有统计学意义。差异标准:auc>0.7。以上对本发明的具体实施例进行了详细描述,但其只作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1