鲜鱼腥草药材的UPLC特征图谱建立方法和检测方法与流程
本发明涉及中药质量检测技术领域,特别是涉及一种鲜鱼腥草药材的uplc特征图谱建立方法和检测方法。
背景技术:
鲜鱼腥草为三白草科植物蕺菜(houttuyniacordatathunb.)的新鲜全草,研究表明,鲜鱼腥草药材含有挥发油、有机酸类、黄酮类、酚类和生物碱类等化合物,具有清热解毒、消痈排脓、利尿通淋的功效,主要用于肺脓疡、痰热咳嗽、热痢热淋、痈疮肿毒等症,是卫生部正式确定的“药膳兼用型”植物资源之一,也是历版《中国药典》收载的常见的鲜品中药材,具有广阔的经济和药用价值。但2015年版《中国药典》仅规定了鲜鱼腥草药材的性状及薄层鉴别,尚未规定其指标成分的含量检测项,不利于鲜鱼腥草的质量控制。
就目前的技术发展而言,以单一成分作为评价指标已不能全面反映鲜鱼腥草药材的质量,通过建立指纹或特征图谱则可较为全面表征其整体化学成分特征信息。现有的针对鱼腥草的特征图谱大多是针对干鱼腥草或干鱼腥草制剂的,而鲜鱼腥草是中国药典规定的鱼腥草项下有别于干鱼腥草的一种鲜品中药材,相较于干鱼腥草,鲜鱼腥草现采即用,未经任何加工处理,有效成分得以最大程度的保留,特征图谱所反映化学成分信息也存在差异。且目前关于鱼腥草指纹(或特征)图谱的检测均采用的是高效液相色谱法(hplc),检测耗时较长(30~90分钟)、试剂用量大、检测成本高,不利于全面推广应用。
技术实现要素:
基于此,有必要提供一种鲜鱼腥草药材的uplc特征图谱建立方法。该方法能够构建鲜鱼腥草药材的特征图谱,填补了现有技术的空白,且质量检测全面、可靠,同时用时较短,便于大规模推广应用。
一种鲜鱼腥草药材的uplc特征图谱建立方法,包括如下步骤:
对照品溶液的制备:取新绿原酸、绿原酸、隐绿原酸、芦丁、金丝桃苷、异槲皮苷和槲皮苷对照品,加溶剂溶解,得对照品溶液;
供试品溶液的制备:取鲜鱼腥草药材,切碎后加入体积分数为70~95%的甲醇水溶液或甲醇进行提取,提取液过滤,取续滤液,得供试品溶液;
将所述对照品溶液和供试品溶液注入超高效液相色谱仪中进行检测,所述超高效液相色谱仪采用的流动相a为乙腈,流动相b为体积分数为0.05~0.15%的磷酸水溶液,洗脱方式为梯度洗脱。
在其中一个实施例中,所述梯度洗脱包括如下程序:
0~7min,流动相a的体积百分比由5%上升至11%;
7~10min,流动相a的体积百分比由11%上升至11.5%;
10~13min,流动相a的体积百分比由11.5%上升至20%;
13~20min,流动相a的体积百分比由20%上升至25%。
在其中一个实施例中,所述超高效液相色谱仪的条件包括:
色谱柱:以十八烷基硅烷键合硅胶为填充剂;检测波长:200~400nm;流速:0.25~0.35ml/min;柱温:25~35℃。
在其中一个实施例中,所述检测波长采用程序波长:0~13分钟为326nm,13~20分钟为254nm。
在其中一个实施例中,所述流速为0.3ml/min;所述柱温为30℃。
在其中一个实施例中,所述供试品溶液的制备中,所述提取的溶剂为体积分数为85~95%的甲醇水溶液,所述提取的方法为回流提取,所述提取的时间为25~35min。
在其中一个实施例中,所述对照品溶液的制备中,所述溶解采用的溶剂与所述供试品溶液的制备中所述提取的溶剂一致。
在其中一个实施例中,所述特征图谱包含10个共有峰,10个共有峰中包括新绿原酸、绿原酸、隐绿原酸、芦丁、金丝桃苷、异槲皮苷和槲皮苷的特征峰。
一种鲜鱼腥草药材的特征图谱和指标成分含量同步检测方法,包括如下步骤:
按照如上所述的建立方法构建所述鲜鱼腥草药材的uplc特征图谱;
指标成分对照品溶液的制备:取绿原酸、金丝桃苷和槲皮苷对照品,加溶剂溶解,配置成不同浓度的指标对照品溶液;
待测样品溶液的制备:取待测鲜鱼腥草药材,切碎后加入体积分数为70~95%的甲醇水溶液或甲醇进行提取,提取液过滤,取续滤液,得待测样品溶液;
将所述不同浓度的指标成分对照品溶液分别注入超高效液相色谱仪中进行检测,并构建指标成分的浓度-峰面积标准曲线;将所述待测样品溶液注入超高效液相色谱仪中进行检测,并将检测图谱与所述鲜鱼腥草药材的uplc特征图谱和指标成分的浓度-峰面积标准曲线进行比较。
其中,所述超高效液相色谱仪采用的流动相a为乙腈,流动相b为体积分数为0.05~0.15%的磷酸水溶液,洗脱方式为梯度洗脱。
在其中一个实施例中,所述梯度洗脱包括如下程序:
0~7min,流动相a的体积百分比由5%上升至11%;
7~10min,流动相a的体积百分比由11%上升至11.5%;
10~13min,流动相a的体积百分比由11.5%上升至20%;
13~20min,流动相a的体积百分比由20%上升至25%。
在其中一个实施例中,所述超高效液相色谱仪的条件包括:
色谱柱:以十八烷基硅烷键合硅胶为填充剂;检测波长:200~400nm;流速:0.25~0.35ml/min;柱温:25~35℃。
在其中一个实施例中,所述检测波长采用程序波长:0~13分钟为326nm,13~20分钟为254nm。
在其中一个实施例中,所述流速为0.3ml/min;所述柱温为30℃。
在其中一个实施例中,所述待测样品溶液的制备中,所述提取的溶剂为体积分数为85~95%的甲醇水溶液,所述提取的方法为回流提取,所述提取的时间为25~35min。
在其中一个实施例中,所述对照品溶液的制备中,所述溶解采用的溶剂与所述待测样品溶液的制备中所述提取的溶剂一致。
与现有技术相比,本发明具有如下有益效果:
本发明的鲜鱼腥草药材的uplc特征图谱建立方法可以建立获得鲜鱼腥草药材的特征图谱,全面地反映鲜鱼腥草药材的主要化学成分信息,且质量检测全面、可靠,同时用时较短,便于大规模推广应用。
本发明的鲜鱼腥草药材的检测方法,可以全面的反映鲜鱼腥草药材的主要化学成分信息,同时还可以准确测定鲜鱼腥草药材中主要成分绿原酸、金丝桃苷和槲皮苷的含量,便于对鲜鱼腥草药材的质量进行全面监控,同步进行定性和定量分析,填补当前药材质量标准中含量检测项的空白,利于鲜鱼腥草药材的质量控制与评价,为鲜鱼腥草药材质量标准的提升提供了参考。且该检测方法操作简便、耗时较短、精密度高、准确度高、稳定性好、重现性好,便于大规模推广应用。
附图说明
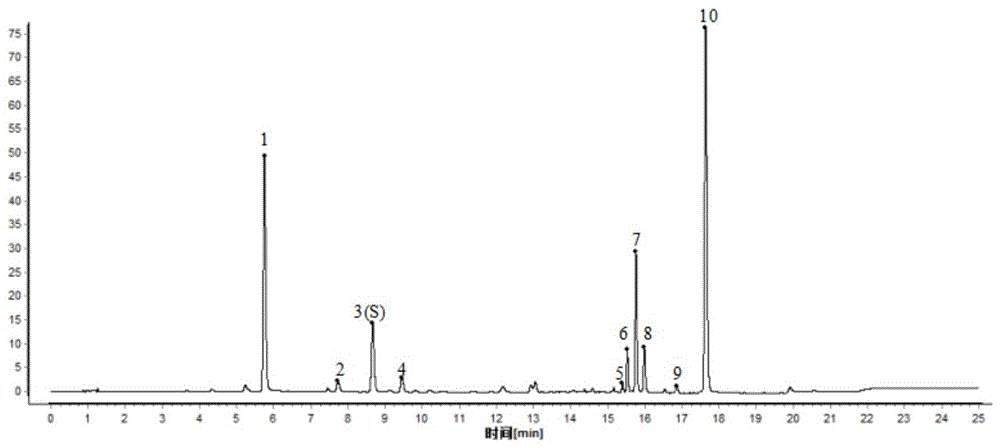
图1为本发明一实施例中的鲜鱼腥草药材的特征图谱(峰1:新绿原酸;峰3(s):绿原酸;峰4:隐绿原酸;峰6:芦丁;峰7:金丝桃苷;峰8:异槲皮苷;峰10:槲皮苷);
图2为上述特征图谱建立过程中吸收波长考察的3d色谱图;
图3为上述特征图谱建立过程中吸收波长考察的色谱图;
图4为上述特征图谱建立过程中流动相考察的色谱图;
图5为上述特征图谱建立过程中柱温考察的色谱图;
图6为上述特征图谱建立过程中流速考察的色谱图;
图7为上述特征图谱建立过程中整体性考察的色谱图;
图8为上述特征图谱建立过程中提取溶剂考察的色谱图;
图9为上述特征图谱建立过程中提取方式考察的色谱图;
图10为上述特征图谱建立过程中提取溶剂用量考察的色谱图;
图11为上述特征图谱建立过程中提取时间考察的色谱图;
图12为上述特征图谱建立过程中鲜鱼腥草色谱峰(特征峰)指认色谱图;
图13为上述特征图谱建立过程中色谱柱耐用性考察的色谱图;
图14为17批鲜鱼腥草药材的特征图谱;
图15为本发明一实施例建立的鲜鱼腥草药材的检测方法的专属性考察的色谱图;
图16为上述鲜鱼腥草药材的三种对照品(绿原酸、金丝桃苷和槲皮苷)的标准曲线图。
具体实施方式
以下结合具体实施例对本发明的鲜鱼腥草药材的uplc特征图谱建立方法和检测方法作进一步详细的说明。
本发明的实施例中采用的仪器和试药如下:
1、仪器
超高效液相色谱仪:watersh-classuplc、thermovanquishuplc、agilentinfinity1290uplc。
电子天平:me203e、me204e、xp26(mettlertoledo公司)。
超纯水机:miliqdirect8(默克密理博公司)。
色谱柱:watersacquityhsst3(2.1mm×100mm,1.8μm)、agilentsbc18(2.1mm×100mm,1.8μm)、agilenteclipesplusc18(2.1mm×100mm,1.8μm)。
2、试药
乙腈、磷酸为色谱纯,水为超纯水;其余实际均为分析纯。
新绿原酸(四川省维克奇生物科技有限公司,批号:wkq18030107);绿原酸(中国食品药品检定研究院,批号:110753-201817);隐绿原酸(四川省维克奇生物科技有限公司,批号:wkq16081903);芦丁(中国食品药品检定研究院,批号:100080-201811);金丝桃苷(中国食品药品检定研究院,批号:111521-201708);异槲皮苷(中国食品药品检定研究院,批号:111809-201804);槲皮苷(中国食品药品检定研究院,批号:111538-201606)。
鲜鱼腥草药材:(批号y1、y2、y3、y4、y5、y6、y7、y8、y9、y10、y11、y12、y13、y14、y15、y16、y17)。
如无特别说明,本发明实施例中的百分比均为体积百分比。
实施例1鲜鱼腥草药材的特征图谱的建立方法
所述建立方法的步骤如下:
1)对照品参照物溶液制备:取新绿原酸对照品、绿原酸对照品、隐绿原酸对照品、芦丁对照品、金丝桃苷对照品、异槲皮苷对照品和槲皮苷对照品适量,精密称定,分别加90%甲醇水溶液制成每1ml含50μg的对照品参照物溶液,即得。
2)供试品溶液制备:取鲜鱼腥草药材2.0g,精密称定,置具塞锥形瓶中,精密加入90%甲醇水溶液50ml,密塞,称定重量,加热回流30分钟,放冷,再称定重量,用90%甲醇水溶液补足减失的重量,摇匀,滤过,取续滤液,即得。
3)检测:分别吸取对照品参照物溶液、供试品溶液各1μl,注入超高效液相色谱仪,色谱条件如下:
以十八烷基硅烷键合硅胶为填充剂(watersacquityhsst3色谱柱,柱长为100mm,内径为2.1mm,粒径为1.8μm);以乙腈为流动相a,0.1%磷酸水溶液为流动相b,按下表1中的规定进行梯度洗脱;流速为每分钟0.3ml;柱温为30℃;检测波长为0~13分钟为326nm,13~25分钟为254nm。理论板数按绿原酸峰计算应不低于30000。
表1
4)结果:建立获得的特征图谱中应呈现10个特征峰,与绿原酸参照物峰相应的峰为s峰,计算各特征峰与s峰的相对保留时间,其相对保留时间应在规定值的±10%范围之内,规定值为:0.66(新绿原酸)、0.89(峰2)、1.09(隐绿原酸)、1.78(峰5)、1.80(芦丁)、1.82(金丝桃苷)、1.85(异槲皮苷)、1.95(峰9)、2.04(槲皮苷)。(见图1和表2)
表2
1、色谱条件与系统适应性试验
吸收波长考察:利用pda检测器对供试品溶液进行全波长扫描,并分别在254nm、326nm、280nm以及程序波长(0~13分钟为326nm,13~25分钟为254nm)下采集供试品溶液的色谱图,对采集的色谱图进行比较,确定最佳波长。结果表明,采用程序波长检测方式,色谱峰峰型好,且主要色谱峰吸收强度高,因此选择程序波长检测方式。(见图2、图3)
流动相考察:考察了3种不同流动相的分离效果,以乙腈为流动相a,分别以0.1%磷酸水、0.1%甲酸水、0.2%醋酸水为流动相b,进行梯度洗脱。结果表明,比较3种不同流动相,发现乙腈-0.1%磷酸和乙腈-0.1%甲酸的梯度洗脱效果整体相差不大,各色谱峰的分离效果和峰型相当,但是乙腈-0.2%醋酸为流动相时,峰1(新绿原酸)出现裂峰。考虑到采用乙腈-0.1%磷酸水为流动相,色谱柱耐受性好,且色谱图基线平稳,最终确定0.1%磷酸水作为流动相。
(见图4)
柱温考察:在以上拟定的实验条件基础上,分别对柱温为28℃、30℃、32℃时进行考察。
(见图5和表3)
表3
结果表明,在柱温为30℃时,色谱图峰形较好,分离度适中。故柱温确定为30℃。
流速考察:在以上拟定的实验条件基础上,分别对流速为0.28ml/min、0.3ml/min、0.32ml/min时进行考察。(见图6和表4)
表4
结果表明,在流速为0.3ml/min时,色谱图峰形较好,分离度适中。故流速确定为0.3ml/min。
整体性考察:在以上拟定的实验条件基础上,将色谱峰采集时间延长至50min。20分钟后,仍以25%乙腈等度洗脱至50分钟,发现20分钟之后已无色谱峰出现。故色谱图采集20分钟时,色谱信息已采集完全。将色谱图采集时间确定为20分钟。(见图7)
综上所述,鲜鱼腥草药材特征图谱色谱条件与系统适应性试验确定为:以十八烷基硅烷键合硅胶为填充剂(watersacquityhsst3色谱柱,柱长为100mm,内径为2.1mm,粒径为1.8μm);以乙腈为流动相a,0.1%磷酸水溶液为流动相b,按表1中的规定进行梯度洗脱;流速为每分钟0.3ml;柱温为30℃;检测波长为0~13分钟为326nm,13~25分钟为254nm。理论板数按绿原酸峰计算应不低于30000。
2、供试品溶液的制备考察
提取溶剂考察:取鲜鱼腥草药材2.0g,精密称定,置具塞锥形瓶中,分别精密加入50%甲醇水溶液、90%甲醇水溶液、甲醇、70%乙醇水溶液、乙醇25ml,密塞,称定重量,超声处理30分钟(功率250w,频率40khz),放冷,再称定重量,分别用提取溶剂补足减失的重量,摇匀,滤过,取续滤液,即得。(见图8和表5)
表5
结果表明,90%甲醇水溶液提取效果较好,故确定提取溶剂为90%甲醇水溶液。
提取方式考察:取鲜鱼腥草药材2.0g,精密称定,置具塞锥形瓶中,精密加入90%甲醇水溶液25ml,密塞,称定重量,分别采用回流和超声提取30min,放冷,再称定重量,用90%甲醇水溶液补足减失的重量,摇匀,滤过,取续滤液,即得。(见图9和表6)
表6
结果表明,回流提取效果较好,故确定提取方式为回流提取。
提取溶剂用量考察:取鲜鱼腥草药材2.0g,精密称定,置具塞锥形瓶中,分别精密加入90%甲醇水溶液25ml、50ml、75ml,密塞,称定重量,加热回流30分钟,放冷,再称定重量,分别用提取溶剂补足减失的重量,摇匀,滤过,取续滤液,即得。(见图10和表7)
表7
结果表明,提取溶剂用量为50ml、75ml时,二者特征图谱的差异不大,提取效果均略优于25ml,基于节约溶剂考虑,故确定提取溶剂用量为50ml。
提取时间考察:取鲜鱼腥草药材2.0g,精密称定,置具塞锥形瓶中,精密加入90%甲醇水溶液50ml,密塞,称定重量,分别加热回流15min、30min、45min、60min,放冷,再称定重量,用90%甲醇水溶液补足减失的重量,摇匀,滤过,取续滤液,即得。(见图11和表8)
表8
结果表明,提取时间为30分钟时,提取效果最好,故提取时间确定为30分钟。
综上所述,鲜鱼腥草药材特征图谱供试品溶液的制备方法确定为:取鲜鱼腥草药材2.0g,精密称定,置具塞锥形瓶中,精密加入90%甲醇水溶液50ml,密塞,称定重量,加热回流30分钟,放冷,再称定重量,用90%甲醇水溶液补足减失的重量,摇匀,滤过,取续滤液,即得。
3、色谱峰指认
供试品溶液的制备:按拟定实验方法制备鲜鱼腥草药材供试品溶液。
阴性对照品溶液的制备:按拟定实验方法制备缺鲜鱼腥草药材的阴性对照溶液。
对照品参照物溶液的制备:取新绿原酸、绿原酸、隐绿原酸、芦丁、金丝桃苷、异槲皮苷、槲皮苷对照品适量,分别加90%甲醇水溶液分别配制成每1ml含40μg的对照品参照物溶液。对鲜鱼腥草药材特征图谱峰进行定位,即可知对应峰处即为相应的组分特征峰。(见图12)
4、方法学验证
精密度试验:取鲜鱼腥草药材约2.0g,精密称定,按拟定实验方法进行供试品溶液的制备及测定,连续进样6次,结果见表9和10。
表9
表10
结果表明,连续进样6次,各特征峰的相对保留时间rsd在0.00%~0.65%范围内,相对峰面积的rsd在0.21%~1.63%范围内,表明该特征图谱的精密度较好。
重复性试验:精密称取鲜鱼腥草药材6份,按拟定实验方法进行供试品溶液的制备及测定,结果见表11和12。
表11
表12
结果表明,6个重复性实验样品的各特征峰的相对保留时间rsd在0.05%~0.12%范围内,相对峰面积的rsd在1.39%~2.93%范围内,表明该特征图谱的重复性较好。
稳定性试验:在以上拟定的实验条件基础上,取同一供试品溶液,分别于0h,2h,4h,8h,16h,24h测定,结果见表13和14。
表13
表14
结果表明,24小时内各色谱峰相对保留时间与相对峰面积的rsd<2.0%,该供试品溶液在24小时内稳定。
中间精密度试验:由不同人员在不同日期在不同的色谱仪器上操作,取同一批鲜鱼腥草药材,按拟定实验方法进行供试品溶液的制备及测定,结果见表15和16.
表15
表16
结果表明,不同人员在不同日期和不同色谱仪下操作,各特征峰相对保留时间rsd在0.00%~0.52%范围内,各特征峰相对峰面积rsd在1.02%~3.22%范围内,表明各色谱峰相对保留时间和相对峰面积中间精密度良好。
耐用性考察:在以上拟定的实验条件基础上,分别对色谱柱为watersacquityhsst3(2.1mm×100mm,1.8μm)、agilentsbc18(2.1mm×100mm,1.8μm)、agilenteclipesplusc18(2.1mm×100mm,1.8μm),进行考察,结果见图13,以及表17和18。
表17
表18
结果表明,用上述3种色谱柱进行检测,各特征峰相对保留时间rsd在0.08%~0.49%之间,各特征峰相对峰面积rsd在0.42%~2.91%之间,表明色谱柱耐用性良好。
5、鲜鱼腥草药材特征图谱的建立
采用最终确定的分析方法,对17批鲜鱼腥草药材(批号:y1、y2、y3、y4、y5、y6、y7、y8、y9、y10、y11、y12、y13、y14、y15、y16、y17)进行特征图谱的测定,计算相对保留时间。(见图14)
根据相对保留时间稳定及各批次样品均能检出且峰相对较高的原则,共选择了10个重复性较好的峰作为特征峰。结果表明,当峰2(绿原酸)作为s峰时,17批次鲜鱼腥草药材特征峰相对保留时间rsd均小于2.0%。最终规定:鲜鱼腥草药材供试品特征图谱中应呈现10个特征峰,与绿原酸参照物峰相应的峰为s峰,计算各特征峰与s峰的相对保留时间,其相对保留时间应在规定值的±10%范围之内,规定值为:0.66(新绿原酸)、0.89(峰2)、1.09(隐绿原酸)、1.78(峰5)、1.80(芦丁)、1.82(金丝桃苷)、1.85(异槲皮苷)、1.95(峰9)、2.04(槲皮苷)。采用中药色谱指纹图谱相似度评价系统(2012版)对17批鲜鱼腥草药材特征图谱进行合成,建立了鲜鱼腥草药材特征图谱的对照图谱,即见图1。
实施例2鲜鱼腥草药材多指标成分的含量测定方法
所述测定方法的步骤如下:
1)对照品参照物溶液制备:取绿原酸对照品、金丝桃苷对照品和槲皮苷对照品适量,精密称定,加90%甲醇水溶液制成每1ml含40μg的混合对照品参照物溶液,即得。
2)待测样品溶液制备:取鲜鱼腥草药材2.0g,精密称定,置具塞锥形瓶中,精密加入90%甲醇水溶液50ml,密塞,称定重量,加热回流30分钟,放冷,再称定重量,用90%甲醇水溶液补足减失的重量,摇匀,滤过,取续滤液,即得。
3)检测:分别吸取对照品参照物溶液、待测样品溶液各1μl,注入超高效液相色谱仪,色谱条件如下:
以十八烷基硅烷键合硅胶为填充剂(watersacquityhsst3色谱柱,柱长为100mm,内径为2.1mm,粒径为1.8μm);以乙腈为流动相a,0.1%磷酸水溶液为流动相b,按下表19中的规定进行梯度洗脱;流速为每分钟0.3ml;柱温为30℃;检测波长为0~13分钟为326nm,13~25分钟为254nm。理论板数按绿原酸峰计算应不低于30000。
表19
1、色谱条件与系统适应性试验
检测波长考察:选择254nm,326nm,280nm,以及程序波长(0~13分钟为326nm,13~25分钟为254nm)进行采集,以绿原酸、金丝桃苷和槲皮苷的含量为评价指标,确定最佳波长,结果见表20。
表20
结果表明,采用程序波长检测方式,绿原酸、金丝桃苷、槲皮苷3个指标成分均呈现最大吸收,含量最高,因此选择程序波长检测方式。
流动相考察:考察了3种不同流动相的分离效果,以乙腈为流动相a,分别以0.1%磷酸水、0.1%甲酸水、0.2%醋酸水为流动相b,进行梯度洗脱,结果见表21。
表21
结果表明,比较3种不同流动相,发现三种流动相的洗脱效果排序为乙腈-0.1%磷酸>乙腈-0.1%甲酸>乙腈-0.2%醋酸,故最终确定乙腈-0.1%磷酸水作为流动相。
流速考察:在拟定的流动相洗脱条件下,分别考察在0.28ml/min、0.3ml/min、0.32ml/min流速下,对鲜鱼腥草药材中绿原酸、金丝桃苷、槲皮苷色谱峰的分离度、理论塔板数、拖尾因子等评价指标的影响,结果见表22。
表22
结果表明,三种流速均能对3个指标成分色谱峰进行很好的分离,随着流速上升,绿原酸理论塔板数逐渐下降,金丝桃苷和槲皮苷的理论塔板数逐渐上升,三种流速对3个色谱峰的分离度以及拖尾因子影响不大,因此选择中间值0.3ml/min为拟定流速。
柱温考察:在以上拟定的实验条件基础上,分别考察柱温为28℃、30℃、32℃时,对鲜鱼腥草药材中绿原酸、金丝桃苷、槲皮苷色谱峰的分离度、理论塔板数、拖尾因子等评价指标的影响,结果见表23。
表23
结果表明,柱温为30℃时,3个指标成分的色谱峰分离度和拖尾因子均优于其它柱温,故确定柱温为30℃。
综上所述,鲜鱼腥草药材多指标成分含量测定色谱条件与系统适应性试验确定为:以十八烷基硅烷键合硅胶为填充剂(柱长为100mm,内径为2.1mm,粒径为1.8μm);以乙腈为流动相a,0.1%磷酸水溶液为流动相b,按表19中的规定进行梯度洗脱;流速为每分钟0.3ml;柱温为30℃;检测波长为0~13分钟为326nm,13~25分钟为254nm。理论板数按绿原酸峰计算应不低于30000。
2、待测样品溶液的制备考察
提取溶剂考察:取鲜鱼腥草药材2.0g,精密称定,置具塞锥形瓶中,分别精密加入50%甲醇水溶液、90%甲醇水溶液、甲醇、70%乙醇水溶液、乙醇25ml,密塞,称定重量,超声处理30分钟(功率250w,频率40khz),放冷,再称定重量,分别用提取溶剂补足减失的重量,摇匀,滤过,取续滤液,即得。然后重复试验一次,结果见表24。
表24
结果表明,以90%甲醇水溶液为提取溶剂,绿原酸、金丝桃苷、槲皮苷含量均最大,故优选90%甲醇水溶液为提取溶剂。
提取方式考察:取鲜鱼腥草药材2.0g,精密称定,置具塞锥形瓶中,精密加入90%甲醇水溶液25ml,密塞,称定重量,分别采用回流和超声提取30min,放冷,再称定重量,用90%甲醇水溶液补足减失的重量,摇匀,滤过,取续滤液,即得。结果见表25。
表25
结果表明,采用回流的提取方式,绿原酸和槲皮苷含量相差不大,但金丝桃苷的含量略高于超声,故优选回流提取。
提取溶剂用量考察:取鲜鱼腥草药材2.0g,精密称定,置具塞锥形瓶中,分别精密加入90%甲醇水溶液25ml、50ml、75ml,密塞,称定重量,加热回流30分钟,放冷,再称定重量,分别用提取溶剂补足减失的重量,摇匀,滤过,取续滤液,即得。结果见表26
表26
结果表明,加90%甲醇25ml、50ml、75ml提取绿原酸、金丝桃苷、槲皮苷含量相差不大,在保证各成分充分提取的前提下,基于节约溶剂方面考虑,故选择50ml90%甲醇提取。
提取时间考察:取鲜鱼腥草药材2.0g,精密称定,置具塞锥形瓶中,精密加入90%甲醇50ml,密塞,称定重量,分别加热回流15min、30min、45min、60min,放冷,再称定重量,用90%甲醇水溶液补足减失的重量,摇匀,滤过,取续滤液,即得。结果见表27。
表27
结果表明,回流30min绿原酸、金丝桃苷、槲皮苷含量最高,故选择回流30min。
综上所述,鲜鱼腥草药材特征图谱供试品溶液的制备方法确定为:取鲜鱼腥草药材2.0g,精密称定,置具塞锥形瓶中,精密加入90%甲醇水溶液50ml,密塞,称定重量,加热回流30分钟,放冷,再称定重量,用90%甲醇水溶液补足减失的重量,摇匀,滤过,取续滤液,即得。
3、方法学验证
专属性试验:按拟定的方法制备待测样品溶液及阴性对照溶液(即缺鲜鱼腥草药材的阴性对照溶液),进行检测。结果见图15。
结果表明,阴性溶液色谱图对待测峰的测定无干扰,表明该方法专属性好。
线性考察:分别取绿原酸、金丝桃苷、槲皮苷对照品适量,置于10ml容量瓶内,加入90%甲醇水溶液溶解,配制成含绿原酸102.875μg/ml、金丝桃苷95.138μg/ml、槲皮苷141.880μg/ml的混合对照品溶液。
分别依次精密吸取上述对照品2.5ml、1.0ml、0.5ml、0.25ml、0.1ml至5ml容量瓶中,用90%甲醇水溶液稀释至刻度,摇匀,按拟定色谱条件依次进样1μl,记录色谱峰面积。以峰面积为纵坐标(y),对照品浓度为横坐标(x),并绘制标准曲线,见图16和表28和29。
表28
表29
结果表明,绿原酸标准曲线为y=9997.2x+1396.6,r2=0.9995。表明供试品溶液绿原酸浓度在2.058~51.437μg/ml范围内,线性关系良好。金丝桃苷标准曲线为y=9356.9x+5005.7,r2=0.9993。表明供试品溶液金丝桃苷浓度在1.903~47.569μg/ml范围内,线性关系良好。槲皮苷标准曲线为y=10578x+8313.2,r2=0.9994。表明供试品溶液槲皮苷浓度在2.838~70.940μg/ml范围内,线性关系良好。
精密度考察:取鲜鱼腥草药材约2.0g,精密称定,按拟定实验方法进行待测样品溶液的制备及测定,连续进样6次。结果见表30。
表30
结果表明,精密度考察中绿原酸、金丝桃苷、槲皮苷的峰面积rsd值分别为0.56%、0.54%、0.54%,故本方法的进样精密度良好。
重复性考察:精密称取鲜鱼腥草药材6份,按拟定实验方法进行待测样品溶液的制备及测定。结果见表31-33。
表31
表32
表33
结果表明,绿原酸、金丝桃苷、槲皮苷的含量rsd值分别为2.99%、2.19%、2.94%,故本方法重复性良好。
稳定性考察:在以上拟定的实验条件基础上,取同一待测样品溶液,分别于0h,2h,4h,8h,16h,24h测定。结果见表34。
表34
结果表明,在本实验条件下,24h内鲜鱼腥草药材待测样品溶液中绿原酸、金丝桃苷、槲皮苷的峰面积rsd值分别为1.67%、1.46%、1.47%,供试品在24h内稳定性良好。
中间精密度考察:由不同人员在不同日期在不同的色谱仪器上操作,取同一批鲜鱼腥草药材,按拟定实验方法进行待测样品溶液的制备及测定。结果见表35-37。
表35
表36
表37
结果表明,绿原酸、金丝桃苷、槲皮苷的含量rsd值分别为3.45%、1.67%、0.84%,故本方法中间精密度良好。
加样回收率考察:取已知含量的鲜鱼腥草药材约1.0g,共6份,精密称定,分别精密加入一定量的绿原酸、金丝桃苷、槲皮苷对照品,按拟定的方法进行待测样品溶液的制备并测定,计算回收率。结果见表38-40。
表38
表39
表40
结果表明,绿原酸、金丝桃苷、槲皮苷的加样回收率分别为99.15%、100.96%、97.03%,rsd值分别为3.51%、3.24%、3.15%,故本方法准确度良好。
耐用性考察:在拟定的实验条件基础上,分别采用不同色谱柱watersacquityhsst3(2.1mm×100mm,1.8μm)、agilentsbc18(2.1mm×100mm,1.8μm)、agilenteclipesplusc18(2.1mm×100mm,1.8μm)在同一仪器对同一供试品进行检测。结果见表41。
表41
结果表明,不同色谱柱的分析色谱指标良好,绿原酸、金丝桃苷、槲皮苷的含量测定结果rsd值分别为0.78%、0.33%、0.41%,故本方法耐用性良好。
4、17批鲜鱼腥草药材待测样品的含量测定
以17批鲜鱼腥草药材为待测样品,按拟定的方法制备待测样品溶液并测定。
结果表明,17批鲜鱼腥草药材中绿原酸、金丝桃苷、槲皮苷的平均含量分别为0.020%、0.028%、0.076%,标准偏差分别为0.012%、0.011%、0.029%。
根据17批不同产地鲜鱼腥草药材中绿原酸的含量浮动范围为0.011%~0.053%,绿原酸含量的最小值为0.011%,修正后取0.010%。因此,为保证鲜鱼腥草药材的质量,规定鲜鱼腥草药材指标成分绿原酸的含量不得低于0.010%。
根据17批不同产地鲜鱼腥草药材中金丝桃苷的含量浮动范围为0.016%~0.052%,金丝桃苷含量最小值为0.016%,修正后取0.015%。因此,为保证鲜鱼腥草药材的质量,规定鲜鱼腥草药材指标成分金丝桃苷的含量不得低于0.015%。
根据17批不同产地鲜鱼腥草药材中槲皮苷的含量浮动范围为0.031%~0.127%,槲皮苷含量最小值为0.031%,修正后取0.030%。因此,为保证鲜鱼腥草药材的质量,规定鲜鱼腥草药材指标成分槲皮苷的含量不得低于0.030%
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!