氦中二氧化氮气体标准物质及其制备方法和应用与流程
本发明属于气体标准物质技术领域,具体涉及一种氦中二氧化氮气体标准物质及其制备方法和应用。
背景技术:
氦原子核质量只有4,仅由两个质子和两个中子构成,是一种非常稳定的元素。氦的重要特性包括:极难发生化学反应、不具有放射性、不可燃烧、无毒等,最关键的是,氦的沸点低至4.2开尔文,即零下268摄氏度,十分接近宇宙中的温度下限——绝对零度。除氦外,其它元素在该温度下都不可能保持液体状态。氦气是目前唯一一种具有上述特性、且能够为人们所用的的物质。对于航天、国防科技、高科技制造业、火箭引擎测试、焊接、商业潜水、粒子加速器磁铁、光纤、半导体芯片而言,氦气是不可或缺的。在医疗领域,由于氦气在血液中的溶解度很低,因此可以加到氧气中防止减压病,作为潜水员的呼吸用气体,或用于治疗气喘和窒息。另外,氦气也可以用于超低温冷却、气相分析、焊接、等离子干刻等。
目前我国对氦中氮氧化物的检测研究较少,不能满足对氦产品中二氧化氮含量的检测及溯源要求。根据国家标准物质资源共享平台提供的相关数据,目前我国已有的以氦气为底气的或以二氧化氮为目标气的气体标准物质较为丰富,包括氦中氢、氦中二氧化硫、氦中一氧化碳、氦中氧、氦中氖、空气中二氧化氮、氮中二氧化氮等气体标准物质。但是,氦中二氧化氮气体标准物质在现有技术中未见报道。
称量法是国际上公认的制备混合气体标准物质的方法。潘义等公开了以高纯氮气和高纯二氧化氮为原料气、采用称量法制备并计算定值,研制(10~5000)μmol·mol-1氮中二氧化氮气体标准物质的方法,其制得的氮中二氧化氮气体标准物质的相对扩展不确定度为3%(k=3)(氮中二氧化氮气体标准物质的研制[j].化学研究与应用,2012,24(5):816-820.)。但是,采用称量法制备以二氧化氮为目标气的气体标准物质时,直接充装二氧化氮易形成四氧化二氮二聚体,从而影响制得的气体标准物质的性能。
技术实现要素:
本发明的一个目的在于提供一种氦中二氧化氮气体标准物质的制备方法,以解决上述技术问题中的至少一个。
本发明的另一个目的在于提供上述氦中二氧化氮气体标准物质的制备方法制得的氦中二氧化氮气体标准物质,以解决上述技术问题中的至少一个。
本发明的又一目的在于提供上述氦中二氧化氮气体标准物质在检测氦中二氧化氮含量中的应用,以解决上述技术问题中的至少一个。
根据本发明的一个方面,提供了一种氦中二氧化氮气体标准物质的制备方法,包括如下步骤:
(1)测定高纯氦气、高纯氧气和高纯一氧化氮的纯度;
(2)对气瓶进行预处理;
(3)采用称量法,以高纯氦气稀释高纯一氧化氮,然后按一氧化氮和氧气的摩尔比为1:(10~15)的比例添加高纯氧气,滚动混匀,静置6~12h,得中间气;
(4)采用称量法,以高纯氦气逐级稀释中间气,滚动混匀,静置6~12h,得氦中二氧化氮气体标准物质;
(5)进行均匀性考察和稳定性考察,分析定值的相对扩展不确定度,对步骤(4)制得的氦中二氧化氮气体标准物质进行定值。
本发明采用称量法,以高纯氦气、高纯氧气和高纯一氧化氮为原料气,制备时,先充装高纯一氧化氮,再充装高纯氦气,以高纯氦气稀释高纯一氧化氮,然后再充装高纯氧气,使高纯一氧化氮在气瓶中与高纯氧气反应生成二氧化氮,利用氧化法间接配制氦中二氧化氮气体标准物质,通过避免直接充装二氧化氮,解决了直接充装二氧化氮时二氧化氮由于充装过程中压力和温度增加而形成四氧化二氮二聚体的问题,提高了氦中二氧化氮气体标准物质的稳定性。同时,本发明制备方法中,添加过量的氧气能有效防止二氧化氮分解,保证二氧化氮的稳定性,使研制的氦中二氧化氮气体标准物质具有良好的性能。
气体标准物质的制备通常需要高纯原料气以及在高度受控的条件下制备,因此,本申请在确定原料气来源后,还对原料气纯度进行了进一步分析。本发明制备气体标准物质前,对原料气高纯氦气、高纯氧气和高纯一氧化氮的纯度进行了测定和分析,且本发明氦中二氧化氮气体标准物质制备过程中所使用的仪器及称量设备均校准,保证测量每个环节都可以不间断的溯源到国际单位制。此外,本发明还对制得的氦中二氧化氮气体标准物质进行定值不确定度评定以及进行均匀性考察和稳定性考察,对氦中二氧化氮气体标准物质进行定值,以满足氦中二氧化氮检测的一致性及溯源性要求。
在一些实施方式中,步骤(2)中,对气瓶进行预处理可以包括如下步骤:将气瓶加热至设定温度后,对气瓶进行抽真空处理,然后用高纯氦气对气瓶进行吹扫,继续抽真空处理6~10h至真空度小于5pa。由此,可以保证气瓶的清洁度和降低制得的气体标准物质中的杂质含量。
在一些实施方式中,设定温度可以为75~85℃。
在一些实施方式中,步骤(3)和步骤(4)中,滚动混匀的转速可以为5000~6000r/h,时间可以为0.5~2h。由此,可以使各组分气体在气瓶中充分反应以及混合均匀,并长期保持均匀稳定。
在一些实施方式中,步骤(3)中,中间气的浓度可以为1~2%mol/mol。
在一些实施方式中,步骤(4)中,氦中二氧化氮气体标准物质的浓度可以为(10~1000)×10-6mol/mol。即,通过本发明的制备方法,可以制得浓度为(10~1000)×10-6mol/mol的氦中二氧化氮气体标准物质。
在一些实施方式中,步骤(4)中,制备浓度为(300~1000)×10-6mol/mol的氦中二氧化氮气体标准物质时,中间气的稀释次数可以为1次;制备浓度为(50~300)×10-6mol/mol的氦中二氧化氮气体标准物质时,中间气的稀释次数可以为2次;制备浓度为(10~50)×10-6mol/mol的氦中二氧化氮气体标准物质时,中间气的稀释次数可以为3次。由此,通过逐级稀释的方式,可以获得定值准确、量值可靠的低浓度氦中二氧化氮气体标准物质。
在一些实施方式中,定值的相对扩展不确定度包括浓度量值不确定度、化学反应引入的不确定度、均匀性引入的不确定度、稳定性引入的不确定度。其中,浓度量值不确定度包括称量过程引入的不确定度、原料气纯度引入的不确定度和摩尔质量引入的不确定度。
根据本发明的另一个方面,提供了上述氦中二氧化氮气体标准物质的制备方法制得的氦中二氧化氮气体标准物质。本发明提供的氦中二氧化氮气体标准物质的相对扩展不确定度为2%(k=2),均匀性和稳定性好,可用于检测超低温冷却、气相分析、焊接、等离子干刻、食品医疗等所用的氦气中的二氧化氮含量,满足超低温冷却、气相分析、焊接、等离子干刻、食品医疗等行业对氦中二氧化氮的检测需求。
附图说明
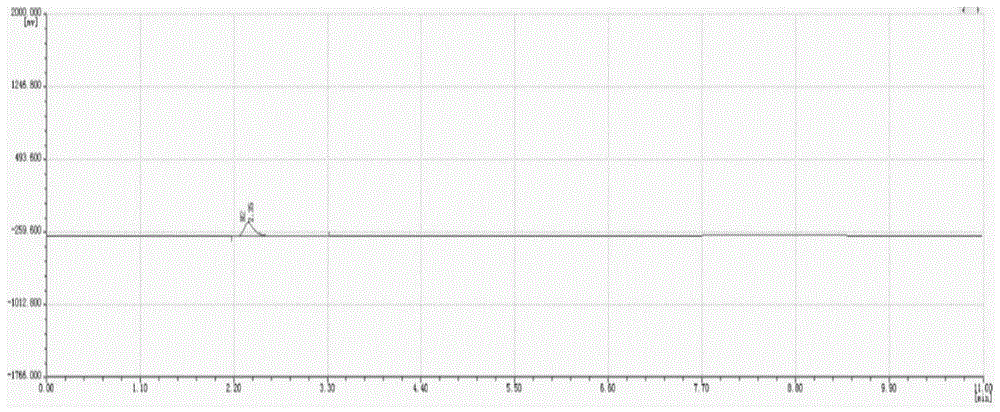
图1~2为高纯氦气的杂质分析图谱,其中,图1中标记的色谱峰为n2(2.35),图2中标记的色谱峰由左至右分别为:h2(0.53)、o2(1.13)、ch4(3.67)、co2(4.56);
图3~4为高纯氧气的杂质分析图谱,其中,图3中标记的色谱峰由左至右分别为:h2(0.53)、ch4(3.93)、co2(4.61),图4中标记的色谱峰为n2(2.48)。
具体实施方式
下面结合具体实施例和附图对本发明做出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例11000×10-6mol/mol的氦中二氧化氮气体标准物质的制备
包括如下步骤:
(1)高纯氦气纯度分析:
高纯氦气(标称纯度≥99.999%)中永久气体杂质分析采用等离子发射气相色谱法(gb/t37182-2018气体分析等离子发射气相色谱),水分含量测定采用光腔衰荡法。采用等离子发射气相色谱法(gc-ped)分析气体杂质时,载气为氮气,输出压力为0.6mpa,驱动气为氮气,输出压力为0.4mpa,定量管0.5ml,采用4mporapakq色谱柱(60-80目)1根,2m5a分子筛色谱柱(40-60目)3根,0.5mcst色谱柱(60-80目)1根。检测器温度为132℃,其中cst色谱柱、5a分子筛色谱柱用于分离h2、o2+ar、ch4、porapakq色谱柱柱温为50℃,原料气组分浓度如表1,高纯氦气杂质分析谱图如图1~2。杂质纯度分析结果不确定度按矩形分布分析结果见表1。
表1氦组分气体纯度分析的实验结果
(2)高纯氧气纯度分析:
采用gc-ped对高纯氧气(标称纯度≥99.99%)中的h2、ch4,n2,co2,c3h8杂质组分进行分析,采用了配ped检测器的气相色谱仪,包括4mporapakq色谱柱(60-80目)1根、2m5a分子筛色谱柱(40-60目)3根、0.5mcst色谱柱(60-80目)1根,载气为氦气,输出压力为0.6mpa,驱动气为氮气,输出压力为0.4mpa,5a分子筛色谱柱柱温为50℃;4mporapakq色谱柱柱温为50℃;cst色谱柱柱温为50℃;定量管0.5ml。采用光腔衰荡法测定原料气中水分含量。原料气高纯氧杂质分析谱图如图3~4,杂质分析不确定度按矩形分布,各组分杂质浓度分析结果如表2。
表2高纯氧组分气体纯度分析的结果
(3)高纯一氧化氮纯度分析:
选用一氧化氮(标称浓度≥99.9%)二级标准物质原料气,一氧化氮中的杂质成分见表3,杂质分析不确定度按矩形分布,各组分杂质浓度分析结果如表3。
表3.高纯一氧化氮组分气体纯度分析的结果
(4)气瓶预处理:
以8l铝合金钢瓶为气瓶,利用带有加热功能的气瓶真空设备,将气瓶置于加热处理槽中加热至80℃,气瓶抽真空后用高纯氦气对气瓶进行吹扫,然后继续抽真空处理6~10h至真空度小于5pa,关闭加热系统并取下气瓶备用。
(5)1%mol/mol氦中二氧化氮中间气配制过程:
采用称量法,以高纯氦气稀释高纯一氧化氮,然后按一氧化氮和氧气的摩尔比为1:10.5的比例添加高纯氧气,将配置好气体的气瓶置于置于滚瓶机上以6000r/h的转速滚动混匀2h,取下静置12h,制成中间气。其中,充装高纯一氧化氮、高纯氦气及高纯氧气的数据如表4所示。
表4.中间气1充装数据(1%mol/mol)
注:mj为原料气平均摩尔质量,mj为充装质量,n为总摩尔数(总摩尔数需扣除反应的氧气和一氧化氮),nj为原料气摩尔数,nk为组分摩尔数。
(6)按需求采用称量法用高纯氦气将中间气逐级稀释成最终混合气。制备浓度为(300~1000)×10-6mol/mol的氦中二氧化氮气体标准物质时,中间气的稀释次数为1次,充入氦气原料气将中间气1稀释至目标浓度;制备浓度为(50~300)×10-6mol/mol的氦中二氧化氮气体标准物质时,中间气的稀释次数为2次,具体可以是先充入氦气原料气将中间气1稀释成浓度约为500×10-6mol/mol的中间气2,再充入氦气原料气将中间气2稀释至目标浓度;制备浓度为(10~50)×10-6mol/mol的氦中二氧化氮气体标准物质时,中间气的稀释次数为3次,具体可以是先充入氦气原料气将中间气2稀释至100×10-6mol/mol的中间气3,再充入氦气原料气将中间气3稀释至目标浓度;将配置好气体的气瓶置于滚瓶机上以6000r/h的转速滚动混匀2h,取下静置12h,得氦中二氧化氮气体标准物质。
本实施例中,1000×10-6mol/mol的氦中二氧化氮气体标准物质充装数据见表5。
表5.1000×10-6mol/mol的no2/he气体标准物质充装数据
在其他实施例中,配制50×10-6mol/mol的氦中二氧化氮气体标准物质具体充装数据见表6、7。
表6.中间气2充装数据(500×10-6mol/mol)
表7.50×10-6mol/mol的no2/he气体标准物质充装数据
在其他实施例中,配制10×10-6mol/mol的氦中二氧化氮气体标准物质具体充装数据见表8、9。
表8.中间气3充装数据(100×10-6mol/mol)
表9.10×10-6mol/mol的no2/he气体标准物质充装数据
(7)进行均匀性考察和稳定性考察,分析定值的相对扩展不确定度,对步骤(6)制得的氦中二氧化氮气体标准物质进行定值。
实施例2均匀性考察
标准物质的均匀性是衡量标准物质性能的一个重要指标,也是标准物质量值准确传递的物质基础,标准物质的特性应该是均匀的,即在一定的细分范围内其特性保持不变。气体标准物质均匀性检验是描述气体标准物质在配制完成后,各个组分在气瓶中达到充分混合均匀的这一过程,以及各个组分量值在气瓶中随着压力变化,其特性量值保持均匀稳定的能力。也就是通常所说的标准气体混匀时间考察和标准气体放压实验考察,具体的均匀性检验和结果分析如下所述。
(1)混匀时间考察
氦中二氧化氮气体标准物质气体配置完成后,将配置好气体的气瓶置于气瓶滚动装置混匀,分别在滚动反应0.5、1.0、1.5小时后,采用气相色谱法检验其浓度(分析时间不计算在内)。结果如表10所示,结果可见,滚动0.5~2h,氦中二氧化氮气体标准物质含量检测结果的相对标准偏差小于0.5%,表明改气体标准物质机械混匀效果良好,在滚匀0.5h后,二氧化氮组分量值即趋于稳定。
表10.氦中二氧化氮气体标准物质组分浓度随混匀时间变化的实验结果
(2)放压实验考察
随着标准气体的消耗,瓶内压力可能会导致气体发生物理化学变化,因此需要考虑压力变化对气体浓度的影响。本发明研制的氦中二氧化氮气体标准物质最终充装压力10mpa,为考察该气体标准物质组分浓度随压力变化的影响,通过流量计式减压阀以10mpa、7mpa、3mpa、0.5mpa压力值放压处理,当达到相应的压力值时,重复测量3次,记录气体标准物质的浓度数据,对测量结果进行f检验。结果如表11,f<fα=4.07,方差分析结果表明组内方差与组间方差在统计学上无显著差异,说明在实验压力范围内,气体标准物质在气瓶内均匀性良好。
表11.氦中二氧化氮气体标准物质组分浓度随压力变化的实验结果
实施例3稳定性考察
为了考察标准气体的长期稳定性,确定其有效期限,对所配混合气体进行了为期12个月的考察。本发明依据标准物质技术规范,本着前紧后疏的原则,对氦中二氧化氮气体标准物质的稳定性进行了考察,实验期限为12个月,每瓶样品每个时间点平行测定3次,记录气体标准物质的浓度数据,对测试结果进行t-因子检验。结果如表12,表12数据表明,在12个月的稳定性考察中,分析测量结果统计计算的回归系数|b1|均小于t0.95,n-2×s(b1),即在95%置信区间内,气瓶内气体样品的稳定性无明显差异,表明氦中二氧化氮气体标准物质的组分量值在12个月内的实验时间内稳定性良好。
表12.氦中二氧化氮气体标准物质的时间稳定性实验结果
实施例4定值的相对不确定度评定
定值的相对扩展不确定度包括浓度量值不确定度、化学反应引入的不确定度、均匀性引入的不确定度、稳定性引入的不确定度。其中,浓度量值不确定度包括称量过程引入的不确定度、原料气纯度引入的不确定度和摩尔质量引入的不确定度。
标准物质量值计算参考iso6142-1-2015gasanalysis—preparationofcalibrationgasmixtures—part1:gravimetricmethodforclassimixtures及gb5274.1-2018气体分析+校准用混合气体的制备第1部分:称量法制备一级混合气体中的规定,混合气体浓度的计算公式为:
式中:
yk——组分k在最终混合气中的摩尔分数,k=1,……,n;
r——制备混合气所用原料气总数;
q——最终混合气ω中组分总数;
mj——最终混合气ω中原料气j加入的质量,j=1,……,r,单位为克(g);
mi——组分i的摩尔质量,单位为克每摩尔(g/mol),i=1,……,n;
xi,j——原料气j,j=1,……,r中,组分i的摩尔分数,i=1,……,n;
xk,j——原料气j中组分k的摩尔分数。
设配制混合气体的过程中分别依次加入原料气:j=a,b,……,p;原料气中各种组分为:i=1,2,……,n;mj为原料气j的平均摩尔质量;nj为原料气j加入的摩尔数;ni为最终混合气中各组分i的摩尔数;yk为最终混合气中组分k的摩尔分数,则:
根据公式(7)与表5的充装数据,瓶号为92906098的氦中二氧化氮标准物质的量值计算过程如下:
浓度量值的不确定度计算公式为:
式中:u(mj)为组分气称量的不确定度;u(mi)为摩尔质量的不确定度;u(xi,j)为组分气中各组分纯度分析的不确定度。
敏感系数的解析表达式如下所示:
如果i≠k,则:
如果i=k,则xi,j=xk,j,则:
将式(9)、(10)、(11)、(12)带入(8)得:
根据公式(13),瓶号为92906098的氦中二氧化氮气体标准物质的量值浓度不确定度uyk,r=0.0113%
二氧化氮标准气体是通过氧气与一氧化氮反应得到的,所以存在二氧化氮与一氧化氮和四氧化二氮的化学反应平衡,所以应该加上化学反应平衡引入的不确定度,分别用urs1,r和urs2,r表示。
一氧化氮和氧气的化学反应如下:
根据该反应的化学平衡常数,可计算在常温常压下该反应达成平衡时,no2和no的浓度比大约为105。在-20℃~80℃温度范围内,no2浓度的浓度变化都小于0.05%。由此引入的不确定度可以按照矩形分布来处理,即:
同理可计算出
均匀性稳定性引入的不确定度ups,r取最大值,ups,r=0.47%。
稳定性引入的不确定度ults,r=0.61%。
最终定值的相对标准不确定度为:
取扩展因子k=2,则相对扩展不确定度:
urel=k×uc,r(15)
根据公式(14)、(15),瓶号为92906098的氦中二氧化氮气体标准物质的相对扩展不确定度为:
以上所述的仅是本发明的一些实施方式。对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!