一种TMAO生物阴性样本、生物标准品的制备方法及检测方法与流程
本发明涉及检测技术领域,具体涉及一种tmao生物阴性样本、生物标准品的制备方法及检测方法。
背景技术:
氧化三甲胺(trimetlylamineoxide,tmao),是胆碱或肉碱等生物碱成分经肠道菌群代谢后生成的一种产物。相关研究表明,tmao与多种心血管疾病的发生发展关系密切,如动脉粥样硬化、心力衰竭和高血压等。因此,对tmao进行检测具有重要意义。在建立tmao检测方法时,需要用到人源血浆、尿液等作为空白基质,然而,几乎所有人血浆中均含有tmao,因此,在方法学验证时空白生物基质的获取成为了难点。传统方法中通常采用水、牛血清白蛋白液、磷酸盐缓冲液、人血清白蛋白等空白生物基质。由于这些空白生物基质与待测样本基质成分相差较远,导致其方法学验证说服力不高,尤其是无法满足药典法规《生物样品定量分析方法验证指导原则》中对于基质效应的阐释要求,因而,得到的检测结果可靠性不佳。
由于氧化甲胺具有氧化性,可被还原成三甲胺,因此,可利用其氧化还原性质,加入特定的还原剂,将其还原为三甲胺或其他物质,从而消除空白基质中的tmao背景干扰。部分研究表明可通过寻找低tmao值样本,然而,由于该类样本数量有限且寻找过程较繁杂,因此,实用性不强。中国发明专利申请文件cn109387410a公开了一种tmao阴性样本及其制备方法与应用,具体公开了通过在生物样本中加入雷氏盐以除去样本中所含有的tmao,该方法虽然能实现消除空白基质中tmao背景干扰的目的,采用化学络合剂反应存在明显缺陷,如:1、反应过程较为剧烈,反应后将产生大量沉淀,而这些沉淀将会对样本中其他成分造成影响;2、由于生物样本中tmao含量相对较低,加入的还原剂易过量,而过量的还原剂难以彻底去除或恰好反应完全,导致得到的阴性样本无法通过后期加入tmao,制备成tmao生物标准品;3、雷氏盐还具有剧毒,极易入眼或粘附在皮肤上,产生强烈刺激;反应过后的样本对水体是极其有害,即使小量产品也不能接触地下水,水道或污水系统,因此对实验操作人员和环境都存在极大的安全隐患。
因此,开发一种高效、安全,既能消除内源性tmao背景干扰,又便于后处理的生物阴性样本的制备方法具有重要意义。
技术实现要素:
本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出一种tmao生物阴性样本的制备方法,该方法制得的生物阴性样本既能高效、安全的消除内源性tmao背景干扰,又便于后处理。
本发明还提出一种tmao生物标准品的制备方法。
本发明还提出一种tmao检测方法。
根据本发明的第一方面实施例的方法,包括以下步骤:
取生物样本,加入生物酶作用于tmao,从而降低或消除生物样本中tmao的含量,终止生物酶与tmao间的反应后得到所述生物阴性样本。
根据本发明的一些实施方式,所述生物酶包括但不限于tmao还原酶(trimethylamine-n-oxidereductase)、tmao脱甲基酶(trimethylamineoxidedemethylase)、tmao醛缩酶(trimethylamineoxidealdolase)、tmao甲醛裂合酶(trimethylamineoxideformaldehydelyase)中的至少一种。
根据本发明的一些实施方式,所述终止生物酶与tmao间的反应采用的是添加酶抑制剂、添加酶灭活剂、改变反应体系温度(使其超出酶促反应的有效温度)或ph值(如加强酸或强碱试剂破坏酶促反应的ph值,反应体系体积1/10左右的hcl、naoh或高氯酸等)。
根据本发明的一些实施方式,若含,所述酶抑制剂选自tmao还原酶抑制剂、tmao脱甲基酶抑制剂、tmao醛缩酶抑制剂、tmao甲醛裂合酶抑制剂中的至少一种;若含,所述酶灭活剂为非特异性终止酶促反应试剂,可选自甲醇、乙腈或三氯乙酸(trichloroaceticacid,tca)(添加量与反应体系溶液体积比为1:5~1:1)中的至少一种。
根据本发明的一些实施方式,若含,所述酶灭活剂抑制剂不低于生物酶的摩尔量。
根据本发明的一些实施方式,每毫升生物样本中生物酶的添加量为1~10ng;优选为2~8ng;更优选为4~6ng。
根据本发明实施方式的制备方法,至少具有如下有益效果:该方法利用生物酶制备tmao生物阴性样本,不仅能够有效地消除内源性tmao背景干扰,而且反应特异性强、效率高、操作方便且经济效益高,通过本发明方案能够有效消除内源性tmao背景干扰。巧妙地利用酶反应,将具备氧化性的tmao还原、代谢分解或添加基团改变结构修饰,从而消除空白基质中tmao引起的背景干扰;后续通过对生物酶灭活或过滤等方式即可实现过量生物酶的去除,使得其还可进一步应用于tmao标准品的制备中。通过本发明方案能够实现大批量样本的制备,避免了现有技术中寻找低浓度tmao难度大且样本量极少的缺陷;本发明方案设计巧妙且实用性强,整个过程无需昂贵的仪器设备或复杂的操作过程,即可实现快速、简便的tmao阴性样本制备,可实现直接将多份生物样本混合后集中加入生物酶统一处理,消除tmao,相比于逐一寻找低tmao值样本更便捷、经济且可实现批量制备。
根据本发明第二方面实施方式的制备方法,包括以下步骤:
s01、采用上述方法制备生物阴性样本;
s02、向步骤s01制得的生物阴性样本定量加入tmao。
根据本发明的一些实施方式,所述步骤s02中加入的tmao终浓度在1~1000ng/ml之间;优选地,所述tmao终浓度在2~500ng/ml之间;更优选地,所述tmao终浓度选自2、5、10、20、50、100、200及500ng/ml中的至少一种。
根据本发明的一些实施方式,所述tmao可以固体的形式添加也可以溶液的形式添加,若以溶液的形式,可以生物阴性样本作为溶剂或稀释剂配制溶液。
根据本发明实施方式的制备方法,至少具有如下有益效果:利用生物酶进行阴性样本的制备,不仅反应过程更温和可控,而且制得的阴性样本可通过将生物酶灭活,进一步制作成生物标准品,使得后续的定量检测过程更准确;通过生物样本直接去除tmao后的阴性样本,加入系列氧化三甲胺标准溶液,而且与待测样本为同源时,可以极大程度的减少现有技术中采用缓冲液或其它溶剂制备的标准溶液带来的基质效应,同时,又可避免采用其它样本作为阴性质控品或标准液溶剂时,存在自带的tmao干扰检测结果的缺陷。
根据本发明的第三方面实施方式的检测方法,包括以下步骤:
i、采用上述方法制备生物阴性样本;
ii、以步骤i制得的生物阴性样本的信号为背景信号,检测待测样本中tmao的信号。
根据本发明的一些实施方式,所述检测方法为定量检测方法,检测过程中以生物阴性样本中添加定量tmao制备成生物标准品,对所述生物标准品中tmao的信号强度进行表征,测定不同浓度下tmao信号强度(可以是光学强度、质谱信号强度或色谱信号强度等现有技术中已知的检测tmao的方式),对待测样本中的tmao进行定量分析。
根据本发明实施方式的检测方法,至少具有如下有益效果:本发明的检测方法不以疾病诊断治疗为目的,检测过程直接以同源样本制备成生物阴性样本,可避免传统技术中使用其他模拟样本作为阴性质控品或标准液溶剂时,因基质效应导致的检测结果不可靠等;本发明检测方法既可实现定量检测也可实现定性检测;通过在生物样本加入酶的方法,可以还原、分解或修饰tmao,从而去除生物样本中存在的tmao,得到不含tmao的生物样本,或残留tmao极地而在作为阴性样本对照时可以忽略不计的生物样本,达到本发明的要求。本发明方案添加的酶与生物样本反应条件温和,反应效率高,对生物样本的破坏程度小,使得到的生物阴性样本能够最大程度的扣除基质效应背景。酶具有高度特异性,不会影响生物样本中的其他物质,也无其他杂质生成,同时,与tmao反应后的产物能够通过检测条件的优化,可与tmao有效分离,从而不对tmao的定量检测造成干扰。此外,所述酶与tmao反应的作用机制不限于还原或分解tmao,还可通过修饰tmao生成新的物质,从而在检测过程中能够将其与tmao分离开而达到阴性样本中不能检测到tmao的效果,当酶处理tmao的机制不同时,多种酶可以同时加入,协同反应,增加反应效果。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
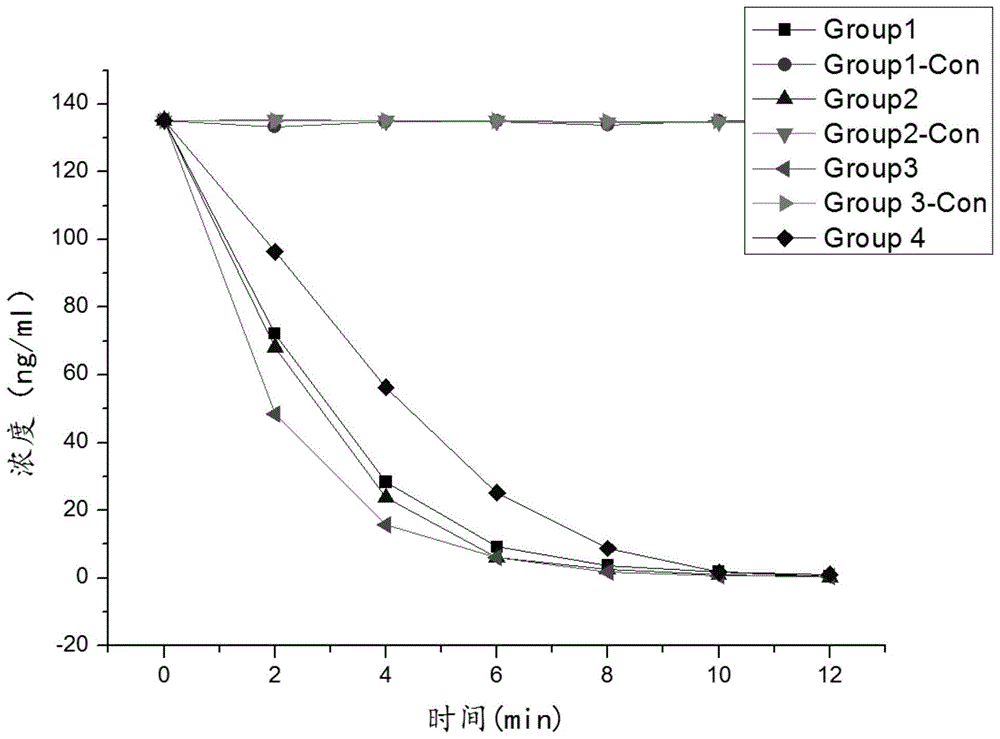
图1为本发明实施例1中不同反应时间后的tmao浓度变化曲线图;
图2为本发明实施例2检测的生物酶反应后的样品中tmao的色谱图;
图3为本发明实施例2中检测的内标物的色谱图;
图4为本发明实施例2测得的标准曲线图。
具体实施方式
为详细说明本发明的技术内容、所实现目的及效果,以下结合实施方式并配合附图予以说明。实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,均可从商业途径得到的试剂和材料。
本发明的实施例一为:一种用于tmao检测的生物阴性样本的制备方法,包括以下步骤:
1.1生物样本收集:临床收集22例中国健康人的全血样本(已做相关病原微生物检测,无相关感染),每例样本取血5ml,分离出血浆后,得血浆1~2ml,将各例样本的血浆混匀,得到生物样本混合物40ml。
1.2标准曲线绘制:甲醇水溶液配置tmao浓度为2、5、10、20、50、100、200及500ng/ml的不同梯度验证标准溶液,加入沉淀剂乙腈和内标tmao-d9后,hplc-ms检测含量,绘制tmao验证标准曲线。其中甲醇水溶液中甲醇的体积百分比为40%(30-60%均可)。
1.3生物样本tmao测定:对1.1得到的生物样本混合物中的tmao含量进行定量检测,重复10次取平均值(每次样本量为200μl)。
1.4按如下分组准备不同酶体外孵育体系:
①第一组(group1):配制tmao还原酶酶促反应缓冲液,精密称取氯化钠12.80g,醋酸钠(干燥)1.54g,抗坏血酸0.127g,半胱氨酸0.036g,二氯化铁0.0038g,亚甲基蓝0.005g,用1.46%(w/v)tritonx-100溶解至290ml,乙酸调节ph值至4.5。加入浓度0.05mg/ml的tmao还原酶提取液(溶于含0.1mol/lnacl,20mmol/ltris-乙酸的溶液中)10ml,充分混匀。
②第一组对照组(group1-con):配制空白的tmao还原酶酶促反应缓冲液,精密称取氯化钠12.80g,醋酸钠(干燥)1.54g,抗坏血酸0.127g,半胱氨酸0.036g,二氯化铁0.0038g,亚甲基蓝0.005g,用1.46%(w/v)tritonx-100溶解至290ml,乙酸调节ph值至4.5。加入浓度10ml含0.1mol/lnacl、20mmol/ltris-乙酸的溶液,充分混匀。
③第二组(group2):配制tmao脱甲基酶酶促反应缓冲液,精密称取tris碱4.36g,半胱氨酸0.087g,抗坏血酸0.127g,二氯化铁0.0143g,加入双蒸水溶解至290ml,乙酸调节ph值至7.0。加入浓度0.05mg/ml的tmao脱甲基酶提取液(溶于含0.1mol/lnacl,20mmol/ltris-乙酸的溶液中)10ml。充分混匀。
④第二组对照组(group2-con):配制空白的tmao脱甲基酶酶促反应缓冲液,精密称取tris碱4.36g,半胱氨酸0.087g,vc0.127g,二氯化铁0.0143g,加入双蒸水溶解至290ml,乙酸调节ph值至7.0。加入10ml含0.1mol/lnacl、20mmol/ltris-乙酸的溶液,充分混匀。
⑤第三组(group3):配制tmao醛缩酶酶促反应缓冲液,精密称取tris碱4.36g,醋酸钠(干燥)2.46g,抗坏血酸0.127g,半胱氨酸0.073g,二氯化铁0.0076g,加入双蒸水溶解至290ml,乙酸调节ph值至7.0。加入浓度0.05mg/ml的tmao醛缩酶提取液(溶于含0.1mol/lnacl,20mmol/ltris-乙酸的溶液中)10ml。充分混匀。
⑥第三组对照组(group3-con):精密称取tris碱4.36g,醋酸钠(干燥)2.46g,抗坏血酸0.127g,半胱氨酸0.073g,二氯化铁0.0076g,加入双蒸水溶解至290ml,乙酸调节ph值至7.0。加入10ml含0.1mol/lnacl、20mmol/ltris-乙酸的溶液,充分混匀。
1.5反应:
①体外酶孵育反应:取1.3混合样本5ml共6份,分别加入group1、group1-con、group2、group2-con、group3、group3-con酶促反应溶液500μl,置于50℃水浴中温浴下反应,每间隔1min将反应溶液上下颠倒摇匀一次,每间隔2min取样200μl用于tmao含量测定。
②第四组雷氏盐对照组(group4):取1.3混合样本5ml,加入0.5ml雷氏盐溶液(浓度依据1.3分析结果而定,需保证雷氏盐与tmao摩尔比不低于1:1),用浓盐酸调至ph=1,4℃条件下反应。每间隔1min将反应溶液上下颠倒摇匀一次,每间隔2min取样200μl用于tmao含量测定。
1.6终止反应:group1、group1-con、group2、group2-con、group3、group3-con组,向样本中加入500μl10%三氯乙酸(tca)终止反应。
1.7血浆样本tmao含量检测:取200μl反应后的血浆样本,加入内标tmao-d9,4℃、4000rpm条件下离心20min,取上清液直接进行hplc-ms检测,并根据验证标准曲线计算样本中tmao的含量。
若血浆样本中tmao含量高于1.6ng/ml,则说明该样本中tmao未被完全反应,此时,需延长样本反应时间后再继续取样检测,直至tmao含量等于或低于1.6ng/ml为止。
1.8阴性样本制备:达到1.7要求的反应样本,即为阴性样本。
1.9tmao定量标准溶液制备:1.7中制得的阴性样本,加入不同浓度的tmao配置成浓度范围在2-500ng/ml之间的tmao定量标准溶液(也可通过将加入高浓度tmao配置成高浓度tmao溶液后,用1.7制得的阴性样本稀释成浓度范围在2-500ng/ml之间的tmao定量标准溶液)。
本实施例采用器材及参数信息如下:
1)仪器与设备
waterstq-d质谱系统;watersuplci-class液相系统;watersunifi软件;thermofisherthermost16r型高速冷冻离心机(赛默飞,美国);xw-80a涡旋混合器(宁波新芝生物科技股份有限公司,中国);移液器(gilson,美国)。电热恒温水槽(上海精宏实验设备有限公司,中国)。
2)试药与材料
氧化三甲胺:东京化成工业株式会社,纯度99.5%,批号:3evjg-mc;氘代氧化三甲胺(tmao-d9):torontoresearchchemicals,纯度98%,批号:3-lxm-155-1;甲醇:hplc级,merck,批号:1.06007.4008;乙酸铵:分析纯,国药,批号:20160310;乙腈:gradientgradeforliquidchromatography,merck;甲酸:lc级,acs。
3)液相色谱和质谱分析条件
色谱条件
色谱柱:acquitybehc18(2.1×50mm,1.7μm);流动相:10mm乙酸铵水溶液:体积百分比0.1%甲酸的乙腈溶液=80:20(v/v);流速0.2ml/min;柱温:30℃;进样室温度:10℃;进样量:3μl;洗针液:80%甲醇水。
质谱条件
采用电喷雾离子源(electrosprayionsource,esi),正离子mrm模式检测;氧化三甲胺:监测离子m/z75.99→m/z58.6;锥孔电压:18v,碰撞能:12ev;氧化三甲胺-d9:监测离子m/z85.1→m/z68,锥孔电压:18v,碰撞能:13ev;毛细管电压:0.5kv;锥孔气流:60l/h;去溶剂气流:1000l/h;离子源温度:150℃;去溶剂温度:500℃。
本实施例相关结果分析如下:
本实施例1.3步骤测得混合物的tmao浓度均值为135.20ng/ml,经上述步骤处理后,1.6各组中最终测得tmao含量见下表1及图1所示:
表1
根据实验结果已知,group1~3组的tmao消耗速率均显著高于group4组,表明酶促反应消耗tmao效率高于雷氏盐沉淀反应。其中,第2、3组在反应进行到第10分钟即低于检测下限;第1、4组在反应进行到第12分钟即达到检测下限。反应到第12分钟时,所有组中tmao的浓度均低于检测下限,此时终止反应。group1~3-con组中tmao没有显著变化,由此可以确定是体外酶反应体系中的酶发挥着消耗tmao的主要作用。
实验结束后,group1~3组分别得到tmao阴性样本3.5ml;第5组由于tmao与雷氏盐直接反应产生大量沉淀,得到tmao阴性样本仅2.8ml。
此外,相比于生物酶,雷氏盐还具有极大毒性,雷氏盐易入眼或粘附在皮肤上,产生强烈刺激;雷氏盐反应过后的样本对水体是极其有害,即使小量产品也不能接触地下水,水道或污水系统。从保护操作人员和环境的角度来讲,利用生物酶制备tmao隐形样本也优于雷氏盐沉淀法。
综上,表明本发明实施例方案可快速制得大量tmao阴性样本,且在反应速度、制备效率和环境保护角度来讲,本发明均显著优于雷氏盐沉淀法。
本发明实施例二为一种tmao生物阴性样本的应用:
2.1定量标准曲线的绘制:取实施例1制得的生物阴性样本适量,添加tmao配制成含有不同浓度(2、5、10、20、50、100、500ng/ml)的tmao的定量标准溶液(各标准溶液中除tmao的含量不同外,其他成分的含量一致),以hplc-ms检测的各标准溶液中tmao及内标物。取实施例1中1.4部分group1组酶反应12min后的样品加入内标物进行hplc-ms测试,tmao和内标物的检测结果如图2和3所示,图2为样品中tmao的图谱,内标物的结果如图3所示。以group1组酶反应后的阴性样本制得的各标准溶液中tmao的色谱峰面积与所述内标物的色谱峰面积的比值为纵坐标,以相应标准溶液中的tmao的浓度与内标物的浓度的比值为横坐标,绘制标准曲线,如图4所示。
2.2方法准确度验证:重复实施例1的操作步骤后制得生物阴性样本,配置浓度分别为2、5、10、20、50、100、200和500ng/ml(依次标记为curve01至curve08)的tmao系列样品,以及浓度分别为6、75和400ng/ml的低、中、高质控样本(依次标记为q1、q2、q3)。分别根据2.1部分实施例1样本绘制得到的定量标准曲线进行系统样品tmao含量定量分析,以验证方法的准确度。
2.3结果分析:
定量标准曲线线性关系:
实施例1阴性样本的定量标准曲线方程为y=0.417x+0.0002,r2为0.9999。表明采用本发明方案的制备的生物阴性样本用于tmao浓度在2~500ng/ml定量检测时,线性相关性良好,由此表明,采用本发明方案制得的阴性样本用于定量检测可以得到较宽的线性范围及较低的灵敏度。
准确度测试:
将2.2制得的阴性样本中添加已知浓度的tmao,结合2.1样本定量标准曲线进行定量分析,以验证本发明方案的稳定可靠性,数据如下表2所示:
表2准确度测试实验数据表
从表2中可以看出,准确度在95%~105%之间,属于合理误差范围内,由此表明,采用本发明方案制备的tmao检测的生物阴性样本进行tmao的定量分析结果准确可靠。
其他组测定得到的工作曲线具有类似的效果,为避免冗余,在此不再赘述。
综上所述,本发明实施例方案利用生物酶代谢作用的特异性和高效性,能高选择性的作用于tmao将其代谢分解,从而消除空白基质中的tmao背景,实现生物样本中tmao的准确检测,且制备过程简单方便。酶反应条件温和、且易灭活,因此可以最大限度的降低对生物样本的影响。酶可以添加一种也可以多种同时加入协同作用,可以以干粉、沉淀、溶液等多种形式加入,使操作方式灵活多样。本发明方案设计巧妙,特异高效,操作简便,实用性强。此外,本发明方案利用生物酶特异性作用于tmao反应将其分解或代谢成其它物质,从而减少或消除生物样本中tmao的含量,通过加入酶抑制剂或酶灭活剂终止酶促反应即可制备tmao阴性样本。无需昂贵的仪器设备和复杂的操作过程,即可实现快速、简便的tmao阴性样本制备;可直接将多份生物样本混合后集中加入生物酶统一处理,消除tmao,相比于逐一寻找低tmao值样本,本发明方案更快捷、方便、经济,且能大批量制备。
上述实施例中均以血液为样本源,也可是其他体液作为样本源,其同样与有与上述样本类似的效果。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等同变换,或直接或间接运用在相关的技术领域,均同理包括在本发明的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!