一种生物阴性样本、生物标准品的制备方法及TMAO检测方法与流程
本发明涉及生物检测
技术领域:
,具体涉及一种生物阴性样本、生物标准品的制备方法及tmao检测方法。
背景技术:
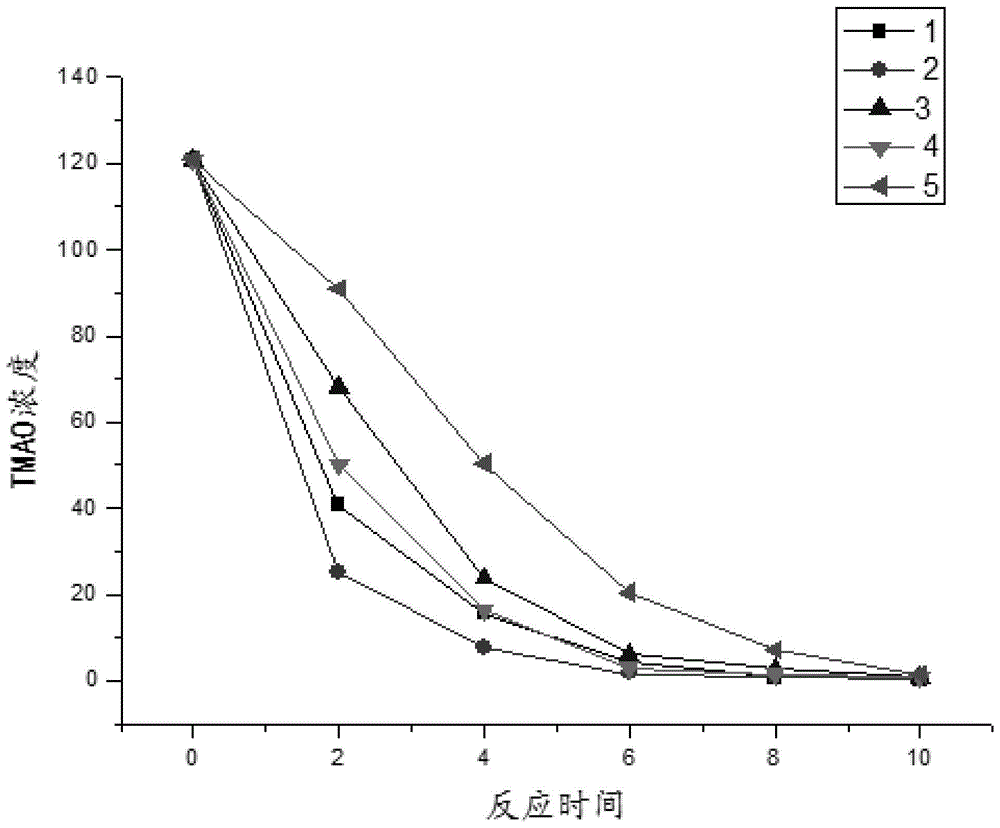
:氧化三甲胺(trimetlylamineoxide,tmao)是一种肠源性菌群相关代谢产物,在肝脏中合成。生物体内的胆碱、左旋肉碱、甜菜碱等生物碱在肠道菌群的作用下转化三甲胺(trimethylamine,tma),tma在三甲胺氧化酶的作用下转化为氧化三甲胺,后经肾脏代谢随尿液排出。相关研究表明,tmao与心血管疾病、慢性肾病肾功能不全和死亡风险、ii型糖尿病、胰岛素抵抗、非酒精性脂肪肝及某些癌症的发生发展都有一定关联。因此,检测生物样本中的氧化三甲胺含量具有重要意义。在检测实验或检测产品设计过程中,通常需要用到阴性对照,由于生物样本(如血液、尿液或组织液等)通常是一个复杂的体系,其中,含有多种蛋白及各类化学成分,因此,传统检测技术通常采用水、磷酸盐缓冲液(phosphatebufferedsaline,pbs)或人血清白蛋白等空白生物基质作为阴性对照,这些方案虽然能一定程度上扣除系统中的背景干扰,然而,由于生物样本成分复杂,因此,传统阴性对照仍然无法消除基质效应,其测定结果通常因各种误差导致其方法学验证说服力不佳,尤其是无法满足药典法规《生物样品定量分析方法验证指导原则》中对于基质效应的阐释要求。部分研究表明可通过寻找低tmao值样本,然而,由于该类样本数量有限且寻找过程较繁杂,因此,实用性不强。中国发明专利申请文件cn109387410a公开了一种tmao阴性样本及其制备方法与应用,具体公开了通过在生物样本中加入雷氏盐以除去样本中所含有的tmao,该方法虽然能实现消除空白基质中tmao背景干扰的目的,采用化学络合剂反应存在明显缺陷,如:1、反应过程较为剧烈,反应后将产生大量沉淀,而这些沉淀将会对样本中其他成分造成影响;2、由于生物样本中tmao含量相对较低,加入的还原剂易过量,而过量的还原剂难以彻底去除或恰好反应完全,导致得到的阴性样本无法通过后期加入tmao,制备成tmao生物标准品;3、雷氏盐还具有剧毒,极易入眼或粘附在皮肤上,产生强烈刺激;反应过后的样本对水体是极其有害,即使小量产品也不能接触地下水,水道或污水系统,因此对实验操作人员和环境都存在极大的安全隐患。因此,开发一种反应条件温和、操作便捷,且安全的用于制备tmao生物标准品的生物样本的制备方法具有重要意义。技术实现要素:本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出一种生物阴性样本的制备方法,能够在温和条件下制得tmao阴性样本,且该阴性样本可进一步用于制备生物标准品。本发明还提出一种利用上述tmao阴性样本制得的tmao生物标准品的方法。本发明还提出一种tmao检测方法。根据本发明的第一方面实施方式的方法,包括以下步骤:取生物样本,向所述生物样本中加入特异性去除tmao的微生物,反应完后除去微生物得到所述生物阴性样本。根据本发明的一些实施方式,所述微生物与生物样本的体积比为1:1000~1:10000;优选为1:1000~1:5000,其中,微生物的浓度为1*108~1*1010cfu/ml。生物样本中所含tmao含量较低,在加入微生物时,需要加入的微生物比例较低,加入的菌液培养基或加入的微生物所产生的代谢产物相对于阴性样本比例极低,对阴性样本成分变化影响较小。根据本发明的一些实施方式,所述微生物与生物样本反应体系温度为15-35℃、反应时间为0.5-4h、反应ph为5.0-9.0;优选地,反应过程中还对反应体系进行摇匀或转动,转速/摇晃间隔为10-100rmp。根据本发明的一些实施方式,所述微生物包括但不限于:弧菌(vibrio)、无硫光合细菌(也可称为非硫光合细菌)、大肠杆菌(enterobacteriaceae)、腐败希瓦氏菌(shewanellaputrefaciens)、嗜麦芽糖寡氧单胞菌(stenotrophomonasmaltophilia)、雷氏普罗威登斯菌(providenciarettgeri)、鼠伤寒沙门菌、无色杆菌属(achromobacter)、产气单胞菌(aeromanas)、交替单胞菌(alteromana)、弯曲杆菌(campylobacter)、棒状杆菌属(corynebacterium)、黄杆菌属(flavobacterium)、微球菌(micrococcus)、发光杆菌属(photobacterium)、假单胞菌(pseudomonas)、红假单胞菌(rhodopseudomamas)、红螺菌属(rhodospirillum)或志贺氏杆菌(shigella)中的至少一种;优选地,所述微生物选自弧菌、无硫光合细菌(也可称为非硫光合细菌)、大肠杆菌、腐败希瓦氏菌、嗜麦芽糖寡氧单胞菌、雷氏普罗威登斯菌、鼠伤寒沙门菌、无色杆菌属、产气单胞菌、交替单胞菌、弯曲杆菌、微球菌、发光杆菌属、假单胞菌、红假单胞菌、红螺菌属或志贺氏杆菌中的至少一种;更优选地,所述微生物选自弧菌、无硫光合细菌、大肠杆菌、腐败希瓦氏菌、鼠伤寒沙门菌、交替单胞菌棒状杆菌属或黄杆菌属中的至少一种;更进一步优选地,若含,所述弧菌选自溶藻弧菌。本发明方案的微生物可以是所有能够利用tmao的微生物,可以是单种添加也可以是多种协同作用。根据本发明的一些实施方式,所述大肠杆菌反应ph为5.0-8.0;鼠伤寒沙门菌反应ph为5.0-5.5;腐败希瓦氏菌反应ph为6.0-9.0;无硫光合细菌反应ph为7.5-8.5。根据本发明的一些实施方式,所述微生物以干粉、沉淀、菌落或菌液的形式加入到生物样本中。可以多种形式添加,操作方式灵活多样。所述微生物干粉无需活化,可直接添加。而菌沉淀、菌落、菌液通常在活化后添加,活化用的培养基为lb培养基。根据本发明的一些实施方式,所述生物样本通常为与待测样本为同源性性样本;如待测样本为人,则生物样本取自人体;若待测样本来源于其他生物,则生物样本取自其他生物体。同一来源的生物样本可以制得的tmao阴性样本可以保证其基质成分较为统一,在作为该种类的待检样本的阴性样本应用过程中,可以最大程度的避免采用其它阴性样本造成的基质效应。根据本发明的一些实施方式,所述生物样本选自血浆、血清、尿液、淋巴液、口腔唾液、脑脊液、腹水或透析液中的至少一种。生物样本的选择可以是所有可能含有tmao的样本,包括但不限于上述举例样本,在生物样本进行微生物处理的过程中,微生物并非一定要在生物样本中繁殖,加入的微生物本身具有活性,本发明仅需加入的微生物能够在生物样本中进行正常的代谢反应消除tmao或其正常的代谢反应虽无法保证,但其消除tmao的代谢反应不受影响或不完全影响即可。根据本发明的一些实施方式,所述生物阴性样本至少满足以下条件:a)残余的tmao含量值应小于所需测定标准曲线定量下限的20%;b)生物阴性样本中残余有tmao,但在对所述生物阴性样本中加入外源性tmao后,实际检测tmao浓度与加入后的理论tmao浓度差小于10%,浓度差优选为小于5%。本发明制备阴性样本的方法,直接在生物样本中加入微生物进行处理后,所制得的生物阴性样本与实际待检测的样本成分更接近。根据本发明的一些实施方式,所述除去微生物的方法选自膜过滤法、沉淀剂灭活法或物理沉淀法中的至少一种。为了避免微生物在生物样本中产生过多的代谢产物,在微生物将tmao反应完全或达到本发明的限量要求后,需终止微生物与在生物样本中的反应。为避免生物样本中原有活性物质的破坏,本发明不优选通过高温的方法灭活微生物,而采用过膜等方法过滤微生物时,由于血清等部分生物样本直接过膜除菌难度较大,操作不便且过膜除菌较难完全。因此,在此类样本进行检测时,生物样本可通过加入沉淀剂和内标再进行检测,沉淀剂的加入本身可使微生物失活,因此,发明人通过加入沉淀剂的方式,直接将微生物灭活,再通过高速离心取上清的方式,得到有效的tmao阴性样本。根据本发明的一些实施方式,所述沉淀剂灭活法具体操作包括加入沉淀剂反应后,固液分离去除沉淀。根据本发明的一些实施方式,所述固液分离的方法为离心。根据本发明的一些实施方式,所述沉淀剂选自磷酸盐、草酸盐、硫化物、氢氧化物强酸、强碱、重金属盐、尿素或有机溶剂中的至少一种;优选地,所述有机溶剂选自极性有机溶剂;更优选地,所述极性有机溶剂选自甲醇、乙腈或丙酮中的一种。根据本发明的一些实施方式,所述沉淀若为固体,则沉淀剂的加入量与生物样本的质量体积比为0.8~1.5%;若含,所述有机溶剂的加入量为生物样本体积量的1/20~1/5。根据本发明实施方式的制备方法,至少具有如下有益效果:本发明方案设计巧妙,操作简便,实用性强,整个过程无需昂贵的仪器设备或复杂的操作过程,即可实现快速、简便的tmao阴性样本制备,可直接将多份生物样本混合后集中加入微生物统一处理,消除tmao,相比于逐一寻找低tmao值样本更便捷、经济且可实现批量制备;通过本发明方案能够有效消除内源性tmao背景干扰,巧妙地利用微生物代谢过程的特殊性,将具备氧化性的tmao还原、代谢分解或添加基团改变结构修饰,从而消除空白基质中tmao引起的背景干扰;后续通过对微生物灭活或过滤等方式即可实现过量微生物的去除,使得其还可进一步应用于tmao标准品的制备中。根据本发明的第二方面实施方式的制备方法,包括以下步骤:s01、采用上述方法制备生物阴性样本;s02、向步骤s01制得的生物阴性样本定量加入tmao。根据本发明的一些实施方式,所述步骤s02中加入的tmao终浓度在1~1000ng/ml之间;优选地,所述tmao终浓度在2~500ng/ml之间;更优选地,所述tmao终浓度选自2、5、10、20、50、100、200及500ng/ml中的至少一种。根据本发明的一些实施方式,所述tmao可以固体的形式添加也可以溶液的形式添加,若以溶液的形式,可以生物阴性样本作为溶剂或稀释剂配制溶液。根据本发明实施方式的制备方法,至少具有如下有益效果:利用微生物进行阴性样本的制备,不仅反应过程更温和可控,而且制得的阴性样本可通过将微生物灭活,进一步制作成生物标准品,使得后续的定量检测过程更准确;通过生物样本直接去除tmao后的阴性样本,加入系列氧化三甲胺标准溶液,而且与待测样本为同源时,可以极大程度地减少现有技术中采用缓冲液或其它溶剂制备的标准溶液带来的基质效应,同时,又可避免采用其它样本作为阴性质控品或标准液溶剂时,自带的tmao含量的影响。根据本发明的第三方面实施方式的检测方法,包括以下步骤:i、采用上述方法制备生物阴性样本;ii、以步骤i制得的生物阴性样本的信号为背景信号,检测待测样本中tmao的信号。根据本发明的一些实施方式,所述检测方法为定量检测方法,检测过程中以生物阴性样本中添加定量tmao制备成生物标准品,对所述生物标准品中tmao的信号强度进行表征,测定不同浓度下tmao信号强度(可以是光学强度、质谱信号强度或色谱信号强度等现有技术中已知的检测tmao的方式),对待测样本中的tmao进行定量分析。根据本发明实施方式的检测方法,至少具有如下有益效果:本发明的检测方法不以疾病诊断治疗为目的,检测过程直接以同源样本制备成生物阴性样本,可避免传统技术中使用其他模拟样本作为阴性质控品或标准液溶剂时,由于基质效应导致的检测结果不可靠等;本发明检测方法既可实现定量检测也可实现定性检测;通过在生物样本加入微生物的方法,可以还原、分解或修饰tmao,从而去除生物样本中存在的tmao,得到不含tmao的生物样本,或残留tmao极地而在作为阴性样本对照时可以忽略不计的生物样本,达到本发明的要求。本发明微生物与生物样本反应条件温和,反应效率高,对生物样本基质的破坏程度小,使得到的生物阴性样本能够最大程度的扣除基质效应背景。同时,微生物与tmao反应后的产物或微生物反应过程中生成的其它代谢物能够通过检测条件的优化,与tmao的检测出峰时间有效分开,从而不对tmao的定量检测造成影响。此外,所述微生物与tmao反应的作用机制不限于还原或分解tmao,还可通过修饰tmao生成新的物质,从而在检测过程中能够将其与tmao分离开而达到阴性样本中不能检测到tmao的效果,当微生物处理tmao的机制不同时,多种微生物可以同时加入,协同反应,增强反应效果。本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。附图说明图1为本发明实施例1中不同反应时间后的tmao浓度变化曲线图;图2为本发明实施例2检测的微生物反应后的样品中tmao的色谱图;图3为本发明实施例2中检测的内标物的色谱图;图4为本发明实施例2测得的标准曲线图。具体实施方式为详细说明本发明的技术内容、所实现目的及效果,以下结合实施方式及附图予以说明。实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,均可从商业途径得到的试剂和材料。本发明最关键的构思在于:利用微生物反应过程较为温和且微生物易除去,通过微生物法除去生物样本中所含有的tmao,可实现生物阴性样本的批量制作,同时,由于反应后残余的微生物易去除,因此,该方案制得的阴性质控品还可用于后续的生物标准品的制备及检测。本发明实施例一为:一种用于tmao检测的生物阴性样本及其制备方法,所述用于tmao检测的生物阴性样本通过以下方法制备而成,所述方法包括以下步骤:1.1生物样本收集:临床收集18例中国健康人的全血样本(已做相关病原微生物检测,无相关感染),每例样本取血5ml,分离出血浆后,得血浆约2ml,将各例样本的血浆混匀,得到生物样本混合物35ml。1.2标准曲线绘制:甲醇水溶液配置tmao浓度为分别为2、5、10、20、50、100、200及500ng/ml的梯度验证标准样品溶液。取标准样品200μl,加入600μltmao-d9(600μl2ng·ml-1)内标工作液,振荡30s,取上清100μl,加入900μl稀释剂(超纯水),涡旋混匀,2μl进样用于测定。液质联用仪(highperformanceliquidchromatography-massspectrometry,hplc-ms)检测含量,绘制tmao验证标准曲线。其中,甲醇水溶液中甲醇的体积百分比为40%(30-60%间即可)。1.3生物样本tmao测定:对步骤1.1得到的生物样本混合物中的tmao含量进行定量检测,重复10次取平均值(每次样本量为200μl)。1.4微生物培养:第一组(溶藻弧菌培养):①配制lbs(高盐)培养基:琼脂25g,蛋白胨10g,肉膏10g,酵母浸膏5g,葡萄糖20g,吐温80ml,k2hpo42g,醋酸钠5g,柠檬酸三氨2g,mgso4·7h2o200mg,mnso4·4h2o50mg,醋酸3.7ml,氯化钠10g,精制水1000ml。加热溶解修正ph在6.0至6.5间,121.3℃,20分钟灭菌。待冷至50℃左右,加入醋酸。充分混合后,分注于平板。②接种:挑选溶藻弧菌单菌落于10ml液体培养基中,30℃、200rpm条件下活化培养24h;③获得菌体:取菌液100μl接种于新的100ml液体培养基中二次活化,30℃、150rpm条件下培养12h,离心得菌体沉淀。用1.5ml1mol/l预冷的山梨醇洗涤、重悬备用。第二组(非硫光合细菌培养):①配制培养基:乙酸钠3g,氯化铵3g,酵母膏0.1g,kh2po40.2g,mgso4·7h2o5mg,碳酸钠0.2g,符合无机盐溶液1ml,精制水1000ml。复合无机盐溶液组成为:edta0.5g,feso4·7h2o0.2g,znso4·7h2o0.01g,硼酸0.03g,mncl2·4h2o0.003g,cacl2·2h2o0.02g,nicl2·6h2o0.002g,cucl2·2h2o0.001g,na2moo4·2h2o0.003g,精制水100ml,hcl调ph=3.0。121℃,20分钟灭菌。待冷却,充分混合后,分注于平板;②接种:挑选非硫光合细菌单菌落于10ml液体培养基中,光照培养箱中800~10000lux光照,30℃、150rpm条件下活化培养120h;③获得菌体:取菌液100μl接种于新的100ml液体培养基中二次活化,30℃、150rpm条件下培养24h,离心得菌体沉淀。用1.5ml1mol/l预冷的山梨醇洗涤、重悬备用。第三组(大肠杆菌培养):④配制lbs(低盐)培养基:琼脂25g,蛋白胨10g,肉膏10g,酵母浸膏5g,葡萄糖20g,吐温80ml,k2hpo42g,醋酸钠5g,柠檬酸三氨2g,mgso4·7h2o200mg,mnso4·4h2o50mg,醋酸3.7ml,氯化钠0.5g,精制水1000ml。加热溶解修正ph在6.0至6.5间,121℃,20分钟灭菌。待冷至50℃左右,加入醋酸。充分混合后,分注于平板;⑤接种:挑选大肠杆菌单菌落于10ml液体培养基中,37℃、200rpm条件下活化培养18h;⑥获得菌体:取菌液100μl接种于新的100ml液体培养基中二次活化,37℃、200rpm条件下培养12h,离心得菌体沉淀。用1.5ml1mol/l预冷的山梨醇洗涤、重悬备用。第四组(腐败希瓦氏菌培养):①配置cm0847培养基:胰蛋白胨15g,大豆蛋白胨5g,氯化钠5g,琼脂13g,精制水1000ml。加热溶解修正至ph7.3±0.2,121℃,20分钟灭菌。冷却后分注于平板;②接种:挑选腐败希瓦氏菌单菌落于10ml液体培养基中,25℃、150rpm条件下活化培养24h;③获得菌体:取菌液100μl接种于新的100ml液体培养基中二次活化,25℃、150rpm条件下培养12h,离心得菌体沉淀。用1.5ml1mol/l预冷的山梨醇洗涤、重悬备用。1.5反应①微生物反应:分别取1.3混合样本6ml4份,分别加入1.4中制备得到的各类菌体沉淀约3μl后,置于适宜条件下(即各菌的最适温度和ph值,溶藻弧菌反应ph为6.0;非硫光合细菌反应ph为3.0;大肠杆菌反应ph为6.0;腐败希瓦氏菌反应ph为7.5;各组温度均为30摄氏度)反应。每间隔30s将反应溶液上下颠倒摇匀一次,每间隔2min取样200μl用于tmao含量测定。②对照组(雷氏盐沉淀):取1.3混合样本6ml,加入0.6ml雷氏盐溶液(浓度依据1.3分析结果而定,需保证雷氏盐与tmao摩尔比不低于1:1),用浓盐酸调至ph=1,4℃条件下反应。每间隔30s将反应溶液上下颠倒摇匀一次,每间隔2min取样200μl用于tmao含量测定。1.6血浆样本tmao含量检测:各组分别取200μl反应后的血浆样本,4℃、4000rpm条件下离心20min,取上清液加入乙腈(20μl)沉淀,4℃、12000rpm条件下离心10min后取上清,加入600μltmao-d9(600μl2ng·ml-1)内标工作液,振荡30s,取上清100μl,加入900μl稀释剂(超纯水),涡旋混匀,2μl进样用于hplc-ms检测,并根据验证标准曲线计算样本中tmao的含量。若血浆样本中tmao含量高于1.6ng/ml,则说明该样本中tmao未被完全反应,此时,需延长样本反应时间后再继续取样检测,直至tmao含量等于或低于1.6ng/ml为止。1.7阴性样本制备:将达到步骤1.6要求的反应样本4℃、4000rpm条件下离心20min,取上清液加入乙腈(约生物样本量体积的十分之一)沉淀,4℃、12000rpm条件下离心10min后取上清制得tmao阴性样本。1.8tmao定量标准溶液制备:步骤1.7中两种方法制得的tmao阴性样本,分别加入不同浓度的tmao标准品配置成浓度范围在2-500ng/ml之间的tmao定量标准溶液,或加入高浓度tmao配置成高浓度tmao溶液后,用步骤1.7制得的阴性样本稀释成浓度范围在2-500ng/ml之间的tmao定量标准溶液。本实施例采用器材及参数信息如下:1)仪器与设备waterstq-d质谱系统(沃特世,美国);watersuplci-class液相系统(沃特世,美国);watersunifi软件;(沃特世,美国)thermofisherthermost16r型高速冷冻离心机(赛默飞,美国);xw-80a涡旋混合器(宁波新芝生物科技股份有限公司,中国);移液器(gilson,美国)。2)试药与材料氧化三甲胺标准品:东京化成工业株式会社,纯度99.5%,批号:3evjg-mc;氘代氧化三甲胺(tmao-d9):torontoresearchchemicals,纯度98%,批号:3-lxm-155-1;乙酸铵:分析纯,国药,批号:20160310;乙腈:gradientgradeforliquidchromatography,merck;甲酸:lc级,acs。3)液相色谱和质谱分析条件色谱条件色谱柱:acquitybehc18(2.1×50mm,1.7μm);流动相:10mm乙酸铵水溶液:体积百分比0.1%甲酸的乙腈溶液=80:20(v/v);流速0.2ml/min;柱温:30℃;进样室温度:10℃;进样量:3μl;洗针液:80%甲醇水。质谱条件采用电喷雾离子源(electrosprayionsource,esi),正离子mrm模式检测;氧化三甲胺:监测离子m/z75.99→m/z58.6;锥孔电压:18v,碰撞能:12ev;氧化三甲胺-d9:监测离子m/z85.1→m/z68,锥孔电压:18v,碰撞能:13ev;毛细管电压:0.5kv;锥孔气流:60l/h;去溶剂气流:1000l/h;离子源温度:150℃;去溶剂温度:500℃。本实施例相关结果分析如下:本实施例1.3步骤测得混合物的tmao浓度均值为120.76ng/ml,经上述步骤处理后,1.6各组中最终测得tmao含量见下表1及图1所示:表1上表中,1~4组代表步骤1.4中对应编号的微生物,第5组为对照组。根据实验结果可知,1~4组的tmao消耗速率均显著高于第5组,表明微生物催化tmao效率高于雷氏盐沉淀反应。其中第2组在反应进行到第六分钟即达到检测下限;第1、4组在反应进行到第8分钟即达到检测下限。反应到第十分钟时,所有组中tmao的浓度均低于检测下限,此时终止反应。实验结束后,第1~4组中,分别得到tmao阴性样本4.6ml;第5组由于tmao与雷氏盐直接反应产生大量沉淀,得到tmao阴性样本仅3.8ml。此外,相比于微生物,雷氏盐具有极大毒性,雷氏盐易入眼或粘附在皮肤上,产生强烈刺激;雷氏盐反应过后的样本对水体是极其有害,即使小量产品也不能接触地下水,水道或污水系统。从保护操作人员和环境的角度来讲,利用微生物制备tmao隐形样本也优于雷氏盐沉淀法。综上,表明本发明方案可快速制得大量tmao阴性样本,且在反应速度、制备效率和环境保护角度来讲,本发明均显著优于雷氏盐沉淀法。本发明实施例二为一种tmao检测方法,包括以下步骤:2.1定量标准曲线的绘制:取实施例1生物阴性样本适量,添加tmao配制成含有不同浓度(2、5、10、20、50、100、500ng/ml)的tmao的定量标准溶液(各标准溶液中除tmao的含量不同外,其他成分的含量一致),以hplc-ms检测各标准溶液中的tmao及内标物。取实施例1中1.5部分第4组微生物反应10min后的样品加入内标物进行hplc-ms测试,tmao和内标物的检测结果如图2和3所示,图2为样品中tmao的图谱,内标物的结果如图3所示。以第4组微生物反应完后制备的标准品各标准溶液中tmao的色谱峰面积与所述内标物的色谱峰面积的比值为纵坐标,以相应标准溶液中的tmao的浓度与内标物的浓度的比值为横坐标,绘制标准曲线,如图4所示。2.2方法准确度验证:重复实施例1的操作步骤后制得生物阴性样本,配置浓度分别为2、5、10、20、50、100、200和500ng/ml(依次标记为curve01至curve08)的tmao系列样品,以及浓度分别为6、75和400ng/ml的低、中、高质控样本(依次标记为q1、q2、q3)。分别根据2.1部分实施例1样本绘制得到的定量标准曲线进行系统样品tmao含量定量分析,以验证方法的准确度。2.3结果分析:定量标准曲线线性关系:图4中,实施例1阴性样本的定量标准曲线拟合得到的方程为y=0.37x+0.00685,r2为0.9999。表明采用本发明方案的制备的生物阴性样本用于tmao浓度在2~500ng/ml定量检测时,线性相关性良好,由此表明,采用本发明方案制得的阴性样本用于定量检测可以得到较宽的线性范围及较低的灵敏度。准确度测试:将2.2制得的阴性样本中添加已知浓度的tmao,结合2.1样本定量标准曲线进行定量分析,以验证本发明方案的稳定可靠性,数据如下表2所示:表2准确度测试实验数据表样品理论浓度(ng/ml)测定浓度(ng/ml)准确度(%)curve-0122.008100.40curve-0254.89997.98curve-031010.175101.75curve-042020.028100.14curve-055050.829101.66curve-0610098.53498.53curve-07200197.72998.86curve-08500503.289100.66q166.165102.75q165.96499.40q166.202103.37q27573.61898.16q27574.70999.61q27575.143100.19q3400407.001101.75q3400394.43598.61q3400401.261100.32从表2中可以看出,本发明实施例检测方法的准确度在95%~105%之间,属于合理误差范围内,由此表明,采用本发明方案制备的tmao检测的生物阴性样本进行tmao的定量分析结果准确可靠。综上所述,本发明提供的一种用于tmao检测的生物阴性样本及其制备方法及其应用,其生物阴性样本可实现生物样本中tmao的准确检测,且制备过程简单方便。上述实施例中均以血液为样本源,也可是其他体液作为样本源,其同样与有与上述样本类似的效果。以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书内容及附图所作的等同变换,或直接或间接运用在相关的
技术领域:
,均同理包括在本发明的专利保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1