检测分析活体细胞生命活动状态的修饰二聚体表面增强拉曼的方法与流程
[0001]
本发明涉及活体细胞成像检测技术领域,具体的,本发明涉及检测分析活体细胞生命活动状态的修饰二聚体表面增强拉曼的方法。
背景技术:
[0002]
细胞是生命活动的基本单元,细胞内的信息变化是疾病发生的最早期信息。在病毒、药物等不同刺激源的刺激下,研究细胞内部特定生命活动产生位置、持续时间及反应物的变化,有望从源头解释生物体病变和治愈的过程,还可以迅速验证药物影响。因此,对活体细胞内部生命活动的定向成像研究对生物学和药学的发展具有十分重要的意义。
[0003]
细胞内生命活动的最小载体为单分子。现有活体细胞单分子检测的方法主要包括荧光成像及光谱学,以及光阱、磁阱和原子力显微镜为代表的力学检测方法。其中,单分子荧光检测技术是现有的发展最充分、最成熟的单分子检测方法,通过单分子荧光检测方法,已经可以实现对dna、mirna等物质的定量检测。然而,荧光检测方法仍存在一些缺陷:首先,许多细胞存在自发荧光,而上述自发荧光会对目标荧光蛋白的发光产生干扰,导致无法有效成像;其次,当目标检测物含量较少时,荧光信号较弱,信号可能无法有效检测;再次,当荧光标记进入细胞之后,其可能不与目标抗原结合,而是游离在细胞内,产生非特异性测量结果,无法确认目标抗原的真实位置。更重要的是,现有的荧光成像方法,往往仅被应用于单分子存在性表征,很难直接体现细胞内部生命活动的发生情况,例如,现有的荧光成像技术可以表征mrna的运动轨迹,但无法有效确认mrna是否与dna模板链结合,发生转录过程;此外,荧光方法也无法直接测量得到活体细胞内部生命活动产物变化。
[0004]
近年来,表面增强拉曼散射(sers)技术在生物学检测中凸显出独特优势:将有表面增强效应的纳米颗粒导入细胞,可实现细胞内拉曼信号的无损测量和实时检测,同时,当目标检测物含量较少时,表面增强拉曼散射方法也可以获得很强的拉曼信号。国际上已开展大量生物拉曼相关的研究,通过配体修饰纳米颗粒的方法,一些工作已经可以定向观测活细胞内特定蛋白或细胞器的拉曼光谱变化,进而分析其性质的变化。但是,由于细胞内结构复杂,拉曼信号强度和峰位可能受到细胞内部环境影响,测量过程中表面增强拉曼散射信号很容易出现波动。现有表面增强拉曼散射测量方法均不能确定活细胞内拉曼信号的测量基准,这会显著影响拉曼信号的可重复性和准确性。此外,由于纳米颗粒进入细胞后自发性趋于聚集,表面增强拉曼散射方法同样存在非特异性检测信号。现有表面增强拉曼散射方法也仅被应用于特定蛋白或细胞器拉曼光谱检测,尚无法确认细胞内生命活动参与物质是否结合,无法实现对细胞内部特定生命活动的定位成像和表征。
[0005]
综上所述,现有活体细胞内单分子检测方法尚不能实现对生命活动参与物质的定向成像及表征;表面增强拉曼光谱法在活体细胞单分子检测领域具有一定优势,但其表征信号稳定性较差,缺乏基准信息,测量中可能出现非特异性信号,且尚未被应用于活体细胞内部特定生命活动的定位成像和表征。
技术实现要素:
[0006]
本发明旨在至少在一定程度上解决现有技术中存在的技术问题。为此,本发明提出了检测分析活体细胞生命活动状态的修饰二聚体表面增强拉曼的方法,利用该方法可以同时实现细胞生命活动定向成像、表征,有助于准确研究分析外界刺激对细胞生命活动的影响,具有检测准确性强、重复性好等优点,具有科学研究和临床应用价值。
[0007]
本发明提出了一种检测分析活体细胞生命活动状态的修饰二聚体表面增强拉曼的方法。根据本发明的实施例,所述方法(1)提供第一类纳米颗粒、第二类纳米颗粒和第三类纳米颗粒;其中,所述第一类纳米颗粒是通过使用参与细胞生命活动的物质a修饰具有表面增强拉曼效应的纳米颗粒;所述第二类纳米颗粒是通过使用参与所述细胞生命活动的物质b修饰具有表面增强拉曼效应的纳米颗粒;所述第三类纳米颗粒是通过使用配体c和具有稳定表面增强拉曼信号的物质e修饰具有表面增强拉曼效应的纳米颗粒,所述配体c可与至少一种细胞器上的受体d结合;(2)将所述第一类纳米颗粒、第二类纳米颗粒和第三类纳米颗粒导入待测细胞,所述物质a和物质b参与生命活动,在生命活动过程中所述物质a和物质b结合,使得第一类纳米颗粒和第二类纳米颗粒组成二聚体;(3)采用拉曼光谱仪对所述待测细胞进行扫描,检测得到所述物质a和物质b拉曼特征峰同时存在的二聚体表面增强拉曼散射信号,确定所述生命活动在细胞中的发生位置,再以所述发生位置周围的所述物质e的拉曼光信号作为基准,确定所述二聚体表面增强拉曼光谱强度和峰位置,以确定所述待测细胞生命活动状态。
[0008]
两个保持一定距离且具有表面增强拉曼效应的纳米颗粒,即可以形成二聚体,二聚体增强拉曼光谱信号远强于单个纳米颗粒诱导产生的表面增强拉曼光谱信号。因此,在生命活动过程中,当且仅当物质a与物质b结合时,二者所修饰的纳米颗粒配对,形成二聚体,从而诱导产生物质a与物质b的二聚体的表面增强拉曼散射。由于未形成二聚体,未配对的第一类和第二类纳米颗粒仅会产生物质a或物质b单独的表面增强拉曼散射信号,且其信号强度会显著弱于二聚体信号。因此,通过对信号强度和特征峰的观测,即可确定是否存在二聚体表面增强拉曼散射信号,一旦出现物质a与物质b同时存在的二聚体表面增强拉曼散射信号,即可有效证明生命活动中物质a与物质b相结合,进而实现活体细胞内生命活动表征。由于二聚体表面增强拉曼散射强度与普通拉曼散射存在数量级上的差异,通过拉曼光谱扫描观测信号强度,可确认活体细胞内所述生命活动的发生场所,实现活体细胞生命活动定向成像,检测拉曼光谱的特征峰,还可确认所述生命活动产物。第三类纳米颗粒表面修饰配体及具有特定表面增强拉曼信号的物质,配体与细胞内的特定细胞器受体结合,具有特定表面增强拉曼信号的物质自身的拉曼信号可以成为细胞内部拉曼信号的检测基准,细胞内部环境的整体变化将不会干扰特定生命活动信号变化,进而保障细胞内拉曼信号可重复、高精度的检测。通过检测有基准条件下,确定细胞内部二聚体表面增强拉曼散射强度和峰位置,即可确定活体细胞生命活动状态。
[0009]
根据本发明的实施例,上述检测分析活体细胞生命活动状态的修饰二聚体表面增强拉曼的方法还可以具有下列附加技术特征:
[0010]
根据本发明的实施例,所述物质a包括但不限于:单链脱氧核糖核酸、单链核糖核酸、脱氧核糖核苷酸、核糖核苷酸和/或蛋白质;所述物质b包括但不限于:受体、辅助因子、转录因子、聚合酶、单链脱氧核糖核酸、单链核糖核酸、脱氧核糖核苷酸、核糖核苷酸、氨基
酸、抗原、脂质和/或糖;所述配体c为一种配体或多种不同配体;所述纳米颗粒选自金纳米颗粒或银纳米颗粒。
[0011]
根据本发明的实施例,在修饰所述物质a、物质b、配体c、物质e之前,在所述纳米颗粒的表面进行表面修饰,所述表面修饰方法包括:表面覆盖修饰、化学修饰、外膜修饰和/或物理修饰。
[0012]
根据本发明的实施例,步骤(2)中,将所述纳米颗粒导入细胞的方式包括:细胞胞吞、吞噬、胞饮或受体介导的内吞。
[0013]
根据本发明的实施例,步骤(3)进一步包括:(3-1)将所述细胞样品置于拉曼光谱仪检测装置之下,调节显微镜焦距至可清晰观察到细胞结构;(3-2)使用激光激发细胞的拉曼光谱,测量得到某一点的光谱后,将光斑移动到另一位置,重复这一步骤,最终扫描得到整个细胞内的拉曼光谱;(3-3)选取拉曼光谱信号最强的位置,作为所述物质a和物质b所参与的生命活动在细胞中的发生位置;(3-4)测定所述发生位置附近的所述物质e的拉曼光谱信号;(3-5)将所述物质e自身的拉曼光谱信号作为检测基准,确定所述物质a与物质b拉曼光谱信号的强度及峰位。
[0014]
根据本发明的实施例,步骤(3-2)中,所述激光的波长大于400nm,所述光斑移动方法包括使用扫描振镜改变光斑位置或者使用位移平台移动样品位置。
[0015]
根据本发明的实施例,步骤(3)进一步包括:(3-6)向所述待测细胞施加不同刺激,重复步骤(3-2)至(3-5),以分析不同刺激条件下细胞生命活动定向成像和变化。
[0016]
根据本发明的实施例,步骤(3-6)中,所述向细胞施加的不同刺激,包括下列至少之一:病毒刺激、因子刺激、相邻细胞刺激、抗体刺激、毒素刺激、抗原刺激、药物刺激、光刺激、热刺激、电刺激、磁刺激、机械力刺激。
[0017]
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
[0018]
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
[0019]
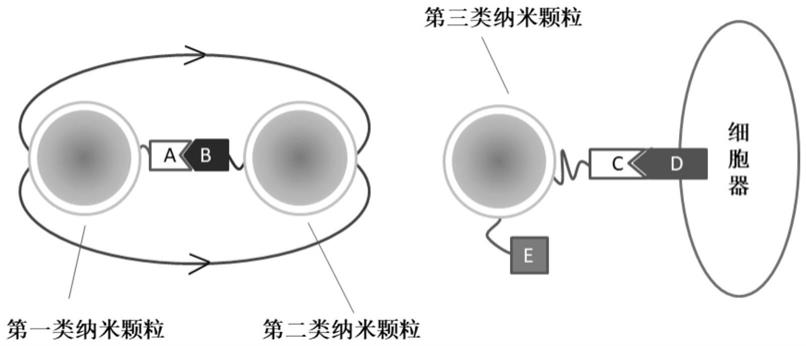
图1显示了根据本发明一个实施例的第一类、第二类和第三类纳米颗粒修饰方法的示意图;
[0020]
图2显示了根据本发明一个实施例的二聚体的特殊形式(多聚体)的示意图,包括(a)多组第一类纳米颗粒和第二类纳米颗粒一一对应形成二聚体组成的多聚体,(b)一个第一类纳米颗粒与多个第二类纳米颗粒结合形成多聚体,(c)多个第一类纳米颗粒上与一个第二类纳米颗粒结合形成多聚体,(d)多个第一类纳米颗粒与多个第二类纳米颗粒逐个相连形成的多聚体;
[0021]
图3显示了根据本发明一个实施例的实现活体细胞生命活动定向成像的拉曼测量装置的示意图;
[0022]
图4显示了根据本发明一个实施例的活体细胞测量中二聚体增强拉曼散射信号、参考信号及非增强位置拉曼信号示意图。
[0023]
附图标记
[0024]
a
ꢀꢀꢀ
参与细胞某生命活动的物质a
[0025]
b
ꢀꢀꢀ
在所述生命活动过程中趋于与物质a结合的物质b
[0026]
c
ꢀꢀꢀ
可与细胞器表面某受体d结合的配体c
[0027]
d
ꢀꢀꢀ
所述细胞器表面受体d
[0028]
e
ꢀꢀꢀ
具体稳定表面增强拉曼信号的物质e
[0029]
000 待测样品
[0030]
010 位移平台
[0031]
101 探测激光器
[0032]
201 带通滤光片
[0033]
202 扫描振镜
[0034]
203 截止滤光片/陷波滤光片
[0035]
204 平面反射镜
[0036]
300 物镜
[0037]
400 光栅
[0038]
401 ccd图像传感器
[0039]
402 拉曼光谱信号处理模块
具体实施方式
[0040]
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
[0041]
需要说明的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。进一步地,在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。
[0042]
本发明提出了检测分析活体细胞生命活动状态的修饰二聚体表面增强拉曼的方法。根据本发明的实施例,所述方法包括:
[0043]
s100:提供第一类纳米颗粒、第二类纳米颗粒和第三类纳米颗粒
[0044]
根据本发明的实施例,第一类纳米颗粒是通过使用参与细胞生命活动的物质a修饰具有表面增强拉曼效应的纳米颗粒;第二类纳米颗粒是通过使用参与细胞生命活动的物质b修饰具有表面增强拉曼效应的纳米颗粒;第三类纳米颗粒是通过使用配体c和具有稳定表面增强拉曼信号的物质e修饰具有表面增强拉曼效应的纳米颗粒,配体c可与至少一种细胞器上的受体d结合。结构参见图1。
[0045]
根据发明的实施例,物质a包括但不限于:单链脱氧核糖核酸、单链核糖核酸、脱氧核糖核苷酸、核糖核苷酸和/或蛋白质。具体地,实施例以转录过程为活体细胞生命活动的代表,则在研究转录过程时,物质a即可为dna模板链;选取直径在50nm以下的金纳米颗粒作为具有表面增强拉曼效应的纳米颗粒,在其上修饰dna模板链,即可得到第一类纳米颗粒,当第一类纳米颗粒进入细胞内时,dna模板链将参与转录活动。
[0046]
根据发明的实施例,物质b包括但不限于:受体、辅助因子、转录因子、聚合酶、单链脱氧核糖核酸、单链核糖核酸、脱氧核糖核苷酸、核糖核苷酸、氨基酸、抗原、脂质和/或糖。
具体地,在研究实施例转录过程时,物质b可为rna聚合酶、或任一核糖核苷酸;将物质b修饰在具有表面增强拉曼效应的纳米颗粒上,即可得到第二类纳米颗粒,当第二类纳米颗粒进入细胞内时,物质b将参与转录活动,且趋于与物质a结合,进而形成图1左侧结构,第一类纳米颗粒与第二类纳米颗粒通过物质a和物质b结合,形成二聚体,产生针对物质a和物质b的二聚体表面增强拉曼散射。
[0047]
根据发明的实施例,配体c为一种配体或多种不同配体。配体可以与一种或多种细胞器上的受体d结合。具体地,配体c可选为核定位信号肽或线粒体靶向肽等可以与细胞器上受体结合的生物大分子,受体d则为细胞器上可识别配体c的特异信号分子
[0048]
本发明所描述的“具有稳定表面增强拉曼信号的物质e”是指拉曼特征峰位受制备条件影响小的物质,相同环境下,不同制备方法得到的物质e拉曼峰位差异小于5cm-1
,其拉曼特征峰位置在实践中已知。实施例中,可选取硅或其他稳定结构。将配体c和物质e修饰在具有表面增强拉曼效应的纳米颗粒上,即可得到第三类纳米颗粒,当第三类纳米颗粒进入细胞内时,配体c趋向于与受体d结合,则第三类纳米颗粒将附着在受体d所对应的细胞器表面,此时物质e的物质也可定位在细胞器附近,通过检测物质e的拉曼信号,即可获得细胞内部的参考信号强度。
[0049]
根据本发明的实施例,纳米颗粒选自金纳米颗粒或银纳米颗粒。在激光照射下,金纳米颗粒或银纳米颗粒可产生表面等离激元,从而实现表面增强拉曼散射。
[0050]
根据本发明的实施例,在修饰物质a、物质b、配体c、物质e之前,在纳米颗粒的表面进行表面修饰,表面修饰方法包括:表面覆盖修饰、化学修饰、外膜修饰和/或物理修饰。为了避免纳米颗粒在细胞内聚集,产生不是物质a与物质b结合得到的二聚体,可以在物质a、b、c修饰之前,先在纳米颗粒的表面额外进行分子修饰或涂层保护,纳米颗粒表面可包裹硅、二氧化硅或蛋白结构等,从而防止纳米颗粒在细胞内部自发聚集,保证纳米颗粒仅能通过物质a和物质b的结合过程靠近,进而有针对性的实现细胞待测生命活动过程的二聚体表面增强拉曼散射。
[0051]
s200:形成二聚体
[0052]
在该步骤中,将第一类纳米颗粒、第二类纳米颗粒和第三类纳米颗粒导入待测细胞,物质a和物质b参与生命活动,在生命活动过程中物质a和物质b结合,使得第一类纳米颗粒和第二类纳米颗粒组成二聚体。
[0053]
s300:拉曼光谱仪扫描检测
[0054]
在该步骤中,采用拉曼光谱仪对待测细胞进行扫描,检测得到物质a和物质b拉曼特征峰同时存在的二聚体表面增强拉曼散射信号,确定生命活动在细胞中的发生位置,再以发生位置周围的物质e的拉曼光信号作为基准,确定二聚体表面增强拉曼光谱强度和峰位置,以确定待测细胞生命活动状态。
[0055]
两个保持一定距离且具有表面增强拉曼效应的纳米颗粒,即可以形成二聚体,二聚体增强拉曼光谱信号远强于单个纳米颗粒诱导产生的表面增强拉曼光谱信号。因此,在生命活动过程中,当且仅当物质a与物质b结合时,二者所修饰的纳米颗粒配对,形成二聚体,从而诱导产生物质a与物质b的二聚体的表面增强拉曼散射。由于未形成二聚体,未配对的第一类和第二类纳米颗粒仅会产生物质a或物质b单独的表面增强拉曼散射信号,且其信号强度会显著弱于二聚体信号。因此,通过对信号强度和特征峰的观测,即可确定是否存在
二聚体表面增强拉曼散射信号,一旦出现物质a与物质b同时存在的二聚体表面增强拉曼散射信号,即可有效证明生命活动中物质a与物质b相结合,进而实现活体细胞内生命活动表征。由于二聚体表面增强拉曼散射强度与普通拉曼散射存在数量级上的差异,通过拉曼光谱扫描观测信号强度,可确认活体细胞内所述生命活动的发生场所,实现活体细胞生命活动定向成像,检测拉曼光谱的特征峰,还可确认所述生命活动产物。第三类纳米颗粒表面修饰配体及具有特定表面增强拉曼信号的物质,配体与细胞内的特定细胞器受体结合,具有特定表面增强拉曼信号的物质自身的拉曼信号可以成为细胞内部拉曼信号的检测基准,细胞内部环境的整体变化将不会干扰特定生命活动信号变化,进而保障细胞内拉曼信号可重复、高精度的检测。通过检测有基准条件下,确定细胞内部二聚体表面增强拉曼散射强度和峰位置,即可确定活体细胞生命活动状态。
[0056]
需要说明的是,未配对的第一类和第二类纳米颗粒没有形成二聚体,因此仅会产生物质a或物质b单独的表面增强拉曼散射信号,且其信号强度会显著弱于二聚体信号,但与第三类纳米颗粒所携带的物质e的参考表面增强拉曼散射信号强度相当。但由于不同物质拉曼光谱存在不同的特征峰,物质a、b与物质e拉曼光谱特征峰峰位不同,因此,通过观察拉曼峰峰位,即可区别游离的第一类、第二类纳米颗粒与第三类纳米颗粒引起的表面增强拉曼散射信号。
[0057]
根据本发明的实施例,参见图2,二聚体至少包括两个纳米颗粒,且由携带物质a的第一类纳米颗粒和携带物质b的第二类纳米颗粒组成;当多个二聚体组成多聚体时,同样可获得显著的拉曼光谱增强效应,所述多聚体的组成方式包括但不限于下述四种:(a)第一类纳米颗粒携带的物质a与第二类纳米颗粒携带的物质b结合形成一个二聚体,多个二聚体靠近组成多聚体;(b)一个第一类纳米颗粒与多个第二类纳米颗粒结合形成多聚体,即第一类纳米颗粒上修饰多个物质a,上述物质a分别和多个第二类纳米颗粒携带的物质b结合形成多聚体;(c)多个第一类纳米颗粒上与一个第二类纳米颗粒结合形成多聚体,即第二类纳米颗粒上修饰多个物质b,上述物质b分别和多个第一类纳米颗粒携带的物质a结合形成多聚体;(d)多个第一类纳米颗粒与多个第二类纳米颗粒逐个相连形成的多聚体,即第一类纳米颗粒携带多个物质a和第二类纳米颗粒携带多个物质b,一个第一类纳米颗粒上结合多个第二类纳米颗粒,一个第二类纳米颗粒上结合多个第一类纳米颗粒,逐个相连形成多聚体。图2给出了上述四种多聚体的示意图。可以看出,上述多聚体的基本组成仍为物质a与物质b结合,引起第一类纳米颗粒和第二类纳米颗粒靠近产生的二聚体结构,因此,多聚体引起的表面增强拉曼散射可以被视为二聚体表面增强拉曼散射的特殊形式。
[0058]
根据本发明的实施例,步骤s300中,将纳米颗粒导入细胞的方式包括:细胞胞吞、吞噬、胞饮或受体介导的内吞。将上述三类纳米颗粒制备成溶液加入细胞培养液,或采用其他手段,诱导细胞通过胞吞、吞噬、胞饮或受体介导内吞等方式将纳米颗粒导入细胞内部。
[0059]
另外,当物质a和物质b结合时发生反应,获得新产物时,新产物的拉曼信号也将被二聚体纳米颗粒增强,因此,通过检测二聚体增强拉曼光谱,还可以进一步确定细胞生命活动的新产物。
[0060]
根据本发明的实施例,步骤s300进一步包括:(3-1)将细胞样品置于拉曼光谱仪检测装置之下,调节显微镜焦距至可清晰观察到细胞结构;(3-2)使用激光激发细胞的拉曼光谱,测量得到某一点的光谱后,将光斑移动到另一位置,重复这一步骤,最终扫描得到整个
细胞内的拉曼光谱;(3-3)选取拉曼光谱信号最强的位置,作为物质a和物质b所参与的生命活动在细胞中的发生位置;(3-4)测定发生位置附近的物质e的拉曼光谱信号;(3-5)将物质e自身的拉曼光谱信号作为检测基准,确定物质a与物质b拉曼光谱信号的强度及峰位。
[0061]
根据本发明的实施例,步骤(3-2)中,激光的波长大于400nm,光斑移动方法包括使用扫描振镜改变光斑位置或者使用位移平台移动样品位置。
[0062]
根据本发明的实施例,步骤s300进一步包括:(3-6)向待测细胞施加不同刺激,重复步骤(3-2)至(3-5),以分析不同刺激条件下细胞生命活动定向成像和变化。
[0063]
根据本发明的实施例,步骤(3-6)中,向细胞施加的不同刺激,包括下列至少之一:病毒刺激、因子刺激、相邻细胞刺激、抗体刺激、毒素刺激、抗原刺激、药物刺激、光刺激、热刺激、电刺激、磁刺激、机械力刺激。
[0064]
具体地,在实施例中,红光对细胞刺激、损伤更小,且针对金纳米颗粒,激光波长大于600nm时更容易产生表面增强拉曼散射,因此,可选用波长大于600nm的激光器;若选用银纳米颗粒作为表面增强纳米颗粒,则可选用波长大于400nm的激光器。需要说明的是,在进行原位组织检测时,激光器波长范围需在相应测量组织对应的光学窗口之内。
[0065]
图3给出了本发明需使用的一种实现活体细胞生命活动定向成像的拉曼测量装置的示意图。
[0066]
本发明的测量装置由待测样品(000)、位移平台(010)、探测激光器(101)、带通滤光片(201)、扫描振镜(202)、截止滤光片/陷波滤光片(203)、平面反射镜(204)、物镜(300)、光栅(400)、ccd图像传感器(401)和拉曼光谱信号处理模块(402)组成。
[0067]
探测激光器(101)用于产生连续探测激光,并且,探测激光器(101)产生的激光波长需与选取的纳米颗粒匹配,以实现表面增强拉曼散射效应。例如:金纳米颗粒需选用波长大于600nm的激光器;银纳米颗粒需用波长大于400nm的激光器。激光波长大于600nm时,对纳米颗粒刺激较小,波长进一步增长时,刺激进一步减小,但相应信号强度会进一步减少,实际测量中,可根据实际需求选取包括但不限于下述激光波长:633nm,635nm,785nm,808nm,980nm,1550nm等。
[0068]
在探测激光器(101)单色性较差时,使用带通滤光片(201)提高探测激光的单色性。
[0069]
扫描振镜(202)用于改变探测激光光斑中心位置;通过调整扫描振镜中反射镜角度和位置,可以改变探测激光进入物镜的位置和角度,进而改变探测激光光斑中心位置,其空间分辨率可达50nm。
[0070]
物镜(300)用于将探测激光和加热激光聚焦在待测样品(000)上。
[0071]
位移平台(010)用于改变样品位置,在激光光斑中心位置固定不变时,可通过移动位移平台位置,改变激光照射在样品上的位置。
[0072]
根据需求,选取使用截止滤光片或陷波滤光片(203),可消除探测激光的瑞利散射,进而获得探测激光激发的拉曼光谱。
[0073]
光栅(400)用于将进入仪器的光线分光,获得样品的拉曼光谱;ccd图像传感器(401)用于测量拉曼光谱信号;拉曼光谱信号处理模块(402)用于分析获得的拉曼光谱信号得到待测样品拉曼峰峰位及峰强。
[0074]
使用平面反射镜(204)构成光路。
[0075]
通过调整扫描振镜(202)的角度,或移动位移平台(010)的位置,即可实现将激光光斑从一个测量位置移动到另一个测量位置的操作,通过重复步骤(3-2),即可获得细胞内部拉曼信号的扫描结果。
[0076]
发明人经过研究发现,现有活体细胞内单分子检测方法尚不能实现对生命活动的定向成像及表征;表面增强拉曼光谱法在细胞表征中,信号缺乏基准信息,导致可重复性差,测量中可能出现非特异性信号,且尚未被应用于活体细胞内部特定生命活动的定位成像和表征。
[0077]
本发明提出的方法和装置,基于二聚体表面增强拉曼信号表征活体细胞内生命活动,通过在纳米颗粒表面修饰进行表面修饰,避免了测量中的非特异性信号;通过将活体细胞某生命活动的两种参与物质a和b分别修饰至不同纳米颗粒上,进而通过两种参与物质在生命活动中结合,将两类纳米颗粒构造为二聚体,通过测量得到二聚体表面增强拉曼散射信号,可以有效证明生命活动中物质a与物质b相结合,进而实现活体细胞内生命活动表征;通过检测二聚体表面增强拉曼散射发生的位置,可以确定活体细胞内生命活动的发生位置;通过检测二聚体表面增强拉曼散射特征峰强度及峰位的变化,可以确认生命活动产物变化。因此,此方法可以实现活体细胞内部生命活动的定向表征及产物研究。此外,此方法在细胞中还导入了第三类纳米颗粒,其修饰有标准物质,以标准物质产生的参考表面增强拉曼信号作为细胞内部拉曼信号的检测基准,则细胞内部环境的整体变化引起的拉曼信号波动将不会干扰特定生命活动信号变化,进而保障细胞内拉曼信号可重复、高精度的检测,在细胞内单分子检测领域中具有很高的应用价值。
[0078]
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0079]
实施例1
[0080]
在该实施例中,对活体细胞生命活动进行定向成像分析:
[0081]
1、提供第一类纳米颗粒、第二类纳米颗粒和第三类纳米颗粒
[0082]
预先在直径为50nm以下的金纳米颗粒表面包裹二氧化硅,以防止纳米颗粒在细胞内部自发聚集。
[0083]
第一类纳米颗粒:将dna模板链修饰在金纳米颗粒表面。
[0084]
第二类纳米颗粒:将rna聚合酶及核糖核苷酸修饰在金纳米颗粒表面。
[0085]
第三类纳米颗粒:将human her2单抗及硅修饰在金纳米颗粒表面,human her2单抗可以结合细胞器上的human her2蛋白受体。
[0086]
2、将第一类纳米颗粒、第二类纳米颗粒和第三类纳米颗粒内吞入待测细胞中。dna模板链在转录时会与rna聚合酶及核糖核苷酸结合,结果过程中使得第一类纳米颗粒和第二类纳米颗粒靠近,形成二聚体,实现二聚体表面增强拉曼散射。
[0087]
3、拉曼光谱仪检测:
[0088]
(3-1)将细胞样品置于拉曼光谱仪检测装置之下,调节显微镜焦距至可清晰观察到细胞结构;
[0089]
(3-2)使用波长大于600nm的激光器激发细胞的拉曼光谱,测量得到某一点的光谱
后,将光斑移动到另一位置,重复这一步骤,最终扫描得到整个细胞内的拉曼光谱;
[0090]
(3-3)选取拉曼光谱信号最强的位置,作为dna模板链、rna聚合酶及核糖核苷酸所参与的生命活动在细胞中的发生位置;
[0091]
(3-4)测定发生位置附近的硅的拉曼光谱信号;
[0092]
(3-5)将硅自身的拉曼光谱信号作为检测基准,确定dna模板链、rna聚合酶及核糖核苷酸拉曼光谱信号的强度及峰位;
[0093]
(3-6)对细胞施加电刺激,重复步骤(3-2)-(3-5),观察拉曼光谱信号最强的位置变化,以确定生命活动发生位置的变化,观察dna模板链、rna聚合酶及核糖核苷酸拉曼光谱信号的强度及峰位的变化,确定电刺激对细胞生命活动的影响。
[0094]
拉曼光谱信号图参见图4,第一类、第二类和第三类纳米颗粒进入细胞后,由于转录过程中,dna模板链在转录时需与rna聚合酶及核糖核苷酸结合,结合过程使得第一类纳米颗粒和第二类纳米颗粒靠近,形成二聚体,从而实现二聚体表面增强拉曼散射。由于二聚体表面增强作用,结合后的物质a和物质b拉曼峰强度可增强2到5个数量级,观察细胞内拉曼峰强度,即可确认细胞内转录过程的发生、持续时间及发生位置。此外,当物质a与物质b产生反应,获得新产物时,新产物的拉曼信号也将被二聚体纳米颗粒增强,因此,通过检测二聚体增强拉曼光谱,还可以进一步确定细胞生命活动的新产物。
[0095]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0096]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1