一种实时动态观察ACE2和新型冠状病毒RBD相互作用的方法
一种实时动态观察ace2和新型冠状病毒rbd相互作用的方法
技术领域
1.本发明属于生物分析检测领域,具体涉及一种实时动态观察ace2和新型冠状病毒rbd相互作用的方法。
背景技术:
2.covid-19是目前已发现的第七种能够引起人类疾病的冠状病毒,其他冠状病毒,如hcov-nl63,hcov-229e,hcov-oc43,hku1,只能引起普通感冒的症状,并且很容易治愈。然而,严重急性呼吸综合征(sars-cov)和中东呼吸综合征(mers-cov)也引起了一定的流行性并且死亡率较高。2002-2003年流行的sars-cov引起了世界范围内超过8000个感染病例,约800例死亡。 mers-cov发现于2012年,截止到2019年,共发现2000多病例和800多例死亡,并且不断有新的病例被发现。相比之下,covid-19的传播速度最快,短短 9个月已经有千万人被感染。对新冠病毒侵染机理的理解是研发疫苗与特效药物的关键。
3.冠状病毒是由核壳蛋白包裹单链rna组成,covid-19感染细胞的机制与 sars-cov相似,都是通过病毒表面的刺突s蛋白与人细胞膜蛋白血管紧张素转化酶2(hace2)结合,在蛋白酶的作用下,内吞进入细胞内,然后释放rna 对机体造成感染。covid-19的s蛋白与sars-cov的s蛋白有近80%的同源性,都是由s1和s2两个亚基组成,其中,s2亚基包含疏水单元,用于侵染细胞膜。而s1亚基包含一个受体结合部位rbd(receptor-binding domain),用于识别宿主细胞的ace2蛋白。研究显示hace2与covid-19的rbd-sd1蛋白的结合力是34.6nm,为与sars-cov的rbd-sd1蛋白(kd=325.8nm)结合力的近10倍,这解释了covid-19的感染性更强的原因。
4.由于rbd与hace2相互作用是病毒侵染细胞的关键,其相互作用活性中心部位是疫苗与药物开发的重要靶点,因此rbd与hace2相互作用的研究具有重要意义,而荧光标记与检测技术因具有原位实时检测,灵敏度高的特色而被广泛的应用于研究蛋白-蛋白的相互作用。目前已报道应用荧光抗体来标记 rbd与hace2蛋白,但是抗体的标记是基于固定的死细胞进行的,无法还原其相互作用的真实环境;而荧光蛋白的标记目前只局限于标记hace2,并且能够使用的荧光种类单一。目前还没有用标签蛋白(snap、halo、pyp、clip等) 专一融合标记hace2和rbd蛋白来研究hace2-rbd相互作用。
技术实现要素:
5.针对现有技术的不足,本发明提供了一种实时动态观察ace2和新型冠状病毒rbd相互作用的方法,属于生物分析检测领域。该方法通过分别荧光标记人源血管紧张素转化酶2(hace2)和新型冠状病毒的受体结合蛋白(rbd)来实现。具体的方法是,首先通过基因工程方法分别在新型冠状病毒的rbd及其受体hace2蛋白融合上标签蛋白,小分子荧光探针通过专一的标记标签蛋白从而荧光标记rbd与hace2。通过荧光成像的方式能够实时动态的观察hace2 和rbd的相互作用。
6.所述hace2与标签蛋白的融合方式为将标签蛋白融合在hace2的n端,如图1所示:
7.与hace2融合的标签蛋白为snap,halo,clip,pyp蛋白或tc多肽标签。
8.新型冠状病毒rbd与标签蛋白的融合方式为将标签蛋白融合在rbd的n 端或者c端,如图8所示:
9.与新型冠状病毒rbd融合的标签蛋白为snap,halo,clip或pyp。
10.所述小分子荧光探针为带有专一底物的小分子荧光探针,能够专一的标记标签蛋白,从而标记rbd或者hace2蛋白。
11.本方法利用荧光成像方式能够实时观察hace2与rbd的相互作用。
12.本发明的优点和有益效果为:
13.本发明通过基因工程方法将蛋白标签融合到目标蛋白上,其优点是根据所用的仪器或者荧光通道不同,可以选择性的将任一带有专一底物的小分子荧光团标记到目标蛋白上应用,并且能够在活细胞内实时成像,可视化hace2与 rbd两种蛋白的相互作用。
附图说明
14.图1为构建的标签蛋白与hace2融合蛋白的基因示意图
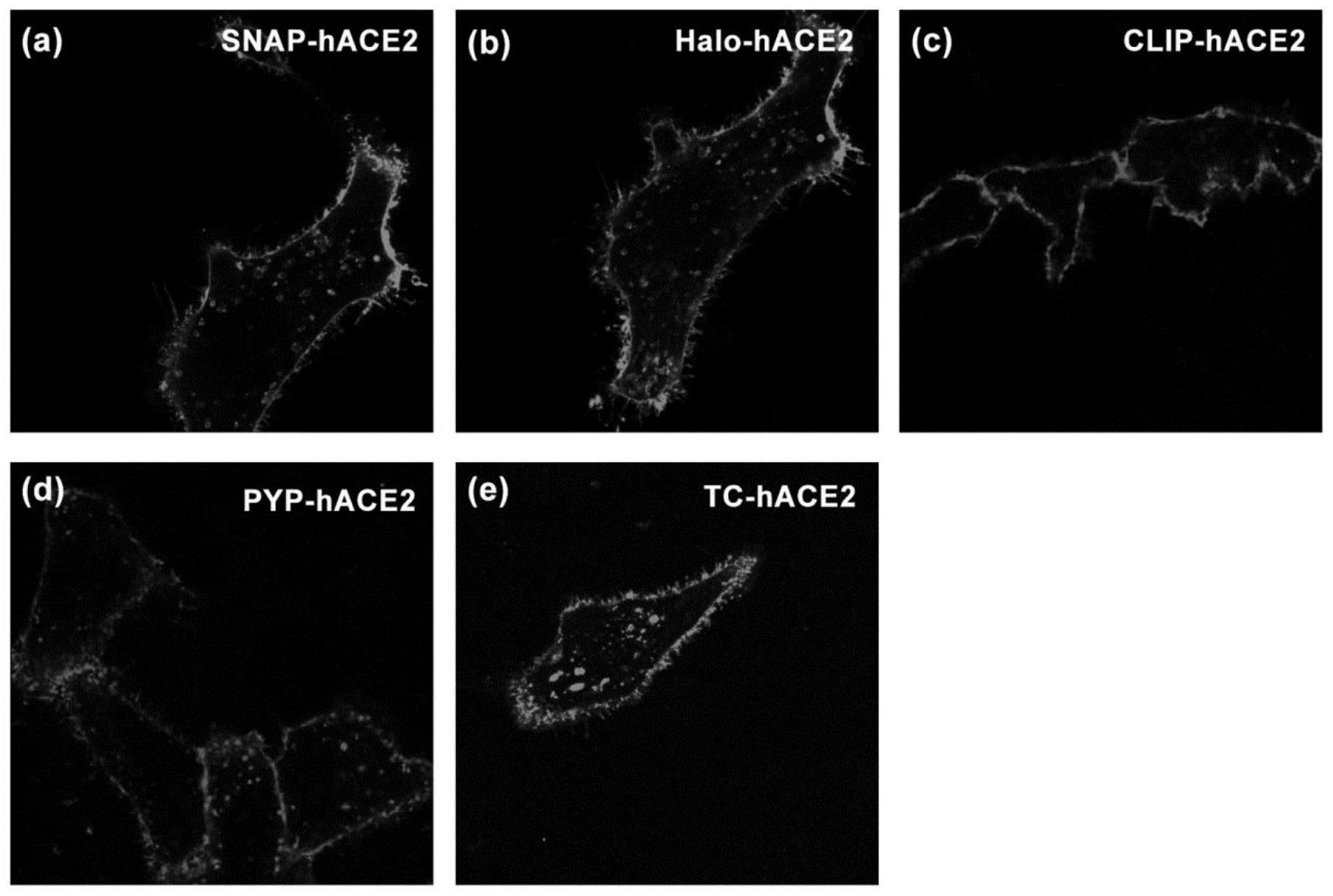
15.图2为不同染料标记各式标签蛋白-hace2的hela细胞成像图
16.图3为snap-rbd(308-553),clip-rbd(308-553),halo-rbd(333-525), rbd(319-541)-pyp四个融合蛋白纯化后的sds-page电泳图
17.图4为rbd蛋白与荧光探针作用前后的sds-page电泳图。
18.图5为rbd蛋白与荧光探针作用前后的sds-page电泳图。
19.图6为hela细胞内snap-hace2与rbd蛋白相互作用的荧光共聚焦成像。
20.图7为hela细胞内halo-hace2,clip-hace2分别与rbd蛋白相互作用的荧光共聚焦成像;
21.图8为新型冠状病毒rbd与标签蛋白的融合方式示意图。
具体实施方式
22.下面的实施例将对本发明予以进一步的说明,但并不因此而限制本发明。
23.实施例1
24.hace2和标签蛋白融合表达载体的构建
25.构建如图1所示的融合蛋白,用常规分子克隆方法先将hace2的全长 cdna亚克隆到商业pcdna3.1载体中,然后分别将snap,clip,halo,pyp, tc标签蛋白的cdna亚克隆到hace2的n端信号肽(hace2的第1-51个碱基为信号肽)之后,得到pcmv-snap-hace2,pcmv-clip-hace2, pcmv-halo-hace2,pcmv-pyp-hace2,pcmv-tc-hace2。
26.实施例2
27.活细胞内对hace2的荧光标记
28.将hela细胞分别传于5个共聚焦成像皿,24小时后,按照说明书用 lipofectamine 2000试剂分别将500ng质粒载体pcmv-snap-hace2, pcmv-clip-hace2,pcmv-halo-hace2,pcmv-pyp-hace2,pcmv-tc-hace2 转入hela细胞,4小时后将培养液换成含有10%胎牛血清的dmem高糖培养液, 37℃5%co2培养箱中继续培养48小时。将snap-561、halo-488、pyp-488、 clip-488以及tc-488荧光染料分别溶于dmem高糖培养基中,终浓度为1μm。用该探针
rbd-pyp-6his。
45.用常规真核hek293t细胞过表达pcmv-rbd-pyp-6his,然后用ni-nta 柱子纯化蛋白,用含200mm咪唑盐的pbs缓冲液洗脱柱子,得到分子量为 42.4kda的目的蛋白rbd(319-541)-pyp约0.5mg。跑sds-page凝胶电泳,如图3所示,第4道为rbd(319-541)-pyp蛋白的纯化后表达条带,分子量略低于标准蛋白44.3kda。
46.实施例7
47.rbd(333-525)-halo融合表达载体的构建,蛋白的表达与纯化
48.用常规分子克隆方法先将新型冠状病毒rbd(333-525)cdna亚克隆到商业pcdna3.1载体中,然后将c端带有6his的halo标签蛋白的cdna亚克隆到rbd的c端,得到pcmv-rbd-halo-6his。
49.用常规真核hek293t细胞过表达pcmv-rbd-halo-6his,然后用ni-nta 柱子纯化蛋白,用含200mm咪唑盐的pbs缓冲液洗脱柱子,得到分子量为 57kda的目的蛋白rbd(333-525)-halo约0.5mg。
50.实施例8
51.荧光标记rbd(333-525)-halo蛋白并纯化
52.rbd(333-525)-halo蛋白溶于pbs(20mm,ph=7.4)缓冲液中,制成 1.1mg/ml的母液。halo640荧光染料溶于dmso配置成2mm的母液。取rbd (333-525)-halo蛋白溶液20μl,加入halo640荧光染料0.6μl,使得蛋白与探针的摩尔比值为1:3,室温下反应2小时得到rbd(333-525)-halo-640dye。然后用pbs(20mm,ph=7.4)缓冲液过葡聚糖凝胶柱g-25除盐,洗脱下来的rbd(333-525)-halo-640dye用浓缩柱浓缩,用考马斯亮蓝染色法测出纯化后的rbd(333-525)-halo-640dye蛋白浓度为0.17mg/ml,摩尔浓度约为3μm。
53.取rbd(333-525)-halo和rbd(333-525)-halo-640dye少量,跑sds-page 电泳,其考马斯亮蓝染色图像以及紫外光激发成像如图4所示。图4的左图为考马斯亮蓝染色,右图为紫外激发的荧光成像,其中第3和4道分别为rbd (333-525)-halo和rbd(333-525)-halo-640dye。蛋白rbd(333-525)-halo 的分子量约为57kda,介于标准蛋白44.3kda与66.4kda之间,荧光标记后的 rbd(333-525)-halo-640dye在紫外光激发下显示出红色的荧光。
54.实施例9
55.rbd(319-541)-halo融合表达载体的构建,蛋白的表达与纯化
56.用常规分子克隆方法先将新型冠状病毒rbd(319-541)cdna亚克隆到商业pcdna3.1载体中,然后将c端带有6his的halo标签蛋白的cdna亚克隆到rbd的c端,得到pcmv-rbd-halo-6his。
57.用常规真核hek293t细胞过表达pcmv-rbd-halo-6his,然后用ni-nta 柱子纯化蛋白,用含200mm咪唑盐的pbs缓冲液洗脱柱子,得到分子量为 59.6kda的目的蛋白rbd(319-541)-halo约0.5mg。
58.实施例10
59.荧光标记rbd(319-541)-halo蛋白并纯化
60.rbd(319-541)-halo蛋白溶于pbs(20mm,ph=7.4)缓冲液中,制成 0.55mg/ml的母液。halo640荧光染料溶于dmso配置成2mm的母液。取rbd (319-541)-halo蛋白溶液20μl,加入halo640荧光染料0.6μl,使得蛋白与探针的摩尔比值为1:3,室温下反应2小时得到rbd
(319-541)-halo-640dye。然后用pbs(20mm,ph=7.4)缓冲液过葡聚糖凝胶柱g-25除盐,洗脱下来的rbd(319-541)-halo-640dye用浓缩柱浓缩,用考马斯亮蓝染色法测出纯化后的rbd(319-541)-halo-640dye蛋白浓度为0.18mg/ml,摩尔浓度约为3.1μm。
61.取rbd(319-541)-halo和rbd(319-541)-halo-640dye少量,跑sds-page 电泳,其考马斯亮蓝染色图像以及紫外光激发成像如图4所示。图4的左图为考马斯亮蓝染色,右图为紫外激发的荧光成像,其中第1和2道分别为rbd (319-541)-halo和rbd(319-541)-halo-640dye。蛋白rbd(319-541)-halo 的分子量约为59.6kda,介于标准蛋白44.3kda与66.4kda之间,荧光标记后的rbd(319-541)-halo-640dye在紫外光激发下显示出红色的荧光。
62.实施例11
63.荧光标记snap-rbd(308-553)蛋白并纯化
64.snap-rbd(308-553)蛋白溶于pbs(20mm,ph=7.4)缓冲液中,制成 0.5mg/ml的母液。snap488荧光染料溶于dmso配置成2mm的母液。取 snap-rbd(308-553)蛋白溶液40μl,加入halo640荧光染料0.6μl,使得蛋白与探针的摩尔比值为1:3,室温下反应2小时得到snap-rbd(308-553)
ꢀ-
488dye。然后用pbs(20mm,ph=7.4)缓冲液过葡聚糖凝胶柱g-25除盐,洗脱下来的snap-rbd(308-553)-488dye用浓缩柱浓缩,用考马斯亮蓝染色法测出纯化后的snap-rbd(308-553)-488dye蛋白浓度为0.22mg/ml,摩尔浓度约为4.3μm。
65.取snap-rbd(308-553)和snap-rbd(308-553)-488dye少量,跑 sds-page电泳,其考马斯亮蓝染色图像以及紫外光激发成像如图5所示。图5 的左图为考马斯亮蓝染色,右图为紫外激发的荧光成像,其中第1和2道分别为snap-rbd(308-553)和snap-rbd(308-553)-488dye。蛋白snap-rbd (308-553)的分子量约为50.7kda,介于标准蛋白44.3kda与66.4kda之间,荧光标记后的snap-rbd(308-553)-488dye在紫外光激发下显示出绿色的荧光。
66.实施例12
67.荧光标记的rbd-halo与荧光标记的snap-hace2的相互作用成像。
68.将hela细胞传于共聚焦成像皿,24小时后,按照说明书用lipofectamine2000试剂分别将500ng质粒载体pcmv-snap-hace2转入hela细胞,4小时后将培养液换成含有10%胎牛血清的dmem高糖培养液,37℃5%co2培养箱中继续培养48小时。将snap-561荧光染料溶于dmem高糖培养基中,终浓度为0.2μm。用该探针溶液孵育细胞15min,然后用dmem洗一遍,加入1mldmem培养基,加入rbd(333-525)-halo-640dye至终浓度为20nm,同时,加入细胞核染料hoechst33342终浓度为0.5μm,在37℃5%co2培养箱中孵育10min。用荧光共聚焦显微镜在100倍油镜下成像,如图6a-d所示。
69.图6a为405nm激发下的hela细胞核成像,显示的是hoechst 33342染料的荧光;图6b为561nm激发下的hela细胞成像,显示的是snap-561染料的荧光,snap-561标记在细胞膜过表达的snap-hace2蛋白上,因此561通道显示的是荧光标记的snap-hace2蛋白;图6c为640nm激发下的hela细胞成像,显示的是rbd525-halo-640dye的荧光;图6d为图2a-c叠加的图像,可见图6b 和图6c的荧光能够很好地重叠,证明了hace2蛋白与rbd蛋白能够相互作用。
70.实施例13
71.荧光标记的rbd-halo蛋白与野生型hace2的相互作用成像
72.将hela细胞传于共聚焦成像皿,24小时后,后,按照说明书用lipofectamine2000
试剂分别将500ng质粒载体pcmv-hace2-sv-egfp转入hela细胞,4小时后将培养液换成含有10%胎牛血清的dmem高糖培养液,37℃5%co2培养箱中培养48小时。将培养基换成1ml dmem培养基,加入rbd(333-525)
ꢀ-
halo-640dye至终浓度为20nm,同时,加入细胞核染料hoechst33342终浓度为0.5μm,在37℃5%co2培养箱中孵育10min。用荧光共聚焦显微镜在100 倍油镜下成像,如图6e-h所示。
73.图6e为405nm激发下的hela细胞核成像,显示的是hoechst 33342染料的荧光;图6f为488nm激发下的hela细胞成像,显示的是绿色荧光蛋白egfp 的荧光,egfp在pcmv-hace2-sv-egfp质粒中是一个报告基因,只要有egfp 表达的细胞,其细胞膜上一定过表达了和野生型的人源ace2蛋白;图6g为640 nm激发下的hela细胞成像,显示的是rbd(333-525)-halo-640dye的荧光;图6h为图6e-h叠加的图像,可见rbd(333-525)-halo-640dye标记在有egfp 蛋白表达的细胞的细胞膜上,证明了rbd(333-525)-halo蛋白能够与野生型的hace2蛋白相互作用。
74.实施例14
75.荧光标记的snap-rbd(308-553)蛋白与halo-hace2的相互作用成像
76.将hela细胞传于共聚焦成像皿,24小时后,后,按照说明书用lipofectamine2000试剂分别将500ng质粒载体pcmv-halo-hace2转入hela细胞,4小时后将培养液换成含有10%胎牛血清的dmem高糖培养液,37℃5%co2培养箱中培养45小时。将halo-561荧光染料溶于dmem高糖培养基中,终浓度为0.2μm。用该探针溶液孵育细胞15min,然后用dmem洗一遍,将培养基换成1mldmem培养基,加入snap-rbd(308-553)-488dye至终浓度为50nm,在37℃ 5%co2培养箱中孵育30min。用荧光共聚焦显微镜在100倍油镜下成像,如图 7a-c所示。
77.图7a为561nm激发下的hela细胞成像,显示的是halo-561染料的荧光, halo-561标记在细胞膜过表达的halo-hace2蛋白上,因此561通道显示的是荧光标记的halo-hace2蛋白;图7b为488nm激发下的hela细胞成像,显示的是snap-rbd(308-553)-488dye的荧光;图7c为图7a,b叠加的图像,可见图 7a和图7b的荧光能够很好地重叠,证明了hace2蛋白与rbd蛋白能够相互作用。
78.实施例15
79.荧光标记的rbd(319-541)-halo蛋白与clip-hace2的相互作用成像
80.将hela细胞传于共聚焦成像皿,24小时后,后,按照说明书用lipofectamine2000试剂分别将500ng质粒载体pcmv-clip-hace2转入hela细胞,4小时后将培养液换成含有10%胎牛血清的dmem高糖培养液,37℃5%co2培养箱中培养45小时。将clip-488荧光染料溶于dmem高糖培养基中,终浓度为0.5μm。用该探针溶液孵育细胞60min,然后用dmem洗一遍,将培养基换成1mldmem培养基,加入rbd(319-541)-halo-640dye至终浓度为100nm,在37℃ 5%co2培养箱中孵育30min。用荧光共聚焦显微镜在100倍油镜下成像,如图 7a-c所示。
81.图7d为488nm激发下的hela细胞成像,显示的是clip-488染料的荧光,clip-488标记在细胞膜过表达的clip-hace2蛋白上,因此488通道显示的是荧光标记的clip-hace2蛋白;图7e为640nm激发下的hela细胞成像,显示的是rbd(319-541)-halo-640dye的荧光;图7f为图7d,e叠加的图像,可见图7d和图7e的荧光能够很好地重叠,证明了hace2蛋白与rbd蛋白能够相互作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1