一种复合痰消化液的制作方法
[0001]
本发明涉及一种复合痰消化液,属于痰消化技术领域。
背景技术:
[0002]
痰液样本、尿液、分泌物、粪便等是临床上常见样本。其中,痰液样本是目前国内样本量最大的样本,占样本总量的70%左右。痰液样本是半固体状的非均一性样本,致病菌常常被包裹在粘液中,随机取样直接检验易造成漏检或误检,因此需要对痰液样本进行细菌学培养后再进行检验。痰液样本均质化(俗称痰消化)是痰液细菌学培养的重要步骤。
[0003]
痰液样本均质化是在痰液样本中加入痰消化液后进行温育消化。现有技术常用的痰消化液有胰酶痰消化液、α-糜蛋白酶痰消化液、n-乙酰-l-半胱氨酸痰消化液、sputasol痰消化液等。为保证消化效果,温育消化时间通常较久(长达1小时),不利于快速接种。而对加入痰消化液的样本进行震荡可以实现快速消化,但震荡消化易导致细菌裂解死亡,进而影响检测结果的准确性。
技术实现要素:
[0004]
本发明的目的是提供一种复合痰消化液,可以解决现有痰消化液在震荡消化时微生物易裂解死亡的问题。
[0005]
本发明还提供了一种上述复合痰消化液的应用。
[0006]
为了实现以上目的,本发明的复合痰消化液所采用的技术方案是:
[0007]
一种复合痰消化液,包括痰消化液和震荡保护剂;所述震荡保护剂包括消泡剂、表面活性剂、蛋白胨中的任意一种或组合。
[0008]
本发明的复合痰消化液,用于震荡消化时,能够在使痰液样本快速消化且保证消化效果的同时,确保微生物在震荡过程中不被裂解、死亡,提高接种结果的准确性。尤其是震荡消化时,采用本发明的复合痰消化液,可以确保化脓链球菌、口腔链球菌、卡他莫拉菌、诺卡菌等不被破裂而死亡。
[0009]
所述痰消化液为市售产品或按照现有技术自制得到,例如为市售的胰酶痰消化液、α-糜蛋白酶痰消化液、n-乙酰-l-半胱氨酸痰消化液、oxoid的sputasol痰消化液或含dtt的痰消化液等,混入震荡保护剂后仍根据原说明书使用。
[0010]
优选的,所述消泡剂为无硅消泡剂。所述无硅消泡剂优选为发酵食品级无硅消泡剂。例如无硅消泡剂为无硅消泡剂f1152和/或无硅消泡剂df-103。
[0011]
优选的,所述表面活性剂为非离子表面活性剂。进一步优选的,所述非离子表面活性剂选自聚氧乙烯型非离子表面活性剂、多元醇型非离子表面活性剂中的任意一种或组合。例如所述聚氧乙烯型非离子表面活性剂为聚乙二醇。所述聚乙二醇的平均分子量为2000~6000。优选的,所述聚氧乙烯型非离子表面活性剂为聚乙二醇2000、聚乙二醇6000中的任意一种或组合。例如所述多元醇型非离子表面活性剂为吐温型非离子表面活性剂。优选的,所述多元醇型非离子表面活性剂选自吐温-20、吐温-80中的一种或两种。
[0012]
优选的,每1l痰消化液对应采用的震荡保护剂的质量为0.01~41g。例如每1l痰消化液对应采用的震荡保护剂的质量可以为0.05g、0.1g、0.2g、0.3g、0.4g、0.5g、0.6g、0.7g、0.8g、0.9g、1g、2g、3g、4g、5g、6g、7g、8g、9g、10g、11g、12g、13g、14g、15g、16g、17g、18g、19g、20g、21g、22g、23g、24g、25g、26g、27g、28g、29g、30g、31g、32g、33g、34g、35g、36g、37g、38g、39g或40g。
[0013]
优选的,所述震荡保护剂包括消泡剂。进一步优选的,每1l痰消化液对应采用的消泡剂的质量为0.01-1g。例如每1l痰消化液对应采用的消泡剂的质量为0.05g、0.1g、0.2g、0.3g、0.4g、0.5g、0.6g、0.7g、0.8g或0.9g。所述震荡保护剂包括消泡剂时,震荡保护剂为消泡剂或表面活性剂、蛋白胨中至少一种与消泡剂的组合,如消泡剂+表面活性剂、消泡剂+蛋白胨、消泡剂+表面活性剂+蛋白胨。
[0014]
优选的,所述震荡保护剂包括表面活性剂。进一步优选的,每1l痰消化液对应采用的表面活性剂的质量为0.1-10g。例如每1l痰消化液对应采用的表面活性剂的质量为0.5g、1g、2g、3g、4g、5g、6g、7g、8g或9g。所述震荡保护剂包括表面活性剂时,震荡保护剂为表面活性剂或消泡剂、蛋白胨中至少一种与表面活性剂的组合,如表面活性剂+消泡剂、表面活性剂+蛋白胨、消泡剂+表面活性剂+蛋白胨。
[0015]
优选的,所述震荡保护剂包括蛋白胨。进一步优选的,每1l痰消化液对应采用的蛋白胨的质量为1-10g。例如每1l痰消化液对应采用的蛋白胨的质量为1g、2g、3g、4g、5g、6g、7g、8g或9g。所述震荡保护剂包括蛋白胨时,震荡保护剂为蛋白胨或消泡剂、表面活性剂中至少一种与蛋白胨的组合,如蛋白胨+消泡剂、蛋白胨+表面活性剂蛋白胨+消泡剂+表面活性剂。所述蛋白动为动物源蛋白胨和/或植物源蛋白胨。所述蛋白胨优选为动物源蛋白胨。
[0016]
优选的,所述震荡保护剂还包括多羟基有机物。每1l痰消化液对应采用的多羟基有机物的质量为1~10g。例如每1l痰消化液对应采用的多羟基有机物的质量为2g、3g、4g、5g、6g、7g、8g或9g。所述多羟基有机物为糖类物质。糖类物质可以为双糖、多糖中的一种或任意组合。优选的,所述糖类物质为糊精、海藻糖、蔗糖中的任意一种或组合。所述震荡保护剂还包括多羟基有机物时,所述震荡保护剂包括多羟基有机物和消泡剂、表面活性剂、蛋白胨中至少一种形成的组合,例如为多羟基有机物+消泡剂、多羟基有机物+表面活性剂、多羟基有机物+蛋白胨、多羟基有机物+消泡剂+表面活性剂、多羟基有机物+消泡剂+蛋白胨、多羟基有机物+表面活性剂+蛋白胨或多羟基有机物+消泡剂+表面活性剂+蛋白胨。
[0017]
优选的,所述震荡保护剂还包括蛋白质。每1l痰消化液对应采用的蛋白质的质量为1~10g。例如每1l痰消化液对应采用的蛋白质的质量为2g、3g、4g、5g、6g、7g、8g或9g。所述蛋白质为牛血清白蛋白、酪蛋白中的任意一种或组合。所述白蛋白优选为牛血清白蛋白。所述震荡保护剂还包括蛋白质时,震荡保护剂包括蛋白质和消泡剂、表面活性剂、蛋白胨中至少一种形成的组合,例如为蛋白质+消泡剂、蛋白质+表面活性剂、蛋白质+蛋白胨、蛋白质+消泡剂+表面活性剂、蛋白质+消泡剂+蛋白胨、蛋白质+表面活性剂+蛋白胨或蛋白质+消泡剂+表面活性剂+蛋白胨。当震荡保护剂含有多羟基有机物、蛋白质和消泡剂、表面活性剂、蛋白胨中至少一种时,震荡保护剂为蛋白质+多羟基有机物+消泡剂、蛋白质+多羟基有机物+表面活性剂、蛋白质+多羟基有机物+蛋白胨、蛋白质+多羟基有机物+消泡剂+表面活性剂、蛋白质+多羟基有机物+消泡剂+蛋白胨、蛋白质+多羟基有机物+表面活性剂+蛋白胨或蛋白质+多羟基有机物+消泡剂+表面活性剂+蛋白胨。
[0018]
作为举例,本发明的复合痰消化液可为痰消化液+消泡剂、痰消化液+表面活性剂、痰消化液+蛋白胨,也可以为痰消化液+消泡剂+表面活性剂、痰消化液+蛋白胨+表面活性剂、痰消化液+蛋白胨+消泡剂、痰消化液+消泡剂+表面活性剂+蛋白胨。本发明复合痰消化液在制备时,包括以下步骤:将痰消化液和震荡保护剂混合均匀。
附图说明
[0019]
图1为实验例2中痰液样本震荡前后的对比图;
[0020]
图2为实验例3中痰液样本震荡前后的对比图;
[0021]
图3为实验例4中痰液样本震荡前后的对比图;
[0022]
图4为实验例5中痰液样本震荡前后的对比图;
[0023]
图5为实验例6中痰液样本震荡前后的对比图。
具体实施方式
[0024]
以下结合具体实施方式本发明的技术方案作进一步的说明。
[0025]
实施例中采用的动物源蛋白胨为购自偃师百家工贸有限公司的细菌学蛋白胨。
[0026]
实施例中采用的安图生物痰消化液为郑州安图生物工程股份有限公司生产的市售痰样本消化液(豫郑械备20190184号,主要成分为dtt),oxoid痰消化液为oxoid公司生产的痰消化液(sputasol)产品。
[0027]
实施例中采用的无硅消泡剂f1152、无硅消泡剂df-103均购自深圳大洋新材料有限公司。
[0028]
实施例1
[0029]
本实施例的复合痰消化液,由痰消化液和震荡保护剂组成;每1l痰消化液对应采用的震荡保护剂的质量为0.1g;其中痰消化液为安图生物痰样本消化液,震荡保护剂为无硅消泡剂f1152。本实施例的复合痰消化液的制备方法包括以下步骤:将痰样本消化液和震荡保护剂混合均匀,即得。
[0030]
实施例2
[0031]
本实施例的复合痰消化液,由痰消化液和震荡保护剂组成;每1l痰消化液对应采用的震荡保护剂的质量为1g;其中痰消化液为安图生物痰样本消化液,震荡保护剂为吐温-20。本实施例的复合痰消化液的制备方法包括以下步骤:将痰消化液和震荡保护剂混合均匀,即得。
[0032]
实施例3
[0033]
本实施例的复合痰消化液,由痰消化液和震荡保护剂组成;其中痰消化液为安图生物痰样本消化液,震荡保护剂为吐温-20和无硅消泡剂f1152;每1l痰消化液对应采用的吐温-20的质量为1g,对应采用的无硅消泡剂f1152的质量为0.1g。本实施例的复合痰消化液的制备方法包括以下步骤:将痰消化液和震荡保护剂混合均匀,即得。
[0034]
实施例4~42
[0035]
实施例4~42的复合痰消化液均由痰消化液和震荡保护剂组成,各实施例具体采用的痰消化液、震荡保护剂以及震荡保护剂的用量见表1。
[0036]
表1实施例4~42采用的痰消化液、震荡保护剂以及震荡保护剂的用量
[0037][0038]
[0039]
[0040][0041]
以上实施例4~42中复合痰消化液在制备时,将所采用的痰消化液和震荡保护剂混合均匀,即得。
[0042]
对比例1
[0043]
本对比例的痰消化液同实施例1,痰消化液中不添加任何震荡保护剂。
[0044]
实验例1
[0045]
取42份1ml的痰液样本分别按照实施例1~42痰液样本的消化方法进行消化;另外设置与42个实施例一一对应的42个对比例,各对比例与对应实施例的区别仅在省去所采用的震荡保护剂;分别取与对应实施例相同的痰液样本1ml按照各对比例的方法进行消化。
[0046]
然后用移液器分别吸取每个消化完成的处理液10微升接种至对应培养基上(各对比例和对应实施例的培养基完全相同),用接种环进行划线,最后放置35-37℃条件下进行细菌学培养,然后对各培养基随机选择的一种或几种菌(各对比例和对应实施例选取的菌一致)采用平板计数法统计各培养基中的活菌数,结果见表2。
[0047]
表2各实施例及对应对比例的培养基中选取菌的活菌数统计结果
[0048]
[0049]
[0050][0051]
由表2中数据可知,添加震荡保护剂的痰消化液对痰样本中的菌有较好的保护作用。
[0052]
实验例2
[0053]
用新鲜活化的卡他莫拉菌atcc25238制成0.5麦氏的菌悬液,从中取3份完全相同的菌悬液(每份1ml),然后任取其中1份(第1份)加入1ml的生理盐水,再取1份(第2份)加入1ml安图生物痰消化液,最后1份(第3份)加入1ml复合痰消化液,然后在室温的环境中震荡10min。其中复合痰消化液是将震荡保护剂加入安图生物痰消化液中混合得到,每1l的安图生物痰消化液中加入的震荡保护剂的质量为1g;所采用的震荡保护剂为吐温80。
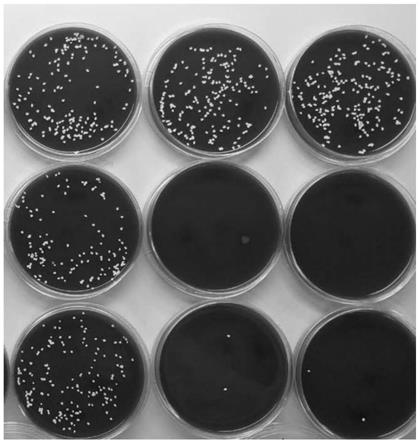
[0054]
每份震荡前后的形貌见图1,其中第1列的第1行为第1份菌悬液加入生理盐水未进行震荡的示意图,第1列的第2~3行为第1份菌悬液加入生理盐水震荡后的示意图。第2列的第1行为第2份菌悬液加入安图生物痰消化液未进行震荡的示意图,第2列的第2~3行为第2
份菌悬液加入安图生物痰消化液震荡后的示意图。第3列的第1行为第3份菌悬液加入复合痰消化液未进行震荡的示意图,第3列的第2~3行为第3份菌悬液加入复合痰消化液震荡后的示意图。由图1可知,是震荡本身导致菌落死亡,使用复合痰消化液震荡后菌落明显多于不加震荡保护剂的安图生物痰消化液。
[0055]
实验例3
[0056]
用新鲜活化的化脓链球菌atcc19615制成0.5麦氏的菌悬液,从中取3份完全相同的菌悬液(每份1ml),然后任取其中1份(第1份)加入1ml的复合痰消化液,再取1份(第2份)加入1ml的生理盐水,最后1份(第3份)加入1ml的安图生物痰消化液,然后在室温的环境中震荡10min。其中复合痰消化液是将震荡保护剂加入安图生物痰消化液中混合得到,每1l安图生物痰消化液中加入的震荡保护剂的质量为1g;所采用的震荡保护剂为吐温80。
[0057]
每份震荡前后的形貌见图2,其中第1列的第1行为第1份菌悬液加入复合痰消化液未进行震荡的示意图,第1列的第2~3行为第1份菌悬液加入复合痰消化液震荡后的示意图。其中第2列的第1行为第2份菌悬液加入生理盐水未进行震荡的示意图,第2列的第2~3行为第2份菌悬液加入生理盐水震荡后的示意图。第3列的第1行为第3份菌悬液加入安图生物痰消化液未进行震荡的示意图,第3列的第2~3行为第3份菌悬液加入安图生物痰消化液震荡后的示意图。由图2可知,是震荡本身导致菌落死亡,使用复合痰消化液震荡后菌落明显多于不加震荡保护剂的安图生物痰消化液。
[0058]
实验例4
[0059]
用新鲜活化的口腔链球菌atcc6429制成0.5麦氏的菌悬液,从中取3份完全相同的菌悬液(每份1ml),然后任取其中1份(第1份)加入1ml的复合痰消化液,再取1份(第2份)加入1ml的生理盐水,最后1份(第3份)加入1ml的oxoid痰消化液,然后在室温的环境中震荡10min。其中复合痰消化液是将震荡保护剂加入oxoid痰消化液中混合得到;采用的震荡保护剂为吐温80和无硅消泡剂f1152,每1l的oxoid痰消化液中加入的吐温80的质量为1g,加入的无硅消泡剂f1152的质量为0.1g。
[0060]
每份震荡前后的形貌见图3,其中第1列的第1行为第1份菌悬液加入复合痰消化液未进行震荡的示意图,第1列的第2~3行为第1份菌悬液加入复合痰消化液震荡后的示意图。其中第2列的第1行为第2份菌悬液加入生理盐水未进行震荡的示意图,第2列的第2~3行为第2份菌悬液加入生理盐水震荡后的示意图。第3列的第1行为第3份菌悬液加入oxoid痰消化液未进行震荡的示意图,第3列的第2~3行为第3份菌悬液加入oxoid痰消化液震荡后的示意图。由图3可知,是震荡本身导致菌落死亡,使用复合痰消化液震荡后菌落明显多于不加震荡保护剂的oxoid痰消化液。
[0061]
实验例5
[0062]
用新鲜活化的嗜麦芽窄食单胞菌atcc17666制成0.5麦氏的菌悬液,从中取3份完全相同的菌悬液(每份1ml),然后任取其中1份(第1份)加入1ml的复合痰消化液,再取1份(第2份)加入1ml的生理盐水,最后1份(第3份)加入1ml的oxoid痰消化液,然后在室温的环境中震荡10min。其中复合痰消化液是将震荡保护剂加入oxoid痰消化液中混合得到;采用的震荡保护剂为吐温80和无硅消泡剂f1152,每1l oxoid痰消化液中加入的的吐温80的质量为2g,加入的无硅消泡剂f1152的质量为0.1g。
[0063]
每份震荡前后的形貌见图4,其中第1列的第1行为第1份菌悬液加入复合痰消化液
未进行震荡的示意图,第1列的第2~3行为第1份菌悬液加入复合痰消化液震荡后的示意图。其中第2列的第1行为第2份菌悬液加入生理盐水未进行震荡的示意图,第2列的第2~3行为第2份菌悬液加入生理盐水震荡后的示意图。第3列的第1行为第3份菌悬液加入oxoid痰消化液未进行震荡的示意图,第3列的第2~3行为第3份菌悬液加入oxoid痰消化液震荡后的示意图。由图4可知,是震荡本身导致菌落死亡,使用复合痰消化液震荡后菌落明显多于不加震荡保护剂的oxoid痰消化液。
[0064]
实验例6
[0065]
用新鲜活化的星型诺卡菌临床株制成0.5麦氏的菌悬液,从中取3份完全相同的菌悬液(每份1ml),然后任取其中1份(第1份)加入1ml的复合痰消化液,再取1份(第2份)加入1ml的生理盐水,最后1份(第3份)加入1ml的安图生物痰消化液,然后在室温的环境中震荡10min。其中复合痰消化液是将震荡保护剂加入安图生物痰消化液中混合得到,每1l安图生物痰消化液采用的震荡保护剂质量为1g;所采用的震荡保护剂为吐温80。
[0066]
每份震荡前后的形貌见图5,其中第1列的第1行为第1份菌悬液加入复合痰消化液未进行震荡的示意图,第1列的第2~3行为第1份菌悬液加入复合痰消化液震荡后的示意图。其中第2列的第1行为第2份菌悬液加入生理盐水未进行震荡的示意图,第2列的第2~3行为第2份菌悬液加入生理盐水震荡后的示意图。第3列的第1行为第3份菌悬液加入安图生物痰消化液未进行震荡的示意图,第3列的第2~3行为第3份菌悬液加入安图生物痰消化液震荡后的示意图。由图5可知,是震荡本身导致菌落死亡,使用复合痰消化液震荡后菌落明显多于不加震荡保护剂的安图生物痰消化液。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1