治疗偏头痛的新药琥珀酸呋罗曲坦片的有关物质测定方法与流程
[0001]
本发明涉及一种药物的检测方法,尤其涉及治疗偏头痛的新药琥珀酸呋罗曲坦片的有关物质测定方法,属医药技术领域。
背景技术:
[0002]
偏头痛是临床最常见的原发性头痛类型,临床以发作性中重度、搏动样头痛为主要表现,头痛多为偏侧,一般持续4-72小时,可伴有恶心、呕吐,光、声刺激或日常活动均可加重头痛,安静环境、休息可缓解头痛。偏头痛是一种常见的慢性神经血管性疾患,多起病于儿童和青春期,中青年期达发病高峰,女性多见,人群中患病率为5%-10%,常有遗传背景。
[0003]
偏头痛原发于中枢神经系统功能紊乱,而血管变化是继发的,偏头痛发作时伴有血及脑脊液中众多神经介质紊乱。有人还提出神经源性炎症引起偏头痛,认为通过刺激三叉神经周围血管纤维可释放出血管活性肽,引起硬脑膜及其所供应组织的神经源性炎症,其主要表现为血浆蛋白外渗和血管扩张。近来研究发现存在于中枢神经系统内的no对疼痛刺激在中枢的传递起重要作用。但近年来倍受关注的是三叉神经血管反射学说,将神经、血管和神经介质三者结合起来,并统一于三叉神经血管系统中。这种假设认为通过刺激大脑中的某些特定区域,经过一系列反应引起颅外血管扩张和颈内动脉血管扩张,产生头痛。在此过程中,血小板释放的5-ht增强了血管受体的敏感性,对疼痛的产生起着重要作用。这一假设较好地解释了一些偏头痛的临床表现,为一些既作用于中枢神经神经系统也作用于外周神经系统的药物用于治疗偏头痛提供了合理的解释。
[0004]
琥珀酸呋罗曲坦是多种物种(包括人)的离体脑血管收缩剂。在离体动脉血管上观察了琥珀酸呋罗曲坦作为血管收缩剂的活性,并与舒马曲坦进行了比较。在人大脑中动脉上,琥珀酸呋罗曲坦是一种部分激动剂(相对于5-ht),且效应至少是舒马曲坦的5倍。琥珀酸呋罗曲坦对人基底动脉是一种完全激动剂,其效应约是舒马曲坦的8.3倍。琥珀酸呋罗曲坦对兔基底动脉和猫脑中动脉的效应分别是舒马曲坦的23和3倍。在兔,与5-ht相比,琥珀酸呋罗曲坦是一种部分激动剂,而舒马曲坦是一种完全激动剂。在猫,相对于5-ht,琥珀酸呋罗曲坦和舒马曲坦都是部分激动剂。
技术实现要素:
[0005]
发明目的:本发明的目的是提供一种能提高重现性和精密度,从而能更好地控制新药琥珀酸呋罗曲坦片的杂质。
[0006]
技术方案:为了解决上述技术问题,本发明所采用的技术方案是:新药琥珀酸呋罗曲坦片的有关物质测定方法,该方法包括如下步骤:(1)供试品溶液的制备:精密称取本品细粉适量,用流动相稀释并制成每1ml中约含呋罗曲坦0.25mg的溶液,滤过,取续滤液作为供试品溶液;(2)对照溶液的制备:精密量取适量,用流动相稀释制成每1ml中含呋罗曲坦2.5μg的溶液,作为对照溶液;
(3)杂质对照储备液的制备:取杂质a、杂质b适量,用水制成约2.5μg/ml的溶液,作为杂质对照储备液;(4)系统适用性溶液的制备:取琥珀酸呋罗曲坦对照品适量,用杂质对照储备液定容并稀释制成0.25mg/ml的溶液,即得系统适用性溶液;(5)有关物质测定:取对照溶液20μl,注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%~25%,再精密量取对照品及供试品溶液各20μl,分别注入液相色谱仪中,记录色谱图。供试品溶液色谱图中如有杂质峰,杂质a(乘以校正因子0.64)峰面积、杂质b(乘以校正因子0.52)峰面积均不得大于对照溶液主峰面积的0.2倍(0.2%);其它单个最大杂质峰面积不得大于对照溶液主峰面积的0.2倍(0.2%);扣除空白溶剂峰后各杂质峰面积的和不得大于对照溶液主峰面积1.0倍(1.0%)。
具体实施方式
[0007]
下面通过实施例来进一步阐述本发明,应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。
[0008]
实施例1 色谱条件精密称取本品细粉适量,用流动相稀释并制成每1ml中含呋罗曲坦0.25mg的溶液,滤过,取续滤液作为供试品溶液;精密量取适量,用流动相稀释制成每1ml中含呋罗曲坦2.5μg的溶液,作为对照溶液。取杂质a、杂质b适量,用水制成约2.5μg/ml的溶液,作为杂质对照储备液。取琥珀酸呋罗曲坦对照品适量,用杂质对照储备液定容并稀释制成0.25mg/ml的溶液,即得系统适用性溶液。精密量取20μl注入液相色谱仪,出峰顺序依次为呋罗曲坦、杂质a、杂质b。主峰与相邻杂质峰的分离度应大于1.5。
[0009]
照高效液相色谱法:用十八烷基硅烷键合硅胶为填充剂;以0.1%磷酸(用三乙胺调ph至2.5)为流动相a,甲醇为流动相b;检测波长为245nm;柱温为25℃。
[0010]
取对照溶液20μl,注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%~25%,再精密量取对照品及供试品溶液各20μl,分别注入液相色谱仪中,记录色谱图。供试品溶液色谱图中如有杂质峰,杂质a峰面积(乘以校正因子0.64)、杂质b峰面积(乘以校正因子0.52)均不得大于对照溶液主峰面积的0.2倍(0.2%);其它单个最大杂质峰面积不得大于对照溶液主峰面积的0.2倍(0.2%);扣除空白溶剂峰后各杂质峰面积的和不得大于对照溶液主峰面积 1.0倍(1.0%)。
[0011]
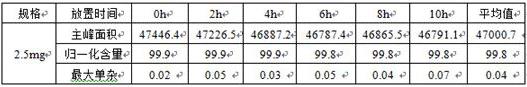
实施例2 样品溶液稳定性分别取本品2.5mg规格制剂有关物质检查供试液,分别于0h、2h、4h、6h、8h、10h进样,考察放置过程中主峰及最大单杂归一化含量的变化。结果见表1。
[0012]
表1 样品溶液稳定性结果表明,本品2.5mg规格制剂有关物质供试液室温放置10小时主峰归一化含量、总杂未有明显变化,即本品有关物质供试液10小时内基本稳定。
[0013]
实施例3 强制降解试验
⑴ꢀ
专属性试验取琥珀酸呋罗曲坦片研磨均匀的细粉适量,采用光、热、酸、碱、氧化及复合的苛刻条件对其进行适度破坏;取各破坏溶液于拟定色谱条件下进样测定,比较破坏前后样品中杂质的变化,同时验证上述色谱条件下主峰与杂质分离效果及主峰峰纯度。
[0014]
试验仪器:agilent 1100高效液相色谱仪 dad检测器
①ꢀ
未破坏:精密称取研磨均匀的本品片剂细粉适量(约相当于琥珀酸呋罗曲坦原料19.55mg),起始比例流动相溶解并稀释至50ml,静置,过滤得未破坏样品溶液;
②ꢀ
高温破坏:精密称取研磨均匀的本品片剂细粉适量(约相当于琥珀酸呋罗曲坦原料19.55mg),西林瓶中,105℃烘箱破坏6小时,放置至室温,起始流动相溶解并转移至50ml容量瓶,静置,定容,过滤得高温破坏样品溶液;
③ꢀ
酸破坏:精密称取研磨均匀的本品片剂细粉适量(约相当于琥珀酸呋罗曲坦原料19.55mg),至西林瓶中,加入1mol/l盐酸溶液1ml,室温放置2小时,加等量1mol/l氢氧化钠溶液中和后,起始流动相溶解并转移至50ml容量瓶静置,定容,过滤得样品溶液;
④ꢀ
碱破坏:精密称取研磨均匀的本品片剂细粉适量(约相当于琥珀酸呋罗曲坦原料19.55mg),至西林瓶中,加入1mol/l氢氧化钠溶液1ml,室温放置1小时,加入等量的1mol/l盐酸溶液中和后,起始比例流动相溶解并转移至50ml容量瓶,静置,定容、过滤得样品溶液;
⑤ꢀ
氧化破坏:精密称取研磨均匀的本品片剂细粉适量(约相当于琥珀酸呋罗曲坦原料19.55mg),置50ml量瓶中,加30%双氧水1.0ml,破坏2小时,起始比例流动相溶解并稀释至刻度,摇匀,过滤;
⑥
光照破坏:精密称取研磨均匀的本品片剂细粉适量(约相当于琥珀酸呋罗曲坦原料19.55mg),置50ml量瓶中,置4500lx光照强度下照射6小时,加起始流动相溶解并稀释至刻度,摇匀,过滤得样品溶液。
[0015]
精密量取上述破坏溶液各20μl,注入液相色谱仪,记录色谱图,考察破坏前后样品中杂质的变化情况,试验结果见表2、表3。
[0016]
表2 琥珀酸呋罗曲坦片破坏试验杂质统计分析(规格:2.5mg、245nm波长)
表3琥珀酸呋罗曲坦片破坏试验杂质统计分析(规格:2.5mg、260nm波长)结果表明,本品制剂在光照条件下,会产生一个新杂质,本品制剂在氧化破坏下,产生两个主要杂质,位于主峰前。
[0017]
本品经光、热、酸、碱、氧化及复合条件破坏产生的多种降解杂质在上述色谱条件下均可与主峰完全分离,且空白辅料在各破坏条件下对杂质检出均无干扰。
[0018]
⑵ꢀ
主峰峰纯度检查为考察经各苛刻条件破坏样品主峰中是否包含未能与之完全分离的杂质,采用dad检测器对各破坏溶液主峰进行纯度分析,结果见表4。
[0019]
表4 破坏试验峰纯度检查(波长245nm)结果表明,采用本品原料有关物质色谱条件测定经各苛刻条件破坏后的本品2.5mg片剂样品中有关物质,琥珀酸呋罗曲坦主峰峰纯度均大于999.000,说明主峰中不包含未能分离的杂质或降解产物,+即原料有关物质色谱条件适用于本品制剂的有关物质检测。
[0020]
⑶ꢀ
物料平衡及降解途径考察为考察拟定有关物质色谱条件能否有效检出降解杂质,对各破坏样品色谱图中主峰面积及其归一化含量进行了统计。结果见表5和表6。
[0021]
表5 破坏试验物料平衡统计(波长245nm)
表6破坏试验物料平衡统计(波长260nm)结果表明本品片剂经各苛刻条件破坏后,样品主峰减少量与其归一化含量下降程度基本一致,说明本色谱条件能将降解杂质有效检出。
[0022]
实施例4 有关物质方法验证总结参照本品原料有关物质测定方法,对本品两规格制剂的有关物质测定方法进行了系统的方法学验证,结果汇总见表7。
[0023]
表7 有关物质方法验证总结结果表明本品原料有关物质测定方法适用于本品的制剂有关物质测定,考虑到本品制剂过程并未明显增加杂质的种类(与原料有关物质进行比较),因此,原料关物质方法亦满足本品制剂检测限定量限及耐用性的要求。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1