一种定量检测生物样品中抗体含量的方法与流程
1.本发明属于生物技术领域,具体涉及一种定量检测生物样品中抗体含量的方法。
背景技术:
2.抗体是机体在抗原的刺激下产生的能够和抗原结合的一类免疫球蛋白。抗体的检测方法众多,除传统的沉淀反应、凝集试验、补体结合试验外,标记免疫测定(如酶联免疫测定、放射免疫测定、荧光免疫测定、发光免疫测定等)已成为主要的免疫测定技术。抗体检测过程中最常见的挑战是抗原对抗体检测的干扰。
3.现有的抗药抗体检测方法包括elisa-桥法、elisa-间接法、电化学发光法等,但各有优缺点。elisa-桥法包被药物,用标记的抗原检测。该方法的优点是能检测各类抗体亚型,无种属特异性,可高通量检测;缺点是不易检测到低亲和力的抗体,包被或标记时可能会掩盖或改变药物的抗原表位,易受药物本身的干扰。elisa-间接法是将抗原直接固定在固相载体上,然后与被测的抗体结合,形成抗原抗体复合物,再利用二抗作为检测试剂进行分析。该方法简单、快速、灵敏度高、便于标准化,但其受抗原的干扰严重,在抗原浓度高的样品中的应用受到限制。电化学发光法源于电化学法和化学发光法,不仅可以应用于所有的免疫测定,还可用于dna/rna探针检测。该方法的优点是灵敏度高、可检测各种抗体亚型、无种属特异性、高通量,可使用高浓度基质,检测表面积大和信号稳定;缺点是需制备2种标记物(生物素和tag)、标记物分子的表位可能会变化或标记过程会改变分子,所用试剂通用性差。由此可见,现有的抗药抗体检测方法普遍存在如下缺点:灵敏度偏低,抗原耐受水平低,靶点干扰无法消除,检测成本高等。
技术实现要素:
4.本发明的目的是如何定量检测生物样品中抗体含量。
5.本发明首先保护一种定量检测生物样品中抗体含量的方法,包括步骤(a)、步骤(b)和步骤(c):
6.所述步骤(a)依次包括如下步骤:
7.(a-1)酸处理生物样品,获得游离的抗体;
8.(a-2)用抗原捕获(a-1)获得的抗体;
9.(a-3)完成步骤(a-2)后,酸处理,获得捕获的抗体;
10.(a-4)完成步骤(a-3)后,用捕获试剂捕获抗体,之后使用标记抗原检测信号强度;
11.所述步骤(b)包括如下步骤:
12.(b-1)酸处理抗体标准溶液,获得游离的抗体;
13.(b-2)完成步骤(b-1)后,用抗原捕获(b-1)获得的抗体;
14.(b-3)完成步骤(b-2)后,酸处理,获得捕获的抗体;
15.(b-4)完成步骤(b-3)后,用捕获试剂捕获抗体,之后使用标记抗原检测信号强度;
16.(b-5)完成步骤(b-4)后,根据抗体标准溶液中各个抗体浓度和相应信号强度绘制
标准曲线;
17.所述步骤(c):将所述步骤(a-4)得到的信号强度代入所述标准曲线,得到生物样品中抗体含量;
18.所述捕获试剂可为protein a、protein g、protein l和所述抗体的抗体中的至少一种;
19.所述酸处理可为ph2.0-6.0(如ph2.0-3.0、ph3.0-4.0、ph4.0-5.0、ph5.0-6.0、ph2.0、ph3.0、ph4.0、ph5.0或ph6.0)的乙酸溶液、磷酸溶液、柠檬酸溶液或盐酸溶液进行处理。
20.上述方法中,所述用捕获试剂捕获抗体时,捕获试剂的浓度可为0.01-100μg/ml(如0.01-1μg/ml、1-5μg/ml、5-50μg/ml、50-100μg/ml、0.01μg/ml、1μg/ml、5μg/ml、50μg/ml或100μg/ml)。所述捕获试剂的溶剂可为ph7.2、10mm pbs缓冲液。
21.上述方法中,所述用捕获试剂捕获抗体时捕获试剂需要进行包被;包被条件可为2-8℃(如2-4℃、4-8℃、2℃、4℃或8℃)孵育12-72h(如12-48h、48-72h、12h、48h或72h)或20-27℃(如20-24℃、24-27℃、20℃、24℃或27℃)孵育0.5-6h(如0.5-2h、2-6h、0.5h、2h或6h)。
22.上述方法中,所述酸处理具体可为浓度为300mm的乙酸溶液(溶剂为ph3.0、10mm pbs缓冲液)进行处理。
23.上述方法中,所述酸处理的条件可为20-60℃(如20-30℃、30-37℃、37-50℃、50-60℃、20℃、30℃、37℃、50℃或60℃)处理5-60min(如5-10min、10-20min、20-30min、30-60min、5min、10min、20min、30min或60min)。
24.上述方法中,所述抗原可为蛋白、多肽、核酸、抗体片段、碳水化合物、脂或小分子化合物。
25.上述方法中,进行步骤(a-2)或(b-2)时,抗原需要固定化。抗原固定化的方法如下:取96孔板,每孔加入抗原,2-8℃过夜;然后洗涤所述96孔板,拍干;之后向所述96孔板中每孔加入200μl 1%(m/v)bsa水溶液,37℃、600rpm处理60
±
5min;再洗涤所述96孔板,拍干。
26.上述方法中,进行步骤(a-2)或(b-2)时,捕获的条件可为20-60℃(如20-30℃、30-37℃、37-50℃、50-60℃、20℃、30℃、37℃、50℃或60℃)孵育40-80min(如40-60min、60-80min、40min、60min或80min)。
27.上述方法中,所述标记抗原可为酶、荧光标记物、化学发光标记物、电化学发光标记物或放射性同位素。
28.上述方法中,所述生物样品可为血清、血浆或脑脊液。
29.上述任一所述的方法中,所述抗体具体可为贝伐珠单抗。此时抗原可为vegf,标记抗原可为biotin-vegf。
30.本发明还保护一种用于定量检测生物样品中抗体含量的试剂盒,具体由捕获试剂、ph2.0-6.0(如ph2.0-3.0、ph3.0-4.0、ph4.0-5.0、ph5.0-6.0、ph2.0、ph3.0、ph4.0、ph5.0或ph6.0)的酸溶液、抗原和标记抗原组成;
31.所述捕获试剂可为protein a、protein g、protein l和所述抗体的抗体中的至少一种;
32.所述抗原可为蛋白、多肽、核酸、抗体片段、碳水化合物、脂或小分子化合物;
33.所述标记抗原可为酶、荧光标记物、化学发光标记物、电化学发光标记物或放射性同位素。
34.上述试剂盒中,所述ph2.0-6.0(如ph2.0-3.0、ph3.0-4.0、ph4.0-5.0、ph5.0-6.0、ph2.0、ph3.0、ph4.0、ph5.0或ph6.0)的酸溶液可为ph2.0-6.0(如ph2.0-3.0、ph3.0-4.0、ph4.0-5.0、ph5.0-6.0、ph2.0、ph3.0、ph4.0、ph5.0或ph6.0)的乙酸溶液、磷酸溶液、柠檬酸溶液或盐酸溶液。
35.上述试剂盒中,所述生物样品可为血清、血浆或脑脊液。
36.上述试剂盒中,所述抗体具体可为贝伐珠单抗。
37.上述试剂盒中,所述抗原可为vegf。
38.上述试剂盒中,所述标记抗原可为biotin-vegf。
39.上述试剂盒中,所述ph2.0-6.0(如ph2.0-3.0、ph3.0-4.0、ph4.0-5.0、ph5.0-6.0、ph2.0、ph3.0、ph4.0、ph5.0或ph6.0)的酸溶液具体可为浓度为300mm的乙酸溶液(溶剂为ph3.0、10mm pbs缓冲液)。
40.实验证明,采用本发明提供的方法定量检测生物样品中抗体含量,批内变异为3.41%—16.39%,批间变异为3.99%—11.07%,批内准确度在83.5%—117.25%,具有较好的准确度和精密度性能;且能够抵抗干扰物的干扰,样品中含有不同浓度的干扰物依然能够准确的定量检测样品的浓度;同时对于超高浓度的样品,未经稀释直接检测,检测结果大于标准曲线的定量上限,未表现出钩状效应;将样品进行不同倍数的稀释,使其浓度落在标准曲线定量范围内,检测结果显示不同稀释样品均符合准确度要求。由此可见,本发明提供的方法可以准确的检测生物样品中抗体含量。本发明具有重要的应用价值。
附图说明
41.图1为采用贝伐珠单抗的梯度溶液制备的标准曲线。
具体实施方式
42.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
43.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
44.实施例1、贝伐珠单抗的检测
45.vegf为北京义翘神州科技股份有限公司的产品。
46.贝伐珠单抗为瑞士roche公司的产品。
47.biotin-vegf:取1支nhs-peg4-生物素(thermo,cat:a39259),加入vegf 0.1mg,混匀,之后室温反应1h,用3kd超滤管以pbs缓冲液超滤换液3次。
48.sa-poly hrp为thermo scientific公司的产品。
49.碳酸盐缓冲液:将1粒胶囊(sigma公司,产品目录号为c3041-50cap)溶于100ml超
纯水,充分溶解。
50.一、生物样品中贝伐珠单抗的浓度检测
51.1、取20μl样品,加入60μl浓度为300mm的乙酸溶液(溶剂为ph3.0、10mm pbs缓冲液),37℃、600rpm处理20
±
5min,得到酸化样品1。
52.样品为浓度为500.00ng/ml的贝伐珠单抗溶液1、浓度为250.00ng/ml的贝伐珠单抗溶液2、浓度为125.00ng/ml的贝伐珠单抗溶液3、浓度为62.50ng/ml的贝伐珠单抗溶液4、浓度为31.25ng/ml的贝伐珠单抗溶液5、浓度为15.63ng/ml的贝伐珠单抗溶液6、浓度为7.82ng/ml的贝伐珠单抗溶液7或生物样品。
53.贝伐珠单抗溶液1—贝伐珠单抗溶液7的溶剂均为人血清。
54.生物样品为血清、血浆或脑脊液。
55.步骤1为第一次酸化,目的为游离抗体。
56.2、取96孔板,每孔加入100μl浓度为100ng/ml的vegf溶液(溶剂为碳酸盐缓冲液),2-8℃过夜。
57.3、完成步骤2后,用洗板机洗涤所述96孔板,拍干。
58.4、完成步骤3后,向所述96孔板中每孔加入200μl 1%(m/v)bsa水溶液,37℃、600rpm处理60
±
5min。
59.5、完成步骤4后,用洗板机洗涤所述96孔板,拍干。
60.步骤2-5为固定化抗原的步骤,抗原为vegf。
61.6、完成步骤5后,向所述96孔板中每孔加入30μl ph9.5、1m的tris-hcl缓冲液,再加入60μl步骤1得到的酸化样品1,37℃孵育60
±
20min。
62.进行步骤6的目的为用抗原捕获样品中游离的抗体。
63.7、完成步骤6后,用洗板机洗涤所述96孔板,拍干。
64.8、完成步骤7后,向所述96孔板中每孔加入100μl浓度为300mm的乙酸溶液(溶剂为ph3.0、10mm pbs缓冲液),37℃、600rpm处理10min,得到酸化样品2。
65.步骤8为第二次酸化,目的为释放捕获的抗体。
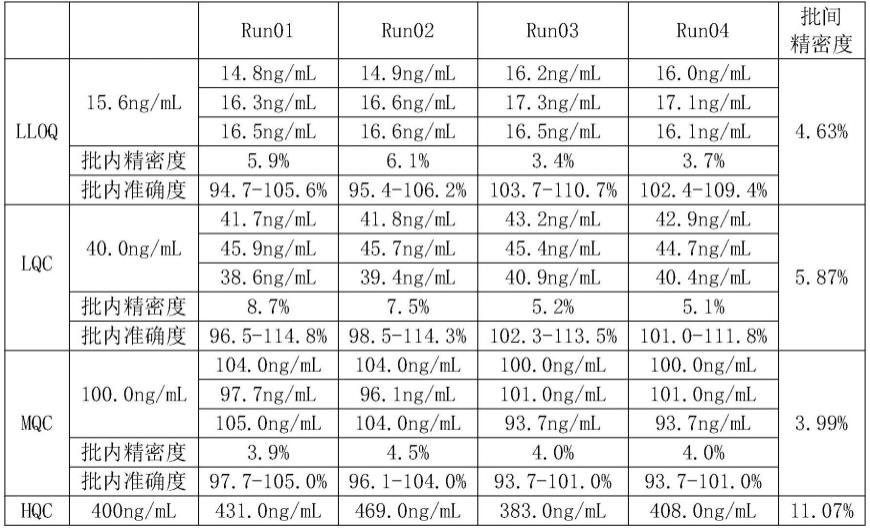
66.9、取新的96孔板,每孔加入100μl浓度为5μg/ml的protein a溶液(溶剂为ph7.2、10mm pbs缓冲液),2-8℃,孵育过夜。
67.protein a为beyotime公司的产品,产品目录号为p5016。
68.10、完成步骤9后,用洗板机洗涤所述96孔板,拍干。
69.11、完成步骤10后,向所述96孔板中每孔加入200μl 1%(m/v)bsa水溶液,37℃、600rpm处理60
±
20min。
70.12、完成步骤11后,用洗板机洗涤所述96孔板,拍干。
71.13、完成步骤12后,向所述96孔板中每孔先加入30μl ph9.5、1m的tris-hcl缓冲液,再加入60μl步骤8得到的酸化样品2,37℃、60orpm孵育60
±
20min。
72.进行步骤13的目的为用捕获试剂protein a捕获释放的抗体。
73.14、完成步骤13后,用洗板机洗涤所述96孔板,拍干。
74.15、完成步骤14后,向所述96孔板中每孔加入100μl浓度为16.7ng/ml的biotin-vegf溶液(溶剂为1%(m/v)bsa水溶液),37℃、600rpm孵育60
±
20min;用洗板机洗涤所述96孔板,拍干。
75.16、完成步骤15后,向所述96孔板中每孔加入100μl sa-poly hrp溶液(使用1%bsa 1:50000稀释作为工作浓度),37℃、600rpm孵育30
±
5min;用洗板机洗涤所述96孔板,拍干。
76.17、完成步骤16后,向所述96孔板中每孔加入100μl tmb(surmodics公司的产品),室温避光反应15min;之后每孔加入50μl终止液(索莱宝公司的产品);最后用酶标仪读取每孔的od
450nm
。
77.18、分别以贝伐珠单抗溶液1—贝伐珠单抗溶液7中贝伐珠单抗的浓度为横坐标,对应的od
450nm
为纵坐标,绘制标准曲线。
78.标准曲线见图1。结果表明,贝伐珠单抗的线性范围为15.625—500ng/ml,线性相关系数大于0.999。
79.19、根据步骤18绘制的标准曲线和生物样品的od
450nm
,获得生物样品中贝伐珠单抗的浓度。
80.二、准确度和精密度检测
81.当步骤一中的生物样品分别为生物样品1(已知生物样品1中贝伐珠单抗的浓度为15.6ng/ml)、生物样品2(已知生物样品2中贝伐珠单抗的浓度为40.0ng/ml)、生物样品3(已知生物样品3中贝伐珠单抗的浓度为100.0ng/ml)、生物样品4(已知生物样品4中贝伐珠单抗的浓度为400ng/ml)和生物样品5(已知生物样品5中贝伐珠单抗的浓度为500ng/ml)时,采用步骤一的方法分别检测生物样品1-生物样品5中贝伐珠单抗的浓度。其中生物样品1和生物样品2为血清,生物样品3和生物样品4为血浆,生物样品5为脑脊液。
82.每个生物样品重复检测3次,统计批内精密度、批内准确度、批间精密度、批内变异和批间变异。
[0083][0084][0085][0086]
检测结果见表1。结果表明,采用步骤一的方法检测生物样品1-生物样品5中贝伐珠单抗的浓度,批内变异为3.41%—16.39%,批间变异为3.99%—11.07%,批内准确度在83.5%—117.25%。由此可见,步骤一的方法具有较好的准确度和精密度性能。
[0087]
表1
[0088][0089][0090]
注:lloq为定量下限,lqc为低浓度质控,mqc为终浓度质控,hqc为高浓度质控,uloq为定量上限,run01-run04为不同分析批次。
[0091]
三、选择性检测
[0092]
当步骤一中的生物样品分别为选择性考察样品时,采用步骤一的方法分别检测选择性考察样品中贝伐珠单抗的浓度。选择性考察样品的配制方法如下:选择10份不同来源的个体血清(依次命名为sel-1—sel-10),之后分别用这10份血清独立配制含lloq浓度水平(15.625ng/ml)和uloq浓度水平(500ng/ml)贝伐珠单抗的样品。。
[0093]
检测结果见表2。结果表明,步骤一的方法对于不同受试样品的选择性,结果显示80%的基质(血清)制备的样品满足准确度要求。
[0094]
表2
[0095] blanklloq(15.625ng/ml)uloq(500ng/ml)sel-1小于定量下限13.5494sel-2小于定量下限15.4545sel-3小于定量下限17.0675sel-4小于定量下限15.8583sel-5小于定量下限15.3660sel-6小于定量下限16.0619
sel-7小于定量下限13.8581sel-8小于定量下限13.3593sel-9小于定量下限13.9532sel-10小于定量下限16.0545
[0096]
注:lloq为定量下限,uloq为定量上限,blank为不同个体来源空白血清基质样品。
[0097]
四、特异性检测
[0098]
当步骤一中的生物样品分别为特异性考察样品时,采用步骤一的方法分别检测特异性考察样品中贝伐珠单抗的浓度。特异性考察样品的配制方法如下:使用空白人血清配制含hqc浓度水平(400ng/ml)和lqc浓度水平(40ng/ml)的贝伐珠单孔溶液,再以此溶液稀释配制含不同浓度人免疫球蛋白干扰物的特异性考察样品,其中特异性考察样品1—特异性考察样品5依次命名为spe-hqc-01—spe-hqc-05,特异性考察样品6—特异性考察样品10依次命名为spe-lqc-01—spe-lqc-05。干扰物为人免疫球蛋白。
[0099]
检测结果见表3。结果表明,步骤一的方法能够抵抗干扰物的干扰,样品中含有不同浓度的干扰物依然能够准确的定量检测样品的浓度。
[0100]
表3
[0101][0102]
五、钩状效应和稀释线性
[0103]
当步骤一中的生物样品分别为稀释线性考察样品1(dqc1)—稀释线性考察样品3(dqc3)时,采用步骤一的方法分别检测特异性考察样品1—特异性考察样品10中贝伐珠单抗的浓度。稀释线性考察样品1(dqc1)—稀释线性考察样品3(dqc3)依次为人空白血清配制的含125000、25000或5000ng/ml的贝伐珠单抗样品。
[0104]
检测结果见表4。结果表明,对于超高浓度的样品,未经稀释直接检测,检测结果大于标准曲线的定量上限,未表现出钩状效应;将样品进行不同倍数的稀释,使其浓度落在标准曲线定量范围内,检测结果显示不同稀释样品均符合准确度要求。
[0105]
表4
[0106][0107][0108]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1