一种羊支原体肺炎平板凝集抗原及其制备方法与应用
1.本发明属于兽医诊断技术领域,具体涉及一种羊支原体肺炎平板凝集抗原及其制备方法与应用。
背景技术:
2.羊支原体肺炎,又称羊传染性胸膜肺炎,是由支原体引起的一种高度接触性传染病,临床上表现为高热、咳嗽胸腔浆液性和纤维素性炎症,传入性强,急性病例表现为肺炎,死亡率高,慢性病例主要表现为关机炎、乳房炎、腹膜炎等。该病在世界范围内广泛存在,我国主要养羊省份均存在该病,特别是内蒙古、青海、新疆、山东等养羊规模较大、密度较高的省份。我国最早于1935年内蒙古就有类似该病的记录,1942年~1943年在甘肃报告过羊传染性胸膜肺炎的流行,其后直到当前,在内蒙、东北、华北等地也出现过该病,其发病率在10~90%,死亡率通常在0.85~60%,最高可达100%。该病给我国养羊业造成巨大的经济损失,严重影响养羊业的长期健康发展。
3.引起羊支原体肺炎的病原种类较多,主要包括丝状支原体山羊亚种、山羊支原体山羊亚种和绵羊肺炎支原体3种病原,也有学者认为丝状支原体丝状亚种也能感染引山羊起肺炎,但病例不常见。其中丝状支原体山羊亚种可感染山羊和绵羊,3岁以下山羊最为易感;山羊支原体山羊亚种只感染山羊,绵羊不易感;绵羊肺炎支原体可感染山羊和绵羊。感染羊是最主要的传染源,传播途径主要通过接触传播和空气传播,引起绵羊支原体肺炎可以由一种支原体感染引起,也可以由2种或3种支原体混合感染所致。当前我国获得批准的羊支原体病检测试剂产品有绵羊肺炎支原体elisa抗体检测试剂盒、山羊传染性胸膜肺炎间接血凝试验抗原与阴阳性血清、绵羊支原体肺炎间接血凝试验抗原与阴阳性血清和山羊支原体山羊肺炎亚种抗体检测试纸条4种产品,但中国兽药信息网的国家基础数据库(http://vdts.ivdc.org.cn:8081/cx/)显示,以上产品批准至今,均无生产和批签发记录,由此可判断当前我国批准生产的羊支原体检测试剂均没有进行实际生产和销售,分析其原因可能是产品与实际需求存在差距,无法满足当前生产需要。当前能引起羊支原体肺炎的主要有3个支原体种类,而获得批准的4个产品均只能检测其中的1种,容易引起误判,而且丝状支原体山羊亚种感染没有相应的检测试剂。因此,缺乏一种能一次检测多种羊支原体感染的试剂,如果能简单快速、可视化,则更能符合现场检测的市场需求。
技术实现要素:
4.针对现有技术中的上述不足,本发明提供一种羊支原体肺炎平板凝集抗原及其制备方法与应用。选用丝状支原体山羊亚种sz013株、山羊支原体山羊亚种sy006株和绵羊肺炎支原体my018株研制开发的羊支原体肺炎平板凝集抗原及其对照血清,用于羊血清中羊支原体抗体的快速检测,有助于解决我国当前羊支原体感染检测和防控中的问题。
5.为了达到上述发明目的,本发明采用的技术方案为:
6.提供一种羊支原体肺炎平板凝集抗原,其使用丝状支原体山羊亚种sz013株、山羊
支原体山羊亚种sy006株和绵羊肺炎支原体my018株制成,其中3种支原体菌体的灭活前浓度均为7.0
×
10
10
ccu/ml。
7.提供一种羊支原体肺炎平板凝集抗原的制备方法,包括以下步骤:
8.(1)将丝状支原体山羊亚种sz013株、山羊支原体山羊亚种sy006株和绵羊肺炎支原体my018株分别接种于羊支原体培养基,传代后制成3种基础种子菌液;
9.(2)将3种基础种子液分别接种于羊支原体培养基中扩大培养,获得3种生产种子液;
10.(3)将3种生产种子液分别进行发酵培养,并对菌液进行ccu计数和无菌检验;
11.(4)在3种发酵培养菌液中分别加入含硫柳汞的pbs重悬灭活,按ccu计数结果调整菌液浓度,将3种重悬后的菌液按体积比1:1:1混合,加入结晶紫溶液染色和甘油制备得到羊支原体肺炎平板凝集抗原,混匀后分装保存。
12.进一步地,羊支原体肺炎平板凝集抗原的制备方法具体包括以下步骤:
13.(1)基础种子液的制备:取丝状支原体山羊亚种sz013株、山羊支原体山羊亚种sy006株和绵羊肺炎支原体my018株冻干菌种,开启后,分别按10%的量接种羊支原体培养基,置37℃培养18~36h收获后作为一级基础种子,将一级种子液按10%比例再接种传代1次,收获分装后置-80℃冻存,作为二级基础种子;
14.(2)生产种子液的制备:取丝状支原体山羊亚种sz013株、山羊支原体山羊亚种sy006株和绵羊肺炎支原体my018株的二级基础种子,按10%比例分别接种于生产用羊支原体培养基,置37℃恒温摇床,120rpm震荡培养18~36h至培养基变为黄色,扩大培养,获得生产种子液;
15.(3)发酵培养:采用生物反应器分别大规模培养丝状支原体山羊亚种sz013株、山羊支原体山羊亚种sy006株和绵羊肺炎支原体my018株,先对生物反应器进行灭菌,无菌加入羊支原体培养基,按1:10的比例接种生产种子液,37℃恒温培养,严格控制不通气,待ph下降至6.9~7.0时,添加羊支原体培养基为原培养体积的20%,进行两次补料培养,待第二次培养ph下降到6.7~6.8时收获菌液,并对菌液进行ccu计数和无菌检验;
16.(4)抗原制备,在3种菌液中分别加入0.2~0.4%羟甲基纤维素钠,置2~8℃静置7~10日,8000rpm离心菌液20min,取沉淀用含0.01%硫柳汞的pbs重悬,按照ccu计数结果,调整菌液浓度为2.3
×
10
11
ccu/ml,置37℃灭活3小时,将3种重悬后的菌液按体积比1:1:1混合,反复搅拌均匀后,加入3%结晶紫溶液至终浓度为0.03%,继续搅拌20分钟,加入10%菌液体积的甘油,继续搅拌10分钟,即得到羊支原体肺炎平板凝集抗原,分装后置2~8℃保存。
17.提供一种羊支原体肺炎平板凝集抗原在羊支原体肺炎检测中的应用。
18.本发明的有益效果为:
19.1.本技术提供的羊支原体肺炎平板凝集抗原,相比当前国内已经注册的羊支原体病检测试剂产品,具有检测范围较广的特点,能同时检测3种支原体感染,而且使用简单、直观,普通饲养员,按照说明书即可使用,并进行结果判定。对于养殖企业和农户来讲,只需要知道羊群是否有支原体感染即可,无需确定由何种支原体感染,无论哪种支原体感染,在使用抗生素或药物治疗上没有区别。
20.3.本技术提供的羊支原体肺炎平板凝集抗原生产成本和检测成本低,有利于规模
化生产和推广应用。
21.4.本技术提供的羊支原体肺炎平板凝集抗原在保存条件为2~8℃下,可保存3年以上,室温下可保存2个月以上,便于运输和存放。
附图说明
22.图1为实施例4羊支原体平板凝集抗原与被检羊血清反应结果判定示意图,其中从左至右依次为弱阳性(++)、阳性(+++)、强阳性(++++)、阴性(-)结果。
具体实施方式
23.下面对本发明的具体实施方式进行描述,以便于本技术领域的技术人员理解本发明,但应该清楚,本发明不限于具体实施方式的范围,对本技术领域的普通技术人员来讲,只要各种变化在所附的权利要求限定和确定的本发明的精神和范围内,这些变化是显而易见的,一切利用本发明构思的发明创造均在保护之列。
24.实施例1
25.羊支原体肺炎平板凝集抗原的制备:
26.(1)基础种子液的制备:取由中国农业科学院北京畜牧兽医研究所分离、鉴定、保存的丝状支原体山羊亚种sz013株、山羊支原体山羊亚种sy006株和绵羊肺炎支原体my018株冻干菌种,开启后,分别按10%的量接种于羊支原体培养基,置37℃培养24~36h,培养基ph下降至6.8左右,收获后作为一级基础种子,将一级种子液按10%比例再接种传代1次,收获分装后置-80℃冻存,作为二级基础种子;
27.(2)生产种子液的制备:取丝状支原体山羊亚种sz013株、山羊支原体山羊亚种sy006株和绵羊肺炎支原体my018株的二级基础种子,按10%比例分别接种于生产用羊支原体培养基,置37℃恒温摇床,120rpm震荡培养18~36h至培养基变为黄色,扩大培养,获得生产种子液;
28.(3)发酵培养:采用生物反应器分别大规模培养丝状支原体山羊亚种sz013株、山羊支原体山羊亚种sy006株和绵羊肺炎支原体my018株,先对生物反应器进行灭菌,无菌加入羊支原体培养基,按1:10的比例接种生产种子液,37℃恒温培养,严格控制不通气,待ph下降至6.9~7.0时,添加羊支原体培养基为原培养体积的20%,进行两次补料培养,待第二次培养ph下降到6.7~6.8时收获菌液,并对菌液进行ccu计数和无菌检验;
29.(4)抗原制备,在3种菌液中分别加入0.3%羟甲基纤维素钠,置5℃静置8日,8000rpm离心菌液20min,取沉淀用含0.01%硫柳汞的pbs重悬,按照ccu计数结果,调整菌液浓度为2.3
×
10
11
ccu/ml,置37℃灭活3小时,将3种重悬后的菌液按体积比1:1:1混合,反复搅拌均匀后,加入3%结晶紫溶液至终浓度为0.03%,继续搅拌20分钟,加入10%菌液体积的甘油,继续搅拌10分钟,即得到羊支原体肺炎平板凝集抗原,分装后置5℃保存。
30.在本实施例中,羊支原体肺炎平板凝集抗原使用丝状支原体山羊亚种sz013株、山羊支原体山羊亚种sy006株和绵羊肺炎支原体my018株制成,该平板凝集抗原中含以上三种支原体菌体的灭活前浓度均为7.0
×
10
10
ccu/ml。
31.实施例2
32.半成品检验(发酵培养菌液检验):
33.【无菌检验】按照《中国兽药典》(2020版,三部)的附录3306进行,即随机取5瓶实施例1羊支原体发酵培养菌液进行检验,各取1ml接种到含50ml tg培养基的小瓶中,37℃静置培养3日后,再分别从每瓶中取培养物接种1支tg小管、1支ga小管和2支tsb小管,每支接种0.2ml,将其中1支tsb小管置25℃生化培养箱培养,其余3支置37℃静置培养,7日后观察结果,均无细菌生长。
34.【ccu计数】取14支装有1.8ml液体培养基的小试管,分别标记为1、2、3
…
12,另2支设为空白对照。取0.2ml实施例1羊支原体发酵培养菌液加入到1号小管,混匀后,再从1号小管中吸取0.2ml加入到2号小管,以此类推,10倍系列稀释至10-12(12号管)。将以上12支小管置37℃培养箱静置培养10日。观察各小管变色情况,对照管颜色不变,试验管发生颜色变化的最高稀释度,即为该羊支原体发酵培养菌液的ccu滴度。在本实施例中,羊支原体发酵培养菌液的ccu滴度应不低于1.0
×
10
10
ccu/ml。
35.实施例3
36.羊支原体对照阴性、阳性血清的制备:
37.选用6头3~4月龄的健康羊,经羊支原体血清抗体检测结果为阴性,采集羊血液,50~80ml/只,提取血清;14日后,再次采血50~80ml/只,提取血清,混合后,分装冻干,作为对照阴性血清。
38.免疫抗原的准备;取丝状支原体山羊亚种sz013株、山羊支原体山羊亚种sy006株和绵羊肺炎支原体my018株各120ml培养物解冻后,8000rpm离心30min,取沉淀,用25ml pbs(ph 7.4)将3种培养物混合重悬,加入0.01%硫柳汞37℃灭活4h,加入5ml灭菌的氢氧化铝胶佐剂,充分混合后,即为羊支原体免疫用抗原,置2-8℃保存。
39.将以上健康青年羊在完成第2次采血后14日,肌肉注射免疫羊支原体抗原,2ml/头,首免后14日,相同剂量加强免疫一次,首免后28日,再次加强免疫一次,同时将剩余的菌液化冻后各取15ml,用于鼻腔喷雾免疫,5ml/只。第二次加强免疫后14日,采血进行效价测定,做1:16倍稀释后,取30μl,加入30μl平板凝集抗原,2分钟内应出现“++”以上凝集,即为合格。
40.采集血清抗体合格的羊血液,100ml/头,提取血清;采血后14日,再次加强免疫一次;再次采血测定抗体效价,再次采集血清抗体合格的羊血液50~80ml/只,提取血清;如此循环采血,可持续获得阳性血清。将抗体效价合格的血清混合后,离心、过滤除菌,分装冻干,作为对照阳性血清。
41.实施例4
42.羊支原体肺炎平板凝集抗原及对照阴性、阳性血清的使用方法:
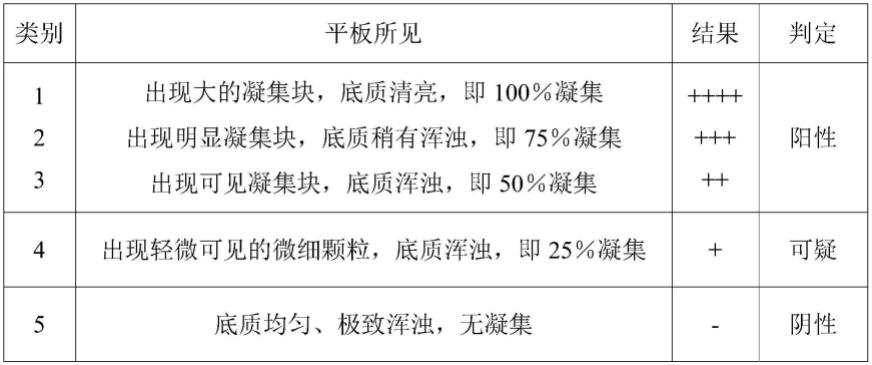
43.将羊支原体肺炎平板凝集抗原取出后恢复到室温,对待检羊血清进行平板凝集试验,以检测其中的羊支原体抗体。具体地说,先在反应板上滴加1滴(约30μl/滴)平板凝集抗原,然后滴入等量的待检血清,将其充分混合,用枪头涂成直径约1.5~2cm的液面,阴、阳性对照样品也使用该方法检测。轻轻摇动反应板,在2分钟内判定结果。当出现50%(++)或以上的凝集即为阳性;不发生凝集为阴性;介于二者之间为可疑反应。阳性对照因出现“++”或“++”以上的凝集,阴性对照应不出现凝集。
44.表1血清平板凝集试验判读标准
[0045][0046]
羊支原体肺炎平板凝集结果判定如图1所示。
[0047]
实施例5
[0048]
羊支原体肺炎平板凝集抗原及对照阴性、阳性血清的检验:
[0049]
1、羊支原体肺炎平板凝集抗原的检验,检验项目包括以下内容:
[0050]
1.1性状本品为紫色的均匀悬液,长时间静置后,菌体下称,上部澄清,振摇后,无凝集块出现。
[0051]
1.2无菌检验
[0052]
按照《中国兽药典》(2020版,三部)的附录3306进行,即将随机取5瓶羊支原体肺炎平板凝集抗原进行检验,各取1ml接种到含50ml tg培养基的小瓶中,37℃静置培养3日后,再分别从每瓶中取培养物接种1支tg小管、1支ga小管和2支tsb小管,每支接种0.2ml,将其中1支tsb小管置25℃生化培养箱培养,其余3支置37℃静置培养,7日后观察结果,应均无细菌生长。
[0053]
1.3效价检验
[0054]
将冻干抗羊支原体阳性血清用pbs进行1:16稀释后,取30μl与等量的平板凝集抗原混合,做平板凝集试验,,做平板凝集试验,应在30秒内出现初凝,在2分钟终止时,应出现“++”或“++”以上的凝集。
[0055]
1.4非特异性检验
[0056]
取羊支原体肺炎平板凝集抗原分别与阴性血清、pbs和生理盐水做平板凝集试验,应不出现凝集。
[0057]
2、阴、阳性对照血清的检验,检验项目包括以下内容:
[0058]
2.1性状本品为紫色的均匀悬液,长时间静置后,菌体下称,上部澄清,振摇后,无凝集块出现。
[0059]
2.2无菌检验
[0060]
按照《中国兽药典》(2020版,三部)的附录3306进行无菌检验,无细菌生长。
[0061]
2.3效价检验
[0062]
将阳性对照血清用pbs进行1:16稀释后,再对阴性血清和稀释后的阳性血清按实施例4的方法进行平板凝集试验,稀释后的阳性血清应出现“++”或“++”以上的凝集;阴性对照血清应不出现凝集。
[0063]
实施例6
[0064]
羊支原体肺炎平板凝集抗原临床应用
[0065]
用自制抗原检测甘肃某个体羊场提供的60份自然感染绵羊血清,该羊场部分羔羊出现肺炎症状,怀疑有绵羊支原体感染。同时以购买的绵羊支原体肺炎间接血凝试验(iha)抗原与阴阳性血清和实施例1制备的羊支原体肺炎平板凝集抗原为对照,进行试验。结果显示,绵羊支原体肺炎间接血凝试验(iha)抗原检测结果为2份阳性,本技术提供的羊支原体肺炎平板凝集抗原检测结果为19份阳性,将血清阳性的羊采集鼻腔拭子进行pcr检测,结果全部为阳性,经对pcr产物进行测序分析,确认该羊群感染的是山羊支原体山羊亚种,这也解释了绵羊支原体肺炎iha抗原检测阳性率低的原因。由此说明,本发明方法制备的羊支原体肺炎平板凝集抗原在用于检测羊支原体肺炎感染中具有良好的通用性,并且使用简单快速、直观的特点,普通饲养员按照说明书即可使用,并进行结果判定。
[0066]
于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
[0067]
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1