一种析氧反应FeOOH/Co(OH)2复合电催化剂的制备方法与流程
本发明属于新型功能材料技术领域,更加具体地说,是一种利用分步电化学沉积技术在碳纤维纸上原位分层生长feooh复合co(oh)2作为析氧反应电催化剂的制备和应用。
背景技术:
目前的析氧反应电催化材料都是以贵金属氧化物如二氧化铱(iro2)或二氧化钌(ruo2)为主,虽然它们具有较高的催化性能,但是价格昂贵、资源稀少、合成成本较高,且在催化过程中的稳定性较差,容易在酸性或碱性反应条件下溶解。因此,非贵金属的氧化物,特别是过渡金属氧化物作为析氧反应电催化剂的开发和应用引起了科研工作者的广泛关注和研究。co(oh)2(氢氧化钴)是一种非常有应用潜力的电催化材料,具有制备温度较低(常温)、不需要烧结、节能环保、催化性能良好、结构稳定等众多优点,在作为电极材料、超级电容、双功能氧催化剂等领域具有广阔的应用前景。目前一般采用化学沉淀法及水热法合成co(oh)2,但是这些方法得到的co(oh)2尺寸较大,较大的颗粒尺度对其作为析氧反应电催化剂的应用有较大限制。人们为了增加co(oh)2的分散性,一般利用水热原位生长将其负载在导电性良好的碳基材料如碳纤维纸或碳纤维布上,虽然该方法确实能够增加co(oh)2的分散性和提高其催化性能,但是一般工艺步骤繁琐且时间较长,如需要通过水热合成,并且碳基基底材料在水热过程中容易被腐蚀从而影响催化剂的稳定性。此外,单相的co(oh)2电催化析氧反应活性较差,因此,如何通过简便易行的方法来进一步提高co(oh)2的催化性能,具有非常重要的研究意义和应用价值。
技术实现要素:
本发明的目的在于针对纯相co(oh)2的析氧反应电催化性能较差,传统制备方法分散性差等问题,提供了一种简便可行制备羟基氧化铁/氢氧化钴复合析氧反应电催化剂的制备方法,大大提高了其催化性能。该方法采用硝酸钴及硝酸铁为原料制成沉积电解液,利用恒压电位分层沉积,沉积原理为硝酸根阴极还原为氢氧根离子,在基底表面与过渡金属离子形成氢氧化物沉淀,并在硝酸盐电解液中加入l-丙氨酸,其两性离子端基和过渡金属盐溶液中阴阳离子间的静电作用可以有效在电沉积过程中在基底碳纤维上形成纳米颗粒生长。利用这种方法在碳纤维纸(cp)上分层沉积制备的feooh/co(oh)2复合催化剂具有较高的电催化性能及电化学稳定性,可以作为析氧反应电催化材料用于金属空气电池和清洁能源的开发等领域。
本发明的技术方案为:
一种析氧反应feooh/co(oh)2复合电催化剂的制备方法,包括以下步骤:
步骤1:配置浓度为0.1-0.2mol/l的硝酸钴溶液;
步骤2:将碳纤维纸在1mol/l氢氧化钾溶液中浸泡,水浴60℃加热2-3h,然后分别在无水乙醇和去离子水中各超声30-40min,取出后烘干;
步骤3:将步骤2中得到的碳纤维纸作为工作电极,镀铂钛网作为对电极,饱和甘汞电极作为参比电极,步骤1中得到的硝酸钴溶液作为第一电解液,进行循环恒电压沉积,每个循环沉积为两步沉积,第一步沉积电压为-1.1v,沉积时间为100s,第二步沉积电压为-0.5v,沉积时间为30s;循环沉积的圈数为1-5圈;
步骤4:将硝酸铁及l-丙氨酸加入到去离子水中,溶解后作为第二电解液;所述的第二电解液中l-丙氨酸的浓度为0.05mol/l;硝酸铁的浓度为0.1-0.2mol/l;
步骤5:将步骤3中得到的沉积产物作为工作电极,镀铂钛网作为对电极,饱和甘汞电极作为参比电极,步骤4中的第二电解液作为本步骤中的电解液,进行恒电压沉积;沉积电压为-1.2v,沉积时间为100-400s;
步骤6:将步骤5得到的产品清洗后烘干,制得析氧反应feooh/co(oh)2复合电催化剂。
本发明的实质性特点为:
本发明采用硝酸钴及硝酸铁为原料制成沉积电解液,利用恒压电位分层沉积,沉积原理为硝酸根阴极还原为氢氧根离子,在基底表面与过渡金属离子形成氢氧化物沉淀。由于在沉积电解液中加入l-丙氨酸,其两性离子端基和过渡金属盐溶液中阴阳离子间的静电作用可以有效在电沉积过程中在基底碳纤维上形成纳米颗粒生长,分层沉积制备的feooh/co(oh)2催化剂具有较高的电催化性能及电化学稳定性。
本发明的有益效果为:
本发明提出的feooh/co(oh)2复合催化剂制备方法简单、操作方便,提高了实验过程中的安全性。采用本发明方法制备的feooh与co(oh)2纳米片复合催化剂,大大提升了电催化性能,并且具有良好的电催化水氧化性能。
本发明主要利用feooh与co(oh)2纳米片之间的相互作用提升电催化性能,并且该方法得到的产物作为析氧反应电催化剂比ruo2贵金属催化剂具有更好的催化性能,为提升非贵金属催化剂性能提供了参考。制备的复合催化剂的过电位为252mv,相比于常见贵金属催化剂二氧化钌具有更低的过电位,相比于纯相co(oh)2及feooh均有大幅性能提升,电化学交流阻抗明显降低,塔菲尔斜率也明显降低,复合催化剂的活性和稳定性明显提升。
附图说明
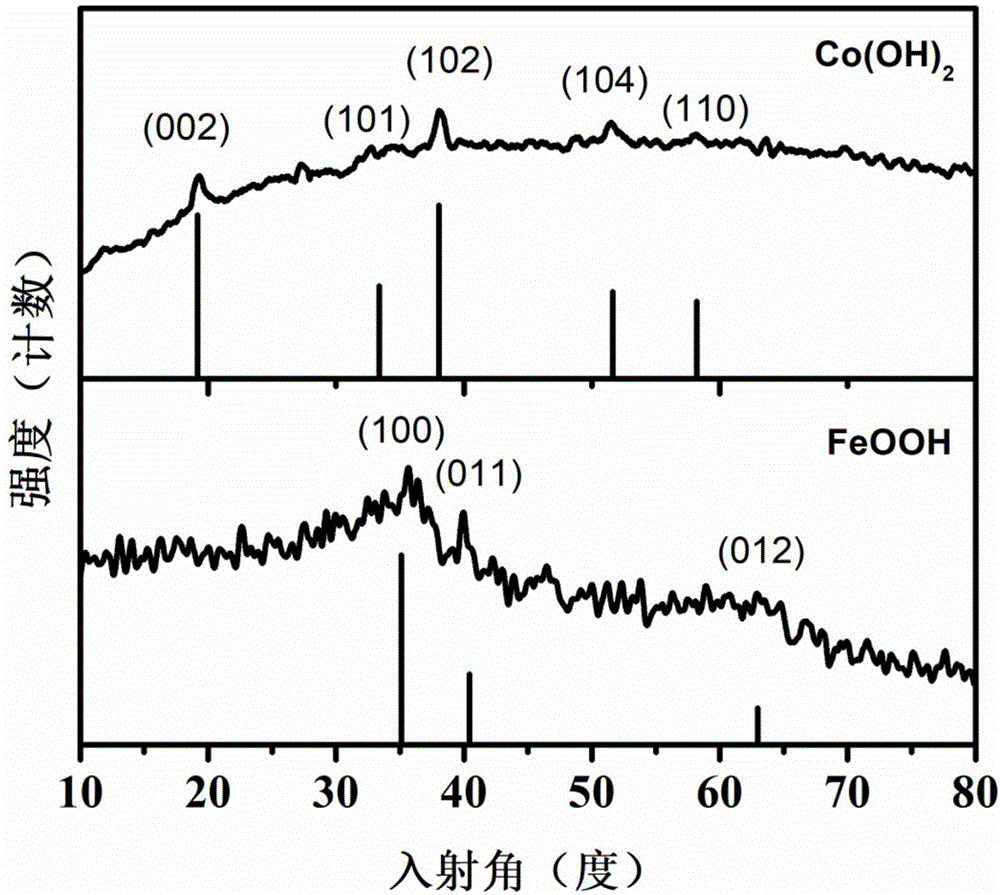
图1是实施例7中硝酸钴溶液中沉积3圈时制备的co(oh)2,硝酸铁和l-丙氨酸混合溶液中沉积200s时制备的feooh的x射线衍射图。
图2是实施例7中硝酸钴溶液中沉积3圈时制备的co(oh)2催化剂的扫描电镜图。
图3是实施例7中硝酸钴溶液中沉积3圈,硝酸铁和l-丙氨酸混合溶液中沉积200s时制备的feooh/co(oh)2复合催化剂的断层元素分布扫描图。
图4是实施例7中硝酸钴溶液中沉积3圈,硝酸铁和l-丙氨酸混合溶液中沉积200s时制备的feooh/co(oh)2复合催化剂的扫描电镜图。
图5是实施例7中硝酸钴溶液中沉积3圈,硝酸铁和l-丙氨酸混合溶液中沉积200s时制备的feooh/co(oh)2复合催化剂的x射线光电子能谱图。
图6是实施例1-5中硝酸钴溶液中不同沉积圈数,硝酸铁和l-丙氨酸混合溶液中沉积200s时制备的feooh/co(oh)2复合催化剂的析氧反应极化曲线对比图。
图7是实施例6-9中硝酸钴溶液中沉积3圈,硝酸铁和l-丙氨酸混合溶液中沉积不同时间制备的feooh/co(oh)2复合催化剂的析氧反应极化曲线对比图。
图8是实施例7中硝酸钴溶液中沉积3圈,硝酸铁和l-丙氨酸混合溶液中沉积200s时制备的feooh/co(oh)2复合催化剂与商用钌黑催化剂的析氧反应极化曲线对比图。
图9是实施例7中硝酸钴溶液中沉积3圈,硝酸铁和l-丙氨酸混合溶液中沉积200s时制备的feooh/co(oh)2复合催化剂及其它催化剂的析氧反应极化曲线对比图。
图10是实施例7中硝酸钴溶液中沉积3圈,硝酸铁和l-丙氨酸混合溶液中沉积200s时制备的feooh/co(oh)2复合催化剂及其它催化剂的塔菲尔斜率对比图。
图11是实施例7中硝酸钴溶液中沉积3圈,硝酸铁和l-丙氨酸混合溶液中沉积200s时制备的feooh/co(oh)2复合催化剂及其它催化剂的电化学交流阻抗对比图。
图12是实施例7中硝酸钴溶液中沉积3圈,硝酸铁和l-丙氨酸混合溶液中沉积200s时制备的feooh/co(oh)2复合催化剂与商用钌黑催化剂的电化学稳定性测试结果图。
具体实施方式
下面结合具体实施例进一步说明本发明的技术方案。
在硝酸钴电解液中沉积不同圈数制备feooh/co(oh)2复合催化剂。
实施例1:
步骤1:将适量的硝酸钴溶于一定体积的去离子水中,在25℃搅拌15分钟,配置好的硝酸钴溶液(0.1mol/l)作为电解液;
步骤2:将厚度为0.3mm的碳纤维纸剪成1*2cm长条状并在1mol/l的氢氧化钾溶液中水浴60℃加热2h,之后在无水乙醇及去离子水中各超声30min,取出后在60℃烘箱中烘干3h;
步骤3:用电极夹夹取步骤2中处理的碳纤维纸作为工作电极,镀铂钛网(2*3cm)作为对电极,饱和甘汞电极作为参比电极,步骤1中硝酸钴溶液作为电解液,进行分步恒电压沉积;第一步沉积电压为-1.1v,沉积时间为100s,然后进行第二步沉积,电压为-0.5v,沉积时间为30s,沉积循环圈数为1圈;
步骤4:将适量的硝酸铁及l-丙氨酸溶于一定体积的去离子水中,在25℃搅拌15分钟,得到电解液,电解液中,硝酸铁浓度为0.1mol/l,l-丙氨酸的浓度为0.05mol/l;
步骤5:用电极夹夹取步骤3中沉积样品作为工作电极,镀铂钛网作为对电极,饱和甘汞电极作为参比电极,步骤4中硝酸铁溶液作为电解液,进行恒电压沉积;沉积电压为-1.2v,沉积时间为200s;
步骤6:将步骤5沉积好的样品水洗后在60℃烘箱中烘干30min,得到制备好的析氧反应feooh/co(oh)2复合电催化剂。
对本发明技术方案制备的feooh/co(oh)2复合催化剂进行了一系列测试和表征。
测试条件为:利用x射线衍射仪(rigakuultimaiv)(扫描范围为10-80度,扫描速率为4度/分,扫描步长为0.02度)、x射线光电子能谱仪(phi1600exca)、扫描电子显微镜(hitachi,s-4800)、透射电子显微镜(jeol,2100)、电化学工作站(上海辰华chi750e)(循环伏安曲线(cv)测试范围为0到0.5v,线性扫描伏安曲线(lsv)测试范围为0-0.7v,交流阻抗谱(eis)测试电压为0.5v)进行性能测试。由测试结果可知:样品为feooh与co(oh)2纳米片分层沉积的复合催化剂,含有fe、co、o、c等化学元素。
实施例2:
其它步骤同实施例1,不同之处在于步骤3中的沉积圈数由1圈改为2圈。
实施例3:
其它步骤同实施例1,不同之处在于步骤3中的沉积圈数由1圈改为3圈。
实施例4:
其它步骤同实施例1,不同之处在于步骤3中的沉积圈数由1圈改为4圈。
实施例5:
其它步骤同实施例1,不同之处在于步骤3中的沉积圈数由1圈改为5圈。
测试结果:通过在硝酸钴电解液中沉积不同圈数制备feooh/co(oh)2复合催化剂,并对其进行了x射线衍射、扫描电子显微镜、透射电子显微镜、x射线光电子能谱、循环伏安测试、线性伏安扫描测试、电化学交流阻抗测试、稳定性测试,测试结果如图1-11所示。
图1是通过电化学沉积制备co(oh)2及feooh的x射线衍射图,co(oh)2样品在19.3度、33.5度、38度、52.3度、57.1度存在几个较强的衍射峰,通过与标准pdf卡片比较(pdf#51-1731),表明为co(oh)2的衍射峰。feooh样品在35.3度、41度、63度存在几个较强的衍射峰,通过与标准pdf卡片比较(pdf#77-0247),表明为feooh的衍射峰。图2是电化学沉积制备co(oh)2的扫描电镜图,结果表明样品的形貌为纳米片状。图3是feooh/co(oh)2复合催化剂的断层元素分布扫描图,结果表明样品中co与fe为分层结构。图4是feooh/co(oh)2复合催化剂的扫描电镜图,结果表明样品的形貌为纳米颗粒状。图5是实施例5中在硝酸钴电解液中沉积3圈,然后在硝酸铁电解液中沉积200s的feooh/co(oh)2复合催化剂的x射线光电子能谱图,结果表明样品中含有co、fe、o、c等四种化学元素。通过分析以上结果,可以得出制备的样品为feooh/co(oh)2复合催化剂。图6是实施例1-5中硝酸钴电解液中沉积1-5圈,硝酸铁溶液中沉积200s制备的feooh/co(oh)2复合催化剂的析氧反应极化曲线对比图。结果表明随着硝酸钴溶液中沉积圈数的提升,其过电位也随之降低,在硝酸钴中沉积圈数为3圈时,过电位到达最低的263mv,之后随着硝酸钴中沉积圈数增加,过电位也随之升高。
在硝酸铁电解液中沉积不同时间制备feooh/co(oh)2复合催化剂。
实施例6:
步骤1:将适量的硝酸钴溶于一定体积的去离子水中,在25℃搅拌20分钟,配置好的硝酸钴溶液(0.1mol/l)作为电解液;
步骤2:将碳纤维纸剪成1*2cm长条状并在1mol/l的氢氧化钾溶液中水浴60℃加热2h;之后在无水乙醇及去离子水中各超声30min,取出在60℃烘箱中烘干3h;
步骤3:用电极夹夹取步骤2中处理的碳纤维纸作为工作电极,镀铂钛网作为对电极,饱和甘汞电极作为参比电极,步骤1中硝酸钴溶液作为电解液,第一步沉积电压为-1.1v,沉积时间为100s,第二步沉积电压为-0.5v,沉积时间为30s,沉积圈数为3圈;
步骤4:将适量的硝酸铁及l-丙氨酸溶于一定体积的去离子水中,在25℃搅拌20分钟,配置好的硝酸铁溶液(0.1mol/l)作为电解液,其中l-丙氨酸的浓度为0.05mol/l;
步骤5:用电极夹夹取步骤3中沉积样品作为工作电极,镀铂钛网作为对电极,饱和甘汞电极作为参比电极,步骤4中硝酸铁溶液作为电解液,沉积电压为-1.2v,沉积时间为100s;
步骤6:将步骤5沉积好的样品水洗后在60℃烘箱中烘干30min,得到制备好的feooh/co(oh)2复合析氧反应电催化材料。
实施例7:
其它步骤同实施例6,不同之处在于步骤5中沉积时间由100s改为200s。
实施例8:
其它步骤同实施例6,不同之处在于步骤5中沉积时间由100s改为300s。
实施例9:
其它步骤同实施例6,不同之处在于步骤5中沉积时间由100s改为400s。
测试结果:通过改变在硝酸铁中沉积不同时间制备了feooh/co(oh)2复合催化剂,对样品进行了x射线衍射、扫描电镜、透射电镜、x射线光电子能谱、循环伏安测试、线性伏安扫描测试、电化学交流阻抗测试、稳定性测试。图7是实施例6-9中在硝酸钴溶液中沉积3圈,在硝酸铁溶液中沉积100-400s制备的feooh/co(oh)2复合催化剂的析氧反应极化曲线对比图。由图7可知,在硝酸钴溶液中沉积3圈,在硝酸铁溶液中沉积200s时制备的feooh/co(oh)2复合催化剂过电位更低,极限电流密度也更高,电催化性能最优。图8是feooh/co(oh)2复合催化剂与商用贵金属钌黑催化剂的析氧反应极化曲线对比图。由图8可知,feooh/co(oh)2复合催化剂,过电位比商用贵金属钌黑催化剂更低,极限电流密度更高,电催化性能更优。图9-12是实施例7中在硝酸钴溶液中沉积3圈,在硝酸铁溶液中沉积200s时制备的feooh/co(oh)2复合催化剂及其它析氧反应催化剂的性能对比图。由图可知,feooh/co(oh)2复合催化剂相比于常见贵金属催化剂ruo2及纯相电化学沉积制备的co(oh)2及feooh的析氧反应电催化性能更好,具有较低的过电位、较好的导电性、较低的塔菲尔斜率和较大的活性表面积,在析氧反应催化剂领域具有广阔的应用前景。由图12可以看出feooh/co(oh)2复合催化剂可以在0.5v的电压下稳定工作12h,稳定性较好。
根据以上结果,可以看出本发明提出的方法避免了复杂的制备工艺,在室温状态下(25℃)和简单工艺下合成出具有较高催化活性的feooh/co(oh)2复合催化剂,有效改善了单相过渡金属氢氧化物及羟基氧化物类材料的催化性能较差、稳定性差等缺点,该feooh/co(oh)2复合催化剂还可以应用于金属空气电池、全解水和新型能源等领域。
以上对本发明做了示例性的描述,应该说明的是,在不脱离本发明的核心的情况下,任何简单的变形、修改或者其他本领域技术人员能够不花费创造性劳动的等同替换均落入本发明的保护范围。
本发明未尽事宜为公知技术。
- 还没有人留言评论。精彩留言会获得点赞!