具有多种检测能力的集成样品处理系统的制作方法
相关申请的交叉引用
本申请是于2017年5月22日提交的美国专利申请62/509,601以及2017年12月19日提交的美国专利申请62/607,773的非临时申请并且要求其提交日期的权益,所有申请出于全部目的以引用方式全文并入本文。
背景技术:
质谱(ms)是分析技术,用于确定样品的元素组成,定量颗粒和分子的质量,并且阐明分子的化学结构。具有高特异性的各种类型的ms,诸如液相色谱(lc-ms)、气相色谱(gc-ms)和基质辅助激光解吸/电离/飞行时间(maldi-tofms)正越来越多地用于临床诊断。这些ms技术克服了免疫测定的许多限制(例如,分析物的非特异性结合和交叉反应性)并提供许多优点。
迄今为止,由于包括样品制备、在线提取、吞吐量、自动化、实验室信息系统接口、仪器间标准化和协调的挑战,ms技术尚未得到广泛的临床应用。
本发明的实施方案可单独地和共同地解决这些和其他挑战。
技术实现要素:
本发明的一些实施方案可包括集成样品处理系统,该集成样品处理系统可包括分析器,诸如与质谱仪集成的化学分析器或免疫分析器。本发明的实施方案提供了具有共用样品制备站的优点,具有使用多个检测系统的选项。此类检测系统可包括可存在于分析器中的质谱仪和光学检测系统。光学检测系统可使用免疫测定检测方法(诸如化学发光或荧光)来操作。
本发明的实施方案还可包括用于分析小分子和大分子(蛋白质)的质谱系统和方法。在一些实施方案中,相对于常规样品制备方法,简化了从样品制备到检测的工作流程。在根据本发明实施方案的简化的样品制备方法中,不需要使用离心系统和/或lc系统。消除样品处理系统中的离心机和lc系统降低了总体样品分析过程的复杂性并改善其稳健性,改善所处理样品的tat(周转时间),并且/或者改善或保持对所处理样品的分析的准确性。
本发明的一个实施方案涉及样品处理系统,该样品处理系统包括:分析器,该分析器包括(i)样品展示单元,该样品展示单元被配置为保持容纳样品的多个样品管;(ii)等分试样站,该等分试样站包括移液器并且被配置为将多个样品管中的样品管中的样品的等分试样提供给反应容器,以及(iii)光学检测站,该光学检测站被配置为使用移液器在反应容器中检测样品的第一处理样品等分试样中的分析物。质谱仪可联接到分析器。质谱仪被配置为从分析器接收第二处理样品等分试样,并且检测所接收的第二处理样品等分试样中的分析物。样品处理系统可包括被配置为控制分析器和质谱仪的控制系统。
本发明的另一个实施方案涉及由样品处理系统执行的方法,该样品处理系统包括分析器,该分析器包括等分试样站,该等分试样站包括至少一个移液器、质谱仪、样品引入设备和控制系统。控制系统可操作地联接到分析器、质谱仪和样品引入设备。该方法包括:由等分试样站的至少一个移液器提供样品的第一样品等分试样和样品的第二样品等分试样;由分析器中的多个处理设备对样品的第一样品等分试样进行处理以形成第一处理样品等分试样;由分析器中的多个处理设备对样品的第二样品等分试样进行处理以形成第二处理样品等分试样;由分析器执行用于使用免疫分析器来检测第一处理样品等分试样中的分析物的方法;由样品引入设备将第二处理样品等分试样从分析器转移到质谱仪;以及使用质谱仪检测第二处理样品等分试样中的分析物或另一种分析物。
本发明的另一个实施方案涉及由样品处理系统执行的方法,该样品处理系统包括分析器,该分析器包括等分试样站,该等分试样站包括至少一个移液器、质谱仪、样品引入设备和控制系统,该控制系统可操作地联接到分析器、质谱仪、样品引入设备和控制系统。该方法包括:由等分试样站的至少一个移液器提供样品的第一样品等分试样和样品的第二样品等分试样;由分析器对来源于反应容器中样品的第一样品等分试样的第一处理样品等分试样中的分析物执行初级分析;由样品引入设备将来源于样品的第二样品等分试样的第二处理样品等分试样从分析器转移到质谱仪;以及由质谱仪在次级分析中对第二处理样品等分试样中的分析物或另一种分析物执行次级分析。
本发明的另一个实施方案涉及样品处理系统,该样品处理系统包括:包括等分试样站的分析器;联接到分析器的质谱仪;联接到分析器和质谱仪的样品引入设备;以及联接到分析器、质谱仪和样品引入设备的控制系统,其中控制系统包括处理器和计算机可读介质。计算机可读介质包括可由处理器执行以实现方法的代码,该方法包括:引导包括至少一个移液器的等分试样站以提供样品的第一样品等分试样和样品的第二样品等分试样;引导分析器来处理容纳样品的第一样品等分试样的反应容器以形成第一处理样品等分试样;引导分析器对第一处理样品等分试样中的分析物执行初级分析;引导分析器来处理样品的第二等分试样以形成第二处理样品等分试样;引导样品引入设备以将样品的第二处理样品等分试样从分析器转移到质谱仪;以及引导质谱仪对第二处理样品等分试样中的分析物或另一种分析物执行次级分析。
本发明的另一个实施方案涉及执行分析的方法,该方法由包括分析器、质谱仪、样品引入设备和控制系统的样品处理系统执行,该控制系统可操作地联接到分析器、质谱仪、样品引入设备和控制系统。该方法包括:由分析器对来源于反应容器中样品的第一样品等分试样的第一处理样品等分试样中的疾病的第一生物标志物执行初级分析;由样品引入设备将来源于样品的第二样品等分试样的第二处理样品等分试样从分析器转移到质谱仪;以及由质谱仪在次级分析中对第二处理样品等分试样中的所述疾病的第二生物标志物执行次级分析。
本发明的另一个实施方案涉及样品处理系统,该样品处理系统包括:分析器,该分析器包括(i)样品展示单元,该样品展示单元被配置为保持容纳样品的多个样品管;(ii)等分试样站,该等分试样站被配置为将样品的第一等分试样以及第二等分试样提供给反应容器,该样品包含多个样品管中的样品管中的分析物,以及(iii)光学检测站,该光学检测站被配置为在反应容器中检测样品的第一处理样品等分试样中的分析物;联接到分析器的质谱仪,其中质谱仪被配置为从分析器接收来源于第二等分试样的第二处理样品等分试样,并且检测所接收的第二处理样品等分试样中的分析物;以及控制系统,该控制系统被配置为控制分析器和质谱仪。
本发明的另一个实施方案涉及由样品处理系统执行的方法,该样品处理系统包括分析器、质谱仪、样品引入设备和控制系统,该控制系统可操作地联接到分析器、质谱仪、样品引入设备和控制系统。该方法包括:由分析器对来源于反应容器中样品的第一样品等分试样的第一处理样品等分试样中的分析物执行初级分析;确定第一处理样品等分试样中的分析物的浓度是低于、高于还是等于预定阈值;由样品引入设备将来源于样品的第二样品等分试样的第二处理样品等分试样从分析器转移到质谱仪;以及由质谱仪在次级分析中对第二处理样品等分试样中的分析物或另一种分析物执行次级分析。
本发明的另一个实施方案涉及样品处理系统,该样品处理系统包括:分析器,该分析器包括(i)样品展示单元,该样品展示单元被配置为保持容纳样品的多个样品管;(ii)等分试样站,该等分试样站被配置为将样品的等分试样提供给反应容器,该样品包含多个样品管中的样品管中的分析物,以及(iii)光学检测站,该光学检测站被配置为在反应容器中检测样品的第一处理样品等分试样中的分析物;联接到分析器的质谱仪,其中质谱仪被配置为从分析器接收第一处理样品等分试样和/或第二处理样品等分试样,并且检测第一处理样品等分试样和/或第二处理样品等分试样中的分析物;以及控制系统,该控制系统被配置为控制分析器和质谱仪。控制系统包括:数据处理器;以及计算机可读介质,该计算机可读介质包括可由数据处理器执行以实现方法的代码。该方法包括:使用来自光学检测站的数据来确定光学检测站处的第一处理样品等分试样中的分析物的检测是低于、高于还是等于预定阈值;响应于确定,使分析器处理第二样品等分试样以形成第二处理样品等分试样,并且使样品引入设备将第二处理样品等分试样从分析器转移到质谱仪;以及使质谱仪检测第二处理样品等分试样中的分析物或另一种分析物的存在。
本发明的另一个实施方案涉及由样品处理系统执行的方法,该样品处理系统包括至少质谱仪、样品引入设备和控制系统,该控制系统可操作地联接到质谱仪和样品引入设备。该方法包括:由质谱仪对来自样品的第一样品等分试样的第一处理样品等分试样的分析物执行初级分析;以及在执行初级分析之后,通过样品处理系统中的质谱仪或分析器对来源于样品的第二等分试样的第二处理样品等分试样中的分析物或另一种分析物执行次级分析。
本发明的另一个实施方案涉及样品处理系统,该样品处理系统包括:质谱仪;样品引入设备;以及控制系统,其中控制系统控制质谱仪和样品引入设备的操作,并且其中控制系统包括处理器和计算机可读介质。计算机可读介质包括可由处理器执行以用于实现方法的代码,该方法包括:由质谱仪对来自样品的第一样品等分试样的第一处理样品等分试样的分析物执行初级分析;以及在执行初级分析之后,通过样品处理系统中的质谱仪或分析器对来源于样品的第二等分试样的第二处理样品等分试样中的分析物或另一种分析物执行次级分析。
本发明的这些以及其他实施方案将在下文中结合附图进一步详细地描述。
附图说明
图1示出了根据本发明的实施方案的样品处理系统的框图。
图2示出了根据本发明的实施方案的示意图,其示出可在样品处理系统中采取的不同处理路径。
图3a和图3b示出了根据本发明的实施方案的高级流程图,其示出由样品处理系统执行的处理步骤。流程图示出了可在样品处理系统中执行的不同检测操作。
图4a示出了根据本发明的实施方案的样品处理系统中的分析器的示意图。
图4b示出了示例性流程图,其示出用于操作分析器的操作过程。
图4c示出了透视图,其示出了主样品移液站和分析器的样品存储装置的布置。
图5a示出了根据本发明的实施方案的温育转盘的顶部/侧面剖视图。
图5b示出了图5a中的温育转盘的一部分的顶部/侧面透视图和剖视图。
图5c示出了图5a中的温育转盘的一部分的顶部透视图。
图6a示出质谱仪的框图。
图6b示出了使用电喷射方法的质谱仪的一部分。
图6c示出了用于质谱仪中的离子检测器的结构。
图7a示出了根据本发明的实施方案的处于第一构型的阱和洗脱系统的示意图。
图7b示出了根据本发明的实施方案的处于第二构型的阱和洗脱系统的示意图。
图8示出了根据本发明的实施方案的流程图,示出免疫纯化过程。
图9示出了根据本发明的实施方案的流程图,示出蛋白质沉淀过程。
图10示出了根据本发明的实施方案的流程图,示出另一个免疫纯化过程。
具体实施方式
本发明的实施方案可用于检测生物或化学样品中分析物的存在、不存在或浓度。生物样品诸如生物流体可包括但不限于血液、血浆、血清、或其他体液或排泄物,诸如但不限于唾液、尿液、脑脊液、泪液、汗液、胃肠液、羊水、粘膜液、胸膜液、皮脂油、呼气等。化学样品可包括任何合适类型的样品,包括包括水样品在内的化学品。
在讨论本发明的实施方案之前,可以更详细地描述一些术语。
术语“分析器”可包括能够分析样品(诸如生物样品)的任何合适的仪器。分析器的示例包括质谱仪、免疫分析器、血液学分析器、微生物学分析器和/或分子生物学分析器。
在一些实施方案中,分析器可以是免疫分析器(通常检测标签(化学发光、电化学发光荧光、放射性、同位素、dna等、或无标签系统))。其他类型的分析器可包括血液学分析器、微生物学分析器、化学分析器、尿液分析器、生物化学分析器和/或分子生物学分析器。当分析生物样品时,可以以任何合适的组合使用这些类型的分析器中的一个或多个来分析生物样品。
血液学分析器可用于执行全血计数,红细胞沉降率(esr)和/或凝血测试。自动化细胞计数器使用电技术和光学技术对血液进行采样,并对细胞群进行定量、分类和描述。
微生物学分析器可用作用于确定生物体的特性的诊断工具。在一些实施方案中,微生物学分析器可识别感染微生物。此类分析器可在包含不同底物的离心转子中或在多孔面板中的多个小样品测试微孔中使用生化制品,这取决于正在执行的测试的类型。
分子生物学分析器可以是能够在其分子水平上分析生物样品的装置。分子生物学分析器的示例可包括核酸分析器,诸如dna分析器。
化学分析器可对诸如血清、血浆、尿液和脑脊液之类的临床样品进行测定,以检测与疾病或药物相关的分析物的存在。化学分析器可使用光度测定法。在光度测定法中,将样品与适当的试剂混合以产生可产生颜色的反应。分析物的浓度确定所产生的颜色的强度。光度计在样品处照射适当波长的光,并且测量吸收的光的量,这与样品中分析物的浓度直接相关。化学分析器中使用的另一种分析方法是使用离子选择性电极(ise)来测量诸如na+、k+、cl–和li+之类的离子。ise是通过测量流过离子选择性膜的电流而确定溶液中离子浓度的传感器。
术语“分析物”可包括其存在、不存在或浓度将根据本发明的实施方案来确定的物质。典型的分析物可包括但不限于有机分子、激素(诸如甲状腺激素、雌二醇、睾丸素、孕酮、雌激素)、代谢物(诸如葡萄糖或乙醇)、蛋白质、脂质、碳水化合物和糖、类固醇(诸如维生素d)、肽(诸如降钙素原)、核酸片段、生物标志物(诸如抗生素,苯二氮之类的药品)、药物(诸如免疫抑制剂药物、麻醉剂、阿片类药物等)、在酶促过程中具有调节作用的分子,诸如启动子、活化剂、抑制剂或辅因子、微生物(诸如病毒(包括ebv、hpv、hiv、hcv、hbv、流行性感冒、诺如病毒、轮状病毒、腺病毒等)、细菌(幽门螺杆菌(h.pylori)、链球菌、mrsa、艰难梭菌(c.diff)、军团菌等)、真菌、寄生虫(疟原虫等)、细胞、细胞组分(诸如细胞膜)、孢子、核酸(诸如dna和rna)等。本发明的实施方案还可以允许同时分析相同类别或不同类别的多种分析物(例如,同时分析代谢物和蛋白质)。在本发明的实施方案中,对特定分析物诸如生物标志物的分析可指示特定状况(例如,疾病)与包含分析物的样品相关联。
术语“免疫测定”可以是用于确定样品中分析物量的实验室方法。它可以基于抗体与抗原的相互作用,并且由于分析物(抗原或抗体)的选择性程度,免疫测定可用于定量地确定测试样品中的分析物的非常低的浓度。“免疫分析器”可包括其上免疫测定已自动化的仪器。各种免疫分析器是可商购获得的,包括dxitm系统(加利福尼亚州贝克曼库尔特公司(beckmancoulter,ca))、adviatm和centaurtm系统(徳国西门子医疗公司(siemenshealthcare,germany))、cobastm系统(徳国罗氏诊断公司(rochediagnostic,germany))、architecttm系统(伊利诺伊州雅培公司(abbott,il))、vitrostm系统(新泽西州奥森多临床诊断公司(ortho-clinicaldiagnostic,nj))、和vidastm系统(法国梅里埃公司(biomerieux,france))。
“质谱仪”是可以测量原子和分子的质量和相对浓度的仪器。质谱仪的一个示例利用移动带电颗粒上的基本磁力。基本上,该仪器使样品电离,然后基于离子的质荷比使离子偏转通过磁场。然后,质谱可用于确定样品的元素或同位素标记,颗粒和分子的质量,并且阐明分子(诸如肽和其他化合物)的化学结构。可根据可商购获得的质谱仪对质量选择分区的方式对其进行分类,包括飞行时间、四极ms、离子阱(包括3d四极、圆柱形离子阱、线性四极离子阱、轨道阱)、傅里叶变换离子回旋共振(ftms)等。作为另外一种选择,可根据离子源(激光解吸、基质辅助激光解吸、热电离、等离子体、火花源等)或检测器(电子倍增器(诸如法拉第杯和离子到光子检测器)、电感检测器等)来对它们进行分区。在优选的实施方案中,质谱仪可以是三重四极质谱仪。
在下文提供的特定示例中,详细描述了包括免疫分析器和质谱仪的样品处理系统。然而,本发明的实施方案不限于此。代替免疫分析器,可使用另一种类型的分析器(诸如化学分析器),而不是免疫分析器。免疫分析器中的许多功能和特征也可存在于化学分析器(例如,试剂存储装置、等分试样站、样品制备站等)中。另外,附加部件诸如样品引入设备也可与样品处理系统中的化学分析器和质谱仪一起使用。
本发明的一些实施方案可包括具有质谱仪(测量质量)和免疫分析器(通常检测标签(化学发光、电化学发光荧光、放射性、同位素、dna等或无标签系统))的完全集成的平台。该系统可具有至少一个样品制备站,该样品制备站可与免疫分析器分离或与免疫分析器共享。该系统可与跟踪系统集成,并且可具有(1)由免疫分析器或质谱仪进行独立分析,或(2)由免疫分析器和质谱仪进行的串行或并行分析的能力。串行分析可包括重新测试(例如,在两个分析器上测试的相同分析物)或反射测试(例如,在一个分析器(通常为免疫分析器)上测试第一分析物,并且在另一个分析器(通常为质谱仪)上测试两个或更多个分析物)。
更具体地讲,本发明的实施方案可包括集成到质谱仪的免疫分析器。还存在样品制备站和样品引入。该系统还包括控制系统,该控制系统可控制质谱仪、免疫分析器、至少一个样品制备站和至少一个样品引入系统。
在一些情况下,单个样品制备站用于免疫分析器和质谱仪两者。在其他实施方案中,存在两个样品制备站,并且其可由免疫分析器和质谱仪专有或相互地使用。样品制备系统包括用于对样品进行等分试样的装置(诸如等分试样器),诸如包括至少一个移液器的等分试样站,用于保持包含免疫测定和/或质谱仪所需的试剂的至少一个试剂包的装置,以及用于将试剂从试剂包转移到等分试样样品的装置。在一些实施方案中,样品制备站包括用于保持至少两个试剂包(即,一个用于免疫分析器的样品制备,而另一个用于质谱仪的样品制备)的装置。
在一些实施方案中,样品引入系统流体连接到样品制备系统中的至少一个。样品引入系统可包括直接流动注入,使用阱和洗脱系统(例如,包括2个泵和6端口开关阀的阱和洗脱系统),使用开放端口设备诸如开放端口探针。
控制系统可使样品处理系统处理次级样品并提供关于次级样品中特定分析物的存在、不存在或数量的结果。控制系统可进一步使样品处理系统处理第二样品并提供关于第二样品中一种或多种分析物的存在、不存在或数量的结果。第一样品和第二样品可通过相同仪器(免疫分析器或质谱仪)或通过不同的仪器(免疫分析器和质谱仪)进行处理。控制系统可控制使用哪些试剂包来处理样品(例如,如果期望使用质量标签,则控制系统可引导样品制备系统使用具有第一样品等分试样的第一试剂包和包含具有第二样品等分试样的质量标签的不同第二试剂包)。
在本发明的一些实施方案中,可使用免疫分析器在样品的初始测试之后执行质量分析。也就是说,质谱仪可用于对先前由免疫分析器处理的样品执行反射测试。根据本发明实施方案的系统和方法还提供使用运行智能软件的控制系统基于预定标准执行自动反射测试的能力。基于初级免疫测定的结果是否满足某些标准,软件可确定样品应通过免疫分析器进行重新测试还是通过质谱仪进行反射测试。由于初级样品仍可在免疫分析器中“准备就绪”,因此,如果控制系统确定期望或需要重新测试或反射测试,则可以启动质谱分析测定的样品制备。样品处理系统可有利地具有用于光学检测过程和质谱过程的试剂盒。
在一些实施方案中,可制备初级样品的两个或更多个等分试样:一个用于免疫测定分析,而另一个用于质谱分析。在一些实施方案中,在从与磁性颗粒结合的抗体洗脱最初存在于初级样品中的分析物后,包含分析物的洗脱液可被表征为处理样品等分试样,因为它来源于原始样品等分试样。然后可通过质谱仪分析处理样品等分试样。在控制系统确定是否需要质谱分析时,可将初级样品和处理样品等分试样以及任何附加样品等分试样暂时保持在样品储存单元(任选地,冷藏单元)中。
当控制系统确定需要或期望重新测试或反射过程时,样品需要由质谱仪进行处理,可以使用初级样品或处理样品等分试样。如果控制系统或其他实体认为初级分析是不确定的,本身不足或不完整的,则重新测试过程可能需要或期望的。如果对第一分析物的初级分析指示期望对一种或多种其他分析物进行进一步测试,则反射测试可能是需要或期望的。
本发明的实施方案可提供从样品制备到最终分析结果的简化的工作流程,具有改善样品分析过程的灵敏度、特异性和准确性的多个选项。如上所述,本发明的实施方案可以在质谱仪分析之前消除使用离心和/或hplc(高压液相色谱法)(即,使用高压液相色谱柱)的需要。在一些实施方案中,样品处理系统中不存在离心机,也不存在hplc设备。
可由样品制备系统执行的第一示例性样品制备程序可包括使用附接到顺磁性颗粒的单克隆或多克隆抗体对来自初级样品的靶标分析物进行免疫纯化。在免疫纯化过程中,在分析物被抗体捕获之后,在洗涤过程中洗掉任何未结合的分子。在后续洗脱步骤中,随后使用缓冲液和洗脱液将分析物从抗体释放。包含“纯化的”靶标的洗脱液可被表征为处理样品等分试样,然后由质谱仪收集并分析该处理样品等分试样。
免疫纯化过程中通常使用的抗体可被替代物取代,例如适体、纳米颗粒、结合蛋白等。可以将免疫捕获试剂设计为捕获特定分析物或特定分析物组,例如药物组或内分泌组等。在本发明的实施方案中,使用三重四极质谱仪的mrm(多重反应监测)工作流程(其中每个分析物都存在特定的母离子到子离子跃迁)可用于精确地分析组中的特定分析物。如果在串联质谱或ms2中没有区分跃迁(通常在同分异构体或同质异位素的情况下),则可以利用ms3中的唯一跃迁来区分它们。
在样品制备系统中执行的第二示例性程序中,使用蛋白质沉淀将蛋白质与小分子分离。使用沉淀试剂沉淀样品等分试样中的蛋白质,之后将沉淀的蛋白质结合到顺磁性珠。可使用磁性洗涤过程将结合到珠的蛋白质与上清液物理分离。可将上清液(其可表征为处理样品等分试样)收集并转移到质谱仪中进行分析。可使用该工作流来分析用于明确或独立测试的药物类别。
在一些实施方案中,在样品制备过程期间,可使用质谱试剂诸如质量标签(例如,amplifextm质量标签)来增强信号并改善灵敏度。质量标签通常被设计成与特定类别分析物通用的官能团(例如,类固醇类中存在的酮官能团或维生素d类中存在的二烯官能团等)特异性反应。质量标签可影响分子的片段化,以产生特定片段以提供唯一跃迁,这可以导致更准确的结果。在一些情况下,气相中的离子的微分迁移率也可用于分离同分异构或同质异位化合物。诸如此的试剂可与将被处理以进行质谱分析的第二样品等分试样一起使用。
质量标签可被设计成以多种方式提供准确性。首先,质量标签可用于修改气相中标记离子(靶标分析物和干扰化合物)的微分迁移率,并基于其迁移率特性的差异来简化其分离。在检测前分离同分异构/同质异位化合物(称为干扰化合物)可有助于改善任何分析结果的准确性。其次,质量标签还可提供靶标分析物的信号增强以改善灵敏度。第三,质量标签可影响标记分子的片段化,以帮助区分分析物和干扰化合物。
在本发明的实施方案中,可在由质谱仪进行分析之前将分析物的内部标准添加到样品。内部标准可为分析物的同位素型式,并且可补偿样品制备过程期间的损失。内部标准与分析物峰的比率可用于定量。如果需要,可使用外部校准曲线来执行定量。
此外,本发明的实施方案可以使用通用阱柱和溶剂以及通用质谱源,这可以使自动化不那么复杂。通用阱柱和源可用于大多数测定,并且不需要在不同测定之间进行切换。控制系统中的软件可指示通用阱柱的寿命何时结束并需要更换。
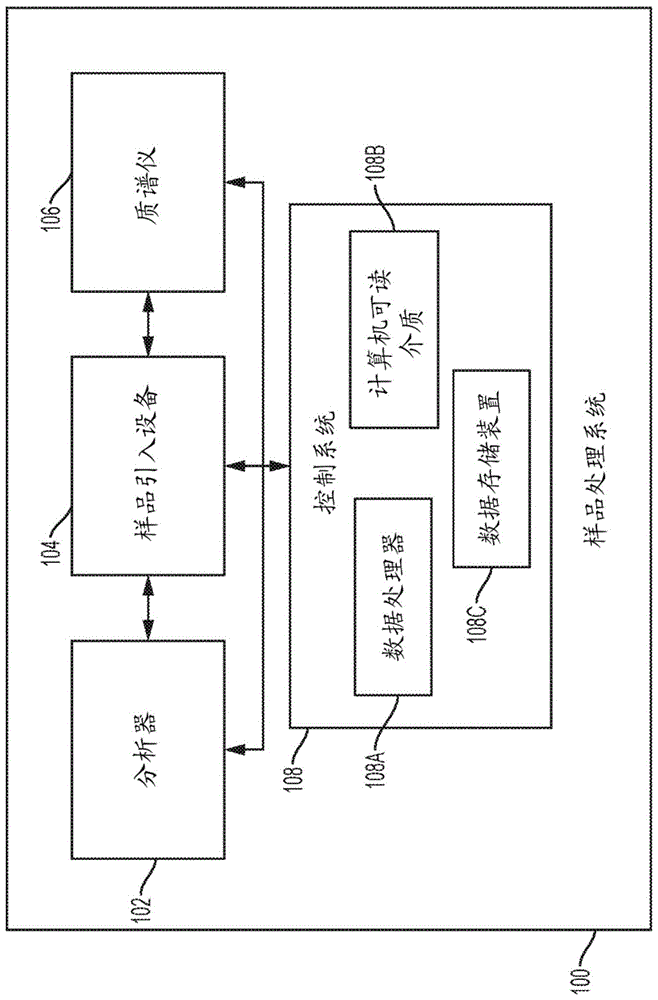
图1示出了根据本发明的实施方案的样品处理系统的高级框图。样品处理系统100包括分析器(例如,免疫分析器)102、质谱仪106和样品引入设备104。样品引入设备104可物理地和/或操作地联接到分析器102和质谱仪106,并且在一些实施方案中可形成单个仪器。样品引入设备104可用于将处理样品或样品等分试样从分析器102转移到质谱仪106。例如,样品引入设备104可被配置为将第一处理样品等分试样或第二处理样品等分试样从分析器102转移到质谱仪106。
分析器102可包括多个样品等分试样处理设备以形成用于分析的处理样品等分试样。此类处理设备可以以任何合适的方式处理样品或样品等分试样。样品等分试样处理设备的示例包括试剂添加站(例如,试剂移液站)、样品移液站、温育箱、洗涤站(例如,磁性洗涤站)、样品储存单元等。多个样品等分试样处理设备能够处理第一样品等分试样以形成第一处理样品等分试样,并且能够处理第二样品等分试样以形成第二处理样品等分试样。“处理样品等分试样”可包括由任何合适数量的处理设备处理任何合适次数的样品等分试样。
控制系统108也可存在于样品处理系统100中。控制系统108可控制分析器102、样品引入设备104和/或质谱仪106。控制系统108可包括数据处理器108a,以及联接到数据处理器108a的非暂态计算机可读介质108b和数据存储装置108c。非暂态计算机可读介质108b可包括代码,该代码可由处理器108a执行以执行本文所述的功能。数据存储装置108c可储存用于处理样品的数据,样品数据或用于分析样品数据的数据。
数据处理器108a可包括任何合适的数据计算装置或此类装置的组合。示例性数据处理器可包括一起工作以实现期望的功能的一个或多个微处理器。数据处理器108a可包括cpu,该cpu包括至少一个高速数据处理器,该高速数据处理器足以执行用于执行用户和/或系统生成的请求的程序部件。cpu可以是微处理器,诸如amd的athlon、duron和/或opteron;ibm和/或motorola的powerpc;ibm和sony的cell处理器;intel的celeron、itanium、pentium、xeon和/或xscale;和/或类似的处理器。
计算机可读介质108b和数据存储装置108c可以是能够储存电子数据的任何合适的一个或多个装置。存储器的示例可包括一个或多个存储器芯片、磁盘驱动器等。此类存储器可使用任何合适的电、光和/或磁操作模式来操作。
计算机可读介质108b可包括代码,该代码可由数据处理器108a执行以执行任何合适的方法。例如,计算机可读介质108b可包括代码,该代码可由处理器108a执行,以使样品处理系统执行方法,该方法包括使用来自免疫分析器的数据来确定免疫分析器处的第一处理样品等分试样中的分析物的检测低于、高于或等于预定阈值;以及响应于确定,使分析器处理样品的第二等分试样以形成第二处理样品等分试样,并且使样品引入设备将第二处理样品等分试样从分析器转移到质谱仪;以及使质谱仪检测第二处理样品等分试样中的分析物或另一种分析物的存在。在其他实施方案中,计算机可读介质108b可包括代码,该代码可由数据处理器108a执行,以使样品处理系统执行方法,该方法包括:使免疫分析器检测第一处理样品等分试样中的分析物;以及使质谱仪检测从分析器转移的第二处理样品等分试样中的分析物。在本发明的另外其他实施方案中,计算机可读介质108b可包括代码,该代码可由数据处理器108a执行,以使样品处理系统执行方法,该方法包括使用来自免疫分析器的数据来确定免疫分析器处的第一处理样品等分试样中的分析物的检测是低于还是高于预定阈值;以及响应于确定,使分析器处理样品的第二等分试样以形成第二处理样品等分试样,并且使样品引入设备将第二处理样品等分试样从分析器转移到质谱仪;以及使质谱仪检测第二处理样品等分试样中的分析物或另一种分析物的存在。在本发明的另外其他实施方案中,计算机可读介质108b可包括代码,该代码可由数据处理器108a执行以执行方法,该方法包括:引导包括至少一个移液器的等分试样站以提供样品的第一样品等分试样和样品的第二样品等分试样,引导分析器来处理容纳样品的第一样品等分试样的反应容器以形成第一处理样品等分试样,并且处理容纳样品的第二样品等分试样的反应容器以形成第二处理样品等分试样;引导分析器对第一处理样品等分试样中的分析物执行初级分析;引导样品引入设备以将样品的第二处理样品等分试样从分析器转移到质谱仪;以及在第二过程中引导质谱仪对第二处理样品等分试样中的分析物或另一种分析物执行次级分析。在另外其他实施方案中,计算机可读介质108b可包括可由数据处理器108a执行的代码以用于实现方法,该方法包括:由质谱仪对来自样品的第一样品等分试样的第一处理样品等分试样的分析物进行初级分析;以及在执行初级分析之后,通过样品处理系统中的质谱仪或分析器对来源于样品的第二等分试样的第二处理样品等分试样中的分析物或另一种分析物执行次级分析。
当分析物的浓度高于,低于或等于免疫分析器所检测到的预定阈值时,质谱仪上的重新测试可确认和/或定量存在的分析物的量。预定阈值可对应于第一处理样品等分试样中的分析物的预定量或预定浓度。当样品中分析物的浓度高于检测限制但低于免疫分析器的定量限制时,由质谱仪进行的重新测试是尤其有用的。当分析物的量指示应对其他分析物进行进一步测试时,由质谱仪进行的反射测试是尤其有用的(例如,如果发现一种麻醉代谢物,则可能期望运行一组其他麻醉剂)。
图2示出了根据本发明的实施方案的示意图,其示出可在样品处理系统中采取的不同处理路径。高级工艺流程可包括样品制备处理模块210、样品引入处理模块230和样品检测处理模块240。
样品制备处理模块210可包括处理包含分析物的样品的工艺步骤,使得其可在样品检测处理模块240期间被检测到。在本发明的实施方案中,样品制备处理模块210可包括免疫沉淀或免疫纯化过程。样品制备处理模块210中的步骤可在分析器102中进行。样品引入处理模块中的步骤可在分析器102、质谱仪106中进行,或者其可为与分析器102和质谱仪106分离或隔开的单独独立设备。样品检测处理模块240可在质谱仪106和/或免疫分析器102中执行。
样品引入处理模块230包括可将包含分析物的样品从分析器102转移到质谱仪106的工艺步骤。另外,样品引入处理模块230可包括在没有附加分离232和带有附加分离234的情况下转移样品。不包括附加分离232的特定样品引入过程可包括流动注入232a或spme(固相微萃取)/opp(开放端口探针)232b。可包括附加分离的样品引入过程可包括阱和洗脱处理模块234a。任选的dms(微分迁移光谱)处理模块238可在样品已被电离之后但在样品被质量分析之前在样品引入处理模块230的下游进行。
直接流动注入处理模块232a可利用可包括直接注入设备的设备,该直接注入设备可将处理样品从分析器直接注入质谱仪中。该设备可包括载体溶液源,该载体溶液源可用于将处理样品携带到质谱仪。直接流动注入设备中可包括诸如蠕动泵之类的泵。
spme/opp处理模块232b可利用spme装置和opp设备,其可包括开放端口采样接口。spme可将采样、样品制备和提取整合到单个无溶剂步骤中。一般来讲,spme装置利用涂覆有提取相的纤维或其他表面(例如,刀片、微尖端、销或网片),当将装置插入样品等分试样或处理样品等分试样中时,样品内的分析物可优先吸附到该提取相。spme装置可靠近opp,该opp可为竖直对齐的同轴管布置,使得溶剂能够通过管材环递送到采样端(开放端口),并且将中心管向下抽吸到由雾化器气体驱动的离子源中。
阱和洗脱处理模块234a可使用阱和洗脱设备。阱和洗脱处理模块234a可涉及将样品注入小体积柱中,其中在洗脱到质谱仪中之前浓缩所关注的分析物。捕集过程优化灵敏度和选择性,并改善稳健性。示例性阱和洗脱设备的示意图在图7a和图7b中示出,其将在下面进一步详细描述。
在其他实施方案中,代替阱和洗脱处理模块,可使用烃(例如,c18)涂覆的尖端。此类尖端可商购获得。
样品引入处理模块230还可包括机械反应容器传送装置。此类传送装置可包括拾取和放置设备诸如拾取和放置转移机架,转移梭诸如延伸的线性反应梭,或拾取和放置转移机架和延伸的线性反应梭的组合。
样品检测处理模块240可包括用于检测样品中特定分析物的存在、不存在和/或量的步骤。样品检测处理模块240可包括质谱处理模块240a和/或光学检测处理模块240b的使用。光学检测处理模块240b可使用基于化学发光或荧光的检测过程。下文提供了有关质谱处理模块240a和光学检测处理模块240b的其他细节。
图3a示出了根据本发明的实施方案的高级流程图300,示出可使用样品处理系统执行的不同类型的检测过程。在流程图300中,示出了使用光学检测过程和质谱过程来检测特定分析物的存在、不存在和/或浓度的能力。显而易见的是,本发明的实施方案在确定特定样品中是否存在分析物方面具有极大的灵活性。
在步骤302中,包括分析器中的至少一个移液器的等分试样站可获得样品的两种或更多种样品等分试样并可将它们分配到两个或更多个反应容器中。等分试样站中的至少一个移液器可向第一反应容器提供(例如,分配)样品的第一样品等分试样。在步骤304处,可在免疫分析器中对样品等分试样中的一个进行免疫测定测试(初级分析的示例)。包括第一样品等分试样的第一反应容器可由免疫分析器处理以形成第一处理样品等分试样。然后,免疫分析器可用于检测反应容器中的第一处理样品等分试样中是存在还是不存在特定分析物。
在步骤306中,在对第一处理样品等分试样执行免疫测定测试之后,样品处理系统中的控制系统可决定是否需要验证测试。如果需要验证测试,则包括该至少一个移液器的等分试样站可提供样品的第二样品等分试样。然后可由分析器处理第二反应容器中的第二样品等分试样以形成第二处理样品等分试样。在步骤314中,可经由适当的样品引入设备将第二处理样品等分试样从分析器转移到质谱仪。一旦处理的第二等分试样在质谱仪中,质谱仪便可在步骤310中对处理的第二等分试样执行质量分析(次级分析的示例)。在对处理的第二样品等分试样执行质量分析之后,可在步骤312中生成报告。如果不需要验证测试,则可在步骤308中生成报告而不在步骤310中执行质谱分析。
在一些实施方案中,来自免疫分析器的数据可指示第一处理样品等分试样中的分析物浓度低于、高于或等于初级分析中的预定阈值。然后,控制系统可确定样品上的反射过程可能是期望的或需要的。该方法然后还可包括使分析器处理样品的第二等分试样以形成第二处理样品等分试样。样品引入设备可将第二处理样品等分试样从分析器转移到质谱仪。然后,控制系统可使质谱仪在次级分析中检测第二处理样品等分试样中的一种或多种其他分析物的存在。
在一些情况下,初级分析中的分析物的检测可指示可存在特定状况(例如,医疗状况)。然而,为了确认存在特定状况,次级分析可使用质谱来分析第二分析物。第一分析物和第二分析物的存在或不存在可一起指示存在特定状况。
上述阈值可为任何合适的值。例如,阈值可以是在可以有把握地断定分析物是否存在于处理样品等分试样中之前,在处理样品等分试样中需要存在预定数量(例如,量)或浓度的特定分析物。
在反射过程中使用质谱分析是期望的。在一些情况下,当在传统的免疫分析器中测试样品的分析物时,非特异性结合可能会在抗体和/或它们所附着的磁珠上发生。这可能影响正在进行的分析的准确性。质谱分析不受与非特异性结合相关联的问题的影响,并且因此可用作反射测试或一般测试的有效机制。
还可参考图3b描述其他方法。在第一示例性方法实施方案中,在步骤322处,样品处理系统中的样品制备模块(例如,在分析器中)可以生成样品的多个样品等分试样。在步骤322中,包括至少一个移液器或其他分配装置的等分试样站可将一个或多个样品的样品等分试样获得到一个或多个反应容器中。可处理这些样品等分试样以形成如本文所述的处理样品等分试样。
在步骤324中,可对在步骤322中获得的处理样品等分试样执行包括质谱测试的初级分析。在执行初级分析之后,可响应于分析的步骤322中的初级分析来由样品处理系统生成报告。可确定样品中特定分析物的存在、不存在或浓度。在一些实施方案中,可对处理样品等分试样进行处理,使得可检测一组分析物内的一种或多种分析物(如果它们存在于样品中)。质谱测试324可在样品中识别出一组分析物(例如,多种潜在的滥用药物、形成一组的多种蛋白质或形成一组的多种类固醇)中的一种或多种分析物,并且/或者确定样品中一种或多种分析物的特定量。样品处理系统可选择样品中的一种或多种识别分析物。此时,样品处理系统的控制系统可使样品处理系统根据次级分析来测试所选择的一个或多个样品。
在其他实施方案中,次级分析可以是步骤326中对质谱仪进行的另一项验证测试。样品制备模块可处理样品的样品等分试样,并将处理样品等分试样转移回质谱仪以执行包括第二质谱测试326的次级分析。次级分析可确认样品中存在在初级分析中识别的特定一种或多种分析物。在完成次级分析之后,可在步骤334中生成报告。
在一些实施方案中,次级分析可为对所选择的一个或多个样品的免疫测定测试(步骤328)。样品制备模块可处理样品的样品等分试样,并且可在免疫分析器中对处理样品等分试样进行处理以执行免疫测定测试328。免疫测定测试可确认在初级分析中识别的一种或多种分析物的存在或量。在次级分析之后,可在步骤330中生成报告。
相对于图3b所述的过程可使用质谱测试来对样品进行初始筛选,以确定特定分析物或分析物组是否可能存在于特定样品中。一旦初始筛选过程完成,则可执行次级分析以提供关于初级分析结果的确认。如果执行的初级分析是尚未经适当授权方(例如,fda或食品和药物管理局)批准的程序,则这可能是有用的。因此,该方法可用于提供以快速执行所关注分析物的样品的测试。
图4a示出了根据本发明的实施方案的可用于自动化样品处理系统中的自动化免疫化学分析器400的框图。自动化免疫化学分析器400的基本结构和功能模块可包括样品呈现单元401,包括主样品移液站402的等分试样站,散装容器进料器403,第一双试剂移液站404和405,第二双试剂移液站406和407,第一拾取和放置夹持器408,第二拾取和放置夹持器409,第三拾取和放置夹持器410,温育箱/洗涤/读取站412,样品存储装置411和试剂存储装置413。任选地,样品和/或试剂存储装置可被冷却。
样品呈现单元401可用于将整个所需的测试样品传送至主样品移液站402并从该主样品移液站传送整个所需的测试样品。样品呈现单元401的配置和功能的详细描述在2001年5月3日提交的美国专利no.6,790,413中提供,该专利全文以引用方式并入本文。
主样品移液站402可用于从样品管中抽吸出样品并将它们分配到由散装容器进料器403供应的反应容器中。散装容器进料器403的配置和功能的详细描述在2001年2月6日提交的美国专利no.6,790,412中提供,该专利全文以引用方式并入本文。
四种试剂移液站404、405、406和407可用于将样品与试剂混合以用于后续的测定。四个试剂移液站404、405、406和407可被布置为两个双移液站并且可彼此独立。四个试剂移液站404、405、406和407中的每个可具有其自身的流体泵和阀、洗涤塔、反应容器托架和移液器。尽管示出了四个移液站404、405、406、407,但应当理解,本发明的实施方案可包括更多或更少的移液站。
三个容器拾取和放置夹持器408、409、410可用于在分析器的各种模块之间传送样品和反应容器。第一拾取和放置夹持器408可用于在散装容器进料器403或样品存储装置411与试剂移液站404、405、406、407之间传送反应容器。第二拾取和放置夹持器409可用于在试剂移液站404、405、406、407和温育箱/洗涤/读取站412的温育箱之间传送反应容器。第三拾取和放置夹持器410用于在温育箱和温育箱/洗涤/读取站412的洗涤轮(洗涤站的示例)之间传送反应容器。容器拾取和放置夹持器408、409和410的配置和功能的详细描述在美国专利no.7,128,874中提供,该专利全文以引用方式并入本文。应当理解,本发明的实施方案可具有更多或更少的拾取和放置夹持器。
样品存储装置411可用于在低温下将容纳在反应容器中的样品储存一定的时间段,例如长达三(3)个小时,使得样品可用于重新测试或反射测试。当要求对患者样品进行测试时,测试结果可能会导致要求进行附加测试。如上所述,附加测试的这种自动请求是反射测试。从第一次尝试到知道是否将开始另一项测试的时间延迟可能长达45分钟或更长。将样品管保持这样的一段时间可防止样品在其他地方使用。如果将管传递到其他仪器,则实验室技术人员可能难以找到管并将其重新装入要求进行反射测试的仪器上。为了允许对可能需要进行反射测试的样品管进行单次快速采样抽取,可用足够的测试材料进行单次抽吸(等分试样)以进行可能的反射测试。然而,为了确保测试材料不蒸发或劣化,可能需要在分析器上冷藏等分试样。
样品存储装置411可为一个或多个反应容器,该反应容器容纳用于在初级分析中处理的样品的样品等分试样。储存在样品存储装置411中的样品等分试样可用于对分析器或质谱仪执行次级分析(例如,反射测试)。
参照图4c,示出了自动化免疫化学分析器的主样品移液站402和样品存储装置411的布置。主样品移液站402的移液器首先从样品管中抽吸样品,然后移动到样品存储装置411上方的位置中。同时,样品存储装置411首先通过拾取和放置夹持器417从散装容器进料器403接收空反应容器,然后在主样品移液站402的移液器下移动空反应容器。然后将抽吸的样品分配到冷却的反应容器中。提供绝缘和门418以控制样品存储装置411中的环境。样品存储装置411可为具有多个存储位置419的精密控制的冰箱,该存储位置能够接收和转移用于样品材料或填充有样品材料的反应容器。样品等分试样可存在于储存在样品存储装置411中的反应容器中。这些样品可用于免疫分析器中或质谱仪中的重新测试或反射测试。
温育箱/洗涤/读取站412可用于测定的温育、洗涤和读取步骤。在一些实施方案中,温育箱/洗涤/读取站412可一般地表征为分离站。其可包括一个或多个温育箱,一个或多个测定洗涤站,以及一个或多个读取器,诸如光电倍增管(pmt)检测器或其他光学检测系统。温育箱/洗涤/读取站的配置和功能的详细描述在2001年3月16日提交的美国专利no.7,217,391中提供,该专利全文以引用方式并入本文。
作为最小化来自过量或未结合材料的背景信号的方式,免疫测定通常使用在反应容器中进行的一个或多个分离相。为了促进分离或洗涤过程,可使用多种技术,包括但不限于孔涂覆技术,珠涂覆技术,或顺磁性颗粒的使用。这些分离介质中的每个涂覆有将在样品中结合所关注的分析物分子的捕获试剂(例如,抗体)。当使用顺磁性颗粒作为分离介质时,在洗涤过程期间将顺磁性颗粒通过磁体拉到反应容器的壁,并且抽吸上清液。然后将发光标签结合到这些分析物分子。当将发光试剂或底物添加到反应容器中时,其与发光标签反应以产生可被分析器的光学检测站检测到的光。
试剂存储装置413可用于储存用于免疫测定以及质谱过程的试剂。在一些实施方案中,试剂存储装置可包括多个试剂包,该试剂包包括包含用于执行免疫测定的试剂的第一多个试剂包,和包含用于在所述质谱仪中执行质量分析的试剂的第二多个试剂包。
在一些实施方案中,试剂存储装置413中的试剂包可包括呈液体或固体形式的试剂。试剂存储装置413可在冷藏环境中储存试剂包,直到被要求使用,当被要求使用时将包转移到适当的试剂移液站,并且当移液完成时将包返回到存储装置。它还可以在请求时将完整或部分使用的包返回给操作者,并自动丢弃空包。试剂存储装置413中的温度可由珀尔帖装置控制并用热敏电阻器监测。
对于免疫测定,某些类型的试剂可包括具有或不具有抗体或抗原涂层的顺磁性颗粒、阻断剂、抗体、测定缓冲液、缀合到酶的抗体(用于化学发光)、样品预处理试剂诸如酸,碱或释放剂。
对于质谱,在样品制备过程期间,可使用质谱试剂诸如质量标签(例如,amplifextm质量标签)来增强信号并改善灵敏度。如上所述,诸如此的试剂可与将被处理以进行质谱分析的第二样品等分试样一起使用。
试剂包可如下装载到试剂存储装置413中:(a)操作者打开输入托盘盖,并在必要时定位输入托盘,以允许操作者将试剂包放入托盘中;(b)关闭输入托盘盖并且输入托盘关闭,从而将试剂包带入试剂存储装置413中;(c)当输入托盘关闭时,每个试剂包位置均通过条形码读取器(bcr),在其中读取并识别四个包位置中的每个;(d)试剂包传送和分选机构的试剂包夹持器移动,以从由条形码读取器识别的输入托盘中得到包;(e)试剂包传送和分选机构的试剂包夹持器将试剂包移动到存储位置或移液位置(如果需要的话),然后将试剂包掉下,以及(f)可以重复上述步骤(d)至(e),直到从输入托盘中移除所有试剂包。
试剂存储装置413包括用于传送和分选多个试剂包的机构。用于传送和分选多种试剂包的这样的机构的配置和功能的详细描述在2000年6月15日提交的美国专利no.6,746,648中提供。试剂存储装置413的其他结构和功能符合本领域的普通技术人员已知的现有布置,因此在此处将不进行详细描述。
图4b示出了示例性流程图,其示出自动化免疫化学分析方法的基本操作程序。
自动化免疫化学分析的基本操作程序可在自动免疫化学分析器的三个主要区段中进行:样品等分试样区段414,其中样品被抽吸出样品管并分配到反应容器中;试剂移液区段415,其中样品与试剂混合;以及温育/洗涤/读取区段416,其中混合的样品被温育、洗涤、并与颗粒分离,并且由光电倍增管(pmt)检测器或其他光学检测站进行读取。
样品等分试样区段414和温育/洗涤/读取区段416各自具有一组单元,并且以循环(在一个实施方案中,九(9)秒循环)工作。试剂移液区段415可具有四(4)个独立工作的试剂移液站,其中每个试剂移液站以秒循环(在一个实施方案中,三十六(36)秒循环)工作。
然而,四个试剂移液站的调度可交错(在一个示例中,间隔九(9)秒)。例如,分析器可在每九(9)秒内接受一(1)个测试样品,即,分析器具有九(9)秒的有效循环。因此,分析器可具有快速吞吐量(例如,每小时四百(400)次测试)。本发明的实施方案不限于这些时序或值。
参照图4a和图4b,样品等分试样区段414、试剂移液区段415和温育/洗涤/读取区段416的基本操作程序描述如下:
a.样品等分试样区段414的操作循环
1.用户将包含多达四(4)个样品管的样品架装载到样品呈现单元401上。
2.将架推进到主样品移液站402中,其中样品可由条形码读取器(bcr)识别并呈现给主样品移液站402。
3.同时,散装容器进料器403将测试所需的反应容器呈现给样品反应容器托架,第一拾取和放置夹持器408从其中将反应容器拾起并将其储存在样品存储装置411中和/或可用试剂移液站404、405、406、407中的任一个的反应容器托架中。
4.主样品移液站402抽吸所需量的样品并将其等分到样品存储装置411中的反应容器中,并且然后将探针在其专用洗涤站中洗涤。可洗涤样品探针以将样品残留减少到不会对其他样品产生不利影响的水平。
b.试剂移液区段415的操作循环
1.第一拾取和放置夹持器408拾起容纳等分试样样品的反应容器,并将其移动到可用的试剂移液站上。
以下描述了该过程:(a)将样品存储装置411中所请求的反应容器定位在第一拾取和放置夹持器408的操作位置下方;(b)将可用试剂移液站的反应容器托架定位在第一拾取和放置夹持器408的另一个操作位置下方;以及(c)第一拾取和放置夹持器408将所请求的反应容器从样品存储装置411转移到可用试剂移液站的反应容器托架中。
2.同时,试剂存储装置413将所需的试剂包带入相同的试剂移液站。
3.在试剂包和反应容器处于适当位置的情况下,该试剂移液站的试剂移液器从样品反应容器抽吸所需量的样品,并将其分配到测定反应容器中,而且还从试剂包中取出所需量的试剂并且将其分配到测定反应容器中,然后在其专用的洗涤站中洗涤探针。
以下描述了样品抽吸过程:(a)将试剂移液站的试剂移液器定位在反应容器上方;(b)使用超声波液位感测电路来检测样品的表面,一旦发现表面并且移液器的深度足以抽取所需的样品体积,便停止移液器的下降(因此减少残留);以及(c)使用精密泵和阀抽取样品,其中在样品抽吸期间,通过使用压力传感器来收集内嵌压力曲线,该曲线可用于验证正确的样品拾取。本文所用的精密泵和阀的配置和功能的详细描述在美国专利no.6,520,755和no.6,843,481中提供,这些专利全文以引用方式并入本文。
以下描述了试剂抽吸过程:(a)试剂移液站的试剂移液器移动到试剂包的适当试剂孔位置;(b)试剂移液器被降低到试剂包孔中,并且如果这是颗粒孔,则启用超声混合电路(并检查锁定信号以确保正确操作)以在抽吸之前混合颗粒;以及(c)使用精密泵和阀抽取试剂,其中在试剂抽吸期间,通过使用压力传感器来收集内嵌压力曲线,该曲线用于验证正确的试剂拾取。
以下描述了样品或试剂递送的过程:(a)试剂移液站的试剂移液器移动到移液站的反应容器托架中的测定反应容器位置;(b)将试剂移液器下降到测定反应容器中,其中计算确切的分配高度,以使样品或试剂在分配后才接触探针(以确保在探针的尖端上没有残留样品或试剂);以及(c)使用精密活塞泵和阀分配样品或试剂,其中在样品递送期间,通过使用压力传感器来收集内嵌压力曲线,该曲线用于验证正确的样品或试剂递送。
以下描述了样品稀释过程:(a)取出适当的样品反应容器以用于移液;(b)将可用试剂移液站的试剂容器托架中的稀释位置定位在第一拾取和放置夹持器408的操作位置下方;(c)散装容器进料器供应两个空容器(反应容器和稀释容器);(d)第一拾取和放置夹持器408将两个容器同时转移到可用的试剂移液站的试剂容器托架;(e)使用精密活塞泵和阀将样品抽吸并与附加体积的缓冲液一起递送到稀释容器,其中计算确切的分配高度,以使稀释样品在分配后才接触探针(以确保在探针的尖端上没有残留样品);或在要求混合的情况下略微更深(在这种情况下,启用超声混合电路并检查锁定信号以确保正确操作);(f)使用精密泵和阀抽吸特定体积的该稀释样品,其中在抽吸期间,通过使用压力传感器来收集内嵌压力曲线,该曲线用于验证正确的稀释样品拾取;(g)如果剩余样品,则将原始反应容器返回样品存储装置411;如果原始反应容器为空,则将其丢弃;以及(h)容纳稀释样品的容器现在成为正在处理的后续测定的反应容器。
以下描述了样品和试剂添加的过程:(a)从样品存储装置411中取出所要求的样品;(b)散装容器进料器将空反应容器供应到容器供应托架;(c)将容器供应托架定位在第一拾取和放置夹持器408的操作位置下方;(d)将可用试剂移液站的试剂容器托架定位在第一拾取和放置夹持器408的其他操作位置下方;(e)第一拾取和放置夹持器408将空反应容器转移到可用试剂移液站的试剂容器托架;(f)试剂容器托架被定位用于移液;(g)所要求的试剂包也被定位用于移液;(h)试剂移液站的试剂移液器移动到试剂洗涤塔,然后下降到试剂洗涤塔中,以用于洗涤探针;(i)抽吸样品并将其递送到反应容器;(j)试剂移液器移动到试剂洗涤塔,然后下降到试剂洗涤塔中,以用于洗涤探针;(k)试剂移液器抽吸适量的试剂并将其递送到反应容器;(l)重复上述步骤(j)和(k),直到所有的试剂已被递送到反应容器;(m)如果期望反应容器混合,则探针略微向下移动,并启用超声混合电路,并且检查锁定信号以确保正确操作;(n)将试剂容器托架定位在第二拾取和放置夹持器409的操作位置下方;(o)将反应容器温育箱轮上的空位置定位在第二拾取和放置夹持器409的另一个操作位置下方;(p)第二拾取和放置夹持器409将反应容器转移到温育/洗涤/读取站412的温育箱中;(q)在两步或三步测定的情况下,第二拾取和放置夹持器409将使反应容器回到移液位置,并且将添加附加试剂,然后通过第二拾取和放置夹持器409将容器转移回到温育/洗涤/读取站412的温育箱以用于第二次或第三次温育。
可洗涤试剂探针以将样品和试剂残留减少到不会对其他样品或试剂产生不利影响的水平。以下描述了该过程:(a)启用超声电路以洗涤试剂探针;(b)真空泵抽空塔,同时监测塔的抽空线压力,以确保塔正确排空;(c)用精密泵和精密阀在内部用缓冲液冲洗探针,并使用蠕动泵在外部进行淋洗;以及(d)当真空泵和超声电路运行时间略长时,停止缓冲液流动,以确保探针被干燥。
4.第二拾取和放置夹持器409拾起容纳样品和试剂混合物的测定反应容器,并将其移动到温育箱/洗涤/读取站412的温育箱轮上。
5.如果需要进行反射测试,则第一拾取和放置夹持器408拾起容纳剩余等分试样的样品的样品反应容器,并且将其返回到样品存储装置411,否则将其射出到废料容器中。
以下描述了该过程:(a)将样品存储装置411中的样品存储位置定位在第一拾取和放置夹持器408的操作位置下方;(b)将试剂移液站的反应容器托架定位在第一拾取和放置夹持器408的其他操作位置下方;以及(c)第一拾取和放置夹持器408将样品反应容器从可用试剂移液站的反应容器托架转移到样品存储装置411。
c.温育/洗涤/读取区段416的操作循环
1.用加热器元件将测定容器在受控温度下保持在温育箱轮中持续编程的时间,并用热敏电阻进行监测,然后由第三拾取和放置夹持器410拾起以进行洗涤。
2.洗涤/读取环具有多个抽吸站和多个分配站,并且测定反应容器在受控温度下用加热器元件经历若干操作(包括颗粒洗涤、底物添加和温育等),并且用热敏电阻进行监测。
3.测定反应容器由读取器/检测器读取,然后由第三拾取和放置夹持器410放回温育箱,然后由第二拾取和放置夹持器409拾起并丢弃在废料容器中。
分析器的操作由流体系统,电子控制硬件和软件支持,包括各种传感器和微控制器、电力供应单元、马达和驱动机构、以及机械结构,并且合适材料和结构的确定在本领域的技术范围内。
在自动化免疫化学分析中执行的方法还可包以下步骤:(a)调整至少两个程序中的至少一个的相应循环,使得至少两个程序中的一个具有第一时间段的操作循环,并且至少两个程序中的另一个具有第二时间段的操作循环,并且第二时间段除以第一时间段的商为整数;(b)提供用于执行至少两个程序中的另一个的多个独立工作站,每个工作站在第二时间段的循环中操作,使得此类站的数量等于整数;以及(c)使独立工作站的相应循环错开持续第一时间段,使得工作站中的至少一个可用于第一时间段的每个操作循环。
分析器具有许多独特的特征和优点。首先,分析器能够具有高吞吐量,例如,每小时400次测试。其次,分析器能够提供多个可独立工作的移液模块,即使模块之一发生故障,也可以确保不间断的分析。第三,分析器可在大容量样品存储区域内执行重新测试或反射测试。
图5a示出了根据本发明的实施方案的温育转盘500的剖视图。图5b示出了温育转盘500的一部分的横截面。图5c示出了温育转盘500的一部分的顶部透视图。
参照图5a,温育转盘500可包括主体,该主体包括呈圆形板形式的顶部部分502,该圆形板具有孔504的阵列以用于接收具有待处理样品的反应容器。每个孔504可对应于离散温育区域,其中可以对反应容器进行温育过程。顶部部分502位于底部部分503的顶部上,该底部部分包括多个同心壁503a(示于图5b中)。主体位于可导致温育转盘500旋转的轴线510上。如果需要,可在主体内包括加热器诸如薄膜加热元件,使得可根据需要加热孔504内的样品。温育箱转盘500可具有其他形状,或者具有比具体示出更多或更少的孔。
磁体508可存在于温育转盘500的主体的底部部分503内。如图5a-图5c所示,磁体508存在于温育区域的最内圆中,但它们是任何合适数量的温育区域的一部分。磁体可用于结合磁性颗粒,使得可以执行适合于下游质谱分析的任何上清液。磁体可以是永磁体或电磁体。抽吸装置(未示出)诸如移液器可移除任何上清液,并且可将上清液转移到样品引入设备,以最终转移到质谱仪。
可形成质谱仪的一部分的多种质量分析器系统可用于根据本发明的实施方案的样品处理系统中。合适的质量分析器系统包括具有离子分裂器的两个质量分离器,该离子分裂器设置在两个质量分离器之间的离子飞行路径中。合适的质量分离器的示例包括但不限于四极、rf多极、离子阱、飞行时间(tof)以及与定时离子选择器结合的tof。合适的离子分裂器包括但不限于基于以下原理操作的那些离子分裂器:碰撞诱导解离(cid,也称为碰撞辅助解离(cad)),光诱导解离(pid),表面诱导解离(sid),源后衰变,与电子束相互作用(例如电子诱导解离(eid),电子捕获解离(ecd)),与热辐射相互作用(例如热/黑体红外辐射解离(bird)),源后衰变,或它们的组合。
合适的质谱仪的示例包括但不限于包括以下各项中的一个或多个的那些质谱仪:三重四极,四极线性离子阱(例如,4000q
在各种实施方案中,质谱仪包括maldi离子源。在各种实施方案中,将组合样品的至少一部分与maldi基质材料混合,并使用具有maldi电离源的质量分析器进行母离子到子离子跃迁监测。
质谱仪可包括三重四极质谱仪,用于选择母离子并检测其片段子离子。在该实施方案中,第一四极选择母离子。将第二四极保持在足够高的压力和电压下,使得发生多次低能碰撞,从而导致一些母离子碎裂。选择第三四极以将所选择的子离子传输至检测器。在各种实施方案中,三重四极质谱仪可包括设置在离子源和三重四极之间的离子阱。离子阱可被设置为收集离子(例如,所有离子,具有特定m/z范围的离子等),并且在填充时间之后,通过对末端电极进行脉冲来将所选离子传输到第一四极以允许所选离子离开离子阱。期望的填充时间可例如基于离子的数量、离子阱内的电荷密度、不同标记肽洗脱之间的时间、占空比、激发态物质或多重带电离子的衰变速率、或它们的组合来确定。
三重四极质谱仪中四极中的一个或多个可被配置为线性离子阱(例如,通过添加末端电极以在四极内提供基本上细长的圆柱形捕集体积)。在各种实施方案中,第一四极选择母离子。将第二四极保持在足够高的碰撞气体压力和电压下,使得发生多次低能碰撞,从而导致一些母离子碎裂。选择第三四极以捕集片段离子,并在填充时间之后,通过对末端电极进行脉冲来将所选离子传输到检测器以允许所选子离子离开离子阱。期望的填充时间可例如基于片段离子的数量、离子阱内的电荷密度、不同标记肽洗脱之间的时间、占空比、激发态物质或多重带电离子的衰变速率、或它们的组合来确定。
在一些实施方案中,质谱仪可包括两个四极质量分离器和tof质谱仪,用于选择母离子并检测其片段子离子。在各种实施方案中,第一四极选择母离子。将第二四极保持在足够高的压力和电压下,使得发生多次低能碰撞,从而导致一些离子碎裂,并且tof质谱仪例如通过以下方式选择子离子以用于检测:监测涵盖所关注子离子和生成的提取离子色谱的质量范围内的离子;使出现在所选子离子的时间窗口之外的离子偏转远离检测器,将检测器按时间选通到所选子离子的到达时间窗口,或它们的组合。
在一些实施方案中,质谱仪可包括两个tof质量分析器和离子分裂器(诸如cid或sid)。在各种实施方案中,第一tof选择母离子(例如,通过将出现在所选母离子的时间窗口之外的离子偏转远离分裂器)以引入离子分裂器中,并且第二tof质谱仪例如通过以下方式选择子离子以用于检测:监测涵盖所关注子离子和生成的提取离子色谱的质量范围内的离子;使出现在所选子离子的时间窗口之外的离子偏转远离检测器,将检测器按时间选通到所选子离子的到达时间窗口,或它们的组合。tof分析器可以是线性或反射分析器。
质谱仪可以包括串联ms-ms仪器,该仪器包括第一无场漂移区,该第一无场漂移区具有定时离子选择器以选择所关注母离子,分裂室(或离子分裂器)以产生子离子,并且选择质量分离器以传输所选子离子以进行检测。在各种实施方案中,定时离子选择器包括脉冲离子偏转器。在各种实施方案中,离子偏转器可用作脉冲离子偏转器。质量分离器可包括离子反射器。在各种实施方案中,分裂室是被设计成引起离子碎裂并且延迟提取的碰撞室。在各种实施方案中,分裂室还可用作延迟提取离子源,以用于通过飞行时间质谱来分析片段离子。
在一些实施方案中,电离可用于产生结构特异性片段离子和q3mrm离子。标记试剂可以全部或部分包含在结构特异性片段离子中。该方法可提供q3mrm离子的灵敏度和特异性。在一些实施方案中,电离可用于产生显性中性损失片段离子,其可在q3中选择,然后分裂以产生结构特异性离子。然后可在称为ms3的程序中使用这些片段离子来进行识别和定量。
图6a示出了示例性质谱仪600和联接到质谱仪的样品引入设备601的框图。样品溶液可能已从分析器转移到样品引入设备601中。在一些实施方案中,样品引入设备601可在分析器中。样品引入设备601可通过连接管602联接到质谱仪600。样品引入设备601可通过连接管602将样品溶液引入到离子源603。离子源603可通过信号线605a由离子源电源604控制。将有关由离子源603生成的样品分子的离子引入质量分析区域606并进行质量分析。通过真空系统607将质量分析区域606抽空至真空。通过离子检测器608检测如此质量分析的离子。检测信号通过信号线605b馈送至数据处理单元609。数据处理单元609可以是单独的单元或者可以是先前描述的控制系统的一部分。
图6b示出了使用电喷射方法的质谱仪的一部分的示意图。图6b为示出样品引入设备619的联接到电喷射离子源的结构的截面图。将由样品引入设备619提供的样品溶液通过连接管622和连接器630引入毛细管621中以用于雾化。通过在雾化毛细管621和反电极632之间施加kv量级的电压,从雾化毛细管的末端圆锥形地雾化样品溶液的小带电液滴,即,发生所谓的电喷雾现象。在电喷雾方法中,提供了用于雾化气体的输出623,以使得气体诸如氮气从雾化毛细管621的周围倒出,从而加速小带电液滴的蒸发。另外,气体(诸如氮气)从出口624被吹向所生成的小带电液滴,以蒸发设置在反电极632侧的气体,从而加速小带电液滴的蒸发。由此生成的离子通过离子采样孔625引入真空626中,并通过质量分析区域626在高真空下进行质量分析。
图6c示出了离子检测器的结构。图6c所示的结构可用于改善质谱仪中的信噪比(sin)。离子偏转电极646可设置在质量分析区域648的后部部分中,以便在高频电场下进行质量分离,以使质量分离的离子偏转。偏转的离子在kv量级的电压下加速并与倍增极657碰撞以产生次级电子。从与离子碰撞的次级电子产生倍增极657发射次级电子。由电子检测器658(诸如电子倍增器)检测发射的次级电子。通过图6c所示的结构,通过离子检测器648防止了不带电荷的中性分子,带电液滴或不带电荷的液滴被检测为信号,使得实现了s/n的提高。
如上所述,样品引入设备可设置在分析器和质谱仪之间。一种类型的样品引入设备可为阱和洗脱设备。合适的阱和洗脱设备的细节可参考图7a和图7b描述。
图7a示出了根据本发明的实施方案的处于第一构型的阱和洗脱设备700中的部件的示意图。图7b示出了根据本发明的实施方案的处于第二构型的阱和洗脱系统700。
阱和洗脱设备700包括与混合器706流体连通的第一泵702和第二泵704。喷射器708位于混合器706的下游并且与该混合器流体连通。喷射器708可与一系列阀710接合。该系列阀中的连接点可标记为1-6。该系列阀可存在于开关阀装置710中,该开关阀装置可连接到阱712,并且可将阱712与下游废料站718或下游质谱仪720连接或断开。阱712可包含任何合适的材料,诸如c18材料。
在图7a中,在质谱仪720中待处理的样品可被泵702泵送到混合器706中并进入喷射器708中。然后可将该待处理的样品注入切换阀装置710中的一系列阀中(连接点1-2、3-4和5-6可以连接),并且可使其流过阱并到达废料站。可将任何所关注的分析物捕获在阱712中,并且可将不受关注的样品的任何液体组分转移到废料站718。
在图7b中,切换阀装置710中的一系列阀中的连接点被切换。现在,连接点2-3、1-6和4-5已连接。如图所示,与质谱仪720相容的缓冲液可从第二泵704泵送到混合器706,并泵送到喷射器708。然后,喷射器708可将缓冲液注入到阱712,并且缓冲液将使任何所关注的分析物从阱712中洗脱掉并进入质谱仪720中。
样品处理系统可能够对任何合适的样品中的任何合适的分析物执行任何合适的分析。这样的分析可包括免疫纯化和检测过程,蛋白质沉淀和检测过程,以及siscapa型处理方法。与通过质谱直接测量完整蛋白质不同,siscapa利用蛋白水解消化(例如,利用胰蛋白酶)将样品蛋白裂解成理想地适于通过质谱进行定量的较小肽。通过选择序列仅在所选靶标蛋白中出现的靶标肽(所谓的“蛋白水解”肽),靶标肽可以用作靶标蛋白的直接定量替代物。含有稳定同位素标记的靶标肽的合成型式可以以已知的量添加到消化的样品中,以用作内部标准(sis)。由于靶标肽和sis在整个工作流程中是化学上不可区分的,但由于稳定同位素标记的质量差可由质谱仪单独测量,因此它们的比率提供靶标肽量的期望定量估计。
图8-图10示出了利用分析器来制备用于质谱分析的样品以及由质谱仪执行的后续质量分析的过程。
图8示出了根据本发明的实施方案的流程图,示出免疫纯化过程。可相对于以上图4a中的分析器图进行参考。
在步骤802中,将样品管中的样品装载到分析器400中的样品呈现单元401中。样品管可与多个其他样品管一起存在于样品管架或其他样品管载体中。
在步骤804中,主样品移液站402然后可将样品管中的样品的一个或多个等分试样移液到由散装容器进料器403提供的一个或多个反应容器中。此时,第一拾取和放置夹持器408可将反应容器转移到试剂移液站404、405、406、407。如果两个反应容器中存在两个样品等分试样,则反应容器中的一个可由第一拾取和放置夹持器40传送到样品存储装置412,以便将来可通过免疫分析器或质谱仪进行反射测试或重新测试。在一些情况下,可将具有样品等分试样的单个反应容器存储在样品存储装置412中,并且可将其用于多次测试(例如,通过从反应容器中取出次级等分试样并转移到第三容器)。在一些情况下,可在反应容器中从初始等分试样进行5-10次测试。
在步骤806中,在试剂移液站404、405、406、407中的一个中,可将涂覆有分析物特异性捕获抗体的磁珠连同任何其他合适的试剂一起添加到反应容器中的样品等分试样中。然后可在试剂移液站中混合试剂和样品等分试样。可通过使用移液器反复抽吸和分配反应容器内部的流体或通过任何其他合适的混合过程来进行混合。还应注意,即使在该示例和其他示例中将试剂描述为已移液,也应当理解,可以以任何合适的方式将试剂添加到反应容器中。例如,可在将样品等分试样添加到反应容器之前或之后将干试剂提供或添加到反应容器中。
在将适当的试剂添加到容纳样品等分试样的反应容器中之后,第二拾取和放置夹持器409可将反应容器转移到温育箱/洗涤/读取站412。
在步骤808中,在温育箱/洗涤/读取站412中的温育箱中,可温育容纳磁珠和样品的反应容器以在附接到磁性颗粒的抗体上捕获任何所关注的分析物。可将反应容器中的混合物温育任何合适的时间量(例如,60分钟)。
在步骤810中,在温育箱/洗涤/读取站412中的洗涤设备中,可用洗涤流体来洗涤磁珠,并将其与上清液磁性地分离。洗涤设备中的移液器可用于从反应容器分配和移除任何流体以执行该过程。
一旦完成洗涤过程,第二拾取和放置夹持器409然后可将反应容器传送到试剂移液站404、405、406、407。一旦所关注的分析物结合到磁性颗粒上的抗体,控制系统便可确定是否将执行免疫测定检测过程或质谱分析过程。在一些情况下,关于是否要执行免疫测定检测过程或质谱分析过程的确定可在该过程的早期进行。
如果要执行免疫测定检测过程,则移液站404、405、406、407中的一个可将化学发光底物或其他光学底物分配到反应容器中。作为另外一种选择,可通过洗涤系统中的专用移液器将底物添加到反应容器中。然后可通过第二拾取和放置夹持器409将反应容器转移到温育箱/洗涤/读取站412中的温育箱中。在温育箱中,化学发光底物可结合到仍结合到磁珠的所关注分析物。然后可使用第三拾取和放置夹持器410将反应容器从温育箱转移到温育箱/洗涤/读取站412中的读取器。然后,读取器可检测分析物是否存在和/或分析物的浓度。
在本发明的一些实施方案中,检测过程可由质谱仪执行。当使用质谱仪来检测样品中分析物的存在或浓度时,可执行步骤812、814、816、822、824、826和828。
在步骤812中,代替将一种或多种光学检测试剂(例如,化学发光底物)添加到反应容器中,试剂移液站404、405、406、407中的一个可向容纳处理样品的反应容器添加洗脱缓冲液。然后,试剂移液站可将洗脱缓冲液与包含结合的分析物的磁性颗粒混合。在执行该步骤之后,第二拾取和放置夹持器409然后可将反应容器转移到温育箱/洗涤/读取站412中的温育箱。
在步骤814中,在温育箱中,可在温育箱/洗涤/读取站412中的温育箱中执行温育过程。可将反应容器中的混合物温育任何合适的时间段。
在步骤816中,可在温育箱/洗涤/读取站412中的洗涤站中执行磁分离过程以将上清液与磁性颗粒分离。作为另外一种选择,如上所述,如果温育箱包括具有磁体的温育区域,则磁分离过程可在温育箱/洗涤/读取站412中的温育箱中执行。在其他情况下,在洗涤站或温育箱/洗涤/读取站412中的温育箱中,或者甚至在移液站404、405、406、407中的一个中的磁体可以将磁性颗粒限制到反应容器中的位置。
在步骤s822中,可将包含反应容器中所关注分析物的上清液使用移液器靠近温育箱/洗涤/读取站或在任何其他合适的位置处转移到第二反应容器,从而在第一反应容器中留下磁性颗粒。
在步骤824中,可使用样品引入设备中的一个或多个将第二反应容器或包含所关注分析物的上清液转移到质谱仪。
如果需要,在该过程的此时,可将一种或多种质量标签或衍生剂加入到包含所关注分析物的上清液中。质量标签或衍生剂可由试剂移液站404、405、406、407中的一个或多个来添加。
在步骤826中,一旦包含所关注分析物的上清液在质谱仪中,便可执行质量分析。
在步骤828中,数据分析可由质谱仪执行,如上所述。
图9示出了根据本发明的实施方案的流程图,示出蛋白质沉淀过程。在蛋白质沉淀过程中,样品中不受关注的蛋白质可结合到磁性颗粒。可在反应容器中将磁性颗粒与包含所关注分析物的上清液分离。图9中所示的分析可代替免疫测定过程执行,或作为先前免疫测定过程的反射测试来执行。
在步骤902中,将样品管中的样品装载到分析器400中的样品呈现单元401中。样品管可与多个其他样品管一起存在于样品管架或其他样品管载体中。
在步骤904中,主样品移液站402然后可将样品的等分试样、测定标准物和包含顺磁性微粒的沉淀缓冲液的混合物移液到由散装容器进料器403提供的反应容器中。然后可使用多个分配和抽吸步骤,或使用任何其他合适的混合过程,在主样品移液站处将反应容器中的混合物混合。
此时,第二拾取和放置夹持器409可将反应容器转移到温育箱/洗涤/读取站412。
在步骤906中,在温育箱/洗涤/读取站412中的温育箱中,可温育容纳混合物的反应容器,使得样品等分试样内的任何蛋白基质结合到顺磁性微粒。
在步骤908中,在温育箱/洗涤/读取站412中的洗涤设备中,将具有结合蛋白基质的顺磁性微粒与包含所关注分析物的上清液磁性地分离。作为另外一种选择,如上所述,如果温育箱包括具有磁体的温育区域,则磁分离过程可在温育箱/洗涤/读取站412中的温育箱中执行。
在步骤910中,可使用移液器靠近温育箱/洗涤/读取站412将反应容器中的包含所关注分析物的上清液转移到由散装容器进料器403提供的第二反应容器中。
在步骤914中,一旦包含所关注分析物的上清液在质谱仪中,便可执行质量分析。
在步骤916中,数据分析可由质谱仪执行。
在一些实施方案中,代替执行步骤908、910和912,分析器可将反应容器转移到离心机模块(其可位于分析器、质谱仪中,也可以与其分离),旋转,然后返回到分析器。
图10示出了根据本发明的实施方案的流程图,示出另一个免疫纯化过程。图10所示的过程可以是如上所述的siscapa型处理方法。
在步骤1002中,将样品管中的样品装载到分析器400中的样品呈现单元401中。样品管可与多个其他样品管一起存在于样品管架或其他样品管载体中。
在步骤1004中,主样品移液站402然后可将样品管中的样品的等分试样和变性试剂/碱化试剂移液到由散装容器进料器403提供的反应容器中。第一拾取和放置夹持器408然后可将反应容器转移到温育箱/洗涤/读取站412中的温育箱中,使得可执行温育过程。
在步骤1006中,温育容纳样品的反应容器。
在温育后,第二拾取和放置夹持器409可将反应容器转移到试剂移液站404、405、406、407。
在步骤1008中,试剂移液站404、405、406、407中的一个可添加胰蛋白酶,并且可在反应容器中混合所得的混合物。第二拾取和放置夹持器409然后可将反应容器转移到温育箱/洗涤/读取站412中的温育箱。
在步骤1010中,在温育箱中,可在温育箱/洗涤/读取站412的温育箱中执行温育过程。此时,第二拾取和放置夹持器409可将反应容器转移到试剂移液站404、405、406、407中的一个。
在步骤1012中,试剂移液站404、405、406、407中的一个可添加涂覆有抗体和sis肽的磁性微粒。在执行该步骤之后,第二拾取和放置夹持器409然后可将反应容器转移到温育箱/洗涤/读取站412中的温育箱。
在步骤1014中,在温育箱/洗涤/读取站412中的洗涤设备中,可执行磁分离和洗涤过程。一旦已执行该工艺步骤,第二拾取和放置夹持器409然后便可将反应容器传送到试剂移液站404、405、406、407。
在步骤1016中,试剂移液站404、405、406、407中的一个可添加洗脱缓冲液,并且然后可将洗脱缓冲液与包含结合分析物的磁性颗粒混合。在执行该步骤之后,第二拾取和放置夹持器409然后可将反应容器转移到温育箱/洗涤/读取站412中的温育箱。
在步骤1018中,在温育箱中,可在温育箱/洗涤/读取站412中的温育箱中执行温育过程。
在步骤1020中,可在温育箱/洗涤/读取站412中的洗涤站中执行磁分离过程。作为另外一种选择,如上所述,如果温育箱包括具有磁体的温育区域,则磁分离过程可在温育箱/洗涤/读取站412中的温育箱中执行。
在步骤1022中,可将包含反应容器中所关注分析物的上清液使用移液器靠近温育箱/洗涤/读取站转移到第二反应容器。
在步骤1024中,可使用一个或多个样品引入设备将第二反应容器或包含所关注分析物的上清液转移到质谱仪。
在步骤1026中,一旦包含所关注分析物的上清液在质谱仪中,便可执行质量分析。
在步骤1028中,数据分析可由质谱仪执行。
根据本发明的实施方案的集成样品处理系统可用于测量或确定在一个或多个样品中各种分析物(诸如激素、滥用药物和肿瘤标记物)的存在。
可测量的滥用药物的非限制性示例包括苯丙胺、巴比妥、苯二氮卓类、阿片类、羟考酮、可卡因、美沙酮、eddp、thc和丁丙诺啡。用于药物测试的样品通常为尿液或口腔流体,诸如唾液。在一些实施方案中,首先在分析器诸如化学分析器或免疫分析器中测量样品以产生测量结果。然后将结果输入到控制系统中,该控制系统将结果与一个或多个预定测定阈值进行比较。如果测量结果超过(例如,大于)一个或多个阈值,则控制系统可确定样品包含所关注的药物。如果测量结果不超过一个或多个阈值,则控制系统可确定样本不包含药物。在一些实施方案中,如果来自分析器的结果对于特定药物是阳性的,则控制系统然后命令取得样品的第二等分试样,并通过质谱仪(ms)进行验证测试。当一种或多种药物是上述药物时,可以使用由药物滥用和精神健康服务管理(samhsa)联邦注册发布的mandatoryguidelinesforfederalworkplacedrugtestingprogram,82frvol.82,7920,7942(2017)(《联邦工作场所药物测试计划的强制性指南》,82fr,第82卷,第7920、7942页,2017年)中指定的标准。
可在样品中分析的激素的非限制性示例可包括醛固酮、血浆肾素活性、可的松、皮质酮、孕酮、皮质醇、雄烷二酮、甲基丙二酸、高胱氨酸、孕酮、dheas、雌二醇/17-β-雌二醇、雌酮、睾丸素、11-脱氧皮质醇、17-羟基孕酮、孕烯醇酮和17-羟基孕酮。在一些实施方案中,某些激素的水平可根据性别和年龄而显著不同。例如,男性的睾丸素含量比女性高10倍。由于与质谱相比,免疫分析器的灵敏度通常有限,因此对于某些已知靶标激素水平较低的人口群体,可以直接在质谱仪中测试这些激素。在一些实施方案中,当患者的人口统计信息不可用时,通常可将分析器诸如免疫分析器用作初始测试。显示具有非常低水平的靶标激素(例如,低于预定阈值,在该预定阈值下免疫分析器无法准确测量浓度)的样品,控制系统可由质谱仪命令进行反射测试以准确测量样品中的靶标激素的浓度。
可使用本文所公开的集成样品处理系统测量的肿瘤标记物的非限制性示例包括脂肪酶、甲胎蛋白、ca125、ca15-3、ca19-9、ca27-29、cea、βhcg+hcg、甲状旁腺激素。在一些实施方案中,该组可包括10-500,例如20-100、30-400、或50-200个已知肿瘤标记物。为了测定诸如肿瘤标记物的大量分析物,首先将质谱用作筛选测定以识别对样品呈阳性的标记物的子组,然后使用化学/免疫分析器来确认这些标记是阳性的。由于质谱仪可特别适于多重测试,但可能不是政府(例如,fda)批准的诊断方法,并且由于免疫测定测试可以是政府(例如,fda)批准的测试,但运行该质谱的成本可能较低,因此这两种技术的组合提供快速标记物识别和鉴定的独特优势。
实施例
示例性样品收集方法
本文所公开的集成样品处理系统可用于测量来自各种体液(诸如血清、血浆和尿液)的分析物。以下描述包括一些样品收集方法的细节并且是示例性而非限制性的。
血清样品可由从受试者抽取的全血制备。可将血液样品在室温下保持静置15-30分钟,以使其凝结。然后将样品在冷冻离心机中在1,000-2,000g下离心至少15分钟。可将上清液(其为血清)用无菌移液管立即转移到清洁小瓶。在处理时,可将血清样品保持在2-8℃下。如果不立即分析血清,则血清可储存在-20℃或更低的温度下,直至使用。可避免重复的冻-融循环,因为这可能对许多血清组分有害并且可能影响测定的准确性。
血浆样品也可由来自受试者的全血样品制备。全血可被抽取并收集到用抗凝剂(例如,肝素)处理的管中。可通过使用冷冻离心机在1,000-2,000×g下离心10分钟,将细胞从血浆中移除。可将所得上清液(其为血浆)用无菌移液管立即转移到清洁小瓶中。血浆样品的处理和储存可与血清样品相同,如上所述。
尿液样品可根据samhsa指南(预防药物滥用的药物滥用和精神健康服务管理中心)收集,网址为https://www.samhsa.gov/sites/default/files/specimen-collection-handbook-2014.pdf。
实施例1:睾丸素
根据本发明的实施方案的样品处理系统可用于测量生物流体样品中的睾丸素。男性的睾丸素由成人睾丸间质细胞分泌,并且由黄体化激素(lh)控制。男性的总睾丸素水平异常低,可能指示性腺机能减退、垂体机能减退、高泌乳素血症、肾衰竭、肝硬化或克氏综合征。男性的总睾丸素值较高可能是由肾上腺和睾丸肿瘤、先天性肾上腺皮质增生症或下丘脑-垂体-睾丸轴异常引起的。在女性中,睾丸素在卵巢、肾上腺和外周脂肪组织中产生。增加的女性总睾丸素水平可指示多囊卵巢综合征(pcos)、间质泡膜增殖症、卵巢和肾上腺肿瘤、先天性肾上腺皮质增生症以及下丘脑-垂体-卵巢轴的其他疾病。因此,需要监测男性和女性的睾丸素水平。由于女性的血清浓度通常比男性低约10倍,并且免疫分析器通常不够灵敏,无法可靠地测量非常低的睾丸素水平,因此ms通常是用于测量女性睾丸素的优选方法。然而,在一些情况下,在测试时,人口统计信息(例如,受试者的性别)不可用。因此,在一些实施方案中,初始测试由免疫分析器执行。如果免疫分析器指示特定样品中的低于检测范围的低睾丸素水平,则控制系统随后可使用ms命令进行验证测试。
access睾丸素测定试剂盒(可从加利福尼亚州布雷亚的贝克曼库尔特公司(beckmancoulter,inc.,brea,ca)商购获得)可用于对生物样品中睾丸素的初始测试。测定可在样品处理系统的免疫分析器上进行。access睾丸素测定是竞争性结合免疫酶测定,使用小鼠单克隆抗睾丸素抗体,睾丸素碱性磷酸酶偶联物和涂覆有山羊抗小鼠多克隆抗体的顺磁性颗粒。样品中的睾丸素从载体蛋白中释放,并与睾丸素碱性磷酸酶偶联物竞争有限量的特定抗睾丸素单克隆抗体上的结合位点。然后将所得抗原-抗体复合物通过捕获抗体结合到固相。在反应容器中温育之后,使结合于固相的材料保持在磁场中,同时洗去未结合的材料。然后,将化学发光底物lumi-phos*530添加到容器中,并采用光度计测量由反应产生的光。产生的光与样品中睾丸素的浓度成反比。从储存的多点校准曲线确定样品中分析物的量。
在第一测试中,从第一受试者获得血清样品,对于该受试者,人口统计信息(年龄、性别等)不可用,将其加载到免疫分析器中的系统样品制备模块上,并且使用上述access睾丸素测定试剂盒制备。免疫测定在免疫分析器上进行。可将免疫测定的结果(其可包括血清睾丸素量)发送到免疫分析器中的控制系统,该控制系统将测量结果与血清睾丸素的参考范围(即,健康个体的浓度范围)进行比较。对于18-66岁之间的男性,参考血清睾丸素水平通常为1.75-7.81ng/ml,而对于女性,参考血清睾丸素水平通常小于0.1-0.75ng/ml。主治医师可以确定阈值,高于该阈值则认为免疫分析器的结果是准确的。如果患者具有低于阈值的睾丸素量,则免疫分析器中的控制系统随后可导致如上所述制备来自样品的第二等分试样。阈值可根据测试所需的精度和准确度的水平而变化,但其通常为2-0.1ng/ml范围内的值,例如1.75ng/ml或0.8ng/ml。然后可处理样品的第二等分试样(如上所述)。然后将处理样品转移到样品处理系统中的质谱仪中并注入到质谱仪中。质谱仪然后确定血清样品中的睾丸素量或浓度。然后可报告由免疫分析器和质谱仪执行的测试的结果。
在第二示例性测试中,可从第二受试者获得血清样品。第二受试者的医疗记录可为可访问的并且可指示受试者是女性。可将该信息发送到样品处理系统中的控制系统,该控制系统确定样品仅由质谱仪分析,并且不需要由免疫分析器分析。然后,控制系统使得样品的等分试样被制备和处理。然后将处理样品等分试样注入到质谱仪中,如上所述。然后质谱仪测量第二受试者的血清样品中的睾丸素量。然后报告来自质谱仪的测量结果。
实施例2:苯丙胺
根据本发明的实施方案的样品处理系统可用于测试滥用药物。一种示例性滥用药物类型是苯丙胺。苯丙胺是中枢神经系统兴奋剂,其可产生清醒、警觉、精力增加、饥饿感减少和整体幸福感。
在任何类型的给药后三小时内,苯丙胺会出现在尿液中,并且在最后一次给药后可由该
测试中使用的试剂包括对右旋苯丙胺(61μg/ml)和右旋甲基苯丙胺(10μg/ml)的小鼠单克隆抗体,6-磷酸葡萄糖(5.5mm),烟酰胺腺嘌呤二核苷酸(3.5mm),牛血清白蛋白,标记有细菌g6pdh的苯丙胺(0.72u/ml),三羟甲基氨基甲烷缓冲液,防腐剂和稳定剂。
对于药物测试,尿液样品可根据samhsa指南(预防药物滥用的药物滥用和精神健康服务管理中心)收集,网址为https://www.samhsa.gov/sites/default/files/specimen-collection-handbook-2014.pdf。通常在收集后24小时内向认证实验室提交尿液样本。在样品处理系统中的样品制备模块中制备尿液样品。将试剂添加到待测试的样品中,并且在免疫分析器上执行免疫测定。然后将结果输入到样品处理系统中的控制系统中。然后,控制系统将结果与测定阈值进行比较。例如,如果量大于阈值(例如,300ng/ml),则控制系统确定,作为初步读数,样品包含苯丙胺。如果量低于阈值,则控制系统确定样本不包含苯丙胺。
如果来自分析器的结果为阳性,则控制系统然后命令进行待由质谱仪执行的验证测试。然后获取并制备样品的第二等分试样以用于质谱仪,如上所述。包含苯丙胺的校准标准和对照物购自cerilliant公司(cerilliant,inc.)和utaklaboratories公司(utaklaboratories,inc.)。如果质谱测量结果指示第二处理样品等分试样包含苯丙胺,则将受试者识别为对苯丙胺呈阳性,并且将生成报告。
实施例3肿瘤标记物组
集成样品处理系统也可用于癌症诊断。质谱可用于多重测试,并且因此可用于测试大量肿瘤抗原,诸如具有数百种已知肿瘤标记物的一组肿瘤抗原。在一个示例中,肿瘤组包括脂肪酶、甲胎蛋白、ca125、ca15-3、ca19-9、ca27-29、cea、βhcg+hcg、甲状旁腺激素。然而,在一些行政辖区,质谱可能不是政府批准的诊断方法。在此类情况下,验证测试可由免疫分析器在样品处理系统中进行以确认由质谱仪进行的初始测定。
为了测试肿瘤组,如上所述制备血浆样品。如上所述制备血浆样品的第一等分试样,并将其发送到质谱仪。将结果返回到样品处理系统中的控制系统,该控制系统将测量结果与预定阈值进行比较,以确定样品中是否有任何肿瘤标记物是阳性的(即,测量结果高于特定标记物的阈值)。
如果根据质谱仪数据将小子组的肿瘤标记物指示为阳性,则样品处理系统中的控制系统随后指示免疫分析器中的样品制备模块制备和处理样品的第二等分试样。然后,免疫分析器使用基于荧光的多重夹心免疫测定来检测肿瘤标记物的子组。测定可涉及向样品等分试样添加对子组中的相应肿瘤标记物有特异性的初级抗体和缀合到荧光团的检测抗体,并且可识别初级抗体中的每一种。荧光团具有不同的激发和发射波长,使得来自检测抗体的荧光信号将不会相互干扰。测量来自检测抗体中的每个的荧光信号,该荧光信号表示样品中的对应肿瘤标记物中的每个的量。然后报告由免疫分析器确定为阳性的肿瘤标记物的结果。
以上描述是说明性而非限制性的。在回顾本公开时,本发明的多种变型对于本领域的技术人员而言将是显而易见的。因此,本发明的范围不应当根据上述具体实施方式确定,而是应当根据待审权利要求连同它们的完整范围或等同形式来确定。
在不脱离本发明范围的前提下,来自任何实施方案的一个或多个特征可以与任何其他实施方案的一个或多个特征相结合。
除非有明确的相反指示,否则,“一个”、“一种”或“所述”的叙述旨在表达“一个或多个”之意。
上文提及的所有专利、专利申请、公布和说明书以引用方式全文并入本文。
- 还没有人留言评论。精彩留言会获得点赞!