电解质回收的制作方法
1.本发明涉及一种从经使用的电解质中回收锂电解质盐的方法,所述方法包括:使经使用的电解质与极性非质子溶剂接触以产生包含锂电解质盐、电解质溶剂和极性非质子溶剂的溶液,其中所述溶液包含碳酸酯溶剂(carbonate solvent);将所述溶液与锂电解质盐难溶于其中的沉淀溶剂组合;使包含由碳酸酯溶剂溶剂化的锂电解质盐的沉淀的组合物沉淀;以及将沉淀的组合物与溶剂混合物分离。本发明还涉及从电化学能量储存装置再循环锂电解质盐的方法,以及生产用于电化学能量储存装置的电解质的方法。
2.发明背景
3.诸如锂离子电池(lib)的电化学能量储存装置现在在社会中是普遍存在的,其中应用范围从便携式电子产品到交通工具运输和家庭能量储存。随着这些装置达到其使用寿命的结束,越来越多量的lib废物正在产生。据估计,2016年在澳大利亚产生约3,300吨的lib废物,并且仅基于预期的电动交通工具的采用情况,预计到2035年,这可能达到180,000吨。目前,锂离子电池未被常规地再循环,并且存在越来越多的环境和经济激励以改善从lib废物的资源的回收。
4.lib废物包含有价值的资源如钴(co)、锂(li)、碱和其他金属以及石墨,所有这些都可以被回收并且被再利用以制造新的产品。鉴于co的商品价值,全球再循环已经主要集中在这种金属的回收上。最近,再循环工艺还已经寻求回收其他重要和战略性的金属,诸如cu、ni和li。
5.金属可以使用基于火法冶金或基于湿法冶金的方法从废lib中回收。火法冶金方法回收高价值的金属诸如镍和钴,同时将其他金属诸如锂、锰和铝保留在渣相中。湿法冶金方法依赖于使用强的无机或有机的酸和碱来溶解废物流中的固体金属级分。因此,锂可以从lib废物的阴极活性材料中回收,但仅以li2co3、lioh和类似物的形式回收。存在于lib电解质系统中的溶解的锂盐不通过火法冶金方法或湿法冶金方法回收。
6.如果可以以在电池制造中即用型的形式回收材料,则回收的金属的净值将增加。然而,电池材料制造商的高纯度要求使这种方法具有挑战性。
7.lib废物中的相当一部分的锂作为锂电解质盐存在于电解质溶剂基质中,该锂电解质盐最常见地是六氟磷酸锂(lipf6),该电解质溶剂基质通常包含两种至三种不同的碳酸烷基酯。lipf6是一种高价值的材料(平均55,000美元/吨电池级),这使得其回收特别有吸引力。此外,从在lib废物的矿物加工或湿法冶金再循环之后获得的碳酸锂或氢氧化锂工业规模合成高纯度lipf6是具有挑战性的,并且涉及使用有毒的和环境有害的化学品,诸如五氟磷酸(pf5)、五氯磷酸(pcl5)和氢氟酸(hf)气体。因此,包括价格、大规模上可及性和hse问题的因素的组合是新的技术的驱动力,该新的技术可以从lib中再循环锂电解质盐用于再利用,而不是将锂作为碳酸锂或氢氧化锂回收。
8.用于lipf6的合成后纯化的工艺已经被报告,例如在wo1999062821a1中被报告。该工艺寻求提供具有低的总有机物含量(toc)的高纯度、未溶剂化的lipf6,并且因此教导lipf6的重结晶应当在通过蒸馏去除增溶溶剂的条件下进行。这需要的高温和/或真空条件
(特别是在使用高沸点增溶溶剂的情况下)增加了工艺成本和复杂性,并且增加了使lipf6产物分解的可能性。
9.尽管上述讨论集中在lipf6,但应理解,类似的考虑适用于其他锂电解质盐,包括四氟硼酸锂(libf4)、双(氟磺酰基)酰亚胺锂(lifsi)、双(三氟甲磺酰基)酰亚胺锂(litfsi)、(氟磺酰基)(三氟甲磺酰基)酰亚胺锂(liftfsi)、双(草酸根合)硼酸锂(libob)、草酰二氟硼酸锂(liodfb)、氟烷基磷酸锂(lifap)和类似物。
10.因此,对于从经使用的电解质或电化学能量储存装置中回收锂电解质盐的新的方法存在持续的需求,这些方法至少部分地解决上文提及的缺点中的一个或更多个,或者提供有用的替代方案。
11.在本文引用作为现有技术给出的专利文件或其他材料不应视为承认在任何权利要求的优先权日该文件或材料是已知的,或者承认其所包含的信息是公知常识的一部分。
12.发明概述
13.根据第一方面,本发明提供了一种从经使用的电解质中回收锂电解质盐的方法,所述方法包括:使包含锂电解质盐和电解质溶剂的经使用的电解质与极性非质子溶剂接触,以产生包含锂电解质盐、电解质溶剂和极性非质子溶剂的溶液,其中电解质溶剂和极性非质子溶剂中的至少一种包含碳酸酯溶剂;将该溶液与锂电解质盐难溶于其中的沉淀溶剂组合;使包含由碳酸酯溶剂溶剂化的锂电解质盐的沉淀的组合物从包含极性非质子溶剂、沉淀溶剂和电解质溶剂的溶剂混合物中沉淀,其中沉淀的组合物作为固体或作为液体沉淀;以及将沉淀的组合物与溶剂混合物分离。
14.因此,本发明提供了一种从经使用的电化学能量储存装置中回收和再循环锂电解质盐诸如lipf6的易于实施的和可扩展的方法。通过以溶剂化的锂电解质盐为目标,发现不需要高温和减压来获得高纯度产物。此外,发明人已经认识到,当电解质使用碳酸酯溶剂基质时,由高纯度碳酸酯溶剂化的锂电解质盐产生的电解质将与使用新合成的无溶剂的盐产生的电解质难以区分。
15.令人惊讶地,还发现仅由碳酸乙烯酯(ec)溶剂化的高纯度锂电解质盐,例如li(ec)npf6,其中n的平均值在约4至5的范围内,即使在锂沉淀步骤之前或期间在溶液中存在其他碳酸酯溶剂分子时也可以产生。由于碳酸乙烯酯是锂离子电池中存在的最常见的碳酸酯分子,回收的锂电解质盐容易用于制备新的用于电化学能量储存装置的电解质。
16.在一些实施方案中,沉淀的组合物作为固体沉淀。
17.在一些实施方案中,锂电解质盐是lipf6。
18.在一些实施方案中,电解质溶剂和极性非质子溶剂两者都包含碳酸酯溶剂。
19.在一些实施方案中,电解质溶剂和极性非质子溶剂中的至少一种包含碳酸乙烯酯。在一些实施方案中,电解质溶剂包含碳酸乙烯酯。
20.在一些实施方案中,极性非质子溶剂包含选自碳酸二甲酯、碳酸甲乙酯、碳酸二乙酯的至少一种。在一些实施方案中,极性非质子溶剂包含碳酸二甲酯。
21.在一些实施方案中,沉淀的组合物包含由碳酸乙烯酯溶剂化或仅由碳酸乙烯酯溶剂化的lipf6。沉淀的组合物可以包含li(碳酸乙烯酯)npf6,其中n是配位的溶剂与锂的比率。在一些实施方案中,n的平均值在约4至5的范围内。
22.在一些实施方案中,经使用的电解质存在于电化学能量储存装置或其部件或衍生
物(derivative)中,并且使经使用的电解质与极性非质子溶剂接触包括用极性非质子溶剂提取电化学能量储存装置或其部件或衍生物。
23.在一些实施方案中,沉淀溶剂具有比极性非质子溶剂低的极性。
24.在一些实施方案中,将溶液和沉淀溶剂组合以形成作为单一液相的溶剂混合物。
25.在一些实施方案中,沉淀溶剂包含烃溶剂或氯化的溶剂。
26.在一些实施方案中,沉淀溶剂具有低于120℃,诸如低于100℃的正常沸点。
27.在一些实施方案中,溶液和沉淀溶剂以在1:2和1:100之间,或在1:3和1:20之间,诸如在1:4和1:15之间的比(v/v)组合。
28.在一些实施方案中,组合和沉淀在低于50℃或低于30℃的温度进行,诸如在环境温度或低于环境温度进行。
29.在一些实施方案中,使沉淀的组合物沉淀包括将溶剂混合物冷却至低于10℃的温度,诸如低于0℃的温度。
30.在一些实施方案中,该方法还包括在将溶液与沉淀溶剂组合之前从溶液中去除固体杂质。
31.在一些实施方案中,该方法还包括在将溶液与沉淀溶剂组合之前,例如通过蒸发极性非质子溶剂的一部分,来浓缩溶液。
32.在一些实施方案中,该方法还包括用至少部分不混溶的非极性溶剂提取溶液,而不引起沉淀,以及在将溶液与沉淀溶剂组合之前将溶液与包含非极性溶剂的提取剂液相分离。
33.在一些实施方案中,该方法还包括在通过冷却溶剂混合物和/或向溶剂混合物添加另外的沉淀溶剂进行分离之后从溶剂混合物中回收另外量的锂电解质盐。
34.在一些实施方案中,该方法还包括洗涤和/或干燥沉淀的组合物。
35.在一些实施方案中,该方法还包括将沉淀的组合物溶解在包含碳酸酯的电解质溶剂中。电解质溶剂中的碳酸酯分子优选地与沉淀的组合物中的溶剂化的锂电解质盐中的碳酸酯分子相同。
36.根据第二方面,本发明提供了一种从经使用的电解质中回收锂电解质盐的方法,所述方法包括:使包含锂电解质盐和电解质溶剂的经使用的电解质与极性非质子溶剂接触,以产生包含锂电解质盐、电解质溶剂和极性非质子溶剂的溶液,其中电解质溶剂和极性非质子溶剂中的至少一种包含碳酸酯溶剂;将该溶液与锂电解质盐难溶于其中的沉淀溶剂组合;使包含由碳酸酯溶剂溶剂化的锂电解质盐的固体组合物从包含极性非质子溶剂、沉淀溶剂和电解质溶剂的溶剂混合物中沉淀;以及将固体组合物与溶剂混合物分离。
37.根据第三方面,本发明提供了一种从电化学能量储存装置再循环锂电解质盐的方法,所述方法包括:提供电化学能量储存装置或其部件或衍生物,该电化学能量储存装置或其部件或衍生物包含电解质,该电解质包含锂电解质盐和电解质溶剂;用极性非质子溶剂提取电化学能量储存装置或其部件或衍生物,以产生包含锂电解质盐、电解质溶剂和极性非质子溶剂的溶液,其中电解质溶剂和极性非质子溶剂中的至少一种包含碳酸酯溶剂;将该溶液与锂电解质盐难溶于其中的沉淀溶剂组合;使包含由碳酸酯溶剂溶剂化的锂电解质盐的沉淀的组合物从包含极性非质子溶剂、沉淀溶剂和电解质溶剂的溶剂混合物中沉淀,其中沉淀的组合物作为固体或作为液体沉淀;以及将沉淀的组合物与溶剂混合物分离。
38.在第三方面的一些实施方案中,沉淀的组合物作为固体沉淀。
39.在第三方面的一些实施方案中,该方法还包括将沉淀的组合物溶解在包含碳酸酯的电解质溶剂中,以产生用于电化学能量储存装置的电解质。电解质溶剂中的碳酸酯分子优选地与沉淀的组合物中的溶剂化的锂电解质盐中的碳酸酯分子相同。
40.根据第四方面,本发明提供了一种从电化学能量储存装置再循环锂电解质盐的方法,所述方法包括:提供电化学能量储存装置或其部件或衍生物,该电化学能量储存装置或其部件或衍生物包含电解质,该电解质包含锂电解质盐和电解质溶剂;用极性非质子溶剂提取电化学能量储存装置或其部件或衍生物,以产生包含锂电解质盐、电解质溶剂和极性非质子溶剂的溶液,其中电解质溶剂和极性非质子溶剂中的至少一种包含碳酸酯溶剂;将该溶液与锂电解质盐难溶于其中的沉淀溶剂组合;使包含由碳酸酯溶剂溶剂化的锂电解质盐的固体组合物从包含极性非质子溶剂、沉淀溶剂和电解质溶剂的溶剂混合物中沉淀;以及将固体组合物与溶剂混合物分离。
41.根据第五方面,本发明提供了一种沉淀的组合物,该沉淀的组合物包含由碳酸酯溶剂溶剂化的锂电解质盐,该沉淀的组合物通过根据第一方面或第三方面的任何实施方案的方法产生。
42.根据第六方面,本发明提供了一种生产用于电化学能量储存装置的电解质的方法,所述方法包括:使包含锂电解质盐和第一电解质溶剂的经使用的电解质与极性非质子溶剂接触,以产生包含锂电解质盐、第一电解质溶剂和极性非质子溶剂的溶液,其中第一电解质溶剂和极性非质子溶剂中的至少一种包含第一碳酸酯溶剂;将该溶液与锂电解质盐难溶于其中的沉淀溶剂组合;使包含由第一碳酸酯溶剂溶剂化的锂电解质盐的沉淀的组合物从包含极性非质子溶剂、沉淀溶剂和第一电解质溶剂的溶剂混合物中沉淀,其中沉淀的组合物作为固体或作为液体沉淀;将沉淀的组合物与溶剂混合物分离;以及将沉淀的组合物溶解在包含第二碳酸酯溶剂的第二电解质溶剂中,以产生用于电化学能量储存装置的电解质。
43.在第六方面的一些实施方案中,沉淀的组合物作为固体沉淀。
44.根据第七方面,本发明提供了一种生产用于电化学能量储存装置的电解质的方法,所述方法包括:使包含锂电解质盐和第一电解质溶剂的经使用的电解质与极性非质子溶剂接触,以产生包含锂电解质盐、第一电解质溶剂和极性非质子溶剂的溶液,其中第一电解质溶剂和极性非质子溶剂中的至少一种包含第一碳酸酯溶剂;将该溶液与锂电解质盐难溶于其中的沉淀溶剂组合;使包含由第一碳酸酯溶剂溶剂化的锂电解质盐的固体组合物从包含极性非质子溶剂、沉淀溶剂和第一电解质溶剂的溶剂混合物中沉淀;将固体组合物与溶剂混合物分离;以及将固体组合物溶解在包含第二碳酸酯溶剂的第二电解质溶剂中,以产生用于电化学能量储存装置的电解质。
45.根据第八方面,本发明提供了一种用于电化学能量储存装置的电解质,该电解质通过根据第六方面或第七方面的任何实施方案的方法产生。
46.应当理解,本文公开的与本发明的第一方面相关的实施方案通常还是本发明的第二方面、第三方面、第四方面、第六方面和第七方面的相关的实施方案。
47.在说明书(包括权利要求)中使用术语“包含(comprise)”、“包含(comprises)”和“包含(comprising)”的情况下,它们应被解释为指定所陈述的特征、整数、步骤或组分,但
不排除一个或更多个其他特征、整数、步骤或组分或其组的存在。
48.如本文使用的,与所公开的装置的多种特征相关的术语“第一”、“第二”、“第三”等被任意地分配,并且仅意图在装置可以并入多种实施方案中的两个或更多个这样的特征之间进行区分。这些术语本身不指示任何特定的方向或顺序。此外,应当理解,“第一”特征的存在不意味着存在“第二”特征,“第二”特征的存在不意味着存在“第一”特征,等等。
49.本发明的另外的方面在下文呈现在本发明的详述中。
50.附图简述
51.本文将参考附图仅通过实例的方式说明本发明的实施方案,在附图中:
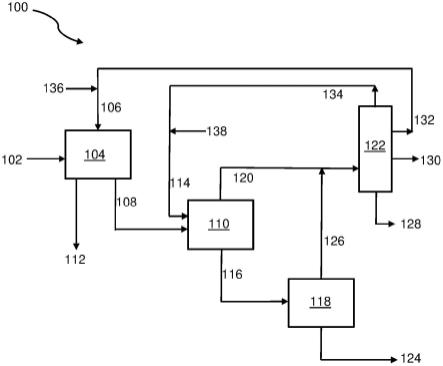
52.图1是用于进行根据本发明的实施方案的方法的工艺的方框流程图。
53.图2是用于进行根据本发明的另一种实施方案的方法的工艺的方框流程图。
54.图3示出了使用用在实施例6和实施例4中回收的li(ec)npf6配制的电解质的lib电池单元的作为循环次数和放电速率的函数的放电容量,与如在实施例9中测量的商业lipf6电解质进行比较。
55.图4示出了使用用在实施例6中回收的li(ec)npf6配制的电解质的lib电池单元的电压-时间概况,如在实施例9中测量的。
56.图5是从实施例8中的基于碳酸酯的电解质中回收的li(ec)nbf4的1hnmr光谱。
57.详述
58.本发明涉及一种从经使用的电解质中回收锂电解质盐的方法。该方法包括使包含锂电解质盐和电解质溶剂的经使用的电解质与极性非质子溶剂接触的步骤。由此产生包含锂电解质盐、电解质溶剂和极性非质子溶剂的溶液。电解质溶剂和极性非质子溶剂中的至少一种包含碳酸酯溶剂。
59.该方法还包括将该溶液与锂电解质盐难溶于其中的沉淀溶剂组合的步骤。使包含由碳酸酯溶剂溶剂化的锂电解质盐的沉淀的组合物从极性非质子溶剂、沉淀溶剂和电解质溶剂的混合物中作为固体或液体沉淀。然后将沉淀的组合物与溶剂混合物分离。
60.经使用的电解质
61.本发明的方法可以用于从经使用的电解质中回收锂电解质盐。如本文使用的,经使用的电解质指的是已经被放置在电化学能量储存装置中的电解质。在大多数情况下,经使用的电解质在电化学能量储存装置中还将经历电化学循环。因此,电解质可以是用于锂离子电池或其他基于锂的能量储存装置诸如锂空气电池和锂离子电容器的电解质。
62.锂电解质盐通常包含锂离子以及弱配位阴离子(wca)。lipf6是迄今为止用于商业锂离子电池的最常见的锂电解质盐,并且本发明的方法对于这种材料特别有意义。然而,适合用于电化学能量储存装置的多种锂电解质盐在本领域中是已知的,并且预期这些方法可以用于回收这些盐中的任何一种。这样的盐的实例包括lipf6、libf4、双(氟磺酰基)酰亚胺锂(lifsi)、双(三氟甲磺酰基)酰亚胺锂(litfsi)、(氟磺酰基)(三氟甲磺酰基)酰亚胺锂(liftfsi)、双(草酸根合)硼酸锂(libob)、草酰二氟硼酸锂(liodfb)、氟烷基磷酸锂(lifap)和类似物。
63.经使用的电解质包含锂电解质盐至少部分地溶于其中的电解质溶剂。在一些实施方案中,电解质溶剂包含碳酸酯溶剂,该碳酸酯溶剂可以任选地包含两种或更多种有机碳酸酯(还被称为碳酸酯(carbonic acid ester))分子的混合物。用于lib的常用电解质包含
至少一种选自碳酸乙烯酯(ec)和碳酸丙烯酯(pc)的环状碳酸酯与至少一种选自碳酸二甲酯(dmc)、碳酸甲乙酯(emc)和碳酸二乙酯(dec)的碳酸二烷基酯的混合物。
64.在一些实施方案中,电解质溶剂包含ec,ec是商业锂离子电池中最常见的碳酸酯。在一些这样的实施方案中,ec是唯一存在的环状碳酸酯。发明人已经发现,即使当lipf6沉淀时在溶液中存在其他碳酸酯溶剂时,也可以经由本发明的方法形成由ec溶剂化的高纯度lipf6。已经通过分析表明,多种实验实施方案的回收的产物是仅由ec溶剂化的li-wca溶剂化物,例如,lipf6溶剂化物。lipf6溶剂化物被认为具有化学计量的li(ec)npf6,其中n的平均值在约4至5的范围内。
65.尽管碳酸酯溶剂存在于许多商业lib中,但不排除电解质溶剂包含非碳酸酯非质子溶剂,并且实际上可以不含碳酸酯。例如,电解质溶剂可以包含醚溶剂和/或酯溶剂或者由醚溶剂和/或酯溶剂组成。合适的醚可以包括二烷基醚和乙二醇醚。然而,应当理解,与沉淀期间最终存在的碳酸酯溶剂相比,存在的任何非碳酸酯溶剂与锂离子的配位应相对较少,使得可以获得碳酸酯溶剂化的锂盐产物。
66.锂电解质盐可以以任何浓度存在于经使用的电解质中,但通常将以适合用于基于锂的电化学能量储存装置中的电解质的常规浓度存在。例如,浓度可以低于4m,例如在0.1m和2.0m之间,诸如在0.5m和1.5m之间。
67.在一些实施方案中,经使用的电解质包含降解产物。降解产物可以是弱配位阴离子例如pf
6-阴离子本身的降解产物。由于固有的热不稳定性和由于与渗透电化学能量储存装置的微量的水的反应两者,这种阴离子可以随着时间的推移而降解。因此,降解产物可以包括通过将电解质暴露于空气和水而产生的固体降解产物。已经发现,在本发明的方法中,在沉淀步骤之前,这样的降解产物可以从可溶性锂电解质盐中分离。然后可以通过过滤从沉淀物中分离更多的可溶性杂质。因此,尽管在典型的lib废物的电解质中发现典型杂质的存在,但仍可以产生高纯度碳酸酯溶剂化的锂盐。
68.使经使用的电解质与极性非质子溶剂接触
69.本发明的方法包括使经使用的电解质与极性非质子溶剂接触以产生包含锂电解质盐、电解质溶剂和极性非质子溶剂的溶液的步骤。
70.在一些实施方案中,当与极性非质子溶剂接触时,经使用的电解质存在于电化学能量储存装置或其部件或使用后衍生物中。典型地,电化学能量储存装置中的电解质与装置的一个或更多个部件诸如分离器、阴极、阳极和外壳紧密接触,使得它不能简单地从废弃的装置中倒出。作为再循环工艺中的初始步骤,电化学能量储存装置因此可以被拆卸成单独的部件或被物理地破碎,例如通过压碎、粉碎或切碎。即使如此,电解质可能仍然主要被吸收在固体材料中或被包覆在固体材料上。因此,经使用的电解质可以用极性非质子溶剂从固体部件中提取,使得实现可接受的回收程度。
71.应当理解,根据应实现锂电解质盐的可接受的回收的要求,通常应将用于提取经使用的电解质的极性非质子溶剂的量最小化。
72.极性非质子溶剂具有足够的极性以提取经使用的电解质,从而提供锂电解质盐溶解在包含极性非质子溶剂和电解质溶剂两者的液相中的溶液。在一些实施方案中,锂电解质盐可溶于纯的极性非质子溶剂。例如,在室温,极性非质子溶剂可以能够每100g的纯的溶剂溶解至少5g或至少10g的lipf6。
73.极性非质子溶剂可以包含碳酸酯溶剂和/或非碳酸酯溶剂。当使用非碳酸酯极性非质子溶剂时的一个考虑是,与在沉淀期间最终存在的碳酸酯溶剂相比,溶剂分子与锂离子的配位应相对较少,使得可以获得碳酸酯溶剂化的锂盐产物。提取经使用的电解质的合适的极性非质子溶剂可以包括醚、酯和碳酸酯溶剂。
74.在一些实施方案中,极性非质子溶剂包含碳酸酯溶剂或由碳酸酯溶剂组成。在一些实施方案中,极性非质子溶剂包含存在于电解质溶剂中的碳酸酯,例如电解质溶剂的非环状碳酸二烷基酯组分。在一些实施方案中,极性非质子溶剂包含碳酸二甲酯(dmc)、碳酸甲乙酯(emc)和碳酸二乙酯(dec)中的一种或更多种。这些碳酸酯具有相对低沸点的优点,这促进它们在闭环工艺中经由蒸馏的再循环。因此,在一些实施方案中可以选择具有最低沸点的dmc。此外,已经发现由ec选择性地溶剂化的高纯度lipf6可以从包含与dmc、emc和dec中的一种或更多种组合的ec的溶液中沉淀。
75.在一些实施方案中,极性非质子溶剂包含ec,例如与dmc、emc和dec中的一种或更多种组合。如果电解质溶剂缺乏ec或具有不足的ec,并且工艺的期望产物是ec溶剂化的锂电解质盐,则这可以是特别优选的。可选择地,在闭环工艺中,可以方便的是允许电解质溶剂的组分(诸如ec)在提取极性非质子溶剂中积累到某种可接受的水平。
76.一旦电解质溶剂与极性非质子溶剂接触,在沉淀锂电解质盐之前,所得到的溶液可以经历一个或更多个加工步骤。
77.在一些实施方案中,溶液在沉淀之前被浓缩(即体积减小),例如通过汽化技术诸如简单蒸馏。这可能是合意的,以便将在后续工艺步骤中循环的液体的体积最小化,在沉淀步骤中提供溶液中li盐的临界(最小)浓度,和/或将实现沉淀所需要的沉淀溶剂的量最小化。在浓缩步骤中去除的溶剂,例如低沸点碳酸酯诸如dmc、emc和/或dec,可以被再循环以形成在提取步骤中使用的极性非质子溶剂的一部分。
78.在一些实施方案中,与溶液一起存在的任何固体,诸如衍生自电化学能量储存装置的锂盐降解产物或其他颗粒杂质,被从溶液中分离。这可以通过过滤或其他常规固-液分离技术来完成。
79.在一些实施方案中,通过用至少部分不混溶的溶剂在锂盐沉淀不发生到任何实质性程度的条件下提取溶液来加工溶液。例如,溶液可以用非极性溶剂诸如石油醚,以不足量的非极性溶剂分配到含锂相中以诱导沉淀的混合比提取。在搅动两相混合物之后,可以然后通过常规液-液提取技术分离相,其中极性的含锂相进行后续沉淀步骤。
80.尽管在本发明的方法中不是必需的,但通过这种初始提取步骤可以获得许多优点。特别地,已经发现某些除ec之外的碳酸酯组分,诸如碳酸二烷基酯dmc、emc和dec,可以选择性地被提取到低极性相中,而某些其他碳酸酯,诸如环状碳酸酯(ec和pc),在更大程度上保留在含锂溶液相中。这种提取可以促进工艺中碳酸二烷基酯的分离和再循环。此外,含锂溶液中特定碳酸酯的浓度有利于随后形成期望的锂电解质盐产物,特别是那些主要或仅用ec溶剂化的产物。
81.如本文公开的,刚好在沉淀之前的溶液包含碳酸酯溶剂,并且在一些实施方案中包含碳酸乙烯酯。溶液中的碳酸酯溶剂可以源自经使用的电解质中的电解质溶剂,或源自极性非质子溶剂,或源自这两种来源。还预期,碳酸酯溶剂诸如ec可以被添加至溶液中,并且由此在用其他溶剂从电化学能量储存装置中初始提取电解质之后与经使用的电解质接
触。
82.将溶液与沉淀溶剂组合
83.本发明的方法包括将溶液与锂电解质盐难溶于其中的沉淀溶剂组合的步骤。难溶意味着锂电解质盐不溶于纯的沉淀溶剂或者在纯的沉淀溶剂中具有低的溶解度。特别地,溶解度足够低使得沉淀溶剂在添加至含锂溶液中时充当锂电解质盐的抗溶剂,由此有助于沉淀的组合物的沉淀。
84.在一些实施方案中,溶液和沉淀溶剂在它们被组合的条件下是可混溶的,即它们组合以形成单相溶剂混合物。然而,应当理解,沉淀溶剂和溶液不需要在所有条件下诸如所有混合比和温度下完全混溶,并且实际上,当沉淀溶剂与溶液组合时,不需要形成单一液相。发明人已经发现,即使当形成两相溶剂混合物时也可以诱导沉淀。在这样的情况下,认为足够量的沉淀溶剂分配到含锂溶液中,使得锂电解质盐从中沉淀。如果不完全混溶,则沉淀溶剂可以由此在诸如混合比和温度的条件下与溶液组合,从而沉淀溶剂充分地可溶于含锂溶液,以至于可以诱导沉淀。
85.在一些实施方案中,沉淀溶剂具有比极性非质子溶剂低的极性。例如,极性非质子溶剂可以包含碳酸酯溶剂,并且极性非质子溶剂包含烃溶剂。然而,应当理解,锂电解质盐的溶解度与溶剂极性不直接相关。例如,中等极性溶剂诸如二氯甲烷和氯仿已经被发现适合作为沉淀溶剂,并且原则上可以在使用相对较低极性的溶剂诸如醚作为提取中的极性非质子溶剂时使用。
86.在一些实施方案中,沉淀溶剂包含烃溶剂或氯化的溶剂。合适的烃溶剂可以包括多种沸点范围的脂族石油醚(aliphatic petroleum benzine),例如石油醚40-60、60-80或80-100、苯、甲苯和类似物。任选地,烃溶剂可以至少包含芳族烃诸如甲苯和/或环状烃诸如环己烷的组分,这可以在与含锂溶液的混溶性和对锂电解质盐的抗溶解力(anti-solvency)的要求之间提供良好的平衡。合适的氯化的溶剂可以包括氯代烃,诸如二氯甲烷、氯仿和类似物。
87.溶液和沉淀溶剂之间的混合比可以是在提供适合诱导沉淀的条件中的相关考虑因素。在特别低极性的沉淀溶剂例如石油醚的情况下,过高的溶液与沉淀溶剂的混合比可以导致不足的沉淀溶剂分配到含锂相中的两相混合物。因此,锂电解质盐可能无法从混合物中充分沉淀。因此,可能需要相对低的溶液与沉淀溶剂的混合比,以在含锂相中溶解足够的沉淀溶剂并且由此诱导沉淀。
88.尽管将理解,合适的混合比范围将取决于电解质溶剂、极性非质子溶剂和沉淀溶剂的性质,但在一些实施方案中,含锂溶液和沉淀溶剂以在1:2和1:100之间,诸如在1:3和1:20之间,例如在1:4和1:15之间的比(v/v)组合。例如,发明人已经发现,当使用基于碳酸酯的锂盐溶液和甲苯作为沉淀溶剂时,在低于1:2(例如在1:4和1:14之间)的混合比可以获得良好的沉淀行为。
89.溶液与沉淀溶剂的组合可以包括将溶液添加至沉淀溶剂中或将沉淀溶剂添加至溶液中。可选择地,组合可以以连续操作进行,其中两种液体被连续地或半连续地添加至沉淀容器(或初步混合容器)中,被保持在期望的溶剂组分的比。
90.本发明的方法的优点在于不需要高温和减压。因此,含锂溶液和沉淀溶剂的组合,以及随后的沉淀,可以在低于50℃或低于30℃的温度进行,例如在环境温度或低于环境温
度进行。因此可以避免或最小化锂电解质盐的热分解。此外,压力可以始终保持在大气压或更高。应当理解,通常应保持低水分含量并且优选地还是低氧含量的惰性条件,以避免锂电解质盐的分解,并且在工艺中避免减压降低了空气或水进入的可能性。
91.本发明的方法的另外的优点在于沉淀溶剂不需要具有高于溶液中的增溶溶剂的沸点,因为沉淀通常不是通过蒸馏掉增溶溶剂来诱导的。因此,在一些实施方案中,沉淀溶剂具有比碳酸酯溶剂低的沸点。较低沸点的沉淀溶剂可以是优选的,因为它们可以更容易地从锂电解质盐产物中去除,并且可以更容易地被回收和再循环。因此,沉淀溶剂可以具有低于120℃或低于100℃的正常沸点。沉淀溶剂可以至少部分地基于与工艺中的其他溶剂诸如碳酸酯的沸点差异来选择。这可以允许溶剂通过蒸馏被分离,并且在闭环工艺中再循环。
92.本发明的另外的优点在于不需要添加氟化氢(hf)来获得纯的锂电解质盐的良好回收。因此,在一些实施方案中,hf不被添加至工艺中。
93.使沉淀的组合物沉淀
94.本发明的方法包括使包含由碳酸酯溶剂溶剂化的锂电解质盐的沉淀的组合物沉淀。沉淀的组合物从含锂溶液中沉淀,这至少部分地由于沉淀溶剂的存在,沉淀溶剂充当如本文描述的锂电解质盐的抗溶剂。
95.沉淀的组合物可以是固体或液体,这取决于例如锂电解质盐中的弱配位阴离子。在一些实施方案中,沉淀的组合物包含以至少50wt.%或至少80wt.%或至少90wt.%或大体上100wt.%的量的由碳酸酯溶剂溶剂化的锂电解质盐。
96.在一些实施方案中,在将溶液和沉淀溶剂组合之后立即开始沉淀的组合物的沉淀。应当理解,这样的自动沉淀行为可以取决于存在的特定的溶剂、它们的相对的比和温度。在一些实施方案中,溶液和沉淀溶剂在选定的温度组合,使得沉淀自动地发生。例如,两种液体可以被连续地或半连续地添加至保持在合适的温度的沉淀容器中以诱导快速沉淀。在一些实施方案中,环境温度将足以实现这一点。然而,在一些情况下可能需要降低的温度。例如,温度可以低于10℃,或低于0℃。
97.在一些实施方案中,沉淀的组合物的沉淀可能需要在组合之后主动地诱导。例如,含锂溶液和沉淀溶剂的组合的混合物可以被冷却至例如低于10℃或低于0℃的温度。在一些实施方案中,可以通过用期望的锂电解质盐产物的晶体接种混合物来诱导沉淀。
98.被沉淀的沉淀的组合物包含包括碳酸酯溶剂的呈溶剂化物形式的锂电解质盐,并且优选地基本上由包括碳酸酯溶剂的呈溶剂化物形式的锂电解质盐组成。本发明的特别的特征是不以无溶剂的锂电解质盐产物为目标。不希望受任何理论的束缚,据信锂电解质盐溶剂化物中的溶剂分子与沉淀的结晶固体或离子液体中的锂离子配位。因此,如本文公开的多种锂电解质盐可以通过本发明的方法作为碳酸酯溶剂化物沉淀。
99.锂电解质盐溶剂化物包含碳酸酯作为溶剂化溶剂分子的至少一部分。在一些实施方案中,固体锂电解质盐主要或大体上全部由碳酸酯溶剂分子溶剂化。如本文公开的,通过确保溶剂混合物中存在的任何其他溶剂分子与锂离子是非配位的,或至少与碳酸酯溶剂相比与锂离子的配位相对较少,可以提供溶剂化物中的高比例的碳酸酯。
100.在一些实施方案中,锂电解质盐溶剂化物包含碳酸乙烯酯(ec)作为溶剂化溶剂分子的至少一部分。在锂电解质盐溶剂化物中,ec可以作为主要的或实际上唯一的溶剂分子存在。因此,锂电解质盐溶剂化物可以包含li(ec)n(wca)或基本上由li(ec)n(wca)组成,其
中n表示溶剂化物晶体中溶剂与锂的比率,并且wca是弱配位阴离子。如本文公开的,已经令人惊讶地发现,即使当在溶液中还存在其他碳酸酯溶剂时,可以通过本发明的方法从溶液中沉淀高纯度锂电解质盐-ec溶剂化物。
101.在锂电解质盐是lipf6的实施方案中,沉淀的组合物由此可以包含li(ec)npf6。在至少一些这样的实施方案中,n的平均值在约4至5的范围内。
102.分离沉淀的组合物
103.本发明的方法包括将沉淀的组合物与溶剂混合物分离的步骤。如果沉淀物是固体,则可以通过常规的固-液分离技术诸如过滤、离心和类似技术来完成分离。如果沉淀物是液体,则可以通过常规的液-液分离技术诸如倾析、重力分离和类似技术来完成分离。
104.分离的沉淀的组合物一旦与溶剂混合物的本体分离就可以被洗涤。可以合意的是洗涤从沉淀物中去除任何残余的游离溶剂,特别是高沸点溶剂诸如游离碳酸酯。洗涤溶剂可以与沉淀溶剂相同,或者是锂电解质盐难溶于其中或不溶于其中的另一种非极性溶剂。洗涤溶剂可以是低沸点溶剂,诸如石油醚40-60,以促进沉淀物的随后的干燥。
105.分离的沉淀的组合物可以被干燥以去除残余的游离溶剂,任选地在如本文公开的第一次洗涤之后被干燥。干燥可以在减压完成,但还预期其他技术诸如在惰性气体中的流体化。
106.分离的沉淀的组合物在洗涤和干燥之后可以包含具有低水平的游离溶剂的高纯度锂电解质盐溶剂化物。此外,由于锂电解质盐溶剂化物包含碳酸酯作为相关溶剂,因此,在不进一步纯化的情况下,它可以适合作为用于使用基于碳酸酯的电解质的应用的电池级锂盐源。已经发现,根据本发明的方法可以提供仅由碳酸酯分子特别是碳酸乙烯酯溶剂化的锂电解质盐。这样的产物在含碳酸乙烯酯的电解质溶剂中的溶解被预期产生与通过将未溶剂化的锂电解质盐溶解在相同的电解质溶剂混合物中制备的电解质大体上相同的组合物。因此,在一些实施方案中,本发明的方法包括将回收的沉淀的组合物溶解在包含碳酸酯的电解质溶剂中的步骤。
107.包含电解质溶剂、极性非质子溶剂、沉淀溶剂和任何洗涤溶剂的分离的溶剂混合物可以被进一步加工。在一些实施方案中,沉淀步骤中的初始回收率不是定量的,并且可以从溶剂混合物中回收另外量的锂电解质盐。这可以通过冷却溶剂混合物和/或向溶剂混合物中添加另外的量的沉淀溶剂来实现。溶剂混合物可以任选地首先被浓缩,例如在减压被浓缩。
108.溶剂混合物可以被分离成不同的流,例如通过蒸馏。特别地,极性非质子溶剂和沉淀溶剂可以在工艺中被回收和再循环,以用于在工艺的接触步骤/提取步骤和组合步骤/沉淀步骤中再利用。电解质溶剂还可以从工艺中分离和去除,以用于再利用或用于其他处置。
109.实施方案
110.现在将参考图1描述本发明的实施方案,图1描绘了工艺100。锂离子电池废物102包括包含溶解在电解质溶剂中的lipf6的电解质,该电解质溶剂包含碳酸乙烯酯和一种或更多种碳酸二烷基酯(例如碳酸甲乙酯)。废物102被引入到提取单元104中,在提取单元104中用基于碳酸酯的极性非质子溶剂106提取废物102,极性非质子溶剂106例如碳酸二烷基酯,诸如碳酸二甲酯。包含溶解在混合的碳酸酯溶剂中的lipf6的经提取的溶液108任选地通过简单蒸馏被浓缩以去除碳酸二烷基酯的级分(未示出),然后任选地被过滤以去除残余
固体(未示出),并且然后被送至沉淀单元110。经提取的电池废固体112被送往用于火法冶金加工或湿法冶金加工以回收金属资源。
111.在沉淀单元110中,将溶液108与沉淀溶剂114组合,沉淀溶剂114可以是低极性烃或氯化的溶剂,例如石油醚。溶液108和沉淀溶剂114以使得至少一些沉淀溶剂分配到含锂溶液中的混合比和温度组合。作为沉淀溶剂的抗溶剂性质的结果,任选地通过在沉淀单元110中保持的低温辅助,在沉淀单元110中形成包含lipf6的固体沉淀物。沉淀物116从沉淀单元110送至过滤单元118。任选地,贫锂溶剂流120从沉淀单元110单独地回收并且被送至溶剂处理单元122。流120可以包含富含沉淀溶剂的低极性液相,如果溶液108和沉淀溶剂114不完全混溶,则可以形成该液相。可选择地,如果在沉淀单元110中形成单一液相,则它可以是通过从沉淀物中倾析混合的溶剂而获得的澄清流。
112.沉淀物116在过滤单元118中过滤以去除残余溶剂,用另外的沉淀溶剂(或其他合适的洗涤溶剂)洗涤并且干燥。因此,在工艺100中产生呈由碳酸酯溶剂化的高纯度lipf6的形式的固体产物124。固体产物124可以呈高纯度li(ec)npf6的形式,并且因此适合在包含ec溶剂基质的电池电解质中被再利用。
113.将来自过滤单元118的滤液126与流120组合并且送至溶剂加工单元122。任选地,流120、滤液126或组合的流可以首先经历进一步的沉淀步骤(未示出)以回收另外的lipf6。在可以包括一个或更多个常规蒸馏过程的溶剂加工单元122中,溶剂的混合物被分离成多种流,例如包括重流128、电解质溶剂回收流130(包含碳酸乙烯酯)、极性非质子溶剂回收流132(包含例如碳酸二烷基酯)和沉淀溶剂回收流134(包含例如石油醚)。流132可以被再循环并且用补充流136补充以形成在提取单元104中使用的极性非质子溶剂106。流134可以被再循环并且用补充流138补充以形成在沉淀单元110中使用的沉淀溶剂114。
114.在变型中,锂离子电池废物102中的电解质包含不同的锂盐,例如lifsi或libf4,使得碳酸酯溶剂化的锂盐在沉淀单元110中作为液体沉淀。然后在沉淀单元110中或在下游的液-液分离器118中将液体沉淀物与溶剂混合物分离。由此在洗涤和干燥之后,在工艺100中产生呈由碳酸酯溶剂化的高纯度li盐的形式的产物124。
115.现在将参考图2描述本发明的另一种实施方案,图2描绘了工艺200。工艺200中类似地编号的项目如本文针对图1中描绘的工艺100所描述的。
116.然而,在工艺200中,包含溶解在混合的碳酸酯溶剂中的lipf6的经提取的溶液108被送至液-液提取单元240,在液-液提取单元240中用非极性溶剂242诸如石油醚提取溶液108。提取在不诱导锂盐的沉淀的条件下进行。特别地,溶液108和非极性溶剂242可以在不冷却至低于环境温度条件的情况下和/或以使得相对少量的非极性溶剂分配到极性的含锂相中的相对高的混合比(例如1:1v/v)组合。然后在单元240中通过常规的液-液提取技术分离相,其中高密度的含锂极性相244行进至沉淀单元210。可以将低密度的低极性相246送至进一步加工,其中任选地将非极性溶剂再循环至流242。有利地,低极性相246可以包含大部分的碳酸二烷基酯,同时将更极性的碳酸乙烯酯留在极性相244中。碳酸二烷基酯的去除有利于在沉淀步骤中形成高纯度碳酸乙烯酯溶剂化的lipf6,并且还可以促进工艺中多种碳酸酯溶剂的回收和/或再循环。特别地,碳酸二烷基酯可以从流246中回收并且被再循环至流106。
117.在沉淀单元210中,极性相244与沉淀溶剂214组合,沉淀溶剂214可以是氯化的溶
剂诸如二氯甲烷并且在沉淀单元210中形成单相。作为沉淀溶剂的抗溶剂性质的结果,任选地通过在沉淀单元210中保持的低温辅助,在沉淀单元210中形成包含lipf6的固体沉淀物。沉淀物216从沉淀单元210被送至过滤单元218,在过滤单元218中沉淀物216被过滤、洗涤和干燥。因此,在工艺200中产生呈由碳酸酯溶剂化的高纯度lipf6特别是li(ec)npf6的形式的固体产物224。
118.来自过滤单元218的滤液226被送至溶剂加工单元222,在溶剂加工单元222中溶剂的混合物被加工并且被分离成多种流,例如包括重流128、电解质溶剂回收流130(包含碳酸乙烯酯)、极性非质子溶剂回收流132(包含在流246中未去除的任何碳酸二烷基酯)和沉淀溶剂回收流234(包含氯化的溶剂)。流234可以被再循环并且用补充流238补充以形成在沉淀单元210中使用的沉淀溶剂214。
119.生产电解质的方法
120.本发明还涉及一种生产用于电化学能量储存装置的电解质的方法。该方法生产并且然后使用沉淀的锂电解质盐组合物,如本文在从经使用的电解质中回收锂电解质盐的方法的上下文中描述的,以产生电解质。
121.生产电解质的方法包括将回收的沉淀的组合物溶解在包含碳酸酯的电解质溶剂中的步骤。在一些实施方案中,电解质溶剂包含任选地与一种或更多种碳酸二烷基酯组合的碳酸乙烯酯(ec)。在一些实施方案中,电解质溶剂包含与碳酸二甲酯(dmc)和/或碳酸甲乙酯(emc)组合的ec。
122.如本文已经公开的,根据本发明可以生产用碳酸酯分子溶剂化的高纯度锂电解质盐。在一些实施方案中,锂电解质盐产物主要或仅由碳酸酯分子特别是碳酸乙烯酯溶剂化。这样的产物在基于碳酸酯的电解质溶剂中的溶解被预期产生与通过将新合成的或未溶剂化的锂电解质盐溶解在相同的电解质溶剂体系中制备的电解质大体上相同的组合物。因此,在一些优选的实施方案中,存在于回收的锂电解质盐溶剂化物中的碳酸酯溶剂分子与合意地存在于新制备的电解质溶剂中的碳酸酯溶剂分子相同。
实施例
123.参考以下实施例来描述本发明。应当理解,这些实施例说明而不限制本文描述的发明。
124.材料
125.电解质制剂源自诸如soulbrain和merck的商业供应商。使用的电解质是在ec/emc(2:1v/v)中的1.2m lipf6,在ec/emc(3:7v/v)中的1.2m lipf6,在ec/dec(1:1w/w)中的1m lipf6,在ec/pc(1:1v/v)中的1m lipf6和在ec/dmc(1:1v/v)中的1m lipf6。非芳族石油醚、石油醚40-60、石油醚60-80和石油醚80-100、甲苯、环己烷、二氯甲烷和氯仿购自商业供应商。非无水性质的溶剂经小块金属锂干燥。
126.阴极材料nmc811和阳极材料石墨-15%硅从阿贡国家实验室(argonne national laboratories)(us)获得,并且在供应商推荐的温度在真空下干燥。分离器材料solupor 3p(20μm厚度)在40℃-50℃在真空下干燥持续至少两天。具有铝包覆底壳的不锈钢硬币型电池2032购自hohsen(日本)。在电池组装之前,所有硬币型电池部件都在乙醇中超声波清洗,并且随后在60℃的烘箱中干燥持续至少两天。包含锂盐的电解质制剂在填充有氩气的手套
箱(kiyon,韩国)中操作。电池硬币型电池在相同的手套箱中被组装。在maccor(us)电化学测试站上在环境温度进行电池测试。
127.实施例1.
128.在混合的碳酸酯溶剂中的lipf6(约1m至1.2m)的溶液被保持在惰性气氛(n2)下。混合的碳酸酯溶剂包含与碳酸二甲酯(dmc)、碳酸甲乙酯(emc)、碳酸二乙酯(dec)和碳酸丙烯酯(pc)中的一种组合的碳酸乙烯酯(ec)。
129.然后在室温在惰性气氛下将一定量的电解质溶液与沉淀溶剂(lipf6抗溶剂)组合。评估以下沉淀溶剂:二氯甲烷(ch2cl2)、氯仿(chcl3)、甲苯、石油醚40-60、石油醚60-80和石油醚80-100。将电解质溶液和低极性溶剂以在约1:11和1:14之间的比(v/v)组合,将电解质溶液(约0.4ml)添加至沉淀溶剂(约4ml)中并且短暂搅动。以这些比,溶剂通常形成单一液相,观察到从该液相中形成固体沉淀物。如果没有立即发生沉淀,则将混合物在冰箱(~4℃)或冷冻柜(-17℃)中冷却以诱导沉淀。在烃(甲苯,环己烷)沉淀溶剂的情况下,冰箱冷却是优选的。一些实验使用4ml-30ml的电解质以较大的规模重现。
130.进行的实验以及对沉淀的观察结果在表1中示出。
131.表1
[0132][0133][0134]a观察到的两相混合物
[0135]
重复实验9-12,其中逆转添加的顺序,即在搅拌的同时将甲苯添加至电解质溶液中(各体积相同)。未观察到沉淀行为的差异。
[0136]
一旦固体产物已经沉淀,在惰性气氛下通过过滤将其从混合的溶剂中回收。将过滤的固体用石油醚40-60洗涤,并且在真空下或在干燥的n2流中干燥。
[0137]
通过多核nmr(h、c、p、f和li)研究回收的产物的组成。所有nmr数据与下文实施例5中呈现的数据类似,并且因此与仅由ec溶剂化的lipf6碳酸乙烯酯溶剂化物的形成一致。
[0138]
来自实验3和实验11的回收的产物经历元素分析,并且结果在表2中示出,与理论溶剂化物的计算值相比较。元素分析结果与li(ec)npf6的形成一致,其中n的平均值在约4-5的范围内。
[0139]
表2.
[0140]
来自测试的盐%c%h%n328.713.40《0.303(重复)28.573.50《0.301128.983.62《0.3011(重复)28.903.65《0.30计算的li(ec)4pf628.603.200计算的li(ec)5pf630.423.400
[0141]
实施例2.
[0142]
使用在混合的碳酸乙烯酯和碳酸甲乙酯(2:1v/v)中的1.2m lipf6研究了改变在电解质溶液和甲苯之间的混合比的影响。在不冷却的情况下将电解质溶液添加至沉淀溶剂中。进行的实验以及对沉淀的观察结果在表3中示出。
[0143]
表3.
[0144][0145]
实施例3.
[0146]
在混合的碳酸酯溶剂中的lipf6溶液,如还在实施例1中使用的,经历两步溶剂提取-沉淀工艺。在室温在惰性气氛下,以约1:2的比(v/v)将一定量的电解质溶液与石油醚40-60混合。以该比,在没有任何固体沉淀的情况下形成两相混合物。然后用分液漏斗(可选择地,通过倾析)将混合物分离成富烃顶部相和富碳酸酯底部相。
[0147]
然后在室温在惰性气氛下以约1:3的比(v/v)在搅拌的同时将富碳酸酯底部相与二氯甲烷组合。以该比,溶剂形成单一液相。通常在环境温度诱导沉淀,但混合物在冷冻柜(-17℃)中冷却,以实现高的沉淀率。
[0148]
进行的实验以及对沉淀的观察结果在表4中示出。
[0149]
表4.
[0150]
测试碳酸酯混合物观察结果27ec&emc当冷却时高的沉淀物收率28ec&dec当冷却时高的沉淀物收率29ec&pc缓慢,低收率沉淀
[0151]
一旦固体产物已经被沉淀,在惰性气氛下通过过滤将其从混合的溶剂中回收。将过滤的固体用石油醚40-60洗涤,并且在真空下或在干燥的n2流中干燥。通过多核nmr(h、c、p、f和li)研究回收的产物的组成。所有nmr数据与下文实施例5中呈现的数据类似,并且因此与仅由ec溶剂化的lipf6碳酸乙烯酯溶剂化物的形成一致。
[0152]
对于每个实验,通过nmr分析滤液和富烃顶部相。碳酸乙烯酯主要存在于滤液中,指示在第一溶剂提取阶段期间,碳酸乙烯酯已经被分配到富碳酸酯底部相中。然而,对于测试27和测试28,第二碳酸酯(emc或dec)主要分布到富烃顶部相中。
[0153]
实施例4.
[0154]
将在混合的碳酸乙烯酯和碳酸甲乙酯中的1.2m lipf6的溶液暴露于空气,通过与氧和水反应导致一部分的lipf6分解。lipf6的固体分解产物被观察到从溶液中沉淀。
[0155]
然后通过膜过滤器过滤电解质以去除固体,并且然后使经过滤的电解质溶液经历与实施例3的测试27相同的两步溶剂提取-沉淀工艺。所得到的固体产物通过nmr进行分析,并且发现具有与测试27的产物相同的纯度。
[0156]
实施例5.
[0157]
将在ec/emc(2:1v/v)中的1.2m lipf6的电解质溶液与甲苯以1:8(v/v)的比组合,导致固体产物的沉淀。在惰性气氛下通过过滤从混合的溶剂中回收固体产物,并且对母液进行采样用于分析。然后将经过滤的固体用石油醚40-60洗涤,并且在真空下干燥。
[0158]
通过多核nmr-δ/ppm研究了回收的产物的组成,多重性:1h-nmr:4.45,s;
31
p-nmr:-144.66,九重峰;
19
f-nmr:-73.94,d;
13
c-nmr:65.04,156;7li-nmr:2.29,s。nmr数据与li(ec)npf6的形成一致。
[0159]
还通过nmr分析了母液,其中结果示出存在预期的溶剂(ec、emc、甲苯),但很少或没有磷物质或氟物质(nmr信号低或与基线不可区分)。
[0160]
将另一种电解质溶液在ec/emc(3:7v/v)中的1.2m lipf6与石油醚40-60以1:1.5(v/v)的比混合。形成两相混合物,并且未观察到沉淀。分离相,其中保留非极性相用于分析。以1:3(v/v)的比将二氯甲烷添加至电解质相中,引起固体的沉淀。在惰性气氛下通过过滤从混合的溶剂中回收固体产物。然后将经过滤的固体用石油醚40-60洗涤,并且在真空下干燥。
[0161]
通过多核nmr-δ/ppm研究了回收的产物的组成,多重性:1h-nmr:4.45,s;
31
p-nmr:-144.65,九重峰(和微量杂质在-20,t);
19
f-nmr:-73.94,d(和微量杂质在-84,d);
13
c-nmr:65.26,157;7li-nmr:2.24,s。nmr数据与li(ec)npf6的形成一致。
[0162]
还通过nmr分析了来自初始提取的非极性石油醚相,其中结果示出存在emc和仅微量的ec,指示emc从电解质相中的选择性提取。据估计,ec形成低至1wt.%的提取到非极性相中的总碳酸酯。没有鉴定出磷物质或氟物质(nmr信号低或与基线不可区分)。
[0163]
实施例6.
[0164]
测试22(根据实施例2;表3)被重复,除了以显著更大的规模,使用25ml的在ec/emc(2:1v/v)中的1.2m lipf6。在将电解质添加至甲苯(约1:7.5v/v的电解质:溶剂)之后,观察到沉淀物的形成,这在室温放置持续若干小时后增加。在通过实施例3的方法回收沉淀物之后,分离出约14g-15g的li(ec)npf6。
[0165]
实施例7.
[0166]
用更稀的电解质溶液进行沉淀实验。未稀释的初始电解质是在混合的ec和emc(2:1v/v)中的1.2m lipf6。然后,在根据实施例3的方法用甲苯沉淀和回收固体沉淀物之前,用dmc稀释该初始电解质。因此,使用表5中示出的未稀释的电解质体积、电解质与稀释溶剂的比和甲苯沉淀剂体积进行测试30-32。nmr分析证实固体沉淀物是li(ec)npf6,尽管存在emc和dmc(仅在测试32中检测到少量的dmc,可能是由于不充分的洗涤)。在每个测试中回收的固体li(ec)npf6的质量还在表5中示出。结果证明,锂电解质盐可以满意地从稀释的电解质中回收,该稀释的电解质模拟当使用极性非质子提取溶剂诸如碳酸酯从废弃的电池中提取(浸出)经使用的电解质(包含典型电池浓度的锂盐)时的情况。
[0167]
表5.
[0168][0169]
实施例8.
[0170]
使用在ec:dmc(2:1v/v)中的libf4和lifsi(fsi=双(氟磺酰基)酰亚胺)的1.2m溶液来研究其他锂电解质盐的回收。将电解质(2ml)与甲苯组合(甲苯:电解质溶液7.5:1v/v)。在这两种情况下,在将电解质添加至甲苯中之后立即形成液体两相体系。将液体沉淀物与上清液溶剂分离,并且通过多核nmr光谱学分析两个相。溶剂相不包含残余的锂盐,证实了定量的沉淀。
[0171]
沉淀的液体通过nmr被鉴定为由ec溶剂化(复合)的li盐,即具有式[li(ec)n][a](a=bf4,fsi]。[li(ec)n][bf4]nmr-δ/ppm,多重性:1h-nmr:4.48,s;
11
b nmr-1.4,s;
19
f nm r-153,s。回收的[li(ec)n][bf4]的1h nmr光谱在图5中示出,证明回收的锂盐产物包含碳酸乙烯酯作为主要溶剂化分子。
[0172]
实施例9.
[0173]
在电化学充放电测试中评估回收的锂电解质盐在电池应用中的性能。由此将在实施例5和实施例6中产生的li(ec)npf6材料溶解在dec中,然后添加ec和少量的固体电解质界面形成添加剂(5wt.%氟代碳酸乙烯酯和5wt.%碳酸亚乙烯酯)以配制在ec/dec(3:7v/v)
中的约1m lipf6的电解质溶液,其代表在商业lib中常用的电解质。使用基准的商业电解质在ec/emc(3:7v/v)中的1.2m lipf6加上专有的电池添加剂用于比较。然后将这些电解质溶液封装在基准的硬币型电池配置中,该配置包含商业nmc 811阴极、石墨-硅(si 15%)阳极和solupor 3p分离器膜。
[0174]
在环境温度,根据速率测试循环概况循环硬币型电池,其中放电速率(c值)在0.2c和10c之间。电池循环结果在图3和图4中描绘。图3示出,包括来自降解的电解质(实施例5)的用回收的li(ec)npf6配制的电解质提供与商业基准相当的循环性能,其中微小的差异归因于不同的溶剂体系和添加剂。图4示出了使用包含回收的li(ec)npf6的电解质制成的lib电池单元的电压-时间概况。结果是使用nmc阴极材料的lib电池的典型结果。
[0175]
在实施例7测试31中产生的li(ec)npf6还溶解在dec中,然后添加ec和少量的固体电解质界面形成添加剂,以配制在ec/dec(3:7v/v)中的约1m lipf6的电解质溶液。获得了良好的循环性能,如在0.1c和2c之间的范围内的c值的电化学充放电测试中测量的,由此证明了从稀电解质中成功回收锂电解质盐。
[0176]
本领域技术人员将理解,除了具体描述的那些之外,本文描述的本发明易于变化和修改。应当理解,本发明包括落入本发明的精神和范围内的所有这样的变化和修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1