芥子酸在种子萌发、根生长和幼苗发育方面的应用的制作方法
本发明属于生物工程技术领域,具体涉及芥子酸在种子萌发、根生长和幼苗发育方面的应用。
背景技术:
芥子酸及其衍生物是一类重要的苯丙烷类代谢中间物质,广泛参与调节植物的生长发育、生殖和应答各种逆境胁迫等。在苯丙烷类代谢途径中,芥子酸是紫丁香基木质素(syringyllignin)生物合成的一个中间产物,也是叶和果实中形成芥子酸酯(sinapateester)可溶性代谢物质的前体(已有的研究表明,芥子酸酯有三种类型:即芥子酰基葡萄糖(sinapoylglucose)、芥子酰基苹果酸(sinapoylmalate)和芥子碱(sinapoylcholine),三种芥子酸酯代谢模式如图1所示)。因此,芥子酸是研究苯丙烷类代谢参与调控植物生长发育和逆境响应的一个重要代谢物质。
脱落酸(abscisicacid,aba)是一种具有倍半萜结构的植物激素,是调节植物生长发育和生理代谢过程的主要激素之一,主要参与植物胚的成熟、种子休眠、萌发、幼苗生长、调控植物根的形态建成,气孔运动和从营养生长到生殖生长的转变过程等。同时,aba在植物响应生物和非生物胁迫过程中也有着重要的调节作用。目前有较多关于aba信号通路的综述报道,对aba的信号转导与种子萌发、气孔运动等生命活动的关系进行了阐述,但由于aba参与了许多的植物生理与发育过程,使得aba信号网络的组分十分复杂,所以aba信号通路的研究仍然是当前植物激素的研究热点之一。
尽管芥子酸及其衍生物在植物生长发育,以及抵御外界环境胁迫多有报道,但芥子酸的代谢是否与植物激素aba有关,其是否参与aba调控的植物生长与发育的过程,目前仍不清楚。因此,研究芥子酸代谢与aba代谢及信号转导途径的关系,对于揭示芥子酸调控植物生长发育以及对逆境胁迫的响应的分子机制,具有重要的生物学意义,同时,也可为生产中利用基因工程技术改善种子营养物质的积累,调节种子萌发与植物生长发育提供的理论依据。
技术实现要素:
通过对芥子酸与aba间作用关系的初步研究,本申请目的在于提供芥子酸在种子萌发和植物生长发育方面的应用,从而为培育种子、种子改良和促进植物生长方面奠定理论和应用基础。
本申请所采取的技术方案详述如下。
芥子酸在种子萌发、根生长和幼苗生长方面的应用,低浓度的芥子酸(0.1~0.5mm)能诱导芥子酰胆碱(sinapolcholine)的累积,促进芥子酸酯类的合成(包括芥子酰葡萄糖(sinapoylglucose)和芥子酰苹果酸(sinapoylmalate)的合成),促进种子萌发、侧根发生和幼苗生长,诱导主根弯曲并抑制其生长;而高浓度的芥子酸(大于0.5mm)则抑制种子萌发和主根生长。
进一步研究表明,芥子酸诱导脱落酸葡糖酯(aba-ge)转移酶代谢相关基因(ugt71c5、ugt71b6、ugt71b7、ugt71b8)的表达;能特异性的促进脱落酸葡糖酯(abscisicacid-glucoseester,aba-ge)的积累,抑制拟南芥aba的合成,降低植物体内脱落酸的含量;而在芥子酸酯合成的关键酶,阿魏酸羟化酶(ferulicacidhydroxylase1)突变体fah1(无法合成芥子酸酯)中,aba含量较高,而脱落酸葡糖酯含量较低,这一结果表明,芥子酸参与调节了拟南芥种子中aba的代谢过程。
而在芥子酸处理后,低浓度的芥子酸(0.5mm)能抑制aba代谢和信号转导相关突变体aba2-1和abi3-1的种子萌发,在这些突变体中,芥子酰胆碱的含量增高;具体而言:
芥子酸代谢突变体(aba2-1和abi3-1)中aba抑制种子萌发的效应发生了变化,表现为在sng1-1中种子萌发率较野生型高,而在sng2和brt1-1中,萌发率较野生型低;
而芥子酰葡萄糖胆碱转移酶(sinapoylglucose:cholinesinapoyltransferas,sct)的表达水平在aba2-1和abi3-1明显较野生型高;同时,sct酶活性、芥子酰胆碱和种子中胆碱含量较野生型高。
芥子酸在种子萌发、根生长和幼苗生长中的应用,可提高种子的萌发率,促进幼苗的生长,具体而言,在播种前,以低浓度(0.1~0.5mm)的芥子酸浸泡作物种子,能提高种子的萌发率,从而节约生产成本;另一方面,利用基因工程技术对芥子酸和脱落酸相关基因的表达或者抑制,可调整种子萌发率。
本申请中,对芥子酸合成代谢相关基因brt1(at3g21560)、sng1(at2g22990)和sng2(at5g09640)以及aba代谢和信号转导相关基因aba2和abi3进行了初步研究,通过对植物中芥子酰胆碱、芥子酰葡萄糖、芥子酰苹果酸、脱落酸和脱落酸葡糖酯含量的分析及相关基因表达的检测,初步揭示了芥子酸和脱落酸协同调控种子萌发与幼苗生长的机制,并利用芥子酸代谢相关突变体和脱落酸代谢与信号转导相关突变体为材料,以检测种子萌发率的实验进一步验证了这一理论。
总体而言,本申请通过对芥子酸与脱落酸的作用关系、作用机制的初步研究,创新性地提出芥子酸与脱落酸存在协同作用,进而调控植物种子萌发及幼苗生长的理论。利用该理论,可为提高农业生产中植物种子的萌发率、促进幼苗生长奠定良好的理论基础和应用基础,并进一步可为基因工程对种子的改良指明方向。
附图说明
图1为芥子酸酯代谢的模式图;f5h为阿魏酸羟化酶(ferulate5-hydroxylase),
sgt为芥子酸葡萄糖基转移酶(udp-glucose:sinapateglucosyltransferase),
sct为芥子酰葡萄糖胆碱转移酶(sinapoylglucose:cholinesinapoyltransferase),
sce为芥子碱酯酶(sinapineesterase),
smt为芥子酰葡萄糖苹果酸转移酶(sinapoylglucose:malatesinapoyltransferase);
拟南芥突变体名称如下,brt:brighttrichomes(明亮的毛状体);sng:sinapoylglucoseaccumulator(芥子酰葡萄糖积累);fah,ferulatehydroxylase(阿魏酸羟化酶);
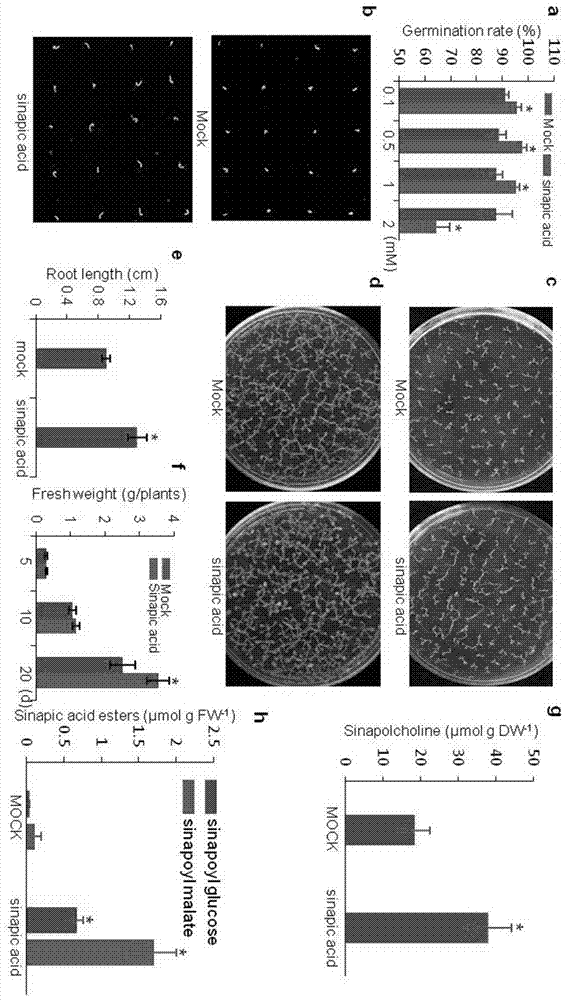
图2为低浓度的芥子酸能促进拟南芥种子萌发和早期幼苗生长;a为统计种子萌发率数据;b为萌发的种子的照片;c和d为正常条件/芥子酸处理条件下生长的幼苗的照片;e为根长度的统计数据;f为测量植物的鲜重;g为不同生长条件下植物体内芥子酸胆碱的含量;h为测量不同生长条件下芥子酸酯类的含量;图中部分横坐标和纵坐标含义如下:germinationrate,萌发率;mock,对照;sinapicacid,芥子酸;rootlength,根长度;freshweight(g/plants),鲜重(克/株植物);d,天;sinapoylcholine,芥子酰胆碱;sinapicacidesters,芥子酸酯类;sinapoylglucose,芥子酰葡萄糖;sinapoylmalate,芥子酰苹果酸;
图3为不同浓度的芥子酸对拟南芥幼苗生长情况的影响;a为在正常条件下生长5天的幼苗,移栽至含不同浓度的芥子酸的培养基中,5天后拍照片;b为统计主根的生长长度;c为统计侧根的数目;图中部分横坐标和纵坐标含义如下:rootlength(cm),主根长度(厘米);sinapicacidconcentration(mm),芥子酸浓度(毫摩尔);lateralrootnumberrate(%),侧根数目百分比;lateralrootnumber,侧根数目;
图4为测量拟南芥种子中aba和脱落酸葡糖酯的含量;a为脱落酸葡糖酯代谢相关基因的表达量分析;b和c分别为测量种子中aba和脱落酸葡糖酯的含量;d为芥子酸特异性降低了aba抑制种子萌发的效应;图中部分横坐标和纵坐标含义如下:mock为对照组实验;relativeexpression,相对表达量;contentofaba/aba-ge(pmol/gdw),aba和aba葡糖酯的含量(干重皮摩尔/克);germinationrate,萌发率;sinapicacid,芥子酸;ferulicacid,阿魏酸;cinnamicacid,肉桂酸;p-coumaricacid,香豆酸;caffeicacid,咖啡酸;
图5为aba影响芥子酸代谢相关突变体的种子萌发;a为sng2、sng1-1和brt1-1的幼苗照片;b为sng2、sng1-1和brt1-1的种子萌发率的统计;c为对sng2、sng1-1和brt1-1的子叶变绿数据的统计;d为测定sng2、sng1-1和brt1-1的体内芥子酸胆碱含量;图中部分横坐标和纵坐标含义如下:germinationrate,萌发率;daysafterimbibition,种子吸水后的天数;greencotyledons(%),绿色子叶的百分比;sinapolcholine(µmolg-1),芥子酰胆碱的含量(微摩尔/克);
图6为检测芥子酸对aba相关突变体aba2和abi3的种子萌发的影响。a为种子萌发率的统计;b为检测sct基因表达量;c为对种子中sct活性的分析;d为植物中芥子酸胆碱含量的分析;e为检测sce基因的表达量;f为测量植物中芥子酸胆碱的含量;图中部分横坐标和纵坐标含义如下:germinationrate,萌发率;relativeexpression,相对表达量;sctactivity,芥子酰葡萄糖胆碱转移酶活性;sinapolcholine(μmolg-1),芥子酰胆碱含量(微摩尔/克);choline(μmolmg-1),胆碱含量(微摩尔/毫克)。
具体实施方式
下面结合实施例对本申请做进一步的解释说明,在介绍具体实施例前,就下述实施例中部分生物材料、实验试剂等问题简要说明如下。
生物材料:
拟南芥野生型、突变体brt1-1(at3g21560)、sng1-1(at2g22990)和sng2(at5g09640)由美国普渡大学clintchapple教授提供;
aba2-1(at1g52340)由发明人前期通过红外成像系统筛选获得;
fah1-2(at4g36220)和abi3-1(at3g24650)从拟南芥资源中心(abrc,ohiostateuniversity)获得;
引物合成及测序,由北京金维智公司提供完成。
实验试剂:
芥子酸,西格玛,美国;
rna提取试剂盒,天根,北京;
revertraaceqpcrrt试剂盒,东洋纺公司,日本;
pcr反应使用高效taq酶easytaqdnapolymerase,全式金,中国;
实时荧光定量rcp反应试剂盒,普洛麦格公司,美国;
胆碱分析试剂盒,亚诺法,美国
aba购自takara,日本。
实验设备:
紫外-可见光分光光度计nanodrop2000c,赛默飞公司,美国;
高效液相色谱仪agilent1260,安捷伦,美国;
质谱仪4000qtrap,罗克韦尔,美国;
超纯水仪b1209907,密理博,美国;
实时定量pcr仪mx3005p,安捷伦,美国。
实施例1
在本实施例中,以拟南芥为例,发明人首先证明了芥子酸能促进种子的萌发和幼苗的生长,相关实验过程简要介绍如下。
将拟南芥野生型(wt)种子播种于0.6%琼脂的ms培养基,以不添加芥子酸的培养基作为空白对照,在培养基中添加不同浓度的芥子酸(sinapicacid)(浓度分别为0.1、0.5、1和2mm)作为实验组,进行培育。
具体培育过程为:4℃春化3天,然后放置于光照培养间,培养室参数为:光/暗周期为16/8h,温度22℃,相对湿度为70%;2天后统计种子的萌发率。
统计结果如图2a所示,从中可以看出,在低浓度芥子酸(0.1~1mm)处理条件下,种子的萌发率较高,尤其是0.5mm的芥子酸处理后,促进种子萌发的效应最高。因此,后续实验均采用0.5mm的芥子酸处理种子材料。
进一步对种子培育,对部分植物形态特征数据及生理指标进行观察统计,结果如图2b~g所示,相关结果简要解释如下。
图2b中,为部分种子萌发状态图,从图2b中可以看出,0.5mm的芥子酸处理后,可明显促进种子萌发;
图2c和2d分别为含0.5mm的芥子酸的ms培养基中种子生长8天和20天后幼苗的生长状态图,从图中可以明显看出,芥子酸能促进幼苗生长;
图2e和图2f分别为含0.5mm的芥子酸的ms培养基上幼苗的根长和植物鲜重统计结果,结果同样表明,芥子酸能促进拟南芥根系生长,并可明显提高植物鲜重;
图2g为0.5mm的芥子酸处理种子两天后,利用高效液相色谱技术对种子中芥子酸胆碱含量的检测分析,结果表明,芥子酸诱导条件下,种子内的芥子酸胆碱在种子内得到了明显积累;
图2h为含0.5mm的芥子酸培养中,种子萌发生长10天后,植物体内芥子酸酯类含量测定结果,结果表明,芥子酸能诱导植物中芥子酸酯类的合成和富集。
对上述结果可以汇总如下:
低浓度芥子酸(0.1~1mm)处理后,可明显促进种子萌发,而高浓度(2mm)则较为明显地抑制了种子的萌发;
低浓度芥子酸(0.1~1mm,优选0.5mm)处理时,可明显促进幼苗生长,在形态指标上,表现为根系生长较长,植物鲜重增加较为明显;而通过生理指标可以发现,芥子酸诱导条件下,种子内的芥子酸胆碱在种子内得到了积累,而在植物幼苗体内,芥子酸诱导了植物体内芥子酸酯类的合成和富集。
为进一步判定芥子酸对于种子萌发率是否具有特异性,发明人以其他有机酸作为对照,进行了对照实验,结果表明,芥子酸能够特异性提高种子的萌发率,相关实验过程简介如下。
将拟南芥种子分别在0.5mm的芥子酸、阿魏酸、肉桂酸、香豆酸和咖啡酸中暗处理36h,然后播种于ms基本培养基中,1~3天后,统计种子萌发率。接结果表明,芥子酸处理后种子在生长1~3天过程中的萌发率明显高于其他有机酸处理过的种子,这表明芥子酸提高种子萌发率的效应具有特异性。
需要解释的是,采用高效液相色谱法测定植物体内芥子酸酯类物质含量时,具体可参考如下步骤进行操作:
(1)将预处理的30mg植物材料转移至组织匀浆器中,向匀浆器中加入1ml的提取液a(70%甲醇,50mm白杨素),将种子研磨至匀浆状态;
(2)将匀浆转移到2ml离心管中,再用1ml的提取液a冲洗匀浆器,合并两次的提取液;
(3)4℃真空抽提1h,然后于4℃、12000rpm离心10min,将上清液转移至5ml离心管中,沉淀用500μl提取液b(70%甲醇)在4℃抽提1h;
(4)4℃、12000rpm离心10min,合并上清液;
(5)用0.22μm孔径的滤膜过滤上清液,收集到另一个ep管中;
(6)用流动相b或纯甲醇以0.4ml/min的速率冲洗柱子,等待基线及柱子压强达到稳定值;
取1.5ml样品放入进样瓶中,并放入液相色谱仪的进样器中,按下列参数设置液相色谱仪程序:
柱温箱,25℃;检测器波长为220~400nm;流速为0.8ml/min;进样量为20μl;进样次数:2次;梯度洗脱程序设置参数如下:
标准曲线绘制:
用70%的甲醇分别配置1μm、10μm和100μm的芥子酸溶液,并按下表设置程序和进样量做关于芥子酸含量的标准曲线:
以芥子酸含量为x值,以上述洗脱程序下所得峰的面积为y值做出关于芥子酸含量相对于芥子酸峰面积的标准曲线;最后根据标准曲线计算获得芥子酸酯类物质含量数据。
对种子中芥子酸胆碱含量测定,可具体参考如下步骤:
(1)称取萌发的种子,转移至组织匀浆器中,然后向组织匀浆器中加入4℃预冷的磷酸缓冲液(pbs缓冲液,8.5g的nacl、5.54g的na2hpo4∙12h2o和1g的nah2po4,用双蒸水定容积至1l)750μl,充分研磨成匀浆,将匀浆转移至2ml离心管中,组织匀浆器用750μl的pbs缓冲液冲洗并转移溶液至含匀浆的离心管;
(2)4℃真空抽提1h,然后于4℃、14000rpm离心5min,取出漂于上层的脂类物质,将上清液转移至新的离心管中,沉淀用500μl的pbs缓冲液混匀,再次于4℃真空抽提1h;
(3)合并两次的提取液,并用滤膜滤去杂质,过滤后的溶液低温保存待测;
(4)将试剂盒中所有试剂置于冰上解冻,在enzymemix(dried)中加入120μlassaybuffer,混匀;
(5)取12μl、2mm的胆碱标准品加入228μl的无菌双蒸水配置成浓度为100μl的母液,并按下表稀释成4个梯度:
(6)将标准品和待检测样品分别转移至酶标板中,每个样品室加入20μl样品,设置三个重复样;
(7)每个样品室加入80μl反应液(反应液按85μlassaybuffer,1μlenzymemix和1μldyereagent的体积比配置),室温孵育30min左右,反应液出现颜色变化;
(8)将酶标板放入酶标仪中,检测并记录光波长570nm下样品的吸光值;
(9)绘制标准曲线,并根据标准曲线计算出待测样品中胆碱的含量。
实施例2
本实施例中,以拟南芥幼苗为例,发明人主要对芥子酸影响拟南芥幼苗根的生长进行了初步研究。结果表明,芥子酸能抑制主根生长,使主根丧失向地性生长,表现为根卷曲生长(图3a和b),而侧根数目增多(图3c)。具体实验情况如下。
将在正常ms培养基中生长5天的幼苗,移栽至含有不同浓度的芥子酸的培养基中,0为添加适量二甲亚砜(dmso)代替芥子酸,5天后拍照片如图3a所示,主根的伸长方向发生变化,表现为卷曲生长,表明其丧失了向地性生长的功能。同时,统计数据表明,芥子酸能够抑制拟南芥主根生长(图3b),但是侧根数目明显增多(图3c)。
实施例3
本实施例中,以拟南芥为例,发明人主要对芥子酸与脱落酸代谢间关系进行了初步研究,结果表明:芥子酸能调节脱落酸和脱落酸葡糖酯的代谢,相关实验简要介绍如下。
将拟南芥种子以0.5mm的芥子酸或二甲亚砜(dmso,0.5mm,阳性对照)在黑暗条件下浸泡36h后,播种于正常的ms培养基上,培养1天后(培养条件参考实施例1),按照现有技术,提取rna,以actin1基因作为内参,对芥子酸合成代谢基因brt1及与脱落酸葡糖酯(aba-ge)转移酶代谢相关基因(ugt71c5、ugt71b6、ugt71b7、ugt71b8)的表达情况进行实时荧光定量pcr分析。
荧光定量pcr时,引物序列设计(如seqidno.1~12所示)如下:
brt1-f:5'-ggtaaaggctatctccggtatg-3',
brt1-r:5'-gtggtcggaggatggttaag-3';
ugt71c5-f:5'-atccgggtctagcttcgg-3',
ugt71c5-r:5'-attccacggcccattgtt-3';
ugt71b6-f:5'-tcgagatggtggaagagc-3',
ugt71b6-r:5'-gtttccgaccaagcaata-3';
ugt71b7-f:5'-aagtcggtgcttccgattac-3',
ugt71b7-r:5'-gtcatctcgatggttggttga-3';
ugt71b8-f:5'-cggtgatagacgtggctaatg-3',
ugt71b8-r:5'-cactgacactgtactccttcttatc-3';
actin1-f:5'-ggtaacattgtgctcagtggtgg-3',
actin1-r:5'-aacgaccttaatcttcatgctgc-3';
20μl扩增反应体系设计如下:
cdna,1μl;
2×sybrgreenpcrmastermix(普洛麦格公司,美国),10μl;
f引物,0.2μl(10μm);
r引物,0.2μl(10μm);
pcr程序为:95℃变性2min;95℃变性5s,60℃复性延伸45s,40个循环;40循环后扩增产物的特异性用溶解曲线分析检测。
统计结果如图4a所示,从图中可以看出,芥子酸能明显诱导brt1和脱落酸葡糖酯转移酶代谢相关基因的表达。
进一步地,参考上述种子处理过程,检测表明,芥子酸处理后能抑制种子中aba的积累,诱导脱落酸葡糖酯的积累;
而在阿魏酸羟化酶突变体fah1-1(无法合成芥子酸酯)中,aba的含量较野生型高,脱落酸葡糖酯的含量较野生型低(测定结果如图4b和图4c所示)。这些结果表明,芥子酸参与调节了拟南芥种子中aba的代谢过程。另外,以不同有机酸同时处理拟南芥种子,仅芥子酸能促进种子萌发(图4d),表明在促进种子萌发方面的特异性。
需要解释的是,aba与aba-ge的测量方法参照文献(lópez-carbonelletal.,2009,plantphysiolbiochem.47(4):256-61)进行,具体如下。
含量测定方法:
(1)材料中aba的提取:
①称取50mg种子材料,加入1ml样品提取液(nacl137mm,kcl2.7mm,na2hpo410mm,kh2po42mm,ph7.4);低温条件下用组织匀浆器研磨成匀浆,转入2mlep管中,再用1ml样品提取液将组织匀浆器冲洗干净,所得溶液一并转入ep管中,摇匀后放置在4℃冰箱中;
②4℃下孵育4h,12000rpm离心8min,将上清液转移至新的ep管中;所得沉淀中加入1ml样品提取液,摇匀,置于4℃下再抽提1h,离心后合并上清液;
③上清液用0.22μm滤膜过滤,除去离心后的漂浮物;
④将过滤后的样品转移至新的离心管中,真空浓缩或用氮气吹干,除去提取液中的甲醇,用样品稀释液(500mlpbs中加入0.5mltween-20,0.5g明胶)定容到2ml;
(2)样品测定:
①竞争:配制系列标样(分别配成100ng/ml、50ng/ml、25ng/ml、12.5ng/ml、6.25ng/ml、3.125ng/ml、1.5625ng/ml和0ng/ml8个浓度),将系列标样加入酶标板前两行,每个浓度重复2次,每个样品室50μl,其余的样品室加入待测样品;
同时,取5ml样品稀释液,按照稀释倍数加入一定量的抗体,混匀,在加标准样及待测样的样品室中加入50μl;将酶标板放入酶标仪进行孵育(37℃,30min);
②洗板:吸出反应液,加入洗涤液洗涤4次,其中第一次洗涤时加入的洗涤液(在1lpbs中加入1mltween-20)要立即甩掉;
③加二抗:在10ml样品稀释液中按照稀释倍数加入酶标二抗,混匀后在酶标板上每样品室加入100μl稀释后的二抗,将酶标板放入酶标仪中内孵育(37℃,30min);
④洗板:将反应液甩干并在报纸上拍干净残留液体;加入洗涤液洗涤4次,其中第一次洗涤时加入的洗涤液要立即甩掉;
⑤加底物显色:称取20mg邻苯二胺(opd)溶解于10ml底物缓冲液(5.1gc6h8o7,18.43gna2hpo4,1mltween-20,双蒸水定容积至1l)中,完全溶解后加入4μl、30%的h2o2混匀,在酶标板每个样品室中加入100μl底物,然后放入酶标仪内,显色15min,每样品室加入50μl的2m的硫酸终止反应;
⑥测量:以酶标仪依次测定标准物和各样品在490nm处的吸光值;
根据标准样品的数据,利用logit曲线作出标准曲线,再根据标准曲线计算出样品中aba的含量。
含量测量方法如下:
取种子材料0.05g,将研钵用液氮预冷,加入700μl提取液(丙酮:水:乙酸按照体积比80:19:1),充分研磨种子,将研磨液收集到离心管中,15000rpm、4℃离心10min;
收集上清液,再加入700μl提取液,将两次上清混合到一起并用氮气吹干;
加入200μl的复溶液(水:乙腈:乙酸按照体积比9:1:0.005),充分混匀,旋涡,15000rpm、4℃离心10min;最后用0.22μm的滤膜过滤;
取滤液,以高效液相色谱仪进行检测。
实施例4
在实施例3基础上,为进一步验证芥子酸与aba代谢间关系,发明人检测了芥子酸合成代谢相关基因brt1(at3g21560)、sng1(at2g22990)和sng2(at5g09640)突变体种子的萌发是否受aba的影响,从而判定芥子酸能否拮抗aba抑制种子的萌发效应。相关实验过程简要介绍如下。
将wt、brt1-1(brt1基因失活)、sng2(sng2基因失活)和sng1-1(sng1-1基因失活)的种子分别播种于ms培养基或者含有0.2μm的aba的培养基中(培养条件参考实施例1),培养条件参考实施例1,生长8天后观察植株的生长表型。
从图5a中可以看出,在含有aba的培养基中,wt受aba抑制生长的效应较brt1-1、sng2和sng1-1相对较弱;换言之,在芥子酸合成缺陷植株或者说芥子酸缺失植株中,植株的生长不受aba的调节,或者说aba对于植株生长调节效果相对较差;
而在正常生长条件下(不受aba调控影响条件下),brt1-1、sng2和sng1-1突变体的种子萌发率低于wt,换言之,芥子酸合成受限情况下,种子发芽率也受到明显影响。进一步地分析表明,在sng1-1中,aba抑制种子萌发的效应低于wt,而在brt1-1和sng2中,aba抑制种子萌发的效应高于wt(图5b)。
进一步地,在含有aba的培养基(含量为0.2μm)中,wt的子叶变绿数目明显高于brt1-1、sng2和sng1-1(图5c);而与wt相比较,在brt1-1、sng2和sng1-1中,芥子酰胆碱的积累量也发生了变化(图5d)。
综上结果可以认为,芥子酸酯代谢关键基因的突变,使拟南芥对aba的敏感性发生了变化,表明aba可以抑制拟南芥种子萌发及幼苗的生长与芥子酸代谢相关。
实施例5
在实施例4基础上,发明人进一步以aba代谢突变体aba2-1(相当于植物体内不含aba)和aba信号传导相关突变体abi3-1(相当于虽然含有aba,但是aba信号传导受影响)为例,对芥子酸与aba间协作关系进行了进一步研究。
以0.5mm浓度芥子酸分别处理野生型(wt)、aba2-1突变体、abi3-1突变体拟南芥种子(处理过程及培育方式参考实施例3),统计种子萌发情况。
结果如图6a所示,从图中可以看出,低浓度的芥子酸(0.5mm)能促进wt种子的萌发,而在aba代谢突变体aba2-1和aba信号传导相关突变体abi3-1中,芥子酸抑制其种子萌发;换言之,芥子酸促进种子萌发的效应与aba含量及aba信号的传导是相关的;
利用实时荧光定量pcr技术,检测芥子酸处理后拟南芥种子中芥子酰葡萄糖胆碱转移酶(sct)基因的表达情况表明(以actin1为内参基因),相对于wt,在aba2-1和abi3-1中,芥子酸诱导了sct基因大量表达(图6b),而且,在aba2-1和abi3-1的种子中,sct活性明显高于wt(图6c);而对芥子酸胆碱含量检测表明,aba2-1和abi3-1突变体中芥子酸胆碱含量也高于wt(图6d);而sce基因的表达量高于wt(图6e),芥子酸胆碱的含量高于wt(图6f)。
荧光定量pcr时,引物序列设计如下:
actin1-f:5'-ggtaacattgtgctcagtggtgg-3',
actin1-r:5'-aacgaccttaatcttcatgctgc-3';
sct-f:5'-gctggctctggatactcttatg-3',
sct-r:5'-gggtgtttcacaaaccaactc-3';
sce-f:5'-ttaaccaccttcctcaatccgcct-3',
sce-r:5'-cagttgcaccatacaccgcgaaat-3';
荧光定量pcr及芥子酰胆碱含量的测量参见前述实施例;sct活性分析见参考文献(vogtetal.,1993,archbiochembiophys.300:622-628);胆碱含量的分析采用美国亚诺法公司的胆碱分析试剂盒,具体步骤见试剂盒说明书。
综上结果可以认为,芥子酸与aba相互协调,从而调节拟南芥种子的萌发与幼苗的生长。
sequencelisting
<110>河南大学
<120>芥子酸在种子萌发、根生长和幼苗发育方面的应用
<130>none
<160>12
<170>patentinversion3.5
<210>1
<211>22
<212>dna
<213>人工设计
<400>1
ggtaaaggctatctccggtatg22
<210>2
<211>20
<212>dna
<213>人工设计
<400>2
gtggtcggaggatggttaag20
<210>3
<211>18
<212>dna
<213>人工设计
<400>3
atccgggtctagcttcgg18
<210>4
<211>18
<212>dna
<213>人工设计
<400>4
attccacggcccattgtt18
<210>5
<211>18
<212>dna
<213>人工设计
<400>5
tcgagatggtggaagagc18
<210>6
<211>18
<212>dna
<213>人工设计
<400>6
gtttccgaccaagcaata18
<210>7
<211>20
<212>dna
<213>人工设计
<400>7
aagtcggtgcttccgattac20
<210>8
<211>21
<212>dna
<213>人工设计
<400>8
gtcatctcgatggttggttga21
<210>9
<211>21
<212>dna
<213>人工设计
<400>9
cggtgatagacgtggctaatg21
<210>10
<211>25
<212>dna
<213>人工设计
<400>10
cactgacactgtactccttcttatc25
<210>11
<211>23
<212>dna
<213>人工设计
<400>11
ggtaacattgtgctcagtggtgg23
<210>12
<211>23
<212>dna
<213>人工设计
<400>12
aacgaccttaatcttcatgctgc23
- 还没有人留言评论。精彩留言会获得点赞!