一种植物组织培养用抑菌剂及其在金线莲组织培养中的应用的制作方法
本发明涉及植物组织培养技术领域,尤其涉及一种植物组织培养用抑菌剂及其在金线莲组织培养中的应用。
背景技术:
金线莲是我国传统珍贵药材,又称金线兰,别名金蚕、金石松、树草莲、鸟人参、金线虎头蕉、金线入骨消,为兰科(orchidaceae)开唇兰属(anoectochilus)多年生草本植物。《福建药物志》载其性味甘平,清热凉血,祛风利湿,主治咳血、支气管炎、结核性脑膜炎、肾炎、膀胱炎、泌尿道结石、风湿性关节炎、小二急惊风、小儿破伤风。《中华药海》载其性味甘平,入肺、肝、肾、膀胱四经,具润肺止咳、凉血平肝、清热解毒之功效,可治肺热咳血、小儿惊风、小便不利及淋漓涩痛等。现代医学表明:金线莲主要含有黄酮、糖类、挥发油、生物碱、有机酸、氨基酸、甾体等。金线莲及其提取物的药理作用主要表现为降血糖、降血压、抗病毒、抗氧化等作用以及其它药理药效还在不断被发现。随着深入的研究,金线莲的优良品质日益突出,受到世人的青睐,具有广阔的开发利用前景。金线莲在我国广西、广东、海南、贵州、四川、云南等省都有分布;但近年来,人们对金线莲的长期采挖已导致其种质资源稀缺。目前,利用植物组织培养技术可以实现金线莲的规模化生产,满足人们的药用、研究和观赏需求。
金线莲组织培养(以下简称“组培”)规模化生产在我国发展迅速,组培技术日渐完善,但在组培中其经常会呈现不同程度的污染。在初代培养这一阶段,由于污染问题,获得无菌苗的成本较高,或者虽然在初代培养得到了无菌苗,但在继代培养时出现大量污染,使组培成本居高不下。
因此,降低组培污染率是规模化生产中重要的技术环节,同时也是衡量组织培养工作成本、风险和可行性高低的重要指标之一。从组培的全过程来看,每个环节都可能出现不同程度的污染,为了降低污染率,在组培过程中除了制定无菌操作的标准化流程,注重无菌操作意识、训练和监督外,同时在培养基中加入广谱性抑菌剂等,也是减少细菌和真菌污染的重要方法。研究、筛选和推广使用有效的抑菌剂,可减少真菌和细菌污染,简化无菌操作,降低组培成本和风险。
技术实现要素:
本发明提供了一种植物组织培养用抑菌剂及其在金线莲组织培养中的应用,该植物组织培养用抑菌剂能够有效减少组织培养中细菌和真菌的污染,并显著提高金线莲组织培养的成苗率,降低产生成本,可广泛应用于组培快速繁殖、种苗脱毒和再生植株系建立等植物生物技术领域。
本发明提供的技术方案,具体如下:
一种植物组织培养用抑菌剂,以1l计,包括以下组分:
植物提取液100~500ml;
壳寡糖5~20g;
表面活性剂5~20ml;
其余为水;
所述植物提取液为大蒜鳞茎、生姜根茎、苦瓜果皮和石榴果皮的混合物的乙醇浸提液。
作为优选,所述植物组织培养用抑菌剂,以1l计,包括以下组分:
植物提取液200ml;
壳寡糖20g;
表面活性剂10ml;
其余为水;
所述植物提取液为大蒜鳞茎、生姜根茎、苦瓜果皮和石榴果皮的混合物的乙醇浸提液。
更优选,所述表面活性剂为tween20。
经试验发现,采用上述植物提取液与壳寡糖进行组合,能够有效抑制组培过程中产生的细菌和真菌,尤其是芽孢杆菌、假单胞菌、链孢真菌、胶红酵母和青霉菌。
具体地,所述植物提取液的制备方法,包括:
(1)将大蒜鳞茎、生姜根茎、苦瓜果皮和石榴果皮进行混合后,加入乙醇中搅拌粉碎,得到混合液;
(2)将所述混合液进行超声波处理后,过滤去除固体杂质,再蒸发浓缩去除乙醇,得到植物提取液。
作为优选,步骤(1)中,所述大蒜鳞茎、生姜根茎、苦瓜果皮和石榴果皮的质量比为1~3:1~2:1~2:1~2。
作为优选,步骤(2)中,所述超声波处理的温度为40~70℃,频率为30~50khz。
本发明还提供了一种利用所述植物组织培养用抑菌剂进行的金线莲组织培养的方法,包括:
(1)外植体的制备:取金线莲的外植体,清洗后置于所述植物组织培养用抑菌剂中浸泡消毒,取出冲洗后,得到灭菌外植体;
(2)诱导培养:将所述灭菌外植体接种于含所述植物组织培养用抑菌剂的诱导培养基中,进行诱导培养,得到含丛生芽的愈伤组织;
(3)增殖继代培养:将所述丛生芽接种于含所述植物组织培养用抑菌剂的增殖继代培养基中,进行增殖继代培养,得到丛生苗;
(4)生根培养:将所述丛生苗接种于含所述植物组织培养用抑菌剂的生根培养基中,进行生根培养,得到组培苗;
(5)炼苗移栽。
所述的外植体为金线莲的鳞茎、种子或叶片。
作为优选,所述诱导培养基为ms+蔗糖20-30g·l-1+琼脂5-10g·l-1+6-ba1.0-2.0mg·l-1+naa0.2-1.0mg·l-1+ga1.5mg·l-1+抑菌剂200-300ml·l-1。
作为优选,所述增殖继代培养基为ms+蔗糖20-30g·l-1+琼脂5-10g·l-1+6-ba0.5-1.5mg·l-1+naa0.2-0.5mg·l-1+抑菌剂300-400ml·l-1。
作为优选,所述生根培养基为1/2ms+蔗糖20-30g·l-1+琼脂5-10g·l-1+naa0.3-0.5mg·l-1+抑菌剂100-150ml·l-1。
与现有技术相比,本发明具有以下有益效果:
本发明以大蒜鳞茎、生姜根茎、苦瓜果皮和石榴果皮为原料制备植物提取液,并将该植物提取液与壳寡糖进行组合得到抑菌剂,该抑菌剂能够有效减少组织培养中细菌和真菌的污染,并显著提高金线莲组织培养的成苗率,降低产生成本,可广泛应用于组培快速繁殖、种苗脱毒和再生植株系建立等植物生物技术领域。
附图说明
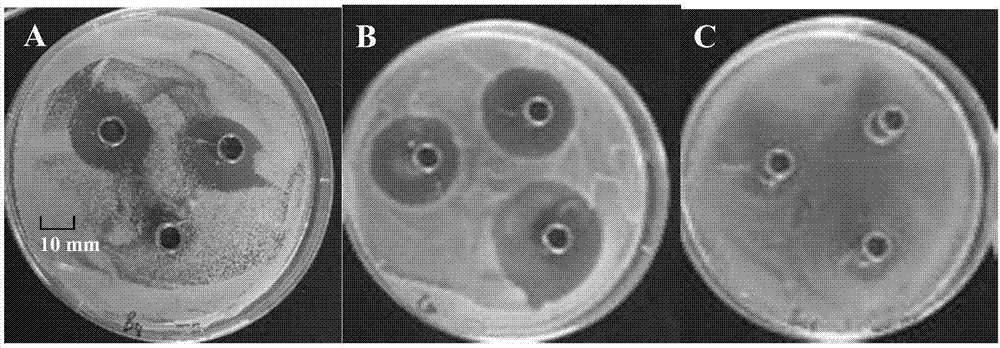
图1为实施例2中植物组织培养用抑菌剂对不同细菌的抑菌效果;
其中,a为假单胞菌;b为芽孢杆菌;c为栖水肠杆菌。
图2为实施例3中植物组织培养用抑菌剂对不同真菌的抑菌效果;
其中,a1为交链孢真菌的实验组;a2为交链孢真菌的对照组;b为胶红酵母;c1为青霉菌的实验组;c2为青霉菌的对照组。
图3为实施例4中植物组织培养用抑菌剂对青霉菌的抑菌效果试验;
其中,a和b为接种青霉素;c和d为含有抑菌剂的培养基+接种青霉素;e和f为未接种青霉素。
具体实施方式
下面结合具体实施例对本发明作进一步说明,但本发明并不局限于所给出的实施例。
实施例1植物组织培养用抑菌剂的制备
1、植物提取液的制备:
(1)取40g大蒜鳞茎、20g生姜根茎、20g苦瓜果皮和20g石榴果皮,清洗后,加入100ml的95%乙醇中,进行搅拌和粉碎,得到混合液;
(2)将上述混合液进行超声波处理,超声波处理的温度为60℃,频率为40khz,时间为30min,过滤去除固体杂质后,再采用旋转蒸发仪去除乙醇获得浓缩液,采用纯水将浓缩液定容至100ml,得到植物提取液。
2、植物组织培养用抑菌剂的制备:
取20ml植物提取液、2g壳寡糖、1ml助溶剂tween20和60ml纯水,放入100ml容量瓶中,混合均匀,用无离子水定容于100ml,倒入试剂瓶中,放置于4℃冰箱中保存备用。
对比例1
1、植物提取液的制备:
(1)取60g大蒜鳞茎和40g生姜根茎,清洗后,加入100ml的95%乙醇中,进行搅拌和粉碎,得到混合液;
(2)将上述混合液进行超声波处理,超声波处理的温度为60℃,频率为40khz,时间为30min,过滤去除固体杂质后,再采用旋转蒸发仪去除乙醇获得浓缩液,采用纯水将浓缩液定容至100ml,得到植物提取液。
2、植物组织培养用抑菌剂的制备:
取20ml植物提取液、2g壳寡糖、1ml助溶剂tween20和60ml纯水,放入100ml容量瓶中,混合均匀,用无离子水定容于100ml,倒入试剂瓶中,放置于4℃冰箱中保存备用。
对比例2
1、植物提取液的制备:
(1)取40g大蒜鳞茎、20g生姜根茎、40g苦瓜果皮,清洗后,加入100ml的95%乙醇中,进行搅拌和粉碎,得到混合液;
(2)将上述混合液进行超声波处理,超声波处理的温度为60℃,频率为40khz,时间为30min,过滤去除固体杂质后,再采用旋转蒸发仪去除乙醇获得浓缩液,采用纯水将浓缩液定容至100ml,得到植物提取液。
2、植物组织培养用抑菌剂的制备:
取20ml植物提取液、2g壳寡糖、1ml助溶剂tween20和60ml纯水,放入100ml容量瓶中,混合均匀,用无离子水定容于100ml,倒入试剂瓶中,放置于4℃冰箱中保存备用。
对比例3
1、植物提取液的制备:
(1)取40g大蒜鳞茎、20g生姜根茎、40g石榴果皮,清洗后,加入100ml的95%乙醇中,进行搅拌和粉碎,得到混合液;
(2)将上述混合液进行超声波处理,超声波处理的温度为60℃,频率为40khz,时间为30min,过滤去除固体杂质后,再采用旋转蒸发仪去除乙醇获得浓缩液,采用纯水将浓缩液定容至100ml,得到植物提取液。
2、植物组织培养用抑菌剂的制备:
取20ml植物提取液、2g壳寡糖、1ml助溶剂tween20和60ml纯水,放入100ml容量瓶中,混合均匀,用无离子水定容于100ml,倒入试剂瓶中,放置于4℃冰箱中保存备用。
对比例4
1、植物提取液的制备:
(1)取40g大蒜鳞茎、20g生姜根茎、20g苦瓜果皮和20g石榴果皮,清洗后,加入100ml的95%乙醇中,进行搅拌和粉碎,得到混合液;
(2)将上述混合液进行超声波处理,超声波处理的温度为60℃,频率为40khz,时间为30min,过滤去除固体杂质后,再采用旋转蒸发仪去除乙醇获得浓缩液,采用纯水将浓缩液定容至100ml,得到植物提取液。
2、植物组织培养用抑菌剂的制备:
取20ml植物提取液、2g壳聚糖、1ml助溶剂tween20和60ml纯水,放入100ml容量瓶中,混合均匀,用无离子水定容于100ml,倒入试剂瓶中,放置于4℃冰箱中保存备用。
实施例2植物组织培养用抑菌剂对细菌和真菌的抑菌性
采用实施例1和对比例1~4制备的植物组织培养用抑菌剂对组培污染中3株细菌(假单胞菌、芽孢杆菌和栖水肠杆菌)以及3株真菌(交链孢真菌、胶红酵母和青霉菌)进行抑菌效果的研究。
具体内容如下:
细菌抑菌性试验:取规格φ7.8mm×6mm×10mm(外径×内径×高)的牛津杯,置于121℃下高压灭菌后,烘干冷却备用。于超净工作台内将芽孢杆菌、假单胞菌和栖水肠杆菌涂布在lb平皿(直径90mm)表面,每个平皿含有200μl浓度106cfu/ml的测试细菌。将牛津杯放入各个平皿表面,吸取实施例1制备的植物组织培养用抑菌剂200μl滴入牛津杯内,再置于30℃培养48~72h,每组进行3个重复;以接种细菌但未加入抑菌剂的lb平皿为对照。
真菌抑菌性试验:取含有100μl的实施例1制备的植物组织培养用抑菌剂的lb平皿,于超净工作台内将真菌链孢真菌、胶红酵母和青霉菌的菌斑接种于上述lb平皿(直径60mm)表面,置于25℃培养4-5d,每组3个重复;以加入抑菌剂但未接种真菌的lb平皿为对照。
试验结果如下:
图1表明,含实施例1制备的植物组织培养用抑菌剂的牛津杯周围有明显抑菌圈;
图2表明,含实施例1制备的植物组织培养用抑菌剂的平皿中真菌生长受到明显抑制;其中,胶红酵母抑菌圈直径达到16mm,对抑菌剂为高度敏感,链孢真菌和青霉菌的抑菌率达到90%((对照菌斑直径-试验菌斑直径)/对照菌斑直径)。
具体抑菌效果的数据见表1。
表1采用实施例1和对比例1~4制备的植物组织培养用抑菌剂对不同菌种进行抑菌处理的结果
注:“+”表示:菌圈直径9-10mm,轻度敏感;“++”表示:菌圈直径10-15mm,中度敏感;“+++”表示:菌圈直径15-20mm,高度敏感;“++++”表示:菌圈直径>20mm,极敏感。
实施例3植物组织培养用抑菌剂对青霉菌的抑制效果
于超净工作台内将青霉菌涂抹在金线莲种苗(组培获得的组培苗)表面,分别接种于含或不含实施例1制备的植物组织培养用抑菌剂的培养基中,置于25℃、光照12h/d、光强2000lx培养3-5d。
试验结果:如图3所示,含有抑菌剂的组培苗的污染程度显著较轻。
实施例4
一种利用植物组织培养用抑菌剂对金线莲进行组织培养的方法,具体内容如下:
(1)外植体的制备:选取金线莲的鳞茎作为外植体,将外植体用水冲洗20分钟,放入实施例1制备的植物组织培养用抑菌剂中浸泡20min,再用无菌水冲洗2次,滤干水分,用经抑菌剂浸泡过的解剖刀对表面灭菌后的外植体进行切割,得到待接种的外植体;
(2)培养基的制备:根据ms基本培养基的成分及用量,配置相应母液,先后取大量元素母液、微量元素母液、铁盐母液及有机成分,混合后按诱导培养基、增殖继代培养基及生根培养基的组分来加入激素以及实施例1制备的植物组织培养用抑菌剂。
用ph计测定培养基的ph值,用1mnaoh溶液或1m盐酸调ph至5.8;然后加热溶化琼脂,最后加水定容;将配好的培养基分装于培养瓶中,用瓶盖封口,121℃高压灭菌,冷却至60℃左右,在无菌条件下加入实施例1制备的植物组织培养用抑菌剂,凝固后至于洁净区备用。
(3)诱导培养:将经消毒处理的金线莲外植体接种于诱导培养基上,置于组培室内进行诱导培养,培养20d后,得到愈伤组织,鳞茎的边缘长出丛生芽;
其中,诱导培养基为:蔗糖30g·l-1+琼脂5g·l-1+ms+6-ba2.0mg·l-1+naa1.0mg·l-1+ga1.5mg·l-1+抑菌剂(实施例1)200ml·l-1,ph至5.8,121℃高压灭菌;诱导培养的条件为:温度为25℃、光照为12h/d、光强为1500lx。
(4)增殖继代培养:将诱导出的丛生芽切开,接种至增殖继代培养基上,进行增殖继代培养,且25天转接一次,得到丛生苗;
其中,增殖继代培养基为:蔗糖30g·l-1+琼脂5g·l-1+ms+6-ba1.5mg·l-1+naa0.5mg·l-1+抑菌剂(实施例1)300ml·l-1,ph至5.8,121℃高压灭菌;增殖继代培养的条件为:温度为25℃、光照为12h/d、光强为1500lx。
(5)生根培养:丛生苗长至2~4cm时,将丛生苗切成单株,接种到生根培养基上,进行生根培养,培养25天后,获得完整的组培苗;
其中,生根培养基为:蔗糖30g·l-1+琼脂5g·l-1+1/2ms+naa0.3mg·l-1+抑菌剂(实施例1)100ml·l-1,ph至5.8,121℃高压灭菌;生根培养的条件为:温度为25℃、光照为12h/d、光强为1500lx。
(6)炼苗移栽:取出生根培养后的完整组培苗,洗净根部的培养基,移栽至穴盘内,栽培获得金线莲;
其中,基质为常用的腐质土、珍珠岩和松木树皮;大棚上层盖遮光网,移栽的环境温度为25℃。最后,移栽成活率达86%。
实施例5
一种利用植物组织培养用抑菌剂对金线莲进行组织培养的方法,具体内容如下:
(1)外植体的制备:选取金线莲的叶片作为外植体,将外植体用水冲洗20分钟,放入实施例1制备的植物组织培养用抑菌剂中浸泡20min,再用无菌水冲洗2次,滤干水分,用经抑菌剂浸泡过的解剖刀对表面灭菌后的外植体进行切割,得到待接种的外植体;
(2)培养基的制备:根据ms基本培养基的成分及用量,配置相应母液,先后取大量元素母液、微量元素母液、铁盐母液及有机成分,混合后按诱导培养基、增殖继代培养基及生根培养基的组分来加入激素以及实施例1制备的植物组织培养用抑菌剂。
用ph计测定培养基的ph值,用1mnaoh溶液或1m盐酸调ph至5.8;然后加热溶化琼脂,最后加水定容;将配好的培养基分装于培养瓶中,用瓶盖封口,121℃高压灭菌,冷却至60℃左右,在无菌条件下加入实施例1制备的植物组织培养用抑菌剂,凝固后至于洁净区备用。
(3)诱导培养:将经消毒处理的金线莲外植体接种于诱导培养基上,置于组培室内进行诱导培养,培养20d后,得到愈伤组织,叶片的边缘长出丛生芽;
其中,诱导培养基为:蔗糖30g·l-1+琼脂5g·l-1+ms+6-ba2.0mg·l-1+naa1.0mg·l-1+ga1.5mg·l-1+抑菌剂(实施例1)200ml·l-1,ph至5.8,121℃高压灭菌;诱导培养的条件为:温度为25℃、光照为12h/d、光强为1500lx。
(4)增殖继代培养:将诱导出的丛生芽切开,接种至增殖继代培养基上,进行增殖继代培养,且25天转接一次,得到丛生苗;
其中,增殖继代培养基为:蔗糖30g·l-1+琼脂5g·l-1+ms+6-ba1.5mg·l-1+naa0.5mg·l-1+抑菌剂(实施例1)300ml·l-1,ph至5.8,121℃高压灭菌;增殖继代培养的条件为:温度为25℃、光照为12h/d、光强为1500lx。
(5)生根培养:丛生苗长至2~4cm时,将丛生苗切成单株,接种到生根培养基上,进行生根培养,培养25天后,获得完整的组培苗;
其中,生根培养基为:蔗糖30g·l-1+琼脂5g·l-1+1/2ms+naa0.3mg·l-1+抑菌剂(实施例1)100ml·l-1,ph至5.8,121℃高压灭菌;生根培养的条件为:温度为25℃、光照为12h/d、光强为1500lx。
(6)炼苗移栽:取出生根培养后的完整组培苗,洗净根部的培养基,移栽至穴盘内,栽培获得金线莲;
其中,基质为常用的腐质土、珍珠岩和松木树皮;大棚上层盖遮光网,移栽的环境温度为25℃。最后,移栽成活率达83.5%。
对比例5
一种金线莲的组织培养方法,具体内容如下:
(1)外植体的制备:选取金线莲的鳞茎作为外植体,将外植体用水冲洗20分钟,放入次氯酸钠中消毒20min,再用无菌水冲洗2次,滤干水分,用解剖刀对表面灭菌后的外植体进行切割,得到待接种的外植体;
(2)培养基的制备:根据ms基本培养基的成分及用量,配置相应母液,先后取大量元素母液、微量元素母液、铁盐母液及有机成分,混合后按诱导培养基、增殖继代培养基及生根培养基的组分来加入激素。
用ph计测定培养基的ph值,用1mnaoh溶液或1m盐酸调ph至5.8;然后加热溶化琼脂,最后加水定容;将配好的培养基分装于培养瓶中,用瓶盖封口,121℃高压灭菌,凝固后至于洁净区备用。
(3)诱导培养:将经消毒处理的金线莲外植体接种于诱导培养基上,置于组培室内进行诱导培养,培养20d后,得到愈伤组织,鳞茎的边缘长出丛生芽;
其中,诱导培养基为:蔗糖30g·l-1+琼脂5g·l-1+ms+6-ba2.0mg·l-1+naa1.0mg·l-1+ga1.5mg·l-1,ph至5.8,121℃高压灭菌;诱导培养的条件为:温度为25℃、光照为12h/d、光强为1500lx。
(4)增殖继代培养:将诱导出的丛生芽切开,接种至增殖继代培养基上,进行增殖继代培养,且25天转接一次,得到丛生苗;
其中,增殖继代培养基为:蔗糖30g·l-1+琼脂5g·l-1+ms+6-ba1.5mg·l-1+naa0.5mg·l-1,ph至5.8,121℃高压灭菌;增殖继代培养的条件为:温度为25℃、光照为12h/d、光强为1500lx。
(5)生根培养:丛生苗长至2~4cm时,将丛生苗切成单株,接种到生根培养基上,进行生根培养,培养25天后,获得完整的组培苗;
其中,生根培养基为:蔗糖30g·l-1+琼脂5g·l-1+1/2ms+naa0.3mg·l-1,ph至5.8,121℃高压灭菌;生根培养的条件为:温度为25℃、光照为12h/d、光强为1500lx。
(6)炼苗移栽:取出生根培养后的完整组培苗,洗净根部的培养基,移栽至穴盘内,栽培获得金线莲.
其中,基质为常用的腐质土、珍珠岩和松木树皮。大棚上层盖遮光网,移栽的环境温度为25℃。最后,移栽成活率仅为72%。
对比例6
本对比例的金线莲组织培养过程中,分别采用对比例1~4的抑菌剂,而其余内容与实施例4完全相同。
最后,移栽成活率分别为75%(对比例1)、73%(对比例2)、78%(对比例4)、80%(对比例4);此外,经检测,组培过程中的金线莲外植体受感染的主要菌种为芽孢杆菌和链孢真菌(对比例1~3),假单孢菌和胶红酵母(对比例4)。
- 还没有人留言评论。精彩留言会获得点赞!